Разработка и лабораторные испытания опытного образца автоматизированного устройства для диагностики туберкулеза методом ПЦР в режиме реального времени
Автор: А.П. Ткачук, А.Г. Алатырев, В.А. Пономарев, Д.В. Каникевич, Ю.К. Дзагоева, А.А. Казюлина, Т.Е. Тюлькова, А.Г. Самойлова, И.А. Васильева
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение для биологии и медицины
Статья в выпуске: 4, 2025 года.
Бесплатный доступ
Представлены результаты разработки и лабораторных испытаний опытного образца портативного автоматического прибора для экспресс-диагностики туберкулеза и определения лекарственной устойчивости возбудителя. Система состоит из анализатора и одноразового картриджа, содержащего все необходимые реагенты для пробоподготовки и проведения ПЦР. Протокол анализа предусматривает обработку мокроты (ультразвуковая обработка, лизис и экстракция ДНК с использованием магнитных частиц), последующую гнездовую ПЦР в режиме реального времени для детекции возбудителя туберкулеза (Mycobacterium tuberculosis) и анализ мутаций гена rpoB методом плавления зондов. В лабораторных испытаниях на образцах мокроты показано, что система успешно выявляет ДНК Mycobacterium tuberculosis (мишень IS6110) с высокой чувствительностью, в том числе в образцах с низкой бактериальной нагрузкой, и корректно идентифицирует мутации, обусловливающие устойчивость к рифампицину. При этом внутренний контроль подтверждает отсутствие ингибирования ПЦР. Точность результатов сопоставима со стандартным лабораторным ПЦР-анализом. Технологические преимущества системы включают полную автоматизацию "от образца до результата" (время анализа около 2 ч) и снижение риска контаминации за счет закрытого картриджа в сравнении с классическими методами молекулярно-генетического анализа. Разработанная платформа перспективна для прикроватной диагностики туберкулеза (исследования по месту нахождения пациента), включая мультирезистентные формы. Планируется расширение панели тестов для выявления устойчивости не только к рифампицину, но и к изониазиду и фторхинолонам.
Туберкулез, молекулярная экспресс-диагностика, молекулярно-генетический тест, полимеразная цепная реакция, гнездовая ПЦР, одноразовый картридж, прикроватная диагностика, антибиотикорезистентность, рифампицин, изониазид, фторхинолоны, мокрота
Короткий адрес: https://sciup.org/142246259
IDR: 142246259 | УДК: 543.426,543.9
Текст научной статьи Разработка и лабораторные испытания опытного образца автоматизированного устройства для диагностики туберкулеза методом ПЦР в режиме реального времени
По данным Глобального отчета Всемирной организации здравоохранения в 2023 г. в мире было зарегистрировано 10.8 млн новых случаев туберкулеза, а умерло 1.1 млн человек, что вновь вывело эту инфекцию на первое место по смертности среди инфекционных заболеваний [1]. Российская Федерация в 2021 г. покинула список стран с высоким бременем туберкулеза. Несмотря на это, распространение инфекции с лекарственной устойчивостью возбудителя остается вызовом для всего медицинского сообщества. Этому существенно способствовала пандемия COVID-19 [2]. По данным Федерального регистра больных туберкулезом, в 2021 г. было зарегистрировано 15 604 больных туберкулезом с подтвержденной устойчивостью как минимум к рифампицину [3]. Раннее выявление устойчивости к антимикробным препаратам способствует своевременному назначению или коррекции противотуберкулезной химиотерапии.
Классические методы диагностики туберкулеза имеют ряд ограничений. Микроскопия мазка мокроты отличается невысокой чувствительностью, особенно при низком содержании микобактерий в пробе. Культуральный метод (посев) — "золотой стандарт" диагностики и определения лекарственной резистентности — обладает высокой чувствительностью, однако требует нескольких недель на рост культуры. В последние годы широкое распространение получили молекулярно-генетические методы диагностики, прежде всего полимеразная цепная реакция (ПЦР), позволяющие выявлять ДНК Mycobacterium tuberculosis в образцах пациента в течение считанных часов и определять мутации, ассоциированные с лекарственной устойчивостью, например, в RRDR-области (81 пара нуклеотидов, участок гена rpoB).
Внедрение автоматизированных ПЦР-систем с одноразовыми картриджами (таких как Cepheid GeneXpert MTB/RIF) совершило революцию в диагностике туберкулеза [4, 5]. Система GeneXpert обеспечивает обнаружение M. tuberculosis и определение устойчивости к рифампицину в одном анализе за ~90 мин и рекомендована ВОЗ к применению во многих странах. Помимо GeneXpert, разработаны и применяются другие молекулярные тесты: линейные ДНК-зонды (Hain GenoType MTBDRplus и др.), изотермические амплификаци-онные тесты, а также портативные ПЦР-приборы типа Molbio Truenat и др. Некоторые новые системы способны одновременно определять устойчивость к нескольким препаратам (например, Xpert MTB/XDR, FluoroType MTBDR, MeltPro и др.). Тем не менее многие из этих решений являются импортными и дорогостоящими, либо требуют лабораторной инфраструктуры. Актуальной задачей является создание отечественных портативных приборов для молекулярной диагностики туберкулеза, пригодных для использования в местах оказания медицинской помощи ("point-of-care"), на основе штаммов, циркулирующих на территории Российской Федерации [6, 7].
В данной работе описывается портативная автоматическая система молекулярно-генетической диагностики туберкулеза, разработанная для проведения анализа в одноразовых картриджах без участия оператора. Прибор обеспечивает полностью автоматическое выделение нуклеиновых кислот из клинического образца (мокроты или бронхоальвеолярного лаважа) и детекцию M. tuberculosis методом ПЦР в режиме реального времени, а также анализ мутаций ДНК возбудителя, ассоциированных с лекарственной устойчивостью. Целью разработки является создание автономной системы "проба–результат", способной значительно ускорить и упростить диагностику туберкулеза и выявление мультирезистентного туберкулеза в клинических условиях в сравнении с неавтоматизированными методами анализа. Настоящая статья представляет результаты испытаний опытного образца прибора и картриджа с необходимыми реагентами, включая оценку его диагностической эффективности (выявление M. tuberculosis в образцах мокроты) и способности идентифицировать мутации, обусловливающие устойчивость к основным противотуберкулезным препаратам — рифампицину, изониазиду и фтор-хинолонам для успешной терапии больных туберкулезом [8].
ОПИСАНИЕ КОНСТРУКЦИИ ПРИБОРА И РЕАГЕНТНОГО КАРТРИДЖА
Анализатор
Опытный образец анализатора представляет собой портативный прибор, рассчитанный на работу с одноразовым картриджем, внутри которого проводится анализ (рис. 1). Конструкция анализатора модульная: при установке картриджа он фиксируется в приборе в строго заданном положении относительно основных модулей — механизма поворота золотникового клапана, узла вертикального перемещения поршня и модуля термоциклирования с оптической системой детекции. Таким образом, анализатор выполняет сразу несколько функций: 1) приведение в действие встроенного в картридж микрофлюидного насоса (поворотного клапана с поршнем) для перекачивания жидкостей между камерами; 2) управление процессом экстракции ДНК (например, активация ультразвукового излучателя и подведение магнитного сепаратора); 3) обеспечение ПЦР-амплификации (нагрев/охлаждение ПЦР-чипа) и регистрацию флуоресцентного сигнала. Оптическая система прибора оснащена набором фотодетекторов по числу используемых флуоресцентных каналов; в опытном образце реализовано до пяти каналов детекции, что позволяет одновременно отслеживать несколько мишеней и контроль в режиме реального времени. Предусмотрено программное обеспечение для управления всеми этапами анализа и автоматической интерпретацией результатов амплификации.
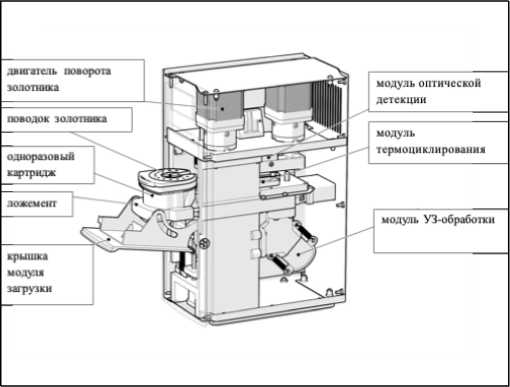
Рис. 1. Общая схема устройства анализатора для молекулярной диагностики туберкулеза и других инфекционных заболеваний.
Картридж
Одноразовый картридж — это полимерное изделие, внутри которого размещен полный комплект реагентов, необходимых для анализа. Конструкция картриджа включает три ключевых узла (рис. 2): 1) набор функциональных ячеек-резервуаров (включая ячейку для внесения пробы и ячейки, содержащие реагенты — лизирующий буфер, промывочные растворы, элюирующий буфер, лиофилизированные реагенты для ПЦР, а также отдельную реакторную ячейку для проведения ПЦР); 2) микрофлюидный ПЦР-чип, герметично соединенный с ячейками; 3) поворотный золотниковый клапан, осуществляющий перемещение жидкостей между ячейками. Картридж загружается оператором в прибор вручную; после этого все стадии анализа выполняются автоматически. Перед началом анализа картридж герметично закрывается в приборе, производится тест на отсутствие утечки (подача воздуха под давлением в ПЦР-ячейки) и инициализация системы. В резервуарах картриджа находятся реагенты: универсальный буфер для ликвификации и лизиса мокроты (средство для разжижения и инактивации биоматериала), магнитные микрочастицы с функционализированной поверхностью для сорбции ДНК, промывочные буферы для очистки выделенных нуклеиновых кислот, элюент для десорбции ДНК, а также ПЦР-смеси (праймеры, зонды, термостабильная ДНК-полимераза, дезоксинуклеотиды и пр.) для амплификации целевого фрагмента ДНК M. tuberculosis и внутренних контролей. В состав тест-системы включен внутренний контроль (ВКО). Наличие ВКО позволяет контроли- ровать эффективность всех этапов — от лизиса до амплификации — и отслеживать возможное ингибирование ПЦР в каждом образце. Отличительной особенностью картриджа является интегрированный микрофлюидный ПЦР-чип, представляющий собой миниатюрный блок с одним или несколькими ПЦР-реакторами (лунками), в которых происходит амплификация ДНК в замкнутом объеме. После заполнения реакционной смеси ПЦР-лунка автоматически герметизируется в картридже, что исключает испарение и контаминацию. Стоит отметить, что в процессе разработки конструкция картриджа оптимизировалась: в частности, была усовершенствована форма и механизм золотникового клапана для обеспечения многостадийной (гнездовой) ПЦР без риска распространения ампликонов. Первоначальный вариант клапана имел открытый сектор, из-за чего после первой фазы ПЦР одна из лунок оставалась открытой, увеличивая вероятность контаминации прибора ампликонами. В опытном образце клапан доработан — он полностью перекрывает вентиляционные каналы во время переноса жидкостей, благодаря чему каждая ПЦР-лунка остается закрытой после заполнения и риск контаминации ампликонами сведен к минимуму.
ПРОТОКОЛ АВТОМАТИЧЕСКОГО АНАЛИЗА ОТ ОБРАЗЦА ДО РЕЗУЛЬТАТА
Анализ выполняется по предварительно запрограммированному протоколу. Ниже описаны основные этапы обработки клинического образца мокроты внутри системы.
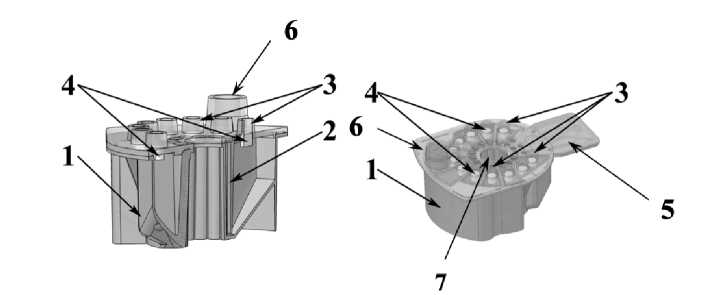
Рис. 2. Общий вид картриджа устройства для автоматического выделения, очистки и амплификации участков ДНК M. tuberculosis с регистрацией результатов в режиме реального времени.
1 — основание с емкостями-резервуарами; 2 — крышка с капиллярами для движения жидкости; 3 — вентиляционные колодцы; 4 — фильтрующий элемент; 5 — ячейки для проведения ПЦР; 6 — крышка и отверстие под ней (порт) для введения пробы; 7 — поворотный клапан
Загрузка пробы
Врач или лаборант вручную собирает образец мокроты пациента в стерильный контейнер. Перед загрузкой в картридж мокроту предварительно смешивают со специальным лизирующим буфером в соотношении 1 : 2 и инкубируют около пяти минут при комнатной температуре для разжижения вязкого материала. Полученную обработанную смесь (в объеме 2.0–2.5 мл) набирают дозатором или одноразовой пипеткой Пастера и вносят в приемную камеру картриджа через специальное загрузочное отверстие под крышкой. После этого картридж помещается в анализатор, крышка прибора закрывается — запускается автоматический цикл анализа.
Лизис и высвобождение ДНК
В автоматической системе реализован метод выделения нуклеиновых кислот, описанный R. Boom и соавторами [9], с модификациями. Прямо в картридже осуществляется обработка образца для инактивации микобактерий и освобождения их ДНК. К реакторной ячейке, куда поступает образец, вплотную прилегает ультразвуковой излучатель. Анализатор генерирует серию ультразвуковых импульсов, передаваемых через стенку ячейки: длительность импульса ~1 с, пауза 1 с, суммарно около 40–60 импульсов. Такая ультразвуковая соникация приводит к механическому разрушению клеток M. tuberculosis , разжижению мокроты и повышению выхода ДНК. Согласно проведенной нами оценке, применение ультразвука в картридже позволяет увеличить количество выделенной микобактериальной ДНК примерно в 10 раз по сравнению с несонированным образцом. Вышеописанная обработка инактивирует микобактерии, что повышает биобезопасность анализа и снижает ингибирование ПЦР.
Экстракция ДНК с использованием магнитных частиц
После этапа лизиса прибор переходит к автоматическому выделению нуклеиновых кислот. В картридже предусмотрены магнитные микрочастицы (ММЧ) со специальным покрытием, способным связывать ДНК. Анализатор посредством встроенного вращающегося клапана и поршня последовательно распределяет жидкость из реактора по другим камерам картриджа: сначала образец смешивается с магнитными частицами, затем частицы с адсорбированной ДНК переносятся в промывочную камеру. Для перемещения жидкостей используется поворотный золотниковый кла- пан: он ориентируется над нужной ячейкой, поршень внутри клапана опускается, выгружая из ячейки заданный объем жидкости за счет создаваемого отрицательного давления, затем клапан поворачивается к целевой ячейке и поршень выдавливает жидкость. Таким образом, реализуется функция своеобразного микрошприца. В промывочной ячейке прибор с помощью постоянного магнита, подводимого к внешней стороне картриджа, удерживает магнитные частицы с ДНК на стенке, тогда как жидкость отбирается клапаном и удаляется. Последовательно выполняется несколько этапов промывки — введение промывочных буферов и их удаление — для очистки сорбированной ДНК от ингибиторов и примесей. После промывок частицы переводятся во вторую камеру, где осуществляется элюция ДНК: добавляется небольшой объем элюента, в котором нуклеиновые кислоты десорбируются с частиц. Затем очищенный элюат с ДНК микобактерий загружается в ПЦР-камеру с лиофилизированными реагентами для амплификации.
Амплификация (гнездовая ПЦР)
Полученная реакционная смесь (элюат с ДНК + реагенты) автоматически разливается по ПЦР-лункам микрофлюидного чипа картриджа. В опытном образце реализована двухстадийная гнездовая ПЦР (nested PCR) для повышения чувствительности. Для этого в картридже предусмотрены по крайней мере две ПЦР-ячейки: в одной происходит 1-я фаза ПЦР — первичное воспроизведение ДНК-мишени с использованием внешних праймеров; затем часть полученных ампликонов автоматически переносится во вторую ячейку, где готовится смесь для 2-й фазы ПЦР с внутренними (nested) праймерами. Двухфазная амплификация позволяет детектировать даже единичные копии ДНК M. tuberculosis и частично нивелировать влияние возможных ингибиторов, остающихся в пробе после экстракции. В финальной конфигурации протокола каждая фаза ПЦР проводилась в 30 циклов, продукты 1-й фазы разбавлялись приблизительно в пропорции 1 : 200 для 2-й фазы. Термальный профиль ПЦР (температурные режимы денатурации, отжига и элонгации) аналогичен стандартным ПЦР в режиме реального времени. Временные затраты на оба этапа амплификации и промежуточный перенос невелики, и полный цикл анализа укладывается в пределах двух часов. После заполнения каждой ПЦР-лунки клапан картриджа поворачивается в положение герметизации, исключая контакт лунки с внешней средой во время амплификации.
Детекция и интерпретация результатов
Термоциклирование в ПЦР-чипе сопровождается регистрацией флуоресцентного сигнала в реальном времени. В тест-системе целевой фрагмент ДНК M. tuberculosis — это мультикопийная последовательность IS6110 , амплификация которой детектируется по каналу FAM (используется зонд с меткой FAM). Одновременно во втором канале (например HEX) регистрируется амплификация ДНК внутреннего контроля (ВКО). Программное обеспечение анализатора строит кривые накопления продукта; по достижении порогового уровня флуоресценции выводится результат ПЦР: положительный (обнаружено IS6110 ) или отрицательный (не обнаружено, при условии положительной реакции ВКО). В случае двухстадийной ПЦР на выходе формируется сводный вывод с учетом обеих фаз. Для определения лекарственной устойчивости к рифампицину реализован дополнительный анализ продуктов амплификации гена rpoB . После завершения ПЦР прибор выполняет анализ кривых плавления зондов (melt curve analysis) для выявления точечных мутаций в RRDR-области. В тестовой системе применены несколько зондов-молекулярных маяков, комплементарных различным участкам RRDR; изменения температур плавления этих зондов при связке с ампликоном указывают на присутствие мутации. Например, для мутантов с заменой Ser531Leu (одна из самых частых мутаций рифампицин-устойчивого туберкулеза, ~75% случаев) характерно увеличение температуры плавления зонда Р-4 на 6.9 °С по сравнению с диким типом. Анализатор регистрирует кривые плавления в нескольких оптических каналах, соответствующих каждому отдельному зонду, и сопоставляет полученные значения температуры плавления Tm с эталонными для дикого типа. На основе этого определяется, присутствует ли мутация в RRDR и какого рода (в границах детектируемых позиций 516, 526, 531 и др.). Результат по устойчивости к рифампицину выдается в формате: "рифампицин-устойчивый" (при обнаружении мутации) либо "рифампицин-чувствительный" (мутация не обнаружена). На этапе опытного образца метод продемонстрировал работоспособность и показал перспективность для распространения на другие препараты. Аналогичным образом планируется реализовать детекцию мутаций генов katG/inhA (изониазид) и gyrA (фторхинолоны), т.е. расширить одноразовый картридж дополнительными реагентами/зондами для одновременного определения нескольких мутаций, ассоциированных с устойчивостью к нескольким антибиотикам в рамках одного анализа, что продиктовано потребностью практического здравоохранения [10].
МЕТОДИКА ИСПЫТАНИЙ И ОБЪЕКТЫ
Объекты исследований
Лабораторные испытания опытного образца прибора проводились на клинических пробах мокроты, полученных от пациентов с подтвержденным диагнозом "туберкулез легких" с их согласия по установленной форме Локальным этическим комитетом ФГБУ "НМИЦ ФПИ" Минздрава РФ. В частности, в исследование включались пробы мокроты от больных, у которых присутствие M. tuberculosis ранее было подтверждено методами ПЦР (тест-система "Амплитуб-РВ") и/или культурально, а также пробы от условно здоровых доноров (отрицательные по туберкулезу). Все образцы до постановки теста хранились в холодильнике (+4°C) не более 1–2 суток или замораживались при –20°C для последующего анализа. Перед загрузкой в прибор мокрота смешивалась с универсальным лизирующим буфером 1 : 2, как описано выше. Анализы проводились на базе лаборатории молекулярно-биологических методов ФГБУ "НМИЦ ФПИ" Минздрава РФ.
Испытание на обнаружение M. tuberculosis
Для оценки работоспособности системы в режиме детекции возбудителя туберкулеза были отобраны как положительные, так и отрицательные клинические образцы. Часть положительных проб имела высокую бактериальную нагрузку, другие — низкую (единичные бактерии, положительные только культурально или ПЦР). Всего на опытном приборе протестировано 6 образцов мокроты и 5 образцов бронхо-альвеолярного лаважа (БАЛ) для идентификации M. tuberculosis . Каждый образец параллельно анализировали референтным методом — ПЦР в режиме реального времени на коммерческом наборе ("Амплитуб-РВ") с экстракцией ДНК методом фенол– хлороформ или на колонках.
Испытание на выявление мутаций лекарственной устойчивости
Для проверки работоспособности системы в режиме определения устойчивости к рифампицину была сформирована выборка из 20 образцов мокроты, содержащих рифампицин-устойчивые штаммы M. tuberculosis (мутации в RRDR rpoB), что подтверждалось стандартным ПЦР-анализом "Амплитуб-РВ" и секвенированием. В данную группу вошли клинические пробы от больных с установленным диагнозом МЛУ-ТБ (множественная лекарственная устойчивость туберкулеза), большинство из которых имели известные мутации rpoB (S531L, H526D/Y и др.). Кроме того, тестировались несколько образцов с лекарственночувствительным туберкулезом (дикий тип rpoB) для контроля специфичности. Все пробы анализировались на опытном приборе с использованием одноразовых картриджей, оснащенных экспериментальным набором реагентов для выявления мутаций rpoB (4 молекулярных зонда по числу основных целевых позиций мутаций). Результаты прибор сравнивал с эталонными данными по каждому образцу.
РЕЗУЛЬТАТЫ И ИХ АНАЛИЗ
Детекция M. tuberculosis
В ходе лабораторных испытаний опытный прибор продемонстрировал способность надежно обнаруживать ДНК возбудителя туберкулеза в образцах мокроты или БАЛ. Все протестированные положительные пробы, содержавшие M. tuberculosis, дали положительный результат на приборе, отрицательные контрольные пробы — отрицательный (при этом в них успешно ампли-фицировался ВКО). В табл. 1 приведены данные серии параллельных испытаний опытного образца: результаты анализов на приборе сопоставлены с данными референтного ПЦР-теста. Как видно, наблюдается полное соответствие — прибор не дал ни одного ложного результата в данной выборке. В частности, образец с низкой концентрацией МБТ (№ 2609243) был определен как положительный как нашим прибором, так и референтным методом. Отрицательные по туберкулезу образцы (например, № 2609241) корректно иденти- фицированы прибором как отрицательные (при наличии сигнала ВКО).
Таким образом, чувствительность и специфичность детекции M. tuberculosis на опытном образце, по предварительным оценкам, находятся на уровне 100% по сравнению с лабораторной ПЦР, однако точные показатели будут установлены на расширенной выборке в рамках клинических испытаний.
Выявление мутаций устойчивости к рифампицину
Опытный образец системы успешно прошел проверку на способность идентифицировать мутации, связанные с лекарственной устойчивостью микобактерий. В 20 проанализированных прибором рифампицин-устойчивых образцах мокроты во всех случаях были зафиксированы изменения кривых плавления зондов, свидетельствующие о наличии мутаций в участке rpoB .
Полученные типы сдвигов температуры плавления соответствовали конкретным мутациям: так, сдвиг температуры плавления по зонду Р-2 характерен только для мутации Asp516Tyr . Сдвиг T m по Р-3 возникает при наличии мутаций в кодонах 526 и 531. Для дифференцировки мутаций по 526 и 531 кодону необходимо сравнение с T m Р-4: сдвиг по Р-4 возникает только при мутациях в кодонах 531 и 533, следовательно, при отсутствии сдвига T m по Р-4 сдвиг T m по Р-3 характерен только для мутаций в 526 кодоне. Все результаты, полученные на приборе, совпали с данными референс-методов: мутации rpoB были обнаружены во всех заведомо резистентных образцах и отсутствовали в заведомо чувствительных.
Табл. 1. Сводные данные анализа образцов мокроты и БАЛ с помощью разработанного набора реагентов в автоматическом анализаторе
|
№ образца |
Результат по данным микробиологического анализа. Наличие МБТ/нагрузка |
Результат анализа, полученный на опытном образце (в ПЦР-ячейках) |
Соответствие результатов |
|
|
ВКО |
MTB (IS6110) |
|||
|
2609241 |
– / отсутствует |
+ |
– |
соответствует |
|
2609242 |
+ / высокая |
+ |
+ |
соответствует |
|
2609243 |
+ / низкая |
+ |
+ |
соответствует |
|
2609244 |
+/ высокая |
+ |
+ |
соответствует |
|
2709241 |
– / отсутствует |
+ |
– |
соответствует |
|
2709242 |
– / отсутствует |
+ |
– |
соответствует |
|
5902230050 |
+ / низкая |
+ |
+ |
соответствует |
|
5902230067 |
+ / низкая |
+ |
+ |
соответствует |
|
1002230046 |
– / отсутствует |
+ |
— |
соответствует |
|
1602230072 |
+ / низкая |
+ |
+ |
соответствует |
|
2102230038 |
+ / высокая |
+ |
+ |
соответствует |
Табл. 2. Результаты детекции мутаций путем сравнения температур Tm плавления зондов, связанных с амплифицированным участком RRDR гена rpoB
|
Мутации в кодонах |
Температуры плавления гибридизованных зондов |
|||||
|
P-2 |
P-3 |
P-4 |
||||
|
T m , °С |
(Δ T m , °С )* |
T m , °С |
Δ T m , °С |
T m , °С |
Δ T m , °С |
|
|
Без мутаций (чувствительны к рифампицину) |
70.4 |
— |
71.7 |
— |
63.7 |
— |
|
516 Asp/Tyr |
66.2 |
– 4 |
71.7 |
— |
63.4 |
— |
|
526 His/Arg |
70.6 |
— |
69.7 |
–2.0 |
64.8 |
— |
|
526 His/Asn |
70.0 |
— |
68.2 |
–3.5 |
64.2 |
— |
|
526 His/Leu |
69.6 |
— |
67.8 |
–3.9 |
64.2 |
— |
|
531 Ser/Leu |
71.0 |
— |
69.4 |
–2.3 |
70.6 |
+6.9 |
|
533 Leu/Pro |
69.8 |
— |
71.6 |
— |
58.5 |
–5.2 |
— указана разница относительно температуры плавления зондов с образца без мутаций.
Более того, использование нескольких зондов позволило предварительно дифференцировать конкретные варианты мутаций. Обработанные усредненные данные по температуре плавления для разных типов мутаций приведены в табл. 2.
Таким образом, методика анализа кривых плавления в картридже продемонстрировала работоспособность при идентификации основных мутаций рифампициновой устойчивости M. tuberculosis .
ОБСУЖДЕНИЕ
Оценка результатов испытания прибора
Результаты испытаний опытного образца прибора и картриджа с набором реагентов подтверждают принципиальную реализуемость концепции "автоматическая лаборатория в картридже" применительно к диагностике туберкулеза. Система продемонстрировала высокую чувствительность в обнаружении M. tuberculosis ДНК — использование гнездовой ПЦР позволило достигнуть порога детекции, сопоставимого с лучшими коммерческими тестами. По нашим данным, при помощи гнездового подхода в сочетании с ультразвуковым лизисом удается выявлять порядка 102–103 копий микобактериальной ДНК в пробе объемом ~1 мл (что эквивалентно ~1–10 микобактериям в поле зрения мазка). Это особенно важно для диагностики скрытых форм туберкулеза и внелегочного туберкулеза. Специфичность метода также находится на высоком уровне: праймеры и зонды системы нацелены на уникальную инсерционную последовательность IS6110, присутствующую только у микобактерий туберкулеза, что исключа- ет ложноположительные реакции. В испытаниях не отмечено ни одного случая ложноположительной детекции M. tuberculosis — все отрицательные пробы дали отрицательный результат при корректном срабатывании внутреннего контроля.
Отдельного внимания заслуживает обсуждение возможностей прибора в плане определения лекарственной устойчивости. В представленном опытном образце реализовано выявление устойчивости к рифампицину — ключевому препарату, по которому, как правило, судят о мультирезистентности туберкулеза. Методика основана на принципе выявления мутаций в горячей точке гена rpoB , который давно зарекомендовал себя как надежный молекулярный маркер: более 95% штаммов, устойчивых к рифампицину, несут мутации именно в RRDR rpoB [11]. Наш подход с анализом кривых плавления зондов аналогичен, по сути, используемому в Xpert MTB/RIF и других системах (Hain, Genoscholar и т.д.), но имеет и преимущества, например, несколько зондов позволяют дифференцировать разные мутации, что дает дополнительную информацию о профиле резистентности. Предварительные испытания показали полное соответствие результатов определению rpoB -мутаций референсными методами, т.е. высокую специфичность и чувствительность определения рифампициновой устойчивости.
Возможности определения устойчивости к изониазиду и фторхинолонам
На этапе опытного образца в тест-системе полностью реализована только детекция мутаций гена rpoB. Тем не менее, методические подходы, заложенные в систему, позволяют аналогичным образом выявлять и другие мутации лекарственной устойчивости M. tuberculosis. Принцип основан на амплификации определенных участков генома микобактерий с последующим анализом продуктов с помощью специфических олигонуклеотид-ных зондов. В частности, для изониазида такими мишенями являются мутации гена katG (позиция Ser315Thr) и промотора inhA, а для фторхиноло-нов — мутации в gyrA (т.н. QRDR-область). В перспективе предполагается дополнить картридж реагентами (праймерами и зондами) для детекции данных мутаций, что превратит систему в мультитестовую, аналогичную по функционалу лучшим зарубежным образцам (наподобие Xpert MTB/XDR или гибридизационного анализа).
Наша система изначально создавалась модульной и гибкой: оптический блок с пятью каналами детекции позволяет при наличии соответствующих реагентов параллельно амплифицировать несколько мишеней. Добавление еще 1–2 ПЦР-реакций (например, для генов katG , gyrA ) в картридж не представляет принципиальных затруднений, учитывая запас по числу ПЦР-лунок и каналов детекции. Таким образом, в дальнейшем прибор может быть доработан до уровня платформы для диагностики туберкулеза с широкой панелью лекарственной устойчивости, вплоть до определения мультирезистентного и экстремально резистентного туберкулеза (МЛУ/ШЛУ-ТБ) в одном анализе. Проведенные нами предварительные эксперименты подтверждают, что разработанный прибор и программное обеспечение готовы к расширению панели. Так, ПЦР-метод с использованием зондов на других генах микобактерий (например, katG ) успешно апробирован на макете прибора, и ожидается его внедрение в следующей версии тест-системы. Таким образом, созданная платформа обладает высоким потенциалом для комплексной диагностики лекарственно-устойчивого туберкулеза.
Технологические преимущества разработанной системы включают не только ее диагностические характеристики, но и удобство использования и безопасность. Прибор рассчитан на применение непосредственно в местах оказания помощи (в смотровом кабинете, процедурной, и т.п.), т.е. по концепции point-of-care. Оператору не требуется выполнять сложных манипуляций — достаточно поместить пробу мокроты в картридж и запустить анализ. Все потенциально опасные этапы (лизис, инактивация патогена, амплификация) происходят внутри закрытого картриджа, что минимизирует риск инфицирования персонала и контаминации помещения возбудителем или ампликонами. После завершения анализа использованный картридж может быть безопасно утилизирован как инфекционный отход. Предусмотрена возможность встроенной дезинфекции лотка при- борного отсека после извлечения картриджа (например, посредством УФ-излучения или обработкой дезраствором), что дополнительно обеспечивает эпидемиологическую безопасность при серийном использовании прибора.
Автономность и мобильность прибора также являются значимыми преимуществами. Анализатор имеет относительно небольшие размеры и вес, может транспортироваться в переносном кейсе. Энергопотребление невысоко; возможно питание как от сети ~220 В, так и от портативного источника (аккумулятора), что важно для полевых условий. Все реагенты стабилизированы в картридже (лиофилизированы), срок их хранения при комнатной температуре составляет не менее нескольких месяцев, а при холодильном хранении — 1 год и более (эти параметры еще уточняются). Таким образом, систему можно применять в отдаленных регионах, мобильных противотуберкулезных лабораториях, при обследовании мигрантов, заключенных и др., где развертывание полноценной лаборатории затруднительно.
ЗАКЛЮЧЕНИЕ
В рамках настоящей работы разработан и изготовлен опытный образец автоматизированной системы для молекулярно-генетической диагностики туберкулеза, включающей портативный анализатор и одноразовый картридж с реагентами. Лабораторные испытания подтвердили работоспособность системы: она успешно выделяет ДНК M. tuberculosis из нативных образцов мокроты и БАЛ и обнаруживает целевой фрагмент методом гнездовой ПЦР-РВ, обеспечивая чувствительность, сопоставимую с традиционными методами. Встроенный внутренний контроль и оптимизация протокола позволили добиться высокой надежности результатов даже на сложных образцах. Реализован также метод молекулярной детекции рифампицин-резистентности микобактерий — идентификация мутаций гена rpoB по изменению температуры плавления специальных зондов, — который показал полное соответствие данным референсного анализа.
Полученные результаты демонстрируют существенные технологические преимущества предлагаемой системы. Полная автоматизация всех этапов — от лизиса образца до выдачи результата — устраняет влияние человеческого фактора и сокращает время получения диагноза до 2 ч. Использование формата "картридж" обеспечивает максимальную простоту и безопасность работы, а портативность прибора — возможность проводить диагностику непосредственно у постели пациента или в полевых условиях (прикроватный тест). Таким образом, данный прибор может найти широкое применение в фтизиатрической практике: для экспресс-выявления туберкулеза у лиц с подозрением на заболевание, скрининга на туберкулез в популяциях высокого риска, оперативного определения лекарственной устойчивости (что особенно важно при МЛУ-ТБ) и т. д.
В перспективе развитие данной платформы будет продолжено. Предстоят ее клиническая оценка в многоцентровом исследовании, доработка конструкции с целью подготовки к промышленному производству, а также расширение возможностей тестирования. Планируется внедрение в картридж дополнительных реакций для определения устойчивости к изониазиду, фторхинолонам и другим ключевым препаратам, что сделает систему полноценным инструментом персонифицированной диагностики туберкулеза. Учитывая стратегическую важность борьбы с туберкулезом и рост доли лекарственно-устойчивых форм, предлагаемая отечественная разработка имеет большие шансы занять нишу в ряду передовых диагностических технологий и внести вклад в улучшение эпидемиологической ситуации по туберкулезу. Описываемая разработка демонстрирует глубинное влияние новых научных знаний и достижений на отраслевое приборостроение.
Список литературы Разработка и лабораторные испытания опытного образца автоматизированного устройства для диагностики туберкулеза методом ПЦР в режиме реального времени
- 1. Organization, 2024. Global tuberculosis report 2024. Geneva: World Health. 69 p. ULR: https://iris.who.int/server/api/core/bitstreams/7292c91effb0-4cef-ac39-0200f06961ea/content
- 2. Васильева И.А., Тестов В.В., Стерликов С.А. Эпидемическая ситуация по туберкулезу в годы пандемии COVID-19 — 2020–2021 гг. // Туберкулез и болезни легких. 2022. Т. 100, № 3. С. 6–12. DOI: 10.21292/2075-1230-2022-100-3-6-12
- 3. Васильева И.А., Тестов В.В., Стерликов С.А., Бурыхин В.С., Кудрина В.Г., Урушадзе Н.Д. Факторы риска летального исхода у больных туберкулезом с устойчивостью к рифампицину по данным федерального регистра лиц, больных туберкулезом // Туберкулез и болезни легких. 2024. Т. 102, № 6. С. 40–47. DOI: 10.58838/2075-1230-2024-102-6-40-47
- 4. Chakravorty S., Simmons A.M., Rowneki M., et al. The New Xpert MTB/RIF Ultra: Improving Detection of Mycobacterium tuberculosis and Resistance to Rifampin in an Assay Suitable for Point-of-Care Testing // mBio. 2017. Vol. 8, no. 4. DOI: 10.1128/mbio.00812-17
- 5. Walzl G., McNerney R., du Plessis N., Bates M., McHugh T.D., Chegou N.N., Zumla A. Tuberculosis: advances and challenges in development of new diagnostics and biomarkers // Lancet Infect Dis. 2018. Vol. 18, no. 7. P. e199–e210. DOI: 10.1016/S1473-3099(18)30111-7
- 6. Беляев Д.В., Умпелева Т.В., Дианов Д.В., Лавренчук Л.С., Ботева Т.Ю., Вахрушева Д.В. Фенотипическая устойчивость к рифампицину у Mycobacterium tuberculosis с мутацией rpoB Leu430Pro // Туберкулез и болезни легких. 2024. Т. 102, № 5. С. 64–69. DOI: 10.58838/2075-1230-2024-102-5-64-69
- 7. Umpeleva T., Chernikova E., Belyaev D., Eremeeva N., Boteva T., Golubeva L., Vakhrusheva D.V., Vasilyeva I.A. Identification of genetic determinants of bedaquiline resistance in Mycobacterium tuberculosis in Ural region, Russia // Microbiology spectrum. 2024. Vol. 12, no. 3. Id. e0374923. P.1–5. DOI: 10.1128/spectrum.03749-23
- 8. Бурмистрова И.А., Ваниев Э.В., Самойлова А.Г., Ловачева О.В., Васильева И.А. Нарастание спектра лекарственной устойчивости возбудителя на фоне неадекватной химиотерапии туберкулеза легких // Туберкулез и болезни легких. 2019. Т. 97, № 8. С. 46–
- 51. DOI: 10.21292/2075-1230-2019-97-8-46-51
- 9. Boom R., Sol C.J., Salimans M.M., Jansen C.L., Wertheim-van Dillen P.M., van der Noordaa J. Rapid and simple method for purification of nucleic acids // J. Clin. Microbiol. 1990. Vol. 28, no. 3. P. 495–503. DOI: 10.1128/jcm.28.3.495-503.1990
- 10. Васильева И.А., Самойлова А.Г., Эргешов А.Э., Багдасарян Т.Р., Черноусова Л.Н. Химиотерапия туберкулеза: проблемы и перспективы // Вестник Российской академии медицинских наук. 2012. Т. 67, № 11. С. 9–14. DOI: 10.15690/vramn.v67i11.465
- 11. Umpeleva T., Belyaev D., Dianov D., Lavrenchuk L., Boteva T., Vakhrusheva D. Mutations outside RRDR lead to increased MICs for M. tuberculosis isolated with “borderline” rpoB mutations // African Journal of Biological Sciences. 2024. Vol. 6, No. 8. P. 2778–2782. URL:
- https://www.afjbs.com/issue-content/mutations-outsiderrdr-lead-to-increased-mics-for-m-tuberculosis-isolateswith-borderline-rpob-mutations-3077


