Разработка и валидация методик хроматографического определения для идентификации, количественной оценки препаратов карбоновых кислот
Автор: Бакина К.Д., Зеленова М.П., Потехина Е.А., Топорец Т.А., Симонян Е.В.
Журнал: Мировая наука @science-j
Рубрика: Основной раздел
Статья в выпуске: 6 (15), 2018 года.
Бесплатный доступ
В статье описываются результаты исследований, проведенных с целью разработки и валидации методик хроматографического определения для идентификации и количественной оценки препаратов карбоновых кислот. В ходе исследований изучена подвижность веществ в растворителях с различной элюирующей способностью. Экспериментально установлено, что наиболее эффективными для идентификации изучаемых веществ являются смеси растворителей с величиной диэлектрической проницаемости равной 0,6. На основании полученных элюотропных рядов были предложены различные бинарные системы растворителей, из которых оптимальными свойствами обладала система этилацетат - спирт этиловый. Для дальнейшей модификации предложенного метода проводилось исследование по влиянию процесса импрегнирования пластинок поверхностно - активными веществами. Для этого целесообразно использовать катионоактивные четвертичные аммониевые основания, в частности цетилпиридиния хлорид.
Жидкостная адсорбционная хроматография, элюирующая способность, растворитель, элюотропные ряды, детектирование
Короткий адрес: https://sciup.org/140263645
IDR: 140263645
Текст научной статьи Разработка и валидация методик хроматографического определения для идентификации, количественной оценки препаратов карбоновых кислот
Выбор элюента в жидкостной адсорбционной хроматографии играет более значимую роль, чем выбор неподвижной фазы. Растворитель напрямую участвует в самом процессе разделения, в связи с чем, изменяя природу растворителей подвижной фазы, возможно в широких пределах изменять удерживание и селективность разделения на одних и тех же адсорбентах. Для получения оптимальных значений R f экспериментально подбирают растворители с определенной элюирующей способностью. Самый простой способ получения подвижной фазы с любой элюирующей способностью состоит в смешивании двух растворителей с разной полярностью [1]. Основной целью исследования была разработка унифицированного метода идентификации для некоторых лекарственных препаратов – производных карбоновых кислот. В качестве объекта исследования нами были выбраны кислота янтарная, фумаровая, никотиновая и глутаминовая. В ходе исследования изучена подвижность веществ в растворителях с различной элюирующей способностью. Результаты представлены в таблице 1.
Таблица 1 - Подвижность некоторых производных карбоновых кислот в растворителях с различной элюирующей способностью
|
Растворитель |
5 я ° о у 2 К У я 8 Я О |
8 я я 8 ся м |
5 я S ^ 5 е |
о я я н |
§ я 2 н я о я к |
|
Бензол |
2,3 |
0,05 |
0 |
0 |
0 |
|
Толуол |
2,3 |
0 |
0 |
0 |
0 |
|
Диэтиловый эфир |
4,2 |
0,45 |
0,19 |
0,01 |
0,88 |
|
Хлороформ |
4,8 |
0 |
0 |
0,03 |
0,03 |
|
Этилацетат |
6,0 |
0 |
0,08 |
0,78 |
0,16 |
|
Кислота ледяная уксусная |
6,2 |
0,84 |
- |
- |
0,6 |
|
Пиридин |
12,9 |
0,05 |
0,03 |
0 |
0,48 |
|
Изоамиловый спирт |
15,2 |
0,65 |
0 |
0,2 |
0,13 |
|
Аммиак |
16,5 |
0,98 |
0,98 |
0,98 |
0,96 |
|
Бутанол |
17,8 |
0,7 |
0,05 |
0,03 |
0,12 |
|
Ацетон |
20,7 |
0,8 |
0,15 |
0 |
0,09 |
|
Изопропанол |
21,8 |
0 |
0 |
0 |
0,15 |
|
Этанол |
24,5 |
0,8 |
0,38 |
- |
0,8 |
|
ДМФА |
36,7 |
0,95 |
0 |
- |
- |
|
Ацетонитрил |
37,5 |
0,74 |
0,2 |
0 |
0,073 |
|
Вода |
78,5 |
0,96 |
0,98 |
0,99 |
0,99 |
Величина Rf 0,4 – 0,7 наблюдалась при использовании растворителей с величиной диэлектрической проницаемости не более 20. На основании полученных данных предложены бинарные системы растворителей с рассчитанной элюирующей способностью. Расчет проводили по формуле [3]:
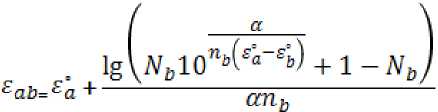
, где
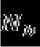
– мольная доля более сильного растворителя;
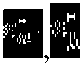
– значения для чистых растворителей;
(≈Ax) – площадь, необходимая для размещения молекулы растворителя B на поверхности;
a - параметр активности;
Параметр Nb рассчитывали по формуле:
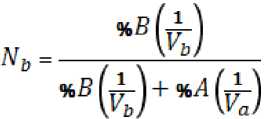
, где
∨ а
- величины, обратные мольной доле.
Экспериментально установлено, что наиболее эффективными для идентификации изучаемых веществ являются смеси растворителей с величиной диэлектрической проницаемости равной 0,6. В дальнейшем, для выбора оптимальных соотношений растворителей, формулу преобразовали:
1 (IQ ® / п ( Е а - Е в ) - 1)
∨ в
А
В
(1Q
а п ( Е Q - а пЕ а )
∨
а
- 1)
∨ в
Для более эффективной работы, была написана программа на основе VisualBasic. Электронная таблица преобразуется посредством объектноориентированной модели кода и данных, которые мгновенно обрабатываются. Таблица становится интерфейсом кода, позволяя легко работать изменять его и управлять расчётами. Смешением двух растворителей с разной полярностью можно приготовить систему с любой элюирующей способностью. На основании полученных элюотропных рядов были предложены различные бинарные системы растворителей, из которых оптимальными свойствами обладала система этилацетат – спирт этиловый. Хроматографирование проводили в данной бинарной системе растворителей с различным соотношением более полярного растворителя (спирта этилового), от 10 до 90% по объему, результаты определения приведены в таблице 2.
Таблица 2 - Определение подвижности кислоты янтарной в системе растворителей этилацетат - спирт этиловый
|
Соотношение растворителей этилацетат: спирт этиловый |
Элюирующая способность системы |
Величина R f кислоты янтарной |
|||
|
Кислота никотиновая |
Кислота глутаминовая |
Кислота фумаровая |
Кислота янтарная |
||
|
9:1 |
0,779 |
0,345 |
0,730 |
0,223 |
0,764 |
|
8:2 |
0,815 |
0,405 |
0,734 |
0,307 |
0,802 |
|
7:3 |
0,833 |
0,412 |
0, 740 |
0,207 |
0,805 |
|
6:4 |
0,850 |
0,388 |
0,738 |
0,212 |
0,812 |
|
5:5 |
0,855 |
0,371 |
0,741 |
0 |
0,815 |
|
4:6 |
0,862 |
0,367 |
Хвост |
0 |
0,823 |
|
3:7 |
0,868 |
Хвост |
Хвост |
0 |
0,823 |
|
2:8 |
0,872 |
Хвост |
Хвост |
0 |
0,834 |
|
1:9 |
0,877 |
Хвост |
Хвост |
0 |
0,830 |
|
0:10 |
0,88 |
0 |
Хвост |
0 |
0,843 |
|
10:0 |
0,48 |
0 |
Хвост |
0 |
0 |
Доказано, что введение более полярного для кислоты янтарной вызывает сначала резкое увеличение элюирующей способности системы, но дальнейшее возрастание его концентрации практически не изменяет свойств системы, носит асимптотический характер, что согласуется с литературными данными. Крутизна начального подъема экспоненциальной кривой тем больше, чем больше различия в полярности обоих растворителей. Кислота фумаровая при соотношении растворителей 1:1 и с дальнейшим увеличением концентрации спирта этилового остается на старте, а для кислоты никотиновой и глутаминовой происходит неполный отрыв вещества от линии старта.
Детектирование осуществляли 0,1% спиртовым раствором метилового красного, а для проявления кислоты глутаминовой использовали раствор 0,1% нингидрина в спирте этиловом с дальнейшим нагреванием на плитке [2].
Для дальнейшей модификации предложенной методики мы проводили исследование по влиянию процесса импрегнирования пластинок поверхностно - активными веществами. Для этого целесообразно использовать катионоактивные четвертичные аммониевые основания, в частности цетилпиридиния хлорид. Известно, что изотерма адсорбции катионных ПАВ имеет два плато: первое характеризует нейтрализацию заряда поверхности силикагеля, при этом мономеры катионного ПАВ замещают адсорбированные молекулы воды, а второе отвечает за образование гемимицелл на поверхности за счет гидрофобных взаимодействий между хвостами мономеров поверхностно-активных веществ [4]. Мицелярные свойства цетилпиридиния хлорида (ЦПХ) подходят для использования в хроматографии: точка Крафта (температура, выше которой возможно мицеллообразование) составляет 19,5°С, а критическая концентрация мицеллообразования 9,0Л0-4 моль/л. В связи с этим мы предложили проводить идентификацию наших производных карбоновых кислот следующим образом. Хроматографическую пластинку «Сорбфил» помещали в камеру с раствором цетилпиридиния хлорида 0,001 %. После того, как фронт растворителей достигнет линии финиша, пластинку вынимали, высушивали в течение 2 часов, а затем на линию старта наносили по 5 мкл 0,1% водно-спиртовых растворов (1:1) кислоты фумаровой, янтарной, никотиновой, глутаминовой и хроматографировали после высушивания восходящим методом в камере, предварительно насыщенной системой растворителей этилацетат – спирт этиловый (8:2). Затем пластинку вынимали, высушивали и детектировали. На хроматограмме наблюдались четкие пятна овальной формы.
Список литературы Разработка и валидация методик хроматографического определения для идентификации, количественной оценки препаратов карбоновых кислот
- Бёккер, Ю. Хроматография. Инструментальная аналитика: методы хроматографии и капиллярного электрофореза / Ю. Бёккер. - Москва: Техносфера, 2009. - 458 с.
- Ворожейкин, С.Б. Тонкослойная хроматография аминокислот в мицеллярных подвижных фазах на силикагеле / С.Б. Ворожейкин, Е.С. Башко, С.Н. Штыков // Сорбционные и хроматографические процессы. - 2011. - Т.11, № 6. - С. 840-847.
- Шаповалов, Е.Н. Хроматографические методы анализа: метод. пособие / Е.Н. Шаповалов, А.В. Пирогов. - Москва: Изд-во МГУ им. М. В. Ломоносова, 2007. - 110 с.
- Kung, K.H.S. Fourier transform infrared spectroscopic study of the adsorption of cetyltrimethylammonium bromide and cetylpyridinium chloride on silica / K.H.S. Kung, K.F. Hayes // Langmuir. - 1993. - Vol. 9, №1. - P. 263-267


