Разработка экологически безопасных средств регенерации ионообменных мембран после их отравления полифенолами
Автор: Корж К.О., Мысак А.П., Ишмухаметова Р.И.
Журнал: Форум молодых ученых @forum-nauka
Статья в выпуске: 8 (36), 2019 года.
Бесплатный доступ
В статье предложен экологически безопасный, простой и доступный способ регенерации ИОМ после их отравления полифенолами на производстве.
Ионообменная мембрана, полифенол, регенерация, фаулинг
Короткий адрес: https://sciup.org/140286980
IDR: 140286980 | УДК: 544.726
Текст научной статьи Разработка экологически безопасных средств регенерации ионообменных мембран после их отравления полифенолами
Большие объемы опасных стоков, образовавшихся после регенерации ИОМ и ИОС требуют дальнейшей нейтрализации и переработки. Данные процессы являются экологически нецелесообразными и энерго/ресурсозатратными.
Замена щелочей и кислот на альтернативные менее опасные вещества для целей регенерации ИОМ и ИОС может существенно увеличить экологическую целесообразность (электро) мембранных методов переработки соков и вина в пищевой промышленности.
В литературе описываются различные экологически безопасные химические методы очистки ионообменных материалов: раствор NaCl, восстановленный раствор морской воды и смесь этанола с водой [1, 2]. Было установлено, что солевые растворы эффективны только для очистки поверхности, поскольку процесс регенерации в этом случае ограничен удалением части наночастиц с поверхности мембраны (контактный угол смачивания уменьшается на 16%). Аналогично, при использовании кислотно-спиртовой смеси, это значение составило более 23%. В дополнение к значительному увеличению ионообменной емкости и объемной доли «межгелевого» раствора, по меньшей мере, на 33% и 61%, соответственно, происходит удвоение значения электропроводности после 120 часов обработки. Последняя химическая обработка представляла собой наиболее подходящий метод для интерстициальной и внешней очистки с удовлетворительными показателями в отношении адекватности результатов, полученных для ИОМ. Значительное восстановление электропроводности более заметно для ИОМ из-за расширения пор.
Когда дело доходит до использования наиболее подходящего метода регенерации мембран в процессах динамической очистки в промышленности, который представляет собой обработку мембран смесью вода-этанол, продолжительность работы может быть уменьшена до 12-24 часов в режиме динамической очистки. В последнем режиме можно избежать повторного осаждения загрязняющих веществ, извлеченных в раствор, на поверхность мембран.
В целях снижения воздействия на окружающую среду, этанол, используемый в процессе регенерации мембран, извлекается путем дистилляции и может быть использован снова.
В качестве объектов исследования были выбраны две анионообменные мембраны:
-
- гомогенная мембрана AMX-Sb (Astom, Япония). Эта мембрана часто используется в электродиализной обработке жидкостей в пищевой промышленности (переработка сыворотки, вина, соков и т. д.). Она изготовлена пастовым методомом [3]. Ионообменная матрица AMX-Sb состоит из сополимера стирола и дивинилбензола. Фиксированные группы представляют собой, главным образом, четвертичные аммониевые основания [4]. Мембрана также содержит инертный наполнитель: гранулы поливинилхлорида, диаметр которых составляет около 60 нм;
-
- гетерогенная мембрана MA-41П (Schekinoazot, Россия) имеет макропористую структуру, полученную путем горячего прессования порошкообразной анионообменной смолы АВ-17-2П и полиэтилена низкого давления, действующего как инертное связующее. Для повышения механической стойкости мембраны используется капроновая сетка. Смола АВ-17-2П представляет собой регулярно сшитый сополимер дивинилбензола и стирола с фиксированными четвертичными аммониевыми основаниями в качестве функциональных групп [5]. Около 80% поверхности мембраны MA-41П покрыто полиэтиленом. Частицы смолы, которые выступают через полиэтилен, обеспечивают ионную проводимость мембраны.
Таблица 1 – Объекты исследования
|
Мембран |
Производител |
Страна |
Тип |
Толщина, |
f 2 * |
|
а |
ь |
мкм |
|||
|
AMX-Sb |
Astom |
Япония |
Гомогенная |
135 |
0,10 |
|
MA-41П |
ОАО Щекиноазот |
Россия |
Гетерогенная |
525 |
0,25 |
* f 2 – это объемная доля электронейтрального раствора в мембране.
В задачи регенерации входит: коагулировать коллоидную частицу и фактически убрать ее из узкого канала, по которому происходит транспорт противоионов. После этого в мембране могут остаться отдельные продукты разрушения коллоидной частицы. Эти вещества могут взаимодействовать с фиксированными группами мембраны. Т.е., чтобы добиться полной регенерации мембран, из них нужно также устранить данные вещества. Применение солевых растворов помогает решить первую задачу (убрать коллоидную частицу из узкого канала). Для исследования было предложено использование солевого раствора NaCl.
Воздействие раствора хлорида натрия на коллоидную частицу обусловлено его свойством двухзарядности, тем самым он одинаково взаимодействует как с положительно, так и с отрицательно заряженными частицами загрязнителя.
Из литературных источников известно, что на процесс регенерации мембран лучше всего влияет этиловый спирт с низким значением рН [6, 7]. Антоцианы и танины заряжены отрицательно, т.к. поровый раствор мембраны всегда имеет более щелочную среду, независимо от свойств среды внешнего раствора. Поэтому подкисленный раствор нейтрализует антоцианы и танины, частички распадаются, а этиловый спирт экстрагирует их продукты распада.
Таким образом, было решено подщелачивать спирт для проверки гипотезы о том, будет ли идти процесс регенерации мембран в растворе этанола при условии, что заряды коллоидных частиц не будут нейтрализованы.
Из ранее проведенных исследований известно, что низкая концентрация раствора электролита (например, 0,02 M NaCl) малоэффективна для регенерации мембран, в то время, как высокая концентрация (более 0.5 М), может создать проблему утилизации соленых стоков после регенерации. Поэтому, оптимальная эквивалентная концентрация растворов электролитов, примененных в данной работе, выбрана равной 0,2 М. Из аналогичных соображений и данных о ПДК, этиловый спирт был разбавлен до 12%.
Перед началом эксперимента была проведена солевая подготовка исследуемых мембран с целью перевода их в хлор-форму. Далее образцы мембран были отмыты дистиллированной водой до значений электропроводности раствора, уравновешенного с мембранами, ниже 10 μSm. Каждая из анионообменных мембран АМХ-Sb и MA-41П была разделена на 4 равные части с размерами 5×5 см. Каждый образец каждой мембраны был погружен в 0,2 М раствор NaCl и 12% раствор C2H5OH (рН = 9). Сначала была измерена электропроводность каждого из образцов в соответствующем ему 0,2 М растворе. Далее образцы были помещены в красное вино марки Gai Kodzor и выдерживались в нем на протяжении 120 часов. После, каждый образец каждой из мембран помещался в емкость (250 мл) с 0.2 М растворами NaCl и в 12% раствор этанола. Через 30 минут с момента погружения каждого образца в регенерирующие растворы была измерена электропроводность образцов мембран. Измерение электропроводности каждого образца мембран проводилось каждый час в течение первых 10 часов; далее было произведено еще по 6-8 измерений в промежутке от 10 до 120 часов. На протяжении всего исследования температура растворов и образцов мембран поддерживалась на уровне 25,5 V.
Одной из важнейших физических характеристик мембран является их электропроводность. Измерение электропроводности исследуемых мембран проводилось разностным методом с помощью ячейки-«пинцета», состоящей из двух симметричных частей и измерителя иммитанса MOTECH MT4080 при частоте переменного тока 1 кГц. После достижения постоянной температуры 25,5 °С проводились измерения в пяти разных точках исследуемого образца мембраны. Измерялось сопротивление ячейки с исследуемым раствором (Rsol) и сопротивление ячейки с мембраной в равновесном растворе (Rmb+sol). Сопротивление мембраны (R*) находилось как разность двух измерений:
*
R = Rmb + sol — R sol (1)
Значение электропроводности мембраны определяли по уравнению:
*
к
^ mb
R* ’
где к* - удельная электропроводность мембраны, dmb - толщина мембраны,
R* - электрическое сопротивление мембраны.
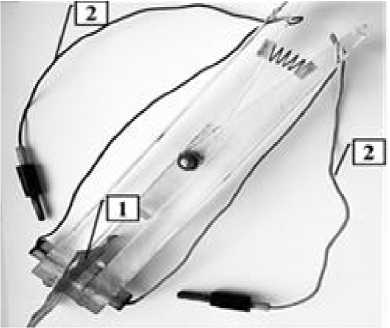
а
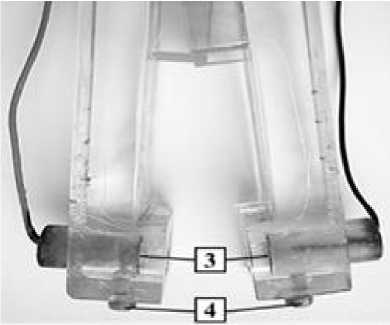
Рисунок 1 – Изображение ячейки - «пинцета» (а) и её измерительной части (б): зажатая между двумя полуячейками мембрана (1); изолированные проводники (2), соединяющие ячейку с измерительным прибором; платиновые платинированные электроды (3) и винты (4), которые фиксируют положение электродов
б
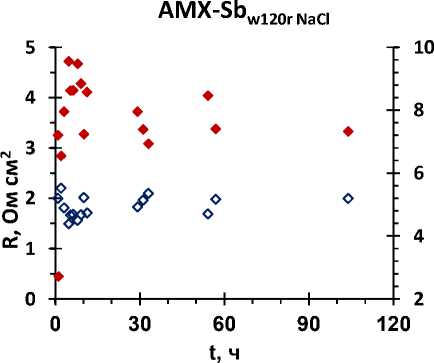
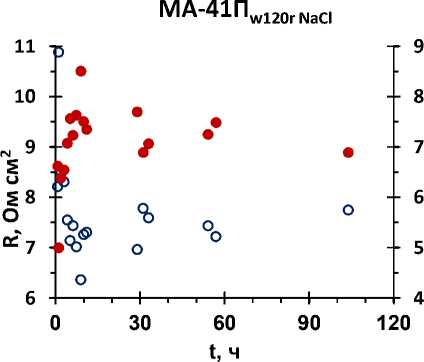
На рисунках 2 – 3 представлены электропроводность и сопротивление образцов мембран в зависимости от времени их выдержки в регенерирующих растворах.
о Сопротивление ♦ Электропроводность
κ, мСм см-1
о Сопротивление о Электропроводность
а
б
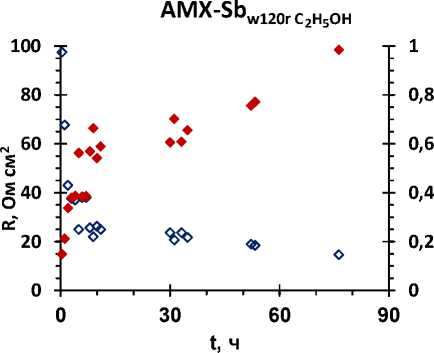
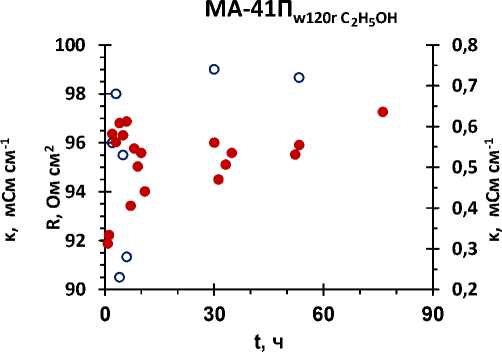
Рисунок 2 – Зависимость электропроводности (к, мСм*см-1) и сопротивления (R, Ом*см2) мембран (а) AMX-Sb, (б) MA-41П от времени их выдержки в 0,2 М растворе NaCl
о Сопротивление ♦ Электропроводность о Сопротивление • Электропроводность
а
б
Рисунок 3 – Зависимость электропроводности (к, мСм*см-1) и сопротивления (R, Ом*см2) мембран (а) AMX-Sb, (б) MA-41П от времени их выдержки в 12% растворе C2H5OH
На рисунках 4 – 5 представлены кинетические зависимости приведенной электропроводности мембран в процессе их регенерации.
Значения электропроводности неотравленных в вине (исходных) мембран в растворах NaCl и 12% растворе С 2 H 5 OH (pH = 9) приведены в таблице 2.
1,2 ++
0,8
I 0,8
0,4
AMX-Sbwr
I I I I I I I I I I 30 60 90 120
t, ч
I 0,6
I 0,4
0,2
MA-41Пwr
0 -I—I—I—I—I—I—I—I—I—I—I—I—I
0 30 60 90 120
t, ч
Таблица 2 – Значение электропроводности к (mS*см-1) исследуемых растворах
|
Мембрана\раствор |
NaCl |
C 2 H 5 OH |
|
AMX-Sb |
5.91 |
1.06 |
|
МА-41П |
7.50 |
1.15 |
1,6
1,2
а
б
Рисунок 4 – Кинетическая зависимость приведенной электропроводности мембран (а) AMX-Sb, (б) MA-41П в процессе их регенерации в 0,2 М растворе NaCl
0,8 .#■
I 0,6 1 + о + + * ■+
£ 0,4 Т ■**
* 0,2 т AMX-Sb wr
0 -------------.-------------1-------------.-------------1-------------.1
0 20 4060
t, ч
а
0,8
X 0,6 о
^ 0,4
* 0,2
МА-41Пwr
30 60 90
t, ч
б
Рисунок 5 – Кинетическая зависимость приведенной электропроводности мембран (а) AMX-Sb, (б) MA-41П в процессе их регенерации в 12% растворе C 2 H 5 OH
Анализ результатов показал, что этиловый спирт с рН = 9 решающей роли в регенерации мембран не играет. Важным является нейтрализация коллоидных частиц, их разрушение и последующая экстракция. В растворе NaCl процесс регенерации выше.
AMX-Sb имеет наименьшее значение f 2 (объемной доли электронейтрального раствора) среди всех изученных мембран. Чем меньше значение f 2 , тем меньше доля пор, в которых могут образовываться коллоидные частицы.
Результаты обработки экспериментальных данных по электропроводности показали, что крупнопористые мембраны лучше поддаются регенерации.
На рисунке 6 представлены нормированные электропроводности мембран в состоянии равновесия с регенерирующим раствором (спустя 30 часов с момента начала регенерации). Нормировка предполагает деление значений электропроводности образцов в процессе регенерации на их электропроводность в соответствующем регенерирующем растворе до выдерживания в вине.
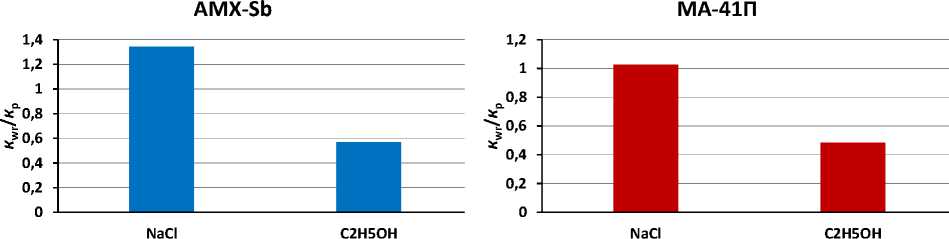
Рисунок 6 – Нормированная электропроводность мембран в состоянии равновесия с регенерирующим раствором
Из рисунка 6 видно, что регенерация пористой мембраны AMX-Sb в электролите (NaCl) достигает 100%-го результата и больше, так как он не является комплексообразователем. Этот эффект достигнут за счет расширения пор и увеличения объемной доли электронейтрального раствора в мембране ( f 2 ). По этой причине наблюдается рост электропроводности мембран.
Электропроводность этилового спирта низкая. Поры мембраны расширены за счет образования коллоидных частиц, и спирт не оказывает значительного влияния на ее матрицу.
В спирте с щелочной средой отрицательно заряженные антоцианы приобретают еще более отрицательный заряд и сильнее связываются с фиксированными группами мембраны. Регенерация мембраны в данном растворе будет невозможна без предварительного разрушения коллоидных частиц.
Список литературы Разработка экологически безопасных средств регенерации ионообменных мембран после их отравления полифенолами
- Ghalloussi R. et al. Ageing of ion-exchange membranes in electrodialysis: A structural and physicochemical investigation //Journal of membrane science. - 2013. - Т. 436. - С. 68-78.
- Strathmann H. Ion-exchange membrane separation processes. - Elsevier, 2004. - Т. 9.
- Astom corporation ion exchange membranes, (n.d.). http://www.astomcorp.jp/en/product/10.html.
- Сарапулова В. В. и др. Эволюция электрохимических характеристик мембраны АМХ-Sb после контакта её поверхности с красным вином //Сорбционные и хроматографические процессы. - 2016. - Т. 16. - №. 5. - С. 672-685.
- United Chemical Company Shchekinoazot. Products. http://www.azotom.ru/monopolyarnye-membrany
- Vernhet A. et al. Relative impact of major wine polysaccharides on the performances of an organic microfiltration membrane //American Journal of Enology and Viticulture. - 1999. - Т. 50. - №. 1. - С. 51-56.
- Blanpain P., Lalande M. Investigation of fouling mechanisms governing permeate flux in the crossflow microFiltration of beer //Filtration
- Corti S. V. et al. Tartaric stabilization of wines: comparison between electrodyalisis and cold by contact //Revista de la Facultad de Ciencias Agrarias, Universidad Nacional de Cuyo. - 2016. - Т. 48. - №. 1. - С. 225-238.
- Kotsanopoulos K. V., Arvanitoyannis I. S. Membrane processing technology in the food industry: food processing, wastewater treatment, and effects on physical, microbiological, organoleptic, and nutritional properties of foods //Critical reviews in food science and nutrition. - 2015. - Т. 55. - №. 9. - С. 1147-1175.
- Conidi C. et al. Separation and purification of phenolic compounds from pomegranate juice by ultrafiltration and nanofiltration membranes //Journal of Food Engineering. - 2017. - Т. 195. - С. 1-13.
- Bazinet L., Doyen A. Antioxidants, mechanisms, and recovery by membrane processes //Critical reviews in food science and nutrition. - 2017. - Т. 57. - №. 4. - С. 677-700.


