Разработка элементов методики апомиктического размножения селекционно ценных образцов капусты кочанной
Автор: Кондратенко С.И., Чернышенко Т.В., Артемьева А.М.
Журнал: Овощи России @vegetables
Рубрика: Теория и практика селекции овощных культур
Статья в выпуске: 2 (11), 2011 года.
Бесплатный доступ
Выявлены экзогенные факторы, влияющие на проявление апомиксиса у капусты кочанной. Апомиктическое развитие семенных зародышей было получено у трех сортов капусты белокочанной - Яна, Лазурная и Леся украинской селекции. Удалось индуцировать незавершенный органогенез партеногенетических семян у четырех сортов капусты кочанной. Проявление нерегулярного апомиксиса было вызвано синергическим действием фитогормональных регуляторов и чужеродной пыльцы при условии одновременного нанесения водной смеси гиббереллина и ци-токинина на основание пестика, а чужеродной пыльцы (китайской редьки Лоба) - на рыльца пестиков кастрированных бутонов капусты за 2-3 суток до их раскрытия.
Капуста кочанная, апомиксис, экзогенные факторы
Короткий адрес: https://sciup.org/14024880
IDR: 14024880 | УДК: 582.683.2:581.1:631.811.982
Текст научной статьи Разработка элементов методики апомиктического размножения селекционно ценных образцов капусты кочанной
Апомиксис – природное явление, заключающееся в развитии зародыша из яйцеклетки или другой клетки зародышевого мешка при отсутствии опыления. Такой тип апомиксиса называется партеногенезом или апогамией и встречается в природе с достаточно низкой частотой проявления (10-6) [1]. В последнее время исследователями предпринимаются попытки индуцировать нерегулярный апомиксис у важнейших сельскохозяйственных растений. К сожалению, у большинства из них почти полностью отсутствует способность к апогамии. Согласно литературным данным у капусты кочанной удалось получить пар- теногенетические семена после экзогенной обработки неоплодотво-ренных завязей фитогормонами или их синтетическими аналогами, дей- ствие которых заключалось в стимуляции митотического деления и удвоения числа хромосом неоплодот-воренных яйцеклеток [2, 3]. Этими же авторами было показано, что на фенотипическое проявление партеногенеза в значительной степени влияет генотип растения, фаза развития зародышевого мешка, вид фитогормонов, их весовые соотношения в апомиктическом агенте для обработки и нормы расхода данного агента на одну неоплодотворенную яйцеклетку [2-4]. Учитывая литературные данные, в задачу наших исследований входила эксперимен- тальная проверка уже предложенных методик индуцирования нерегулярного апомиксиса капусты кочанной и возможная их оптимизация в случае получения отрицательного результата при использовании на наших растительных объектах.
Материалы и методы
Для получения апомиктических семян капусты кочанной использовались элементы методик, предложенные в работах [2, 4]. В качестве объектов исследований были использованы семенники капусты белокочанной сортов Лазурная, Лика, Леся, Белоснежка, Яна, Харьковская зимняя и капусты краснокочанной сорта Палета. В опыте изучались семенники капусты на начальном периоде фазы цветения (распускание цветков на главном стебле и осях первого порядка верхнего яруса). Для получения апомиктических семян первоначально проводилась процедура кастрации бутонов полностью сформированных цветков за 2-3 суток до их раскрытия. Кастрированные бутоны обрабатывали модифицированными вариантами апомиктического агента (АГ), в основе которого было обязательное присутствие водной смеси регуляторов роста – гиббереллина (ГК3) и цитокинина (БАП) с добавлением других биологически-активных веществ. Перед нанесением АГ у кастрированных бутонов обрабатывали рыльца и пестики 96%-водным раствором этилового спирта для удаления на их поверхности случайно попавшей пыльцы капусты. Затем с помощью микропипетки на основание пестиков наносили 10 мкл АГ. Процедуру кастрации проводили в утренние часы суток (7-10 ч.). Обработанные, таким образом, репродуктивные побеги с кастрированными бутонами изолировали от остальных пергаментными изоляторами до времени полной потери восприимчивости рыльца к пыльце капусты на
8-10 суток. На семенниках, с обработанными АГ бутонами, оставляли стебли, на которых проходило свободное опыление цветков капусты насекомыми. После удаления изоляторов проводили фенологические наблюдения за ростом стручков и формированием апомиктических семенных зародышей в течение всего периода роста семенников до полного вызревания семян капусты, которые образовывались в результате свободного внутрисортового опыления.
Результаты и их обсуждение
В 2006 году были начаты исследования по индукции нерегулярного апомиксиса на экспериментальной базе Института овощеводства и бахчеводства НААН. При использовании методических рекомендаций по обработке АГ кастрированных бутонов цветков, предложенных в работах [2, 4], по истечении срока вызревания семенников в наших опытах наблюдали формирование только бессемянных стручков у всех изученных сортов капусты кочанной. Согласно данных вышеуказанных литературных источников на капусте белокочанной удалось получить патреногенетические семе-
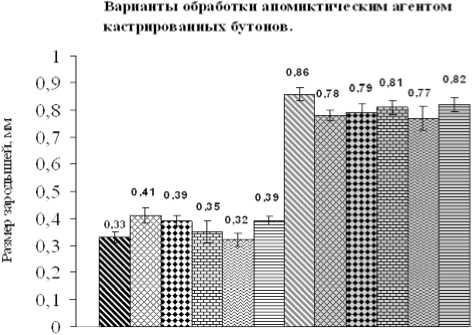
Рис. 1. Результаты биометрических измерений (в световом поле бинокуляра) длины 10 рендомизировано отобранных апомиктических зародышей капусты кочан-
ной разных сортов, проведенные в конце периода созревания семенников (дан-
ные 2007 года).
123456789 10 11 12
на при обработке АГ, содержащем водный раствор гиббереллина (ГК3) [2] или гиббереллина (ГК3) и цитокинина (БАП) [4].
В 2007 году был расширены поисковые работы по оптимизации компонентного состава АГ. В отличие от предыдущего года в работе использовали следующие варианты обработки кастрированных бутонов:
-
1) АГ № 1 – водная смесь ГК3 и
- БАП (контроль);
-
2) АГ № 2 – водная смесь ГК3, БАП и препарата Марс-El;
-
3) АГ № 1 с дополнительным одновременным нанесением на рыльце инородной пыльцы несовместимых с капустой кочанной видов растений семейства крестоцветные;
-
4) АГ № 2 с дополнительным одновременным нанесением на рыльца инородной пыльцы несовместимых с капустой кочанной видов растений семейства крестоцветные.
В результате проведенных исследований были выделены, как наиболее перспективные для дальнейшей работы 3-й и 4-й варианты обработки, при использовании которых был обнаружен эффект кратковременного роста апомиктических семенных
Сорта капусты кочанной.
-
к I Лазурная < вар 1)
-
Q 2. Тика (вар 1)
-
0 5. X зимняя (вар !)
В 3 Белоснежка (ва)) 1)
В 4 Яна (вар 1)
-
9 6 Палета (вар 1)
я7 Лазурная (вар.З)
S 8 Лика (вар 3)
Q 9. Белоснежка (вар 3)
S 10 Яна (вар.З)
-
§ 11 X зимняя (вар 3)
-
в 12 Палета (вар.З)
зародышей в стручках всех задействованных в эксперименте сортовых генотипов капусты кочанной. После эмпирического перебора был обнаружен вид растения семейства Brassicaceae – подвид китайской редьки Лоба (Convar lobo Sazon) вида Raphanus sativus L., пыльца с растений которой обеспечивала вышеуказанный прирост. В частности, в наших экспериментах использовали сорт Трояндовая селекции ИОБ НААН вышеуказанного подвида редьки.
На рис. 1 представлены результаты биометрических измерений длины семенных апомиктических зародышей у сортов капусты кочанной, которые были задействованы в 1-м и 3-м вариантах опыта. Из полученных данных следует, что синергическая обработка АГ № 1 и пыльцой редьки Лоба (3-й вариант) стимулирует частичный рост зародышей, увеличивая их размер в 1,8-2 раза, по сравнению с обработкой только АГ № 1 (1-й вариант). На рис. 2 показаны фотографии сформированных стручков с недоразвитыми зародышами, которые были получены во 2м и 4-м вариантах обработки семенников сорта капусты краснокочанной Палета.
В общем, если использовали для обработки АГ № 1 или АГ № 2 (1-й и 2-й варианты обработки), то при этом наблюдали исключительно пар-тенокарпический рост стручков без роста зародышей. Использование препарата Марс-El в смеси с фито-гормональными регуляторами было обусловлено его функциональной особенностью, как пленкообразующего и водоудерживающего вещества для сохранения на более длительное время на поверхности пестика капли водной смеси ГК3 и БАП [5]. Однако в дальнейших опытах было обнаружено негативное действие данного препарата на органогенез семенных зародышей, поэтому он был исключен из работы.
В 2008 году использовали следу- ющие варианты обработки кастрированных бутонов:
-
1) АГ № 1 – водная смесь ГК3 и
- БАП (контроль);
-
2) АГ № 2 – АГ №1 с дополнительным одновременным нанесением на рыльце пыльцы редьки сорта Трояндовая;
-
3) АГ № 3 – водная смесь ГК3, БАП и регулятора ДГ-475(12) с дополнительным одновременным нанесением на рыльце пыльцы редьки сорта Трояндовая.
При использовании 1-го варианта обработки мы наблюдали только партенокарпический рост стручков. По результативности выделили 2-й и 3-й варианты обработки. Как и в опыте 2007 года, при применении 2-го варианта у сортов Лика, Белоснежка, Яна, Харьковская зимняя обнаружен эффект кратковременного роста апомиктических зародышей. В отличие от предыдущих лет исследований были увеличены репрезентативные выборки бутонов по каждому сорту капусты кочанной (на одном семеннике 10-15 образцов в
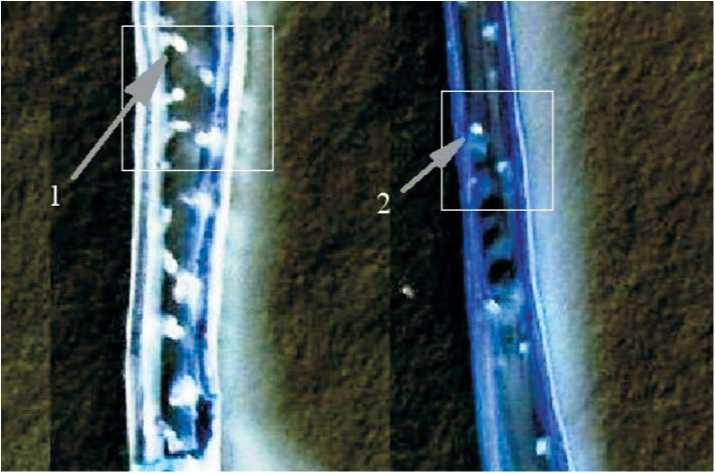
Рис. 2. Временная стимуляция формирования апомиктических зародышей в 4-м варианте и ее отсутствие во 2-м варианте опыта по индукции нерегулярного апомиксиса (растения репродуктивной фазы развития сорта капусты краснокочанной Палета, данные 2007 года):
1) 4-й вариант обработки (нанесение на пестики АГ № 2 и пыльцы дикой редьки на рыльца кастрированных бутонов);
2) 2-й вариант обработки (нанесение на пестики АГ № 2).
2006-2007 годах и 50-70 образцов в 2008 году). В результате во 2-м варианте обработки у сорта капусты белокочанной Леся было обнаружено формирование апомиктических семян (14 образцов, частота образования 25,6 %) и у сорта Лазурная – 2 образца (частота образования 2,9 %). Применение АГ № 3, также, оказалось эффективным на сорте капусты краснокочанной Палета (прирост семенных зародышей в 3-3,5 раза больший по сравнению с вариантом обработки АГ № 1). Данный экспериментальный факт свидетельствует о довольно существенном влиянии генотипа сорта на фитогормональный состав АГ, обнаружено избирательное позитивное действие на данный сорт капусты препарата ДГ-475 (12), который является химическим соединением, производным пиридина. ДГ-475 (12) ранее использовали мы в опытах по культуре протопластов капусты белокочанной in vitro, как регулятор, инициирующий и поддерживающий митотическую активность соматических клеток [6]. Аналогично предыдущим годам исследований, в 2008 году АГ № 1 не обнаружил высокой стимулирующей активности, поэтому в дальнейшем был исключен из работы.
В 2009 году использовали такие же модификации компонентного состава АГ, как и в 2008 году (только 2й и 3-й варианты обработки). Получены партеногенетические семена сорта капусты белокочанной – Яна (4 семени, частота образования 3,2 %). Позитивное регуляторное действие на формирование апомиктических семян имела синергическая обработка кастрированных бутонов АГ №3 и пыльцой растений редьки сорта Трояндовая.
Опыты 2010 года оказались неудачными вследствие неблагоприятных климатических условий, которые сложились в период вызревания семенников капусты. В течение мая-июня месяца были отмечены высокие дневные температуры воздуха до 40оС. При такой высокой температуре пыльца китайской редьки Ло-ба теряла свою фертильность, что негативно сказалось на завязывании партеногенетических семян капусты кочанной.
Как правило, полностью сформированные партеногенетические семена завязывались в проксимальной части (по отношению к столбику) за- вязи в количестве 1-2 экземпляров на стручок (рис. 3.). Все апомиктические семена показали 100 % всхожесть в лабораторных условиях при проращивании в чашках Петри на влажных фильтровальных мостиках.
Рис. 3. Сформированное партеногенетическое семя в проксимальной части завязи
(сорт капусты белокочанной Лазурная, опыт 2008 года)

Заключение и выводы
В результате проведенных исследований выявлены экзогенные факторы, влияющие на проявление нерегулярного апомиксиса у капусты кочанной. Из семи изученных сортов партеногенетические семена были получены у трех сортов капусты кочанной – Яна, Лазурная и Леся с разной частотой формирования в зависимости от генотипа сорта. Действием экзогенных факторов удалось индуцировать незавершенный органогенез партеногенетических семян у всех остальных сортов капусты кочанной. Проявление нерегулярного апомиксиса было вызвано синергическим воздействием фито-гормональных регуляторов и чужеродной пыльцы при условии одновременного нанесения водной смеси гиббереллина и цитокинина на основание пестика, а чужеродной пыльцы (китайской редьки Ло-ба) – на рыльца пестиков кастрированных бутонов капусты за 2-3 суток до их раскрытия.
Список литературы Разработка элементов методики апомиктического размножения селекционно ценных образцов капусты кочанной
- Тырнов В.С. Гаплоидия у растений: научное и прикладное значение//М.:Наука.-1998.-53с.
- Eenink A.H. Matromorphy in Brassica oleracea L. IV. Formation of homozygous and heterozygous diploid products of gametogenesis and qualitative genetical research on matromorphic plants//Euphytica -1974. -V. 23. -P. 719-724.
- Бабицкий А. Эволюция и репродуктивная память//Reports and Abstracts of the VIII Geneticist's and Breeder's Congress of Moldova «Genetics and breeding of Plants, Animals and Microorganisms». -Chishinau (Moldova), 2005. -С 696-701.
- Способ получения гомозиготных диплоидов сельскохозяйственных культур: Патент. Российская Федерация. A01H 1/04, A 01N 43/40, 61/00/В.Г. Курбатов -№ 2035134; Заявл. 23.01.91; Опубл. 20.05.95, Бюл. № 14.
- Кондратенко С.И., Чернишенко Т.В., Баштан Н.А., Дульнєв П.Г. оценка регуляторного эффекта биологично-активных соединений, производных пиридина и полиэтиленгликоля на вегетирующих растениях капусты белокочанной//овощеводство и бахчеводство. -Харьков: ИОБ УААН. -2005. -Вып. 50. -С. 342-351.
- Kondratenko S.I. Effect of plant extract and new synthetical substitutes of phytohormones on plant regeneration from protoplasts of cabbage (Brassica oleracea var. capitata)//Horticulture and Vegetable Growing. -Babtai: Lithuanian Institute of Horticulture. -2001. -V.20(3), №1. -P. 343-349.


