Разработка элементов технологии получения посадочного материала салата (Lactuca sativa L.) на безвирусной основе с использованием методов биотехнологии
Автор: Романова О.В., Солдатенко А.В., Чичварина О.А., Ахраменко В.А., Павлова О.В., Романов В.С.
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 2 (46), 2019 года.
Бесплатный доступ
В статье представлены результаты исследований по получению в культуре in vitro растений-регенерантов из семян сортов салата (Lactuca sativa L.) Изумрудный, Букет, Хамелеон (селекции ФГБНУ ФНЦО), восприимчивых к вирусу аспермии томата (Tomato aspermy cucumovirus) - AsTV. Семена сильновосприимчивых к AsTV сортов салата Хамелеон и Букет были подвергнуты термотерапии при разных температурных режимах (37°С, 38°С, 40°С) в течение различного временного интервала (1, 3, 5, 7, 10 суток) в сухом виде и при увлажнении. Отмечена сортовая специфичность при прорастании семян после термотерапии. Так, наибольшее количество проростков у сорта Изумрудный получено после 5 суток термотерапии (10,0±0), тогда как у сорта Букет лучшие показатели были после 3 суток термотерапии (9,3±1,2) при увлажнении. После термотерапии сухих семян при 40°С сорта Изумрудный растительный материал был высажен на твердые и жидкие питательные среды. Подобраны условия ступенчатой стерилизации семян салата для введения в культуру in vitro: промывание в 96% этаноле, затем в 50% водном растворе «Белизны» с добавлением Твина-20, после в стерильной дистиллированной воде...
Салат, вирус аспермии томата (tomato aspermy cucumovirus) -astv(cucumovirus, bromoviridae) термотерапия, стерилизация семян, биотехнология, безвирусные растения
Короткий адрес: https://sciup.org/140240685
IDR: 140240685 | УДК: 635.5:573.6 | DOI: 10.18619/2072-9146-2019-2-22-26
Текст научной статьи Разработка элементов технологии получения посадочного материала салата (Lactuca sativa L.) на безвирусной основе с использованием методов биотехнологии
Received: 15.02.2019
Accepted: 30.03.2019
DEVELOPMENT OF ELEMENTS
OF TECHNOLOGY FOR PLANTING
MATERIAL OF LETTUCE
(LACTUCA SATIVA L.)
ON VIRUS-FREE BASIS USING
METHODS OF BIOTECHNOLOGY
The article presents the results of research on the production in vitro of regenerated plants from the seeds of cultivars of lettuce (Lactuca sativa L.) Emerald, Bouquet, Chameleon (FSBSI Federal Scientific Vegetable Center), susceptible of aspermia tomato (Tomato aspermy cucumovirus) – AsTV. Seeds of strongly susceptible to AsTV varieties of salad Chameleon and Bouquet were subjected to thermotherapy at different temperatures (37 ° C, 38 ° C, 40 ° C) for a different time interval (1, 3, 5, 7, 10 days) in dry form and when moistened. Marked varietal specificity during germination of seeds after thermotherapy. Thus, the greatest number of seedlings in the emerald variety was obtained after 5 days of thermotherapy (10.0±0), while the Bouquet variety had the best results after 3 days of thermotherapy (9.3±1.2) with moisture. After thermotherapy of dry seeds by 40 ° C plant material of cultivar Emerald was planted on solid and liquid culture media. The conditions of step sterilization of lettuce seeds for introduction into the culture in vitro were chosen: washing in 96% ethanol, then in 50% aqueous solution of "Whiteness" with the addition of Twin-20, after in sterile distilled water. The nutrient medium for germination of lettuce seeds was used: Gamborg B5 (2% sucrose, 7.0 g/l agar), and the liquid nutrient medium was of that composition. The obtained seedlings were cutted and transferred to medium MS (2% sucrose, 0.1 mg/l ha and 1 mg/l BAP, 3.0 g/l phytogel). The formed shoots for rooting were transferred to the MS medium (2% sucrose, 3.0 g/l phytogel). In the future, lettuce plants will be adapted in vivo and tested for the presence of tomato aspermia virus in the planting material.
С алат ( Lactuca sativa L . ) является листовым овощем, принадлежащим к семейству Asteraceae . Эта культура выращивается повсеместно. Потребляют салат исключительно в свежем виде. Имеет диетическую ценность, так как на 95% состоит из воды.
Одним из факторов, лимитирующих размножение и возделывание салата, являются инфекционные болезни вирусной природы. На данный момент известно порядка 15 наиболее вредоносных вирусопатогенов, наносящих экономический ущерб культуре. В последние годы нарастает вредоносность вируса аспермии томата ( Tomato aspermy cucumovirus – AsTV ) ( Cucumovirus, Bromoviridae ), вызывающего чрезмерную кустистость растений, угнетение главного стебля, слабое развитие пазушных и боковых побегов. Листья деформируются, приобретают мозаичную расцветку и мельчают. Семена имеют аномалии развития или вообще отсутствуют. Этому способствует возделывание сортов со слабой устойчивостью к вирусам, а также климатические условия Центрального региона РФ, когда наблюдается большой перепад дневных и ночных температур и высокая влажность. В отдельные годы обилие насекомых-переносчиков создают высокий инфекционный фон (Енгалычева и др., 2015; Енгалычева, Павлова, 2016).
Вирус аспермии томата ( Cucumovirus, Bromoviridae ) имеет широкий круг-хозяев, относящихся к различным семействам. Штаммы AsTV передаются векторно несколькими видами тлей неперсистентным способом; по горизонтали распространение также возможно механическим путем, прививкой. По вертикали передача семенами возможна для Stellaria media и Phaseolus vulgarus (Noordam et al., 1965; Wang, 1982).
Вирусы быстро накапливаются и распространяются в растениях. Они поражают надземную часть и сохраняются в семенах. Репродукция вирусов тесно связана с метаболизмом клетки растения-хозяина (Бойко, 1990; Журавлёв, 1979), и это основное препятствие для прямого подавления жизнедеятельности вирусов растений (Митрофанова и др., 2014).
С точки зрения биологии вирусов, передача их семенами служит самым надёжным резервом, поддерживающим сохранение вируса в природе. Кроме того, при передаче вируса семенами создаются очаги инфекции при посеве и посадке растений в полевых условиях. Особенно это касается вирусов, являющихся общими для овощных культур (Гнутова, 2009).
При решении этой проблемы исследователи высказываются за интегрированный подход, используя современные достижения биотехнологии и вирусологии (Кеглер и др., 1986). Освобождение растений от вирусов представляет собой единый процесс: тестирование растений на вирусы, термотерапия, стерилизация семян, регенерация растений из семян in vitro , культивирование регенерантов in vivo , повторное тестирование адаптированных растений на вирусы (рис.1).
Для оздоровления растений используют термотерапию. Она подразделяется на два способа: применение горячей воды и применение горячего сухого воздуха. Второй способ оказался более эффективным, особенно при использовании вегетирующих цветочных растений (Митрофанова и др., 2014).
Высокие температуры вызывают физическое разрушение термолабильных вирусов, а также нарушают равновесие
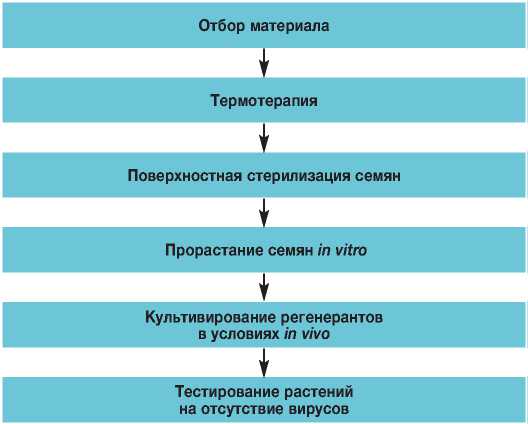
Рис. 1. Получение безвирусных растений салата.
Fig. 1. Preparation of virus-free lettuce plants.
между синтезом и деградацией вирусов. При термотерапии иногда удается вылечить растение целиком (Hollings, Kassanis, 1957). Однако чаще от вирусов освобождаются только верхушки побегов, отросшие за время термотерапии. Исследования показали, что чем дольше экспозиция термотерапии и больший прирост растений, тем выше гарантия получения безвирусных верхушек (Митрофанова,1986). Этот прием используют в сочетании с культурой меристемы для получения безвирусного посадочного материала плодовых и цветочно-декоративных культур (Тесленко и др., 1986). Об использовании термотерапии растений хризантем, инфицированных вирусом аспермии томата, сообщали ряд исследователей (Hollings, Kassani, 1957; Brierley, Lorentz, 1960). Также оздоровленные растения хризантем получали при помощи культуры меристем (Bachelier et al., 1976)
Основным методом получения и клонального микроразмножения безвирусных растений является культура органов и тканей (Бутенко, 1964, 1999; Катаева, Бутенко, 1983; Калинин и др., 1992; Митрофанова и др., 2000; Torrence, Jones, 1981; Biotechnology of Ornamental Plants, 1997; George et al., 2008). Первыми успешно регенерировали растения салата из каллуса Дершуг и Миллер (1967). Растения салата также успешно регенерировали из апикальных сегментов и семян (Koevary et al., 1978; Bloksberg, Saltveit, 1986; Pink, Carter, 1987; Armas et al., 2017).
Для поверхностной стерилизации исходных растительных образцов использовали погружение в растворы хлора и неоднократное промывание в стерильной дистиллированной воде (Berry et al., 1982; Brown et al., 1986). Иногда применяли предварительную стерилизацию, включающую промывку в воде с Tween 80 (Bloksberg, Saltveit, 1986) и погружение в 40% этанол на несколько секунд (Alconero, 1983).
Большинство исследователей использовали среду Мурасиге-Скуга (1962) (МС). Однако, для культуры in vitro применяли и другие среды (Alconero, 1983; Pink, 1992). Рост побегов происходил на среде, содержащий ИУК и БАП (Bloksberg, Saltveit, 1986).
Армаз с сотрудниками (2017) использовали среды МС и ШХ (Schenk, Hildebrandt, 1972) с разным содержанием сахарозы, БАП, кинетина, зеатина, ИУК, ИМК, ТДЗ. Они подтвер- дили, что замена МС среды на ШХ среду не влияет на индуцирование регенерации, как и сообщалось ранее (Teng et al., 1992; Xinrun, Conner, 1992; Ampomah-Dwamena, 1997). Не было различий в регенерации в средах, содержащих глюкозу и сахарозу, хотя Тенг и Коннер (1992) получили лучшие результаты на средах с сахарозой. Замена БАП на кинетин или ТДЗ не вызывала значительных изменений. Изучение влияния БАП на индукцию каллуса, среднее количество регенерированных побегов на листовой эксплант показало, что при низких концентрациях БАП каллусообразование было незначительным, а регенерация побегов увеличивалась (Mohebodini, 2011; Latif et al. 2014).
Методы in vitro позволяют сохранить отобранные генотипы салата, выращивая семена на средах, свободных от болезней (Jenni et al., 2006). Также были разработаны методы оценки LMV ( Lettuce Mosaic Virus ) на регенерируемых растениях (Mazier et al.,1999; Koyama, 2012).
В ФГБНУ ФНЦО в лаборатории биотехнологии исследования по клональному микроразмножению и получению безви-русного посадочного материала овощных культур ведутся достаточно давно (Domblides et al., 2017), но для культур, относящихся к семейству Asteraceae, они носили лишь поисковый характер, и действующих протоколов еще не разработано.
Объекты и методы исследования
В нашей работе ранее были исследованы линии и сорта разновидностей салата, дикие виды ( L. serriola, L. salligna, L. virosa, L. livida, L. scariola ), гибриды разных поколений (F1, F2, F3, F4). Идентификацию вируса AsTV проводили методами визуальной, серологической диагностики (иммунофер-ментный анализ), методом растений-индикаторов, «экспресс-методом» с использованием иммунострипов, методом электронной микроскопии. Оценку результатов имму-ноферментного анализа (ИФА) проводили с помощью спектрофотометра при длине волны 480 нм, определяя относительную концентрацию вирусных частиц в пробах по коэффициентам экстинции. В течение всего вегетационного периода проводили визуальную оценку по шестибалльной шкале. Устойчивость образцов оценивали на основе комплекса показателей: распространенность (%), индекс поражения (средний балл), степень развития болезни (%) (Методические рекомендации по оценке и созданию исходного материала перца сладкого с устойчивостью к вирусу бронзовости томата, 2007). По совокупности всех оценок и ИФА образцы дифференцировали на четыре группы устойчивости.
Целью настоящей работы является разработка методики получения и клонального микроразмножения безвирусного материала культур вида Lactuca sativa L. Объектами исследования служили сорта салата селекции ФБГНУ ФНЦО: Букет, Изумрудный, Хамелеон.
Термотерапию семян проводили при температуре 37°C, 38°C и 40°C в течение разного временного интервала (1, 3, 5, 7, 10 суток) в сухом виде и при увлажнении. В опытах использовали по 10 семян каждого сорта в 3-х вариантах. Контроль – семена без прогревания.

Рис. 2. Поражение растения салата вирусом аспермии томата.
Fig. 2. The defeat of the salad with the virus of tomato aspermy.
Семена для культуры in vitro стерилизовали 30 с в 96% этаноле, затем ещё течение 5 мин в 50% водном растворе «Белизны» с добавлением Твина-20 (1 капля на 100 мл). После трехкратно промывали в стерильной дистиллированной воде.
Семена салата помещали в чашки Петри на среду Gamborg В5 (Gamborg, 1968), содержащей 2% сахарозу и 7,0 г/л агара, и на мостики из фильтровальной бумаги в пробирки с жидкой питательной средой того же состава. Полученные проростки черенковали и переносили на среду МС c 2% сахарозой, 0,1 мг/л ГК и 1 мг/л БАП и 3,0 г/л фитогеля. Образовавшиеся побеги для укоренения были перенесены на среду МС с 2% сахарозой и 3,0 г/л фитогеля. Культивирование проводили на стеллажах с люминесцентными лампами при 25°С и фотопериоде 14 часов, освещенности 2,5 тыс. люкс.
Результаты
Вирус аспермии томата ( Tomato aspermy cucumovirus - AsTV ) в условиях Московской области на растениях салата вызывал симптомы осветления жилок на пластинах листьев, образование укороченной розетки, зональной крапчатости (рис. 2). При электронной микроскопии в препаратах, изготовленных из сока инфицированных растений салата с симптомами угнетенного роста, были обнаружены изометрические вирионы размером 40 нм. По массовому проявлению симптоматики в период «бутонизация – начало цветения» образцы разделили на четыре группы устойчивости к Tomato aspermy cucumovirus : толерантные, слабо-, средне- и сильновосприимчивые.
У сортов салата Хамелеон, Букет балл поражения был достаточно высоким и составил 2,50-2,65. По результатам ИФА в данных образцах содержание вируса в соке было средним (коэффициент экстинции составил 0,232 и 0,314)
(Енгалычева, Павлова, 2016). Семена, полученные от этих наиболее восприимчивых к вирусу AsTV растений, были использованы для дальнейших исследований.
Проведение термотерапии семян сортов, восприимчивых к вирусу AsTV растений, является важнейшим этапом получения оздоровленных растений. Прогревание семян при точке термической инактивации (ТТИ) вируса позволяет существенно снизить вирусное заражение и в дальнейшем использовать семена, подвергнутые термотерапии, для получения без-вирусных растений салата. Исходя из ранее проведенных исследований на хризантемах, ТТИ-температура вируса аспермии томата составила 36°-37°С (Hollings, Kassani, 1957; Brierley, Lorentz, 1960; Johnstone, Wade, 1974).
Термотерапия семян салата выявила сортовую специфичность. Так, наибольшее количество проростков у сорта Изумрудный было получено после 5 суток термотерапии (10,0±0; НСР05=0), тогда как у сорта Букет лучшие показатели были после 3 суток термотерапии (9,3±1,2; НСР05=0,3) при увлажнении (рис. 3). .
В результате проведенных исследований условия термотерапии и подобранные среды позволили получить растения-регенеранты из семян салата (рис. 4). В дальнейшем будет проведена адаптация растений салата в условиях in vivo и тестирование на наличие вируса аспермии томата AsTV для подтверждения получения безвирусного посадочного материала.
Решение поставленной задачи имеет важные экономические последствия, так как семенная передача вирусов способствует сохранению инфекции в семени длительное время и распространению на большие расстояния. Правила международной торговли также требуют получение специальных сертификатов для посадочного материала, подтверждающих отсутствие вирусов.
Разработка биотехнологических методов получения без-вирусного материала салата обеспечит рост качества посадочного материала, что, в свою очередь, будет в большем объёме удовлетворять потребности рынка независимо от времени года.
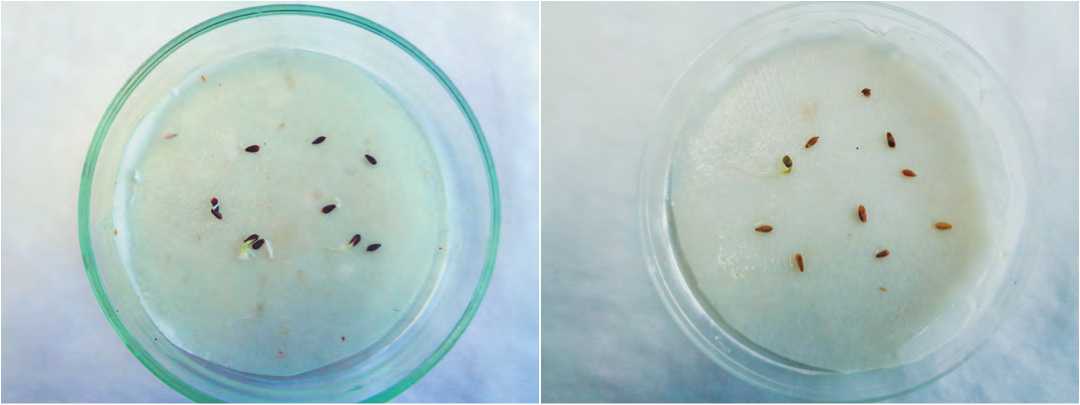
А
Б
Рис.3. Прорастание семян при термотерапии. А – сорт Изумрудный, Б – сорт Букет.
Fig. 3. Germination of seeds during thermotherapy. A - cultivar Emerald, Б - cultivar Bouquet.

А
В
Рис. 4. Прорастание семян салата на твердых (А и Б) и жидких питательных средах (В).
Fig. 4. Germination of lettuce seeds on solid (A and Б) and liquid nutrient media (B).
Об авторах:
Чичварина О.А. – м.н.с.
RAS, Chief Researcher
Chichvarina O.A. – junior researcher
Список литературы Разработка элементов технологии получения посадочного материала салата (Lactuca sativa L.) на безвирусной основе с использованием методов биотехнологии
- Енгалычева И.А., Пышная О.Н., Джос Е.А., Тимина Л.Т., Золотарёва О.И. Использование межвидовой гибридизации в селекции перца и салата на устойчивость к вирусной инфекции//Rus. Agr. Sci. Rev. -2015. -Т. 6. -№ 6-2. -С. 2-4.
- Енгалычева И.А.,Павлова О.В. Межвидовая гибридизация салата (Lactuca sativa L.) селекции на устойчивость к Tomato aspermy cucumovirus// Мат. междунар. конф. «Эколого-генетические основы современных агротехнологий» (СПб, 27-29 апреля 2016 г.) // Вест. защ. раст. - 2016. -
- Noordam D., Bijl M., Overbeek S.C., Quiniones S.S. Viruses uit Campanula rapunculoides en Stellaria media en hun relalie tot komkommermozaiek virus en tomaat-'aspermy' -virus//Neth. J. Pl. Path. -V. 71. -P. 61.
- Wang W.J. Tech Bull Plant Quarantine Res. Inst. Pl. Quarantine. Dong San Huan Beijine. -1982. -№ 3.
- Бойко А.Л. Экология вирусов растений. К.: Вища школа. -1990. -166 с.
- Журавлев Ю.Н. Фитовирусы в целом растении и в модельных системах. -М.: Наука, 1979. -246 с.
- Митрофанова О.В., Митрофанова И.В., Лесникова-Седошенко Н.П., Иванова Н.Н. Применение биотехнологических методов в оздоровлении растений и размножении безвирусного посадочного материала перспективных цветочно-декоративных культур // Сб. научн. тр. ГНБС. - 2014. - Т. 138. - С. 5-56.
- Гнутова Р.В. Таксономия вирусов растений Дальнего Востока. -Владивосток: Дальнаука, 2009. -467 с.
- Кеглер Х., Кляйнхемпель Х., Эртель К., Презелер Г., Шимански Х.-Х., Шмидт Х., Шпаар Д., Вердеревская ТД Борьба с вирусными болезнями растений/Пер. с нем. Г.И. Лойдиной; Под ред. и с предисл. И.Г. Атабекова и В.А. Шмыгли. -М.: Агропромиздат, 1986. -480 с.
- Hollings M., Kassanis B. The curl of chrysanthemums from some virus diseases by heat//J. Roy. Hortic. Soc. -1957. -V. 82. -N 8. -P. 339-342.
- Митрофанова О.В. Разработка биотехнологии ускоренного размножения в стерильной культуре цветочных растений на безвирусной основе // Всесоюз. конф. ВАСХНИЛ: Тез. Докл. - Л., 1986. - С. 101-104.
- Тесленко A.B., Митрофанова О.В., Лукичева Л.А. Разработка технологии получения безвирусного материала персика // Сб. науч. тр. Никит. ботан. сада. - 1986. - Т. 99. - С.85-92.
- Brierley P., Lorentz P. Heathy tip cutting from some mosaic-diseased Asiatic chrysanthemums: some benefits and other effects of heat treatment//Phytopathology. -1960. -V.50. -№ 6. -P. 404-408.
- Bacheelier J.C., Monsion M., Dunez J. Possibilities of improving detection of chrysanthemum stunt and obtaining viroid-free plants by meristem-tip culture//Acta Hort. -1976. -№ 59. -P. 63-69.
- Бутенко Р.Г. Культура изолированных тканей и физиология морфогенеза растений. -М.: Наука, 1964. -272 с.
- Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе: Учеб. пособие. -М.: ФГК-ПРЕСС, 1999. -160 с.
- Катаева Н.В., Бутенко Р.Г. Клональное микроразмножение растений. -М.: Наука, 1983. -232 с.
- Калинин Ф.Л., Кушнир Г.П., Сарнацкая В.В. Технология микроклонального размножения растений. -К.: Наукова думка, 1992. -232 с.
- Митрофанова О.В., Славгородская-Курпиева Л.Е., Митрофанова И.В., Лукичева Л.А. Диагностика вирусных болезней и биотехнологические приемы получения безвирусного посадочного материала косточковых плодовых культур. -Ялта: Крымпресс, 2000. -45 с.
- Torrence L., Jones R.A.C. Recent developments in serological methods suited for use in routine testing for plant viruses//Plant Pathology. -1981. -V. 30. -P. 1-24
- DOI: 10.1111/j.1365-3059.1981.tb01218.x
- Biotechnology of Ornamental Plants/Eds. R.L. Geneve, J.E. Preece, S.A. Merkle. -Wallingford: CAB International, 1997. -412 p.
- George E.F., Hall M.A., De Klerk G.-J. Plant Propagation by Tissue Culture. 3rd Edition. -Dordrecht, Netherlands: Springer, 2008. -501 p.
- Doerschug M.R., Miller C.O. Chemical control of adventitious organ formation in Lactuca sativa explants.//Am. J. Bot. -1967. -№ 54. -P. 410-413.
- Koevary K., Rappaport L., Morris L.L. Tissue culture propagation of Head lettuce//Hortic. Sci. -1978. -№ 13. -P. 39-41.
- Bloksberg L.N., Saltveit M.E. Regeneration of plants from axillary buds of harvested and stored heads of field-grown Iceberg lettuce//Hortic. Sci. -1986. -№ 21. -P. 1201-1203.
- Pink D.A.C., Carter P.J. Propagation of lettuce (Lactuca sativa) breeding material by tissue culture. Ann. Appl. Biol. -1987. -P. 611-616.
- Armas I., Pogrebnyak N. Raskin I. A rapid and efficient in vitro regeneration system for lettuce (Lactuca sativa L.)//Plant Methods. -2017. -V.13. -Is. 1. -P. 1-9
- DOI: 10.1186/s13007-017-0208-0
- Berry S.F., Lu D.Y., Pental D., Cocking E.C. Regeneration of plants from protoplasts of Lactuca sativa L. Z Pflanzen physiol. -1982. -№ 108. -P. 31-38
- DOI: 10.1016/S0044-328X(82)80088-3
- Brown C., Lucas J.A., Crute I.R., Walkey D.G.A., Power J.B. An assessment of genetic variability in somaclonal lettuce plants (Lactuca sativa L.) and their offspring//Ann. Appl. Biol. -1986. -№ 109.
- Alconero R. Regeneration of plants from cell suspensions of Lactuca saligna, Lactuca sativa and Lactuca serriola//Hortic. Sci. -1983. -№ 18. -P.305-307.
- Murashige T. Skoog F.A. Revised medium for rapid growth and bioassays with tobacco cultures//Physiol Plant. -1962. -№ 15. -P. 473-497.
- Pink D.A.C. Micropropagation of Lettuce (Latuce sativa L.)//Biotechnology in Agriculture and Forestry. Vol. 19. High-Tech and Micropropagation III (ed. by Y.P.S. Bajaj) -Springer-Verlag Berlin Heidelberg. -1992. -P. 42-57.
- Schenk R.V., Hildebrandt A.C. Medium and techniques for induction and growth of monocotyledo-nous and dicotyledonous plant cell cultures//Canad. J. Bot. -1972 -№ 50. -P. 199-204
- DOI: 10.1139/b72-026
- Teng W.L.Liu Y.J., Soong T.S. Rapid regeneration of lettuce from suspension culture//Hortic Sci. -1992. -№ 27. -P. 1030-1032.
- Xinrun Z., Conner A.J. Genotypic effects on tissue culture response of lettuce cotyledons//J Genet Breed. -1992. -№ 46. -P. 287-90.
- Xinrun Z., Conner A.J. Genotypic effects on tissue culture response of lettuce cotyledons//J Genet Breed. -1992. -№ 46. -P. 287-90.
- Ampomah-Dwamena C., Conner A.J., Fautrier A.G. Genotypic response of lettuce cotyledons to regeneration in vitro//Sci Hortic (Amsterdam). -1997. -№ 71. -P. 137-145.
- Mohebodini M., Javaran M.J., Mahboudi F., Alizadeh H. Effects of genotype, explant age and growth regulators on callus induction and direct shoot regeneration of lettuce [Lactuca sativa L.)//Aust. J. Crop Sci. -2011. -№ 5. -P.92-95.
- Latif B., Javaran M.J., Alizadeh H., Memari H.R., Mohammadi R. Interactions of genotype and plant growth regulators affecting direct shoot regeneration of lettuce (Lactuca sativaL.)//Int. J. Biosci. -2014. -V. 5. -№ 1. -P. 315-322.
- Mazier M., Maisonneuve B., Bellec Y., Chupeau M.C., Souche S. and Chupeau Y. Interest of protoplasts for lettuce breeding//Eucarpia Leafy Vegetables 99, A. Lebeda, Kristkova, ed., Proccedling of the Eucarpia Meeting on Leafy Vegetables Genetics and Breeding, Olomouc, the Czech Republic, 8-11 June, 1999, Palacky University Olomouc, Olomouc/1999. -P.239-244.
- Domblides E.A., Shmykova N.A, Shumilina D.V., Zayachkovskaya T.V., Yjurtts T.S., Kozar E.V., Kan L.Yu., Romanov V.S., Domblides A.S., Pivovarov V.F., Soldatenko A.V. Biotechnological approaches for breeding programs in vegetable crops. Agrosym 2017. Book of proceedings. -2017. -P. 452-460
- DOI: 10.18619/2072-9146-2018-6-3-7
- Koyama R., Sanada M., Itoh H., Kanechi M., Inagaki N., Uno Y. In vitro evaluation of tipburn resistance in lettuce (Lactuca sativa Lj//Plant Cell Tiss. Organ Cult. -2012. -№ 108. -P. 221-227
- DOI: 10.1007/s11240-011-0033-5
- Gamburg O.L., Miller R.A., Ojima K. Nutrients requirements of suspension cultures of soybean root cells//Exp. Cell. Res. -1968. -№ 50. -P. 151-158.
- Методические рекомендации по оценке и созданию исходного материала перца сладкого с устойчивостью к вирусу бронзовости томата/В.Ф. Пивоваров, О.Н. Пышная, М.И. Мамедов, И.Т. Балашова, Л.К. Гуркина, Е.Г. Козарь, И.А., Енгалычева//-М., 2007. -18 с.
- Johnstone G.R., Wade G.C. Therapy of virus-infected plants by heat treatment I. Some properties of tomato aspermy virus and its inactivation at 36°C//Austral. J. Bot. -1974. -V.22. -№ 3. -P. 437-450
- DOI: 10.1071/BT9740437


