Разработка комбинированного растительного препарата для применения в области челюстно-лицевой хирургии и в стоматологической практике
Автор: Шагалиева Н.Р., Авдеева Е.В., Куркин В.А., Колпакова С.Д., Петрова Н.А., Байриков И.М., Вдовина Э.В.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Средства коррекции экологического неблагополучия
Статья в выпуске: 1-6 т.11, 2009 года.
Бесплатный доступ
Обоснованы оптимальный состав и способ получения комбинированного растительного препарата, предназначенного для применения в области челюстно-лицевой хирургии и в стоматологической практике. Данный лекарственный препарат обладает высокой и разнообразной фармакологической активностью, сочетая антимикробное, противовоспалительное, вяжущее, регенерирующее и иммунокорригирующее действия. Предложены объективные и унифицированные методы анализа лекарственного препарата, отвечающие фармакопейным требованиям современной стандартизации. В результате проведенных микробиологических исследований была доказана высокая антимикробная активность в отношении основных возбудителей пародонтоза и пародонтита, а также других инфекционно-воспалительных заболеваний ротовой полости.
Комбинированный растительный препарат, челюстно-лицевая хирургия, стоматологическая практика
Короткий адрес: https://sciup.org/148198502
IDR: 148198502 | УДК: 615.32:
Текст научной статьи Разработка комбинированного растительного препарата для применения в области челюстно-лицевой хирургии и в стоматологической практике
Колпакова Светлана Дмитриевна, доктор медицинских наук, доцент кафедры общей и клинической микробиологии, иммунологии и аллергологии Петрова Надежда Александровна, аспирант
Байриков Иван Михайлович, доктор медицинских наук, профессор, заведующий кафедрой и клиникой челюстно-лицевой хирургии и стоматологии Вдовина Элина Владимировна, студентка
Целесообразность разработки нового отечественного лекарственного средства указанной направленности связано еще и с тем, что что ассортимент используемых в настоящее время лекарственных средств растительного происхождения является недостаточным и представлен в основном дорогостоящими импортными разработками [2]. Кроме того, у имеющихся лекарственных средств имеется ряд существенных недостатков. Во-первых, для аналогичных разрабатываемому новому комплексному лекарственному препарату растительных препаратов («Стоматофит», «Мара-славин», «Хлорофиллипт», «Ротокан», «Саль-вин», «Настойка календулы» и др.) не характерен весь необходимый для эффективного лечения спектр биологической активности. Как правило, в них нет сочетания антимикробного, противовоспалительного, вяжущего, кровоостанавливающего, регенерирующего, адаптогенного, иммуномодулирующего действия. Во-вторых, используемые препараты [2] не содержат оптимальный состав биологически активных соединений (БАС), сонаправленно действующих на патологические звенья заболевания и, соответственно, усиливающих целевой (например, антимикробный, противовоспалительный) эффект. В-третьих, способы получения лекарственных форм на основе известных прописей [3, 6, 8] не являются оптимальными с точки зрения экстракции, так как не позволяют исчерпывающе извлекать весь комплекс БАС. Кроме того, среди современных лекарственных растительных препаратов для стоматологической практики преобладают препараты в виде жидких лекарственных форм (растворы для полосканий, ирригаций, примочек, аппликаций), гелей и паст и совсем не используется такая, перспективная, на наш взгляд, лекарственная форма, как спрей.
В ходе ранее проведенных в Самарском государственном медицинском университете исследований по углубленному изучению химического состава, стандартизации, разработке экстракционных препаратов на основе различных видов лекарственного растительного сырья с широким спектром биологической активности были выработаны методологические подходы, позволяющие обосновать взаимосвязь и взаимозависимость в тройной системе «компонентный состав БАС - механизм действия БАС - фармакологический эффект». Основываясь на достигнутых результатах, на текущем этапе осуществляются исследования по созданию нового комбинированного фитопрепарата на основе лекарственного растительного сырья (ЛРС), содержащего разнообразный комплекс БАС фенольной и терпеноидной природы: листья эвкалипта (Eucaliptus viminalis Labill.), кору дуба (Quercus robur L.), цветки календулы (Calendula officinalis L.), траву эхинацеи пурпурной [Echinacea purpurea (L.) Moench.], а также масло гвоздики (Caryo-phyllus aromaticus L.) [1, 3, 5]. Для нового комбинированного препарата характерен широкий спектр фармакологической активности: антимикробная (эуглобали эвкалипта, эвгенол - эфирное масло гвоздичного дерева); противовоспалительная (гидроксикоричные кислоты, представленные кофейной, цикориевой и хлорогеновой кислотами эхинацеи и календулы, полифенольные соединения дуба); регенерирующая (каротиноидный комплекс календулы); местное иммуномодулирующее действие (цикориевая кислота и другие производные кофейной кислоты, полисахаридный комплекс эхинацеи и календулы), вяжущее действие и обусловленный им местный анестезирующий и противовоспалительный эффект (полифенольные соединения дуба и эвкалипта) [3].
Ближайшим аналогом нашей разработки является фитопрепарат «Мараславин», в состав которого входят цветки гвоздики (гвоздичное масло), полынь понтийская, черный перец, чабер и винный уксус (экстрагент). На наш взгляд, недостатком состава данного препарата является тот факт, что он не отличается разнообразием БАС и, как следствие, не обладает выраженными антимикробными и противовоспалительными свойствами, не обеспечивает других необходимых эффектов -кровоостанавливающего, капилляроукрепляющего, иммуномодулирующего и адаптогенного. Низкая эффективность мараславина объясняется еще и тем обстоятельством, что используемый в качестве экстрагента винный уксус не позволяет исчерпывающе извлекать липофильные и малополярные действующие вещества, составляющие основу данной композиции. Кроме того, данный экстрагент и входящий в состав композиции черный перец обладают выраженными раздражающими свойствами.
Нами были проведены исследования по оптимизации условий экстракции лекарственного растительного сырья (концентрация спирта этилового, соотношение сырье - экстрагент, метод экстракции, временной и температурный режим, степень измельченности ЛРС, введение масла гвоздичного) как в плане обеспечения эффективной экстракции, так и с точки зрения достижения максимальной фармакологической активности. Были проведены микробиологические эксперименты по изучению влияния разрабатываемого препарата на различные штаммы микроорганизмов, наиболее часто являющиеся этиологическим фактором возникновения заболеваний пародонта.
В качестве тестовых культур были взяты штаммы Американской коллекции типовых бактериальных культур (АТСС), полученные из Государственного научно-исследовательского института стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича. Видовой состав был представлен следующими микроорганизмами: Bacillus cereus (ATCC 10704), Staphylococcus aureus (ATCC 25923), Escherichia coli (ATCC 25922), Pseudomonas aeruginosa (ATCC 27853), Klebsiella pneumonia (ATCC 7о0бО3), Candida albicans (клинический штамм), Staphylococcus haemolyticus (клинический штамм), Bacillus cereus (клинический штамм).
Для исследования готовили из тестовых культур инокулюм 20-24 часовой культуры в физиологическом растворе, мутность 0,5 по стандарту McFarland. Инокулюм наносили на чашки Петри с пластинчатым агаром стерильным ватным тампоном. Тампон предварительно был погружен в суспензию микроорганизмов и отжат. Периодически поворачивая чашку Петри на 60 градусов равномерно проводили инокуляцию штриховыми движениями. Далее на засеянном пластинчатом агаре размещали полые стеклянные цилиндры (колодцы) диаметром 5,0 мм. Исследуемый раствор вносился в колодцы в объеме 0, 005 мл. Чашка ставилась в термостат на 20-24 часа при 370С, затем определяли зону задержки роста в мм. При измерении зоны задержки роста тестовых культур ориентировались на полную ингибицию видимого роста. Результаты данных исследований представлены в таблице 1. Так, установлено, что наибольшей антимикробной активностью обладают спирто-водные извлечения эвкалипта, дуба, особенно в отношении Staphylococcus aureus, Pseudomonas aeruginosa, Staphylococcus haemolyticus. Что же касается суммарной композиции, то она проявила антимикробную активность в отношении всех изученных штаммов, незначительно уступающую экалипту и дубу; при этом обращает на себя внимание появление нового свойства — бактериостатического эффекта в отношении
Klebsiella pneumonia, что представляет особый интерес для дальнейшего изучения спектра применения разрабатываемого препарата (табл. 1).
Таблица 1. Средние значения диаметра зон задержки роста тестовых культур под действием нового комплексного фитопрепарата и входящих в его состав компонентов
|
Спиртоводные извлечения из ЛРС |
Значения диаметра зоны задержки роста (мм) (M±m) |
||||||
|
St. aureus |
Ps.aerugi nosa |
Kl. pneumonia |
B. cereus |
C. albicans |
E coli |
St. haemo lyticus |
|
|
кора дуба |
25,21±0,34 |
17,14±0,53 |
- |
17,02±0,50 |
12,21±0,33 |
9,62±0,23 |
29,33±0,42 |
|
листья эвкалипта |
25,11±0,37 |
17,21±0,56 |
- |
15,10±0,41 |
15,10±0,22 |
15,01±0,21 |
29,12±0,35 |
|
цветки календулы |
13,40±0,23 |
11,23±0,41 |
- |
13,21±0,23 |
9,31±0,47 |
17,43±0,45 |
15,21±0,28 |
|
трава эхинацеи |
- |
15,81±0,53 |
- |
13,51±0,31 |
- |
10,82±0,67 |
16,71±0,34 |
|
комбинированный фитопрепарат |
19,65±0,37 |
15,01±0,58 |
9,51±0,56 |
14,32±0,23 |
16,32±0,78 |
13,12±0,43 |
22,40±0,58 |
|
водный спирт |
- |
- |
7,05±0,15 |
- |
- |
- |
- |
В результате микробиологических исследований, проведенных на базе кафедры общей и клинической микробиологии, иммунологии и аллергологии, установлена бактериостатическая доза - 500 мкг (достоверно значимый эффект проявляется в отношении St. aureus, Kl. pneumonia, Candida, E. coli, St. haemolyti-cus, Ps. aeruginosa). Это послужило основанием для рекомендации способа применения нового фитопрепарата: в виде полосканий из расчета 5 мл на 50 мл воды 3 раза в день. Время экспозиции в ротовой полости - 30-40 секунд при кратности полосканий - 5-7 раз в день.
Антимикробная активность нового фитопрепарата на основе фармакопейных растений и лекарственных субстанций, разрешенных к применению в медицинской практике РФ, также была подтверждена в ходе клинических наблюдений в отделении челюстно-лицевой хирургии на этапе санации в дооперационный и послеоперационный период. В отношении последнего обстоятельства, актуальным представляется использование разработанного препарата не только в качестве самостоятельного средства (в форме полосканий), но и в большей мере - в качестве лекарственной субстанции, включенной в лекарственную форму «спрей», которая, на наш взгляд, является особенно перспективной для применения в челюстно-лицевой хирургии за счет минимизации травматического воздействия при нанесении на раневую поверхность. Наряду с этим данная лекарственная форма обеспечит пролонгацию действия и равномерность распределения действующих веществ. В настоящее время на основе проведенных ранее исследований химического состава указанных сырьевых источников [4], разработаны аналитические подходы к решению проблемы стандартизации.
Фитохимические исследования выполнены с использованием традиционных и современных инструментальных методов физикохимического анализа (тонкослойная и колоночная адсорбционная хроматография, спектрофотометрия) в сочетании с экстракционными методами при выполнении технологической части работы. В ходе проведенных исследований нами был изучен в сравнительном плане компонентный состав полученного комбинированного препарата, при этом анализировались как полученные нами в лабораторных условиях образцы настоек, так и заводские образцы (настойки эвкалипта, календулы, эхинацеи) качественного метода анализа разработанного препарата нами предлагается тонкослойная хроматография (пластинки «Silufol UV 254»); оптимальной системой растворителей, на наш взгляд, является хлороформ - этанол в соотношении 4:1. Результаты оценивались при просмотре хроматограмм в УФ-свете при длине волны 254 и 366 нм, а также после проявления раствором диазотированной сульфаниловой кислоты. Результаты проведенного нами анализа доказали эффективность и целесообразность применения метода ТСХ для идентификации БАС, содержащихся в исходном комбинированном препарате (флавоноидов, фенилпропаноидов, каротиноидов, дубильных веществ).
Силуфол УФ - 254.
WVWVW*ZVWWWW '
система растворителей: хлороформ - этанол (4:

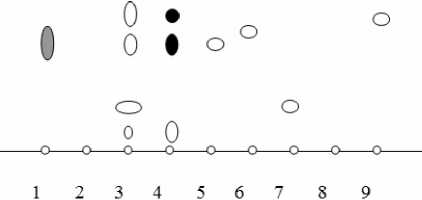
Рис. 1. Схема хроматограммы ТСХ-анализа разработанного комбинированного фитопрепарата и извлечений из растительных компонентов, входящих в его состав:
1 — рабочий стандартный образец нарциссина;
2 — рабочий стандартный образец в -каротина;
3 — новый комбинированный фитопрепарат;
4 - извлечение на 70% спирте этиловом из цветков календулы лекарственной;
-
5 - извлечение на 70% спирте этиловом из коры дуба обыкновенного;
-
6 - извлечение на 70% спирте этиловом из травы эхинацеи пурпурной;
-
7 - извлечение на 70% спирте этиловом из листьев эвкалипта прутовидного;
-
8 - рабочий стандартный образец эвкалимина;
-
9 - рабочий стандартный образец эвгенола
Установлено, что для качественного и количественного анализа нового комбинированного препарата адекватным и объективным методом является УФ-спектро-скопия в диапазоне от 200 до 400 нм. Нами были получены УФ-спектры нового комбинированного фитопрепарата и водно-спиртовых извлечений из входящих в его состав растений. При этом установлено, что характерными для разработанного комбинированного препарата максимумами светопоглощения являются максимум при 275±2 нм (вклад комплекса фенольных соединений эвкалипта, флавоноидов календулы, по-лифенольного комплекса дуба и эвгенола) и плечо при 330±2 нм (фенилпропаноиды календулы и эхинацеи, представленные в основном кофейной, цикориевой и хлорогеновой кислотами).
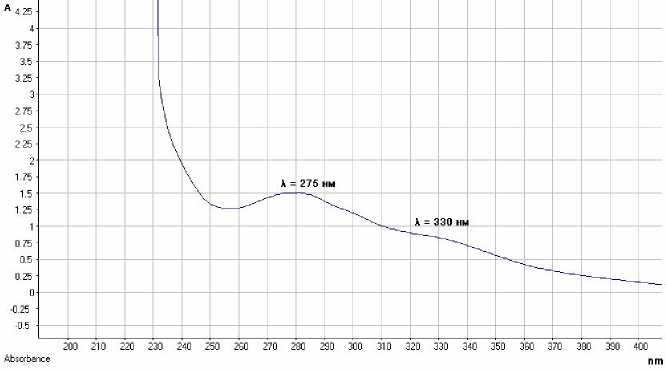
Рис. 2. УФ-спектр спиртового раствора нового комбинированного лекарственного препарата (разведение 1:200)
Данные подходы в настоящее время в соответствии с принципом гармонизации и унификации методик качественного и количественного анализа используются нами для решения проблемы стандартизации разрабатываемой лекарственной формы препарата «спрей».
Выводы: в результате комплексных фито-химических, технологических и микробиологических исследований предложен состав нового комбинированного фитопрепарата для использования в области челюстно-лицевой хирургии и стоматологической практике, разработан способ его получения и обоснованы рекомендации для применения.
Список литературы Разработка комбинированного растительного препарата для применения в области челюстно-лицевой хирургии и в стоматологической практике
- Ботанико-фармакогностический словарь/Под ред. К.Ф. Блиновой, Г.П. Яковлева. -М.: Высшая школа, 1990. -272 с.
- Государственный реестр лекарственных средств. -М., 2008. -1398 с.
- Куркин, В.А. Фармакогнозия: Учебник для студентов фармацевтических вузов. -Изд. 2-е, переработанное и дополненное. -Самара, 2007. -1239 с.
- Куркин, В.А. Фенилпропаноиды лекарственных растений/В.А. Куркин, Г.Г. Запесочная, Е.В. Авдеева, В.Н. Ежков. -Самара, 2005. -126 с.
- Лепешкова, Л.В. Антигипоксическое средство при пародонтите/Л.В. Лепешкова, О.Л. Орлова, Г.Ф. Белоклицкая//А.с. 1782600 (СССР). -Бюл. № 47, 23.12.92 г.
- Николаевский, В.В. Биологическая активность эфирных масел/В.В. Николаевский, А.Е. Еременко, И.К. Иванов//М.: Медицина, 1987. -144 с.
- Ронь, Г.И. Средство для лечения периодонтитов и пародонтитов/Г.И. Ронь, М.М. Еловикова, В.К. Слободенюк, П.И. Лавин, Н.М. Батюков//Патент РФ 94014271. -Бюл. № 3, 27.01.96 г.
- Фармакотерапия в стоматологии/А.И. Марченко, Е.Ф. Кононович, Т.А. Солнцева//Киев: Здоровья, 1986. -200 с.


