Разработка лабораторного фитотрона с возможностью варьирования спектра излучения и длительности суточной экспозиции и его биологическое тестирование
Автор: Кулешова Татьяна Эдуардовна, Блашенков М.Н., Кулешов Д.О., Галль Н.Р.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Разработка приборов и систем
Статья в выпуске: 3 т.26, 2016 года.
Бесплатный доступ
Разработан и оттестирован компактный лабораторный фитотрон с программируемым светодиодным источником облучения для изучения влияния физических факторов на растения. Устройство позволяет обеспечить воспроизводимость результатов биофизических исследований и стандартизовать условия роста и развития растений, используемых как объекты исследования. Изучено действие спектра освещения и суточной экспозиции, в том числе в условиях светодефицита, на содержание светочувствительных пигментов в хлорофитуме хохлатом ( Chlorophytum comosum maculatum ) и овсе посевном ( Avena sativa).
Спектр освещения, световой день, фитотрон, светодиодный источник освещения, фотосинтетический поток фотонов, содержание хлорофилла
Короткий адрес: https://sciup.org/14265031
IDR: 14265031 | УДК: 628.931,
Текст научной статьи Разработка лабораторного фитотрона с возможностью варьирования спектра излучения и длительности суточной экспозиции и его биологическое тестирование
В настоящее время биофизические исследования, относящиеся к воздействию физических факторов на живые системы, выходят на первое место по отношению к традиционным физическим задачам [1]. Одним из наиболее удобных объектов для биофизических исследований являются растения, изучение которых возможно на различных стадиях жизненного цикла. Однако для обеспечения воспроизводимости результатов необходимо обеспечить стандартизацию условий роста и развития растений. Это особенно важно в том случае, если предполагается исследовать отклик живой системы на слабые физические поля: электрические, магнитные, электромагнитные и/или комбинированные. Во многих работах показано, что такие поля способны существенно ускорить или, наоборот, подавить рост живых систем и их регенерацию после повреждений [2, 3], причем они особенно эффективны тогда, когда физиологическое состояние организма далеко от оптимального [4]. Это относится и к растениям, и к животным, и даже к биотестам [5]. В связи с этим встает важная задача получения воспроизводимого референтного состояния растения в условиях стресса, но в пределах лишь функциональной недостаточности, без органических, и тем более анатомических поражений.
Ключевыми параметрами, определяющими функциональное состояние растения, являются световой режим, свойства почвы, режим увлажнения и температура. В мире накоплен огромный объем знаний относительно влияния этих факторов на сельскохозяйственные, декоративные и комнатные растения [7–10]. Подробно изучен спектральный состав света, благоприятно влияющий на рост и развитие растений; имеются данные об оптимальных световых режимах, приводящих к максимальным показателям продуктивности растений [11–13]. Можно считать установленным, что основную роль в освещении играют суммарный суточный фотосинтетический поток фотонов и спектральный состав освещения [14], а остальные факторы носят второстепенный характер.
К сожалению, стандартные теплицы и фитотроны ориентированы в первую очередь на обеспечение максимально благоприятного режима роста и развития растений и малопригодны для создания и воспроизведения системы управляемого стресса. Целью настоящей работы была разработка и тестирование экспериментального лабораторного фитотрона с программируемым светодиодным источником облучения, позволяющим варьировать спектр и длительность светового дня, для изучения влияния неблагоприятных условий освещения на развитие растений.
ПОСТАНОВКА ЗАДАЧИ
При разработке конструкции устройства, несмотря на его видимую простоту, необходимо было решить следующие задачи. Во-первых, оно должно было содержать несколько ящиков, в каждом из которых можно было бы размещать несколько растений, находящихся в изотермических условиях при одинаковой влажности и под воздействием одинакового или близкого светового потока, т. е. не затеняющих друг друга. Во-вторых, было важно иметь возможность менять суточный фотосинтетический поток фотонов (PPFD — photosynthetic photon flux per day) [15] независимо для каждого ящика в широких пределах, воспроизводимо и с достаточной точностью. В-третьих, должен быть обеспечен легкий доступ к растениям, возможность перемещения их в пределах ящика, визуальный осмотр, перестановка, полив, замер влажности почвы. Задача создания и поддержания искусственного температурного режима не ставилась, т. к. в наших лабораторных помещениях установлены системы климат-контроля.
УСТРОЙСТВО ФИТОТРОНА
Для выполнения перечисленных выше требований фитотрон был организован на базе стандартной лабораторной стойки размерами 500×600×1500 мм. Стойка была разделена перегородками на 4 рабочих ящика по 375 мм высотой (рис. 1), для размещения электроники был установлен дополнительный ящик рядом со стойкой. Для увеличения количества экспериментальных образцов с разными параметрами для тестирования каждый ящик был оснащен дополнительной подвижной светонепроницаемой заслонкой, позволяющей разделить его еще на 2 ящика длиной по 250 мм. Боковые и задняя стенки были термоизолированы экструдированным полистиролом, который был снаружи декорирован пластиком. Изнутри каждый ящик был покрыт слегка гофрированной зеркальной алюминиевой фольгой, которая выполняла роль светоотражателя и электростатического экрана. Передняя стенка каждого ящика закрывалась собственной светонепроницаемой шторой, внутренняя поверхность которой была белого цвета.
Источниками света служили светодиоды марки Jazzway с электрической мощностью 0.24 Вт и светоотдачей порядка 30 %, генерировавшие красный, синий, теплый и холодный белый свет. Светодиоды собирались в блоки площадью 120×200 мм, в которые входило по 15 источников; их комбинация позволяла широко варьировать спектр излучения. Такая компоновка улучшала
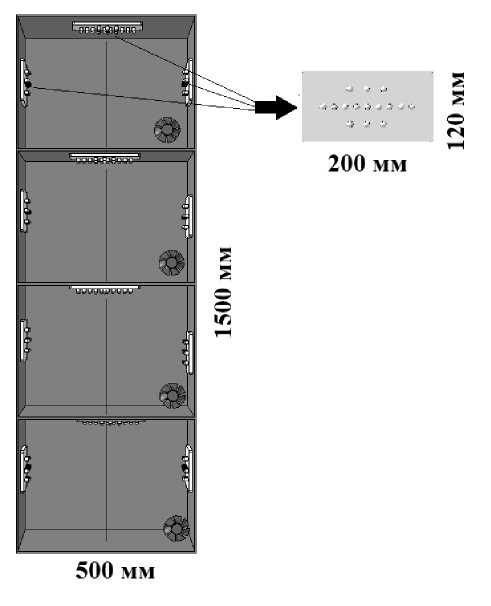
Рис. 1. Вид фитотрона и светодиодного блока с 15 источниками, позволяющими создавать различные спектры излучения пространственную однородность и исключала возникновение локальных точек перегрева, что является основным недостатком при использовании газосветных ламп высокого давления или мощных светодиодов. Для освещения большей поверхности исследуемого объекта блоки располагались как на верхней крышке ящика, так и на его боковых стенках в равном количестве. Количество блоков в ящике и состав светодиодов в них можно было варьировать в зависимости от того, какой именно фотосинтетический световой поток (PPF — photosynthetic photon flux) [15] и с каким спектром следовало создать. Также каждый ящик был оснащен механическими таймерами для возможности изменения длительности освещения, т. е. светового дня для растений.
Для обеспечения дыхания растений и фотосинтеза, а также для воздухообмена и отвода тепла, выделяемого источником света, каждый ящик был оборудован системой принудительной вентиляции. В углах задней стенки были прорезаны по четыре отверстия диаметром 50 мм каждое, и в них установлены вентиляторы, используемые в кулерах персональных компьютеров. Скорость воздухообмена могла варьироваться в зависимости от мощности светильника в интервале 5–15 л∙с-1.
Температура внутри каждого ящика контролировалась стандартной термопарой от мультиметра UNI-T DT830E. В использованном нами режиме при фотосинтетическом световом потоке PPF в диапазоне от 40 до 190 мкмоль·м-2·с-1, достигаемом при мощности светильника в 15 Вт, температура во всем ящике была постоянной с точностью ± 0.5 градуса, это обеспечивалось вентиляцией со скоростью воздухообмена ~10 л∙с-1.
Электрическое питание для светодиодов и вентиляторов подавалась с помощью витых пар таким образом, чтобы они не образовывали петель или контуров во избежание возникновения паразитных электромагнитных полей.
ТЕСТИРОВАНИЕ И КАЛИБРОВКА СВЕТОДИОДНЫХ БЛОКОВ
Для экспериментального определения абсолютной величины фотосинтетического потока фотонов в ящике фитотрона и его пространственного распределения были измерены усредненные по всему объему фитотрона электромагнитные спектры излучения от используемых экспериментальных искусственных источников света с помощью переносного спектрометра Ocean Optics USB 4000-UV-VIS-ES с интегрирующей сферой ISP-R, присоединенной через волоконно-оптический кабель. Угол сбора сферы составлял порядка 120 градусов, сфера располагалась в разных точках ящика и ориентировалась под разными углами относительно его входной стенки. При расположении сферы не ближе 70 мм к стенке разброс измеренных интенсивностей не превышал 10 %, что позволяло считать распределение излучения изотропным.
Для оптимизации спектра источника был изготовлен специальный тестовый блок из одинакового количества красных, синих, холодных и теплых белых светодиодов, часть из них затемнялась, и измерялся спектр излучения, который оптимизировался под номинальный спектр поглощения хлорофилла [16]. Это было необходимо, поскольку реальная светоотдача коммерческих светодиодов может значительно отличаться от номинальной от партии к партии. Наиболее близким к оптимальному спектром обладал блок, содержащий 9 красных, 3 синих и 3 холодных белых светодиода.
Было также необходимо провести измерение абсолютной величины светового потока для калибровки светодиодных блоков. В качестве стандарта с достоверно известной световой отдачей и спектром была выбрана лампа накаливания с мощностью 40 Вт, которая помещалась по центру ящика и питалась стабильным напряжением 220 В; для нее был также измерен спектр с применением того же прибора.
Темп фотосинтеза при низкой освещенности в первом приближении пропорционален концентрации светопоглощающих пигментов и числу фотонов с длинами волн в интервале между 350 и 750 нм, т. е. фотосинтетическому световому потоку; обычные энергетические и светотехнические единицы плохо подходят для его характеризации. Величина фотосинтетического потока фотонов обычно выражается в микромолях в секунду на м2 или микромолях в день на м2 — PPF и PPFD соответственно. Величина PPFD получается из величины PPF просто умножением на 84000, т. е. на количество секунд в календарных сутках.
Расчет плотности фотосинтетического потока фотонов PPF осуществлялся по следующему алгоритму. Пусть имеется спектр зависимости числа излучаемых фотонов n в относительных единицах от длины волны λ в м. Возьмем в качестве калибровочного источника света лампу накаливания с известной полной мощностью P = = 40 Вт (эффективность светоотдачи m = 1.9 %) и измерим для нее спектр излучения n ( λ ) в тех же относительных единицах. Тогда для получения значения PPF для экспериментальной лампы нужно выполнить следующие шаги.
-
1) Перевести интенсивность излучения из относительных единиц счета фотонов в относительные энергетические единицы f ( λ )
n(λ)hc λ, где h — постоянная Планка 6.625∙10–34 Дж·c; c — скорость света 3∙108 м∙с–1.
-
2) Рассчитать коэффициент k ( λ ) перевода полученной интенсивности в относительных энергетических единицах в Вт
к < Л ) =
Pmf ( λ )
750 , т L f <^)d^
где τ — время интегрирования, с.
-
3) Используя полученный коэффициент k ( λ ), можно перевести исходную спектральную зависимость интенсивности f ( λ ) в относительных единицах от длины волны в м в интенсивность F ( λ ), выраженную в системных энергетических величинах — Вт.
-
4) Рассчитать полную величину фотосинтетического потока фотонов PPF, мкмоль·м–2·с–1,
F ( λ )d λ PPF = J350--------- ,
ShcNA , где S — площадь освещаемой поверхности, м2, NA = 6.023·1017 мкмоль-1 — число Авогадро.
Такой же расчет можно применить для получения значения PPF для экспериментальных светодиодных источников, используя приборный коэффициент перевода k ( λ ), вычисленный из данных для лампы накаливания, т. к. мощность и коэффициент светоотдачи для лампы, сконструированной из разных светодиодов, как правило, неизвестны.
Интенсивность излучения от трех блоков, расположенных на верхней и боковых стенках, выраженная в числе фотонов фотосинтетического диапазона во всем объеме каждого ящика фитотрона, составляла 135 ±20 мкмоль·м–2·с–1, что соответствует 4.5 Вт для экспериментального светодиодного источника излучения, и 87 ±15 мкмоль·м–2·с–1 для нормировочного источника — лампы накаливания с выходной мощностью излучения 0.76 Вт. Увеличивая количество блоков и мощность светодиодов, можно было легко добиваться стандартно используемой величины PPF в 300–600 мкмоль·м–2·с–1 без перегрева ящика.
ТЕСТИРОВАНИЕ ФИТОТРОНА
Нами было предложено, в согласии с [17], использовать содержание хлорофилла и его молекулярных форм в листьях как меру ответа организма растения на величину суммарной суточной экспозиции растений и спектра освещения. В качестве опытных растений были взяты хлорофитум хохлатый (Chlorophytum comosum maculatum) и овес посевной (Avena sativa). Растения выращивали в почвенной культуре при 21–22 ºС и влажности воздуха 75– 80 %. Все хлорофитумы брались от одного родителя и выращивались до начала эксперимента в теплице в одинаковых горшках с одним и тем же грунтом, при дневном свете с дополнительным искусственным освещением лампой накаливания. С помощью таймеров для каждого ящика фитоторона устанавливалась длительность суточного освещения (9, 3, 1 и 0.25 ч), в остальное время хлорофитумы находились в темноте. В случае экспериментов с овсом, наоборот, длительность суточного освещения была одинаковой, а спектр освещения различался от ящика к ящику.
Для измерений спектральной оптической плотности использовался спектрофотометр JEANWAY 6305. Оптическая плотность образца нормировалась на чистый растворитель для каждого измерения, которые проводились в кварцевых кюветах объемом 3 мл.
Измерение поглощения хлорофилла от тестовых растений проводилось без предварительного разделения на фракции. Экстракция пигментов из отобранных 100 мг листьев проводилась в 10 мл 100 % ацетонитрила в течение 30 мин в затемненных условиях для предотвращения деградации хлорофилла, после чего образец фильтровался и использовался для измерений.
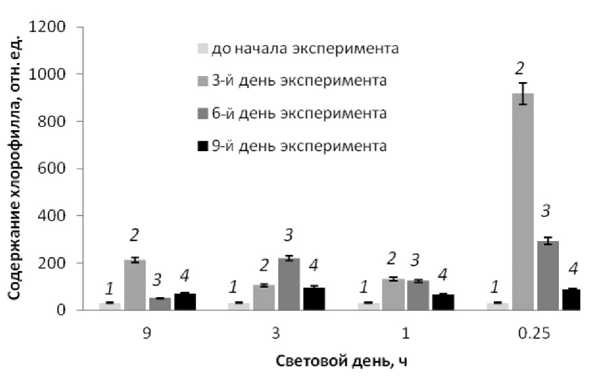
Рис. 2. Изменение полного количества светочувствительных пигментов, содержащихся в листьях исследуемого растения, в зависимости от срока выдержки растения на свету в течение 9, 3, 1 и 0.25 ч в сутки.
1 — контроль, 2 — третий день эксперимента, 3 — шестой день эксперимента, 4 — девятый день эксперимента
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование роли суточной экспозиции проводилось с применением трех светодиодных блоков в каждом ящике по методике, описанной выше. Хлорофитумы помещались в экспериментальный фитотрон и освещались в течение 9, 3, 1 и 0.25 ч в сутки, остальное время растения находились в темноте. Измерения содержания хлорофилла проводили до начала эксперимента и каждые последующие 3 дня в течение 12 дней. Доля листьев, забираемая от каждого из растений для измерений, составляла порядка 5 % от его суммарной лиственной массы.
На рис. 2 представлены зависимости полного количества светочувствительных пигментов, содержащихся в листьях исследуемых растений — каротиноидов, хлорофилла а и хлорофилла b, — от срока выдержки растений в условиях светодефицита. Как видно, все четыре растения демонстрируют качественно схожее поведение: резкий рост количества хлорофилла на 3 и 6 днях эксперимента по сравнению с содержанием хлорофилла 31 отн. ед. до начала эксперимента, которое затем снижается и стабилизируется к девятому дню. Наиболее сильно указанный эффект проявляется в условиях наибольшего светодефицита, т. е. минимального из использованных величин PPFD. Зрительно хлорофитумы остаются неизменными: нет ни увеличения, ни уменьшения длины листьев, ни изменения их формы.
По изменению формы полученных спектров поглощения (рис. 3) можно сказать, какой из пигментов (хлорофилл а или b) синтезируется в большей степени в зависимости от условий эксперимента. Это позволило использовать неразделенный спектр и делать на его основании выводы не только об общем количестве пигмента, но и о его фракционном составе. Измеренный спектр неразделенной смеси демонстрирует все особенности, присущие отдельным компонентам: максимумы при 660 и 430 нм соответствуют максимумам для хлорофилла а и каротиноидов, плечи при 640 и 460 нм соответствуют максимуму поглощения хлорофилла b.
Отметим, что по мере выдерживания растений в условиях светодефицита изменяется не только площадь под спектрами, но и форма спектров поглощения. Так, возрастает относительный вклад плеча на длине волны 460 нм по сравнению с основным пиком при длине волны 430 нм в спектрах поглощения выделенного хлорофилла. Это говорит о нарастающем увеличении концентрации хлорофилла b по сравнению с хлорофиллом а в листьях растений. Можно предположить, что увеличение количества хлорофилла b
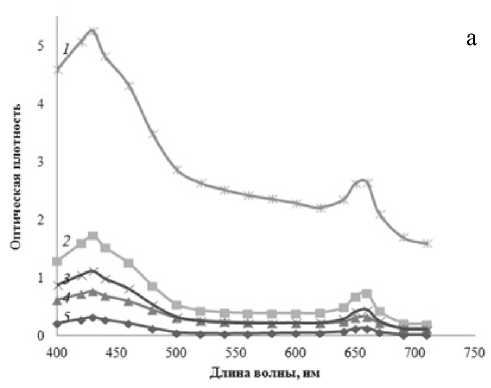
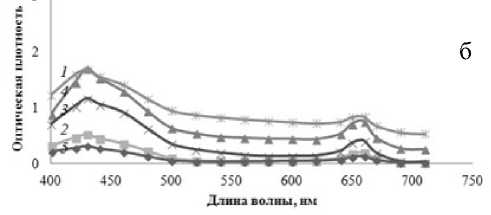
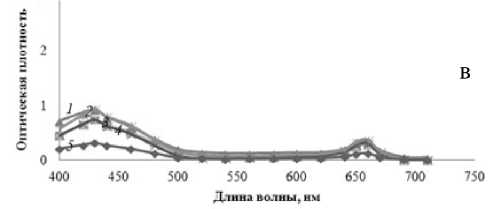
Рис. 3. Спектры общей фракции хлорофилла.
Спектры а, б, в получены последовательно с интервалом в 3 дня для хлорофитумов, освещаемых в течение 15 мин ( 1 ), 9 ч ( 2 ), 1 ч ( 3 ), 3 ч ( 4 ) в сутки, и для контрольного растения ( 5 )
в темно-адаптированном хлоропласте расширяет поглощаемый пигментом спектр длин волн.
Исследование роли спектра облучения проводилось с использованием овса посевного на стадии прорастания семян. Были посажены семена овса, и горшки помещены в фитоторон. Каждый ящик разделялся подвижной перегородкой. Источники освещения содержали по 15 светодиодов, причем конструктивно они выполнены так, чтобы можно было освещать бόльшую поверхность растений, т. е. содержали загнутые концы 50×120 мм под углом 30°, основная часть составляла 100×120 мм. Всего было сделано 6 светодиодных ламп с различающимися спектрами
400 450 500
550 600 650 700
Длина волны, нм
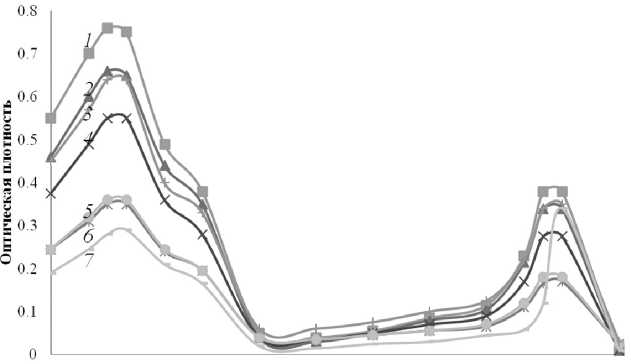
Рис. 4. Спектры поглощения хлорофилла для растений, освещаемых: 1 — теплыми белыми светодиодами, 2 — синими светодиодами, 3 — сине-бело-красными светодиодами, 4 — холодными белыми светодиодами, 5 — красно-синими светодиодами, 6 — красными светодиодами, 7 — лампой накаливания 40 Вт освещения, для каждого из которых была посчитана величина PPF, данные представлены в таблице (см. Приложение).
После выдержки растений в фитотороне в течение 9 дней, проводилось экстрагирование хлорофилла и измерялись спектры его поглощения (рис. 4). Полученные формы кривых поглощения светочувствительных пигментов листьев качественно остаются практически одинаковы для всех режимов освещения, но амплитуды пиков при длине волны 430 нм и 660 нм — максимумах поглощения хлорофилла, различаются. Так, амплитуда пика при длине волны 430 нм лежит в интервале от 0.8 до 0.25 единиц оптической плотности. Амплитуда пика при 660 нм пропорциональна амплитуде коротковолнового пика и составляет примерно 50 % от него, за исключением случая освещения растений лампой накаливания, когда амплитуда этого пика даже несколько превышает пик при длине волны 430 нм.
Значения площадей под спектрами поглощения, отражающие содержание хлорофилла в овсе посевном, освещаемом в течение 9 дней источниками освещения с различным соотношением светодиодов, т. е. с различными спектральными характеристиками, составили (в отн. ед.):
Для теплых белых светодиодов — 5;
Для синих —4.3;
Для холодных белых —3.6;
Для красных —2.4;
Для сине-красных —2.5;
Для сине-бело-красных —4.4;
Для лампы накаливания —2.
Видно, что освещение в условиях дефицита синего света, т. е. коротковолновых фотонов, приводит к относительно меньшему количеству хлорофилла в листьях растений, чем при более сбалансированном освещении. Особенно благоприятным является облучение лампой со спектральным составом света, в котором присутствуют как синие, так и красные компоненты. Таким образом, оказалось, что оптимальным с точки зрения количества хлорофилла является спектр, близкий к спектру его поглощения. Это позволяет предложить принцип построения светодиодного источника света для использования в сельскохозяйственном производстве в условиях уменьшенного светосинтетического потока.
КРАТКИЕ РЕЗУЛЬТАТЫ И ВЫВОДЫ
Разработанный экспериментальный лабораторный фитотрон позволяет проводить эксперименты в отношении роли суточной экспозиции, величин фотосинтетического потока PPF и спектра освещения. Использованные источники света можно легко перестраивать под требуемую задачу. В фитотроне приняты специальные меры для уменьшения возможного влияния электромагнитных полей, создаваемых цепями питания, на рост и развитие экспериментальный растений, что делает его особенно пригодным для биофизических исследований.
ПРИЛОЖЕНИЕ
Фотометрические величины и электромагнитные спектры излучения для экспериментальных светодиодных ламп
|
Цветовая характеристика и количество светодиодов в источнике освещения |
Электромагнитный спектр излучения |
Плотность фотосинтетического потока фотонов PPF, мкмоль·м-2·с-1 |
Мощность излучения, Вт |
|
1 |
2 |
3 |
4 |
|
Теплые белые (2700 К), 15 шт. |
ц 40000 ° 34ЮОО - | 20000- А S 10000 400 450 500 550 600 650 700 750 600 Длина волны, нм |
190 ±30 |
3 |
|
Синие, 15 шт. |
50000- 4 у 40000 - ■ £ 30000 - ■ g 20000 - 10000 400 450 500 550 600 650 700 750 600 Длина волны, нм |
44 ±7 |
0.8 |
|
Холодные белые (5000 К), 15 шт. |
ц. 40000- ■ ° зоооо- Ж = 20000 2 10000- «00 450 500 550 600 650 700 750 800 Длина волны, нм |
175 ±27 |
2.9 |
|
Красные, 15 шт. |
50000 - 1 У 40000- 1 30000- Ж = 20000 - 2 1оооо - «00 450 500 550 600 650 700 750 800 Длина волны, нм |
40 ±6 |
0.6 |
( Продолжение )
|
1 |
2 |
3 |
4 |
|
Синие, 6 шт.; Красные, 9 шт. |
/ 30000- В 1 g 20000- E i Ж 1 S 10000- <00 450 500 550 600 650 700 750 000 Длина волны, нм |
71 ±11 |
1.2 |
|
Синие, 3 шт.; Белые, 3 шт.; Красные, 6 шт. |
а 40000 ° 30000- Ж = 20000 - Я 2 10000- «00 450 500 550 600 650 700 750 800 Длина волны, нм |
71 ±11 |
1.1 |
Список литературы Разработка лабораторного фитотрона с возможностью варьирования спектра излучения и длительности суточной экспозиции и его биологическое тестирование
- Glaser R. Physical factors of the environment//Biophysics. Springer, Berlin, Heidelberg, 2012. P. 245-332.
- Бучаченко А.Л. Магнитно-зависимые молекулярные и химические процессы в биохимии, генетике и медицине//Успехи химии. 2014. Т. 83, №. 1. С. 1-12.
- Бинги В.Н., Савин А.В. Физические проблемы действия слабых магнитных полей на биологические системы//Успехи физических наук. 2003. Т. 173, №. 3. С. 265-300.
- Гедерим В.В., Соколовский В.В., Горшков Э.С., Шаповалов С.Н., Трошичев О.А. Периодические изменения некоторых гематологических показателей, характеризующих процесс адаптации в организме человека и вариации гравитационного поля//Биофизика. 2001. Т. 46, № 5. С. 833-834.
- Соколовский В.В. Тиолдисульфидная система в реакции организма на факторы окружающей среды. СПб.: Наука, 2008. 112 с.
- Тихомиров А.А., Шарупич В.П., Лисовский Г.М. Светокультура растений: биофизические и биотехнологические основы. Учебное пособие для вузов. Новосибирск: Изд-во СО РАН, 2000. 213 c.
- Спиваков Д.С., Мынбаев К.Д. Светодиодные нанотехнологии в биологии и медицине. Учебное пособие. СПб.: НИУИТМО, 2013. 139 с.
- Massa G.D., Kim H.H., Wheeler R.M., Mitchell C.A. Plant productivity in response to LED lighting//HortScience. 2008. Vol. 43, no. 7. P. 1951-1956.
- Olle M., Viršile A. The effects of light-emitting diode lighting on greenhouse plant growth and quality//Agricultural and food science. 2013. Vol. 22, no. 2. P. 223-234.
- Folta K.M., Childers K.S. Light as a growth regulator: controlling plant biology with narrow-bandwidth solid-state lighting systems//HortScience. 2008. Vol. 43, no. 7. P. 1957-1964.
- Протасова Н.Н. Светокультура как способ выявления потенциальной продуктивности растений//Физиология растений. 1987. Т. 34, №. 4. С. 51.
- Шибаева Т.Г., Марковская Е.Ф. Влияние круглосуточного освещения на состояние фотосинтетического аппарата и рост растений огурца Cucumis sativus L. на ранних этапах онтогенеза//Труды Карельского научного центра РАН. 2012. №. 2. C. 162-166.
- Pfeiffer N.E. Anatomical study of plants grown under glasses transmitting light of various ranges of wave lengths//Botanical Gazette. 1928. P. 427-436 DOI: 10.1086/333854
- Cathey H.M., Campbell L.E. Light and lighting systems for horticultural plants//Horticultural Reviews. 1980. Vol. 2. P. 491-537 DOI: 10.1002/9781118060759.ch10
- Ritchie R.J. Modelling photosynthetic photon flux density and maximum potential gross photosynthesis//Photosynthetica. 2010. Vol. 48, no. 4. P. 596-609. Doi: 10.1007/s11099-010-0077-5.
- Бриттон Г. Биохимия природных пигментов. М.: Мир, 1986. 422 c.
- Дымова О.В., Гриб И., Головко Т.К., Стржалка К. Состояние пигментного аппарата зимне-и летнезеленых теневыносливого растения Ajuga reptans//Физиология растений. 2010. Т. 57, № 6. C. 809-818.


