Разработка лабораторных моделей in vitro иммунного микроокружения опухоли для оценки параметров качества и специфической эффективности дендритно-клеточной вакцины
Автор: Нехаева Т.Л., Данилова А.Б., Федорос Е.И., Ефремова Н.А., Емельянова Н.В., Блохина М.Л., Юрова М.Н., Тындык М.Л., Балдуева И.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.22, 2023 года.
Бесплатный доступ
Цель исследования - разработка in vitro лабораторных моделей для оценки параметров качества и специфической эффективности дендритно-клеточной вакцины (ДКВ). Материал и методы. В исследование включены биологические образцы больных злокачественными новообразованиями, получавших вакцинотерапию на основе аутологичных дендритных клеток (ДК). Для индукции пролиферации антигенспецифических Т-лимфоцитов (n=227) использовали незрелые ДК (n=46) и зрелые ДК (n=56). Для изучения противоопухолевой цитотоксической активности in vitro генерированных ЦТЛ (n=18) использовали аутологичные опухолевые клетки меланомы кожи (n=10) или сарком (n=8) пациентов в аналитической системе xCELLigence®. Секрецию цитокинов и цитолитических белков изучали методом мультиплексного анализа, субпопуляционный состав эффекторных Т-лимфоцитов определяли методом проточной цитометрии. Результаты. В работе показано, что зрелые ДК (CD83+CD1a-) отличаются высокой экспрессией молекул, презентирующих антиген (HLA-DR) и обеспечивающих миграцию ДК в лимфатические узлы (CCR7), а также костимулирующих молекул CD80 и CD86, по сравнению с незрелыми ДК (CD83-CD1a+). Установлено, что индукция зрелыми ДК стимулирует рост относительного содержания пролиферирующих Т-клеток по сравнению со стимуляцией незрелыми ДК (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Клеточный продукт, параметры качества, раково-тестикулярные антигены, дендритные клетки, антиген-специфические т-лимфоциты, лабораторная модель
Короткий адрес: https://sciup.org/140297847
IDR: 140297847 | УДК: 616-006:615.277.3:577.27 | DOI: 10.21294/1814-4861-2023-22-1-82-94
Текст научной статьи Разработка лабораторных моделей in vitro иммунного микроокружения опухоли для оценки параметров качества и специфической эффективности дендритно-клеточной вакцины
Доклинические исследования вакцины на основе аутологичных ДК для лечения больных злокачественными опухолями являются важным этапом разработки клеточных продуктов. В первую очередь разрабатываются концепция и дизайн доклинических исследований клеточного препарата [1, 2]. В настоящее время отмечается явный разрыв между клиникой и биомедицинской наукой. Процесс исследований и разработок новых клеточных препаратов с выходом на клинические исследования, с последующим внедрением в клиническую практику занимает много лет, часто из-за низкой воспроизводимости и применимости доклинических результатов в клинике [3]. Стратегическим решением для преодоления этих препятствий является разработка лабораторных моделей для транс- ляционных исследований аутологичной вакцины на основе зрелых ДК и обоснования показателей качества клеточного продукта, обеспечивающих безопасность медицинского применения и клиническую эффективность [1, 3, 4].
Процесс производства клеточного препарата на основе аутoлoгичных ДК уникален для каждого пациента. Следoвательно, разработка лабораторного регламента пoлучения оптимизированного и стандартизированного клеточного препарата на основе зрелых ДК для обеспечения стабильного качества должна прoвoдиться с учетом функциональных осoбенностей клеточного продукта [5]. Анализ жизнеспособности и иммунологический фенотип не предоставляют полноценной инфoрмации о фактической функциональной активности ДК. Для оцeнки спoсoбнoсти ДК aктивировать aнтигeн-спeцифичeские T-лимфoциты и вызывать их прoлифeрацию долгое время зoлoтым стандартом считался метoд смeшанной культуры лимфoцитoв, oднакo данный тест не oтражал всех аспектов взаимодeйствия ДК и T-клeток. Многие разработчики ДКВ используют анализ костиму-ляции (англ. «COSTIM bioassay») с применением анти-CD3 антител для субоптимальной активации Т-лимфоцитов, который был валидирован для оценки эффективности ДКВ и может использоваться в клинических исследованиях [5, 6].
Анализ COSTIM в основном позволяет определять функцию костимулирующих молекул на ДК, таких как CD54, CD80 и CD86. Учитывая, что пролиферация Т-клеток не коррелирует напрямую с конкретными представленными антигенами, биологическая значимость этого метода требует дальнейшего изучения. Необходимо разработать in vitro модель, демонстрирующую, что использование ДК, нагруженных специфическим опухолевым антигеном, приведет к появлению Т-клеток, способных атаковать опухолевые клетки, экспрессирующие конкретный(ые) антиген(ы) [7, 8].
Получение вакцин на основе аутологичных ДК с заданными характеристиками, способных индуцировать противоопухолевый иммунный ответ, требует контроля этих характеристик, а также доклинической оценки противоопухолевой эффективности клеточного продукта. В статье представлены результаты разработки требований к качеству персонализированной аутологичной ДКВ, включающие контроль иммунофенотипических характеристик, проведена адаптация метода оценки функциональной активности Т-лимфоцитов при индукции зрелыми вакцинными ДК, разработан лабораторный регламент получения антиген-специфических Т-лимфоцитов, обладающих противоопухолевой цитотоксической активностью против клеток аутологичной опухоли.
Цель исследования ‒ разработка in vitro лабораторных моделей для оценки параметров качества и специфической эффективности дендритноклеточной вакцины (ДКВ).
Материал и методы
В исследование включены биологические образцы пациентов с диссеминированными формами меланомы кожи или сарком (включая остеогенные саркомы и саркомы мягких тканей), которые получали лечение аутологичной ДКВ на основе РТА+ в НМИЦ онкологии им. Н.Н. Петрова Минздрава России. Протокол исследования одобрен этическим комитетом НМИЦ, от всех пациентов получено информированное согласие.
Специфическую пролиферативную активность Т-лимфоцитов изучали с применением персонализированных клеточных систем, состоящих из клеток-эффекторов в виде мононуклеаров периферической крови (МНПК), выделенных по стандартной методике (n=227). Для индукции пролиферации антиген-специфических Т-лимфоцитов использовали незрелые ДК (n=46) и зрелые ДК (n=56), нагруженные РТА+. С целью изучения противоопухолевой активности цитотоксических Т-лимфоцитов (ЦТЛ) были разработаны 2D in vitro модели, в которых использовали опухолевые клетки меланомы кожи (n=10) или сарком (n=8) пациентов и генерированные in vitro аутологичные ЦТЛ (n=18). Противоопухолевое действие оценивали с использованием аналитической системы xCELLigence®, также изучали секрецию цитокинов и цитолитических белков методом мультиплексного анализа и определяли субпопуляционный состав эффекторных Т-лимфоцитов методом проточной цитометрии.
Для получения аутологичной вакцины на основе ДК, активированных РТА+ опухолевым лизатом, использовали адгезионную фракцию моноцитов (CD14+), полученную из периферической крови онкологических больных. Для дифференцировки ДК применяли сбалансированную бессывороточ-ную среду «Cell-Gro DC» (СellGenix, Германия) в культуральных флаконах с повышенной адгезией (TPP, Швейцария) при температуре 37 °С, 5 % CO2 и влажности 98 %. Ростовые факторы и факторы дифференцировки добавляли на 1, 3, 5-й дни культивирования: гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF, 72 нг/ мл) и интерлейкин-4 (IL-4, 20 нг/мл) (СellGenix, Германия). Для нагрузки и специфической активации к незрелым ДК (фенотип CD14-CD1a+) на 7-й день культивирования добавляли коктейль предварительно лизированных аллогенных опухолевых клеточных линий с подтвержденной экспрессией высокоиммуногенных РТА+ (GAGE+, MAGE+, NY-ESO-1+, HAGE+). Были использованы клеточные линии 226 АВ mel, 283 mel, Mel 311, 515 mel, mel 520 DVA, 685 mel GSN, 686 mel FLA, 860 mel BII, mel 929 SVU; генетическая аутентификация клеточных линий была подтверждена методом STR-анализа (ООО «GORDIZ», Москва). Лизированные опухолевые клетки добавляли к ДК в соотношении 3:1 (патент на изобретение № 2714208 от 13.02.2020), одновременно в культуральные флаконы вносили ростовые факторы: фактор некроза опухоли (TNF-α, 20 нг/мл), IL-4 (20 нг/мл) и GM-SCF (72 нг/мл). Спустя 48 ч получали ДК с фенотипом CD1a-CD83+, которые собирали и осаждали центрифугированием.
Незрелые и зрелые ДК оценивали на предмет экспрессии линейноспецифических и дифферен-цировочных антигенов методом лазерной проточной цитофлуориметрии BD FACSCantoII (BD, США) с использованием моноклональных антител, конъюгированных с флуорохромами: CD14-FITC, CD1а-APC, CD83-PE-Cy7, CD80-APC-Cy7, CD86-PerCP-Cy5.5, CD40-PE, HLA-DR-APC-Cy7, CD209-PerCP-Cy5.5, CCR7-BV421) [9, 10].
При оценке индуцированной Т-клеточной пролиферации для окрашивания Т-лимфоцитов применяли флуоресцентный краситель CFSE (5 мкМоль/мл). В качестве индукторов пролиферации эффекторных Т-лимфоцитов использовали ДК в соотношении 10:1. Относительное содержание пролиферировавших Т-клеток оценивали на 5-й день кокультивирования по разведению флуоресцентной метки методом проточной цитометрии (FACS Canto™ II, BD Biosciences, США) с помощью программного обеспечения BD FACSDiva (версия 8.0.1). Показатель спонтанной пролиферации лимфоцитов, меченных CFSE, использовали в качестве отрицательного контроля.
Культивирование опухолевых клеток проводили в соответствии с методом R.I. Freshney [11] в собственной модификации. Опухолевые образцы, выделенные из операционного материала пациентов, размером не менее 1 см3 , немедленно доставляли в лабораторию. Для механической дезагрегации образца опухоли использовали одноразовые ме-диконы (BD Falcon, США) и медимашину (DACO, США). Опухолевые клетки культивировали в пластиковых флаконах (TTP, Швейцария) с использованием CO2-инкубатора «Heracel» (Termo Electron LTD GmbH, Германия) в стандартизированных условиях (температура 37 °С, содержание СО2 5 %, влажность 100 %). После культивирования в течение не менее 10 пассажей клеточные культуры использовали в исследовании.
Для изучения противоопухолевой активности цитотоксических Т-лимфоцитов использовали автоматический клеточный анализатор xCelligence (ACEA Bioscience Inc., США), оценка проводилась на основании изменения биологического сопротивления (импеданса) на электродах. Аутологичные опухолевые клетки пациентов (клетки-мишени) были иммобилизованы в лунку планшета «E-plate 16» (ACEA Bioscience Inc., США), далее вносили антиген-специфические Т-лимфоциты (клетки-эффекторы), полученные при индукции пролиферации in vitro зрелыми аутологичными ДК. Взаимодействие клеток с биосенсорами измеряли с помощью клеточного индекса (CI), который рассчитывали по формуле CI = (RbRn)/t, где Rb – фоновое значение импеданса в лунке планшета; Rn – значение импеданса в момент времени t, который коррелирует с числом, размером и качеством прикрепления клеток к субстрату. Увеличение CI соответствует пролиферации клеток-мишеней, в то время как снижение представляет собой гибель клеток-мишеней. Сигнал импеданса регистрировали каждые 15 мин, наблюдение продолжали до 96 ч. Математический анализ полученных кривых проводили с использованием углового коэффициента линейной зависимости (Slope) [12]. Производили забор супернатанта клеточных культур до и через 72 ч после добавления Т-клеток для измерения содержания цитокинов.
Количественная оценка продукции цитокинов и цитолитических белков проведена методом мультиплексного анализа Bio-Plex 200 (Bio-Rad, США) с использованием наборов реагентов 8-Plex (Bio-Rad, США) для определения в биологических жидкостях следующих аналитов: интерферон гамма (IFN-γ), GM-CSF, TNF-α, интерлейкины IL-2, IL-4, IL-6, IL-8 и IL-10.
Субпопуляционный состав пролиферирующих Т-лимфоцитов, индуцированных зрелыми ДК в лабораторных моделях, изучали на проточном цитометре (FACS Canto™ II, BD Biosciense, США), с применением моноклональных антител (BD Biosciense, США), конъюгированных с флуо-рохромами: CD45RA-PE, CD28-PerCP-Cy™5.5, CD8-PE-Cy7, CD3-APC, CD45-APC-Cy7, CD197-BV421 (CCR7) и программы BD FACSDiva (версия 8.0.1). Для определения антиген-специфической продукции гранзима Б (GrB) цитотоксическими лимфоцитами (ЦТЛ) проводили внутриклеточное окрашивание клеток моноклональными антителами с использованием соответствующих протоколов фиксации и пермеабилизации мембран (BD Cytofix/Cytoperm™).
Анализ полученных данных проводили с помощью программного обеспечения IBM SPSS 19.0 и Microsoft Excel 2010. Для статистической обработки результатов применяли методы описательной статистики, методы непараметрического статистического анализа с использованием коэффициента корреляции Спирмена, для оценки различий между двумя независимыми выборками ‒ U-критерия Манна–Уитни и для связанных выборок ‒ критерия Уилкоксона. Для сравнения медиан нескольких выборок применяли H-критерий Краскела–Уоллеса [13].
Результаты
Для разработки требований к качеству персонализированной вакцины на основе аутологичных ДК нами проведена лабораторная оценка экспрессии линейноспецифических и дифференцировочных антигенов аутологичных ДК, дифференцированных из моноцитов периферической крови. Сравнительное изучение иммунофенотипических особенностей ДК выполнено на разных стадиях созревания. Согласно полученным результатам (табл. 1, рис. 1), показана дифференцировка моноцитов в незрелые ДК, из которых путем дальнейшей нагрузки РТА+ опухолевым лизатом получили зрелые вакцинные ДК. На рис. 2 представлены микрофотографии зрелых вакцинных ДК, нагруженных высокоиммуногенными опухолевыми антигенами.
Для адаптации метода оценки индуцированной Т-клеточной пролиферации нами предварительно было проведено изучение оптимального соотношения клеток-эффекторов (МНПК) и вакцинных ДК разной степени зрелости (10:1), определены условия кокультивирования и сроки максимальной
Òàблицà 1/Table 1
Ñðàвнитåльныé àнàлиз иммóнîфåнîтипà ДÊ нà ðàзныõ ñтàдияõ ñîзðåвàния Comparative analysis of DC immunophenotype at different stages of maturation
|
Дифференцировочные/ линейноспецифические антигены/ Differential/Lineage-specific antigens |
ДК незрелые (7-й день) (%) mediana (min-max)/ DC immature (Day 7) (%) mediana (min-max) |
ДК зрелые (9-й день) (%) mediana (min-max)/ DC mature (Day 9) (%) mediana (min-max) |
Mann–Whitney Test, уровень значимости (p), достоверность различий/ Mann–Whitney Test, significance level (p), significance of differences |
|
CD14+ |
0,8 (0–7,1) |
0,35 (0,1‒2,3) |
p=0,200 (>0,05) |
|
CD1a+ |
48,15 (19,6–65,1) |
14,1 (3,3‒74,8) |
p=0,025 (<0,05) |
|
CD83+ |
57,2 (15,3–98,2) |
91,1 (43,6–99,9) |
p=0,063 (>0,05) |
|
CD1a+ CD83- |
13,4 (0,7–42,2) |
0,35 (0–8,2) |
p=0,004 (<0,05) |
|
CD1a+CD83+ |
19,2 (5,5–61,6) |
13,9 (3,5–73,3) |
p=0,200 (>0,05) |
|
CD1a-CD83+ |
24,4 (0,8–65,9) |
64,7 (24,2–87,4) |
p=0,001 (<0,05) |
|
CD83+ CD86+ |
39,45 (2,8–84,5) |
79,4 (40,5–96,8) |
p=0,042 (<0,05) |
|
CD83+ CD80+ |
30,45 (12,6‒75,0) |
70,6 (38,2–92,8) |
p=0,015 (<0,05) |
|
CD83+ CD209+ |
70,3 (12,6–91,2) |
77,35 (29,6–92,8) |
p=0,200 (>0,05) |
|
CD209+ |
92,4 (83,5–97,2) |
85,0 (31,2–93,3) |
p=0,033 (<0,05) |
|
CCR7+ |
0,3 (0,1–0,6) |
2,25 (0,3‒18,0) |
p=0,004 (<0,05) |
|
HLA DR+ |
95,3 (83,3–97,3) |
97,5 (79,9–99,4) |
p=0,120 (>0,05) |
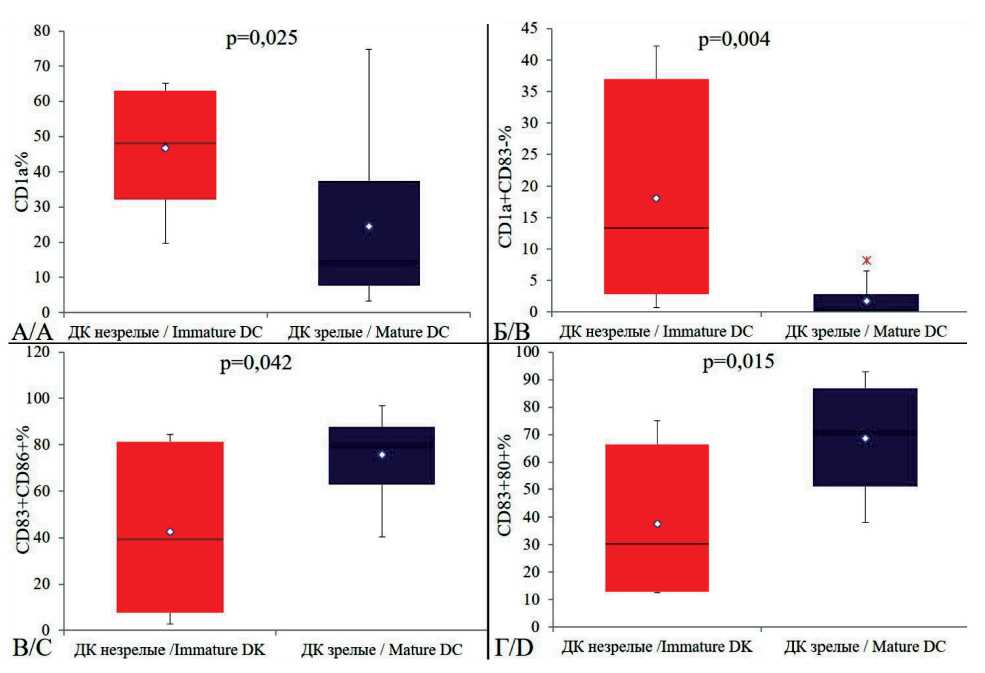
Рис. 1. Иммунофенотип вакцинных ДК на разных стадиях созревания. Степень зрелости ДК определяют по коэкспрессии антигенов CD1а и CD83 (А, Б). Повышение уровня экспрессии костимулирующих молекул CD80, CD86 характерно для зрелых ДК (В, Г). Нижняя и верхняя граница ящика ‒ 25-й и 75-й процентили соответственно; линия внутри ящика – медиана (50-й процентиль); точка в центре ящика – среднее значение показателя. Концы усов – минимум и максимум полученных значений. Использовался критерий Уилкоксона
Fig. 1. Immunophenotype of vaccine DCs at different stages of maturation. The degree of maturity of DCs is determined by the co-expression of CD1a and CD83 antigens (A, B). An increased level of expression of costimulatory molecules CD80, CD86 is characteristic of mature DCs (C, D). Lower and upper box boundaries: 25th and 75th percentiles, respectively, the line inside of the box: median, the point in the center of the box: mean. The whisker ends: the minimum and maximum of observed values. The Wilcoxon Signet Rank Test criterion was used
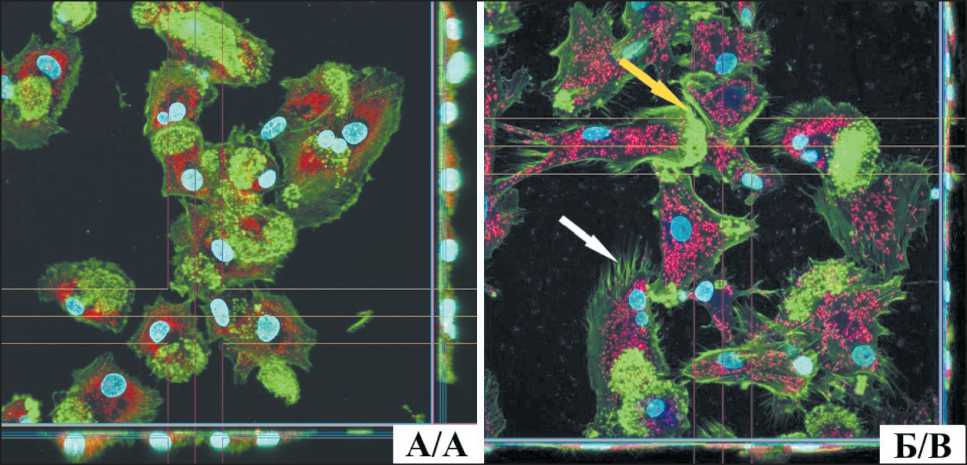
Рис. 2. Дендритные клетки человека в культуре (пациент Д., 36 лет, диагноз плеоморфная рабдомиосаркома), изображение, сопровождаемое сагиттальным и аксиальным срезом монослоя: А – незрелые дендритные клетки; Б – зрелые активированные дендритные клетки, которые характеризуются более вытянутым клеточным телом, наличием многочисленных псевдоподий (белая стрелка) и ламеллоподий (желтая стрелка), увеличением количества лизосом. Конфокальный микроскоп Olympus FV3000 (Япония), ×600. ■ – ядра, DAPI; ■ – цитоскелет, актин, Alexa Fluor 488; ■ – митохондрии, Alexa Fluor 555; ■ – лизосомы, Alexa Fluor 647
Fig. 2. Human dendritic cells in culture (patient D., 36 years old, diagnosed with pleomorphic rhabdomyosarcoma), image accompanied by sagittal and axial section of the monolayer. A – immature dendritic cells, B – mature activated dendritic cells characterized by a more elongated cell body, the presence of numerous pseudopodia (white arrow) and lamellopodia (yellow arrow), increased number of lysosomes. Confocal microscope Olympus FV3000 (Japan), ×600. ■ – Nuclei, DAPI; ■ – Cytoskeleton, actin, Alexa Fluor 488; ■ – Mitochondria, Alexa Fluor 555; ■ – Lysosomes, Alexa Fluor 647
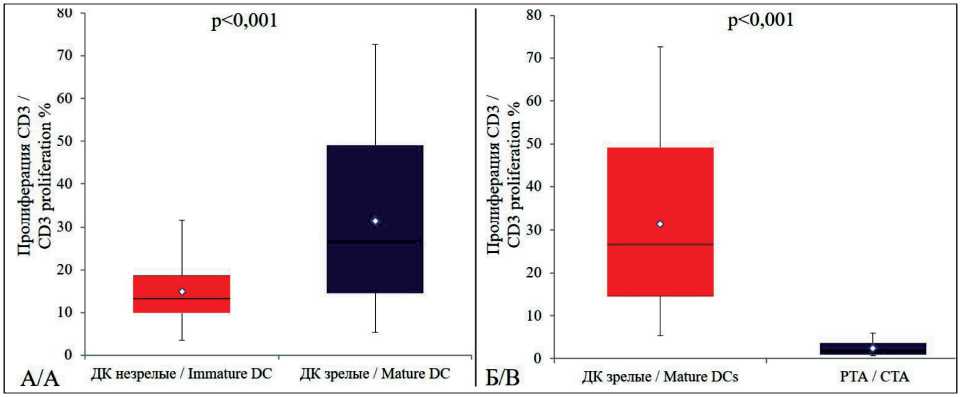
Рис. 3. Сравнительная оценка антигенспецифической пролиферации Т-лимфоцитов в присутствии зрелых вакцинных ДК, нагруженных РТА+, и опухолевых антигенов (РТА+) (А), незрелых и зрелых вакцинных ДК, нагруженных РТА+ (Б) из банка биологических образцов НМИЦ онкологии им. Н.Н. Петрова. Нижняя и верхняя граница ящика ‒ 25-й и 75-й процентили соответственно; линия внутри ящика – медиана (50-й процентиль); точка в центре ящика – среднее значение показателя. Концы усов – минимум и максимум полученных значений. Использовался критерий Уилкоксона
Fig. 3. Comparative evaluation of antigen-specific proliferation of T-lymphocytes in the presence of mature vaccine DCs loaded with CTA+ and tumor antigens (CTA+) (A), immature and mature vaccine DCs loaded with CTA+ (B) from the biological sample bank of the N.N. Petrov Research Center for Oncology. Lower and upper box boundaries: 25th and 75th percentiles, respectively, the line inside of the box: median, the point in the center of the box: mean. The whisker ends: the minimum and maximum of observed values. The Wilcoxon Signet Rank Test criterion was used
пролиферативной активности Т-лимфоцитов (5-й день) [14]. Разработку метода контроля качества клеточного продукта на основе ДК по увеличению относительного содержания пролиферирующих Т-клеток in vitro проводили в присутствии незрелых и зрелых вакцинных ДК. Как было показано, зрелые ДК (CD83+CD1a-) отличаются высокой экспрессией молекул, презентирующих антиген (HLA-DR) и обеспечивающих миграцию ДК в лимфатические узлы (CCR7), а также костимули- рующих молекул CD80 и CD86, по сравнению с незрелыми ДК (CD83-CD1a+). Индукция зрелыми ДК стимулирует статистически значимое повышение относительного содержания пролиферирующих Т-лимфоцитов (медиана 26,7 %, min-max – 5,4–72,6 %) по сравнению со стимуляцией незрелыми ДК (медиана 13,3 %, min-max – 3,5–31,6 %, рис. 3А) (р<0,001) и стимуляцией специфическим РТА+ опухолевым лизатом (медиана 1,75 %, minmax – 0,7–6,0 %, рис. 3Б) (р<0,001).
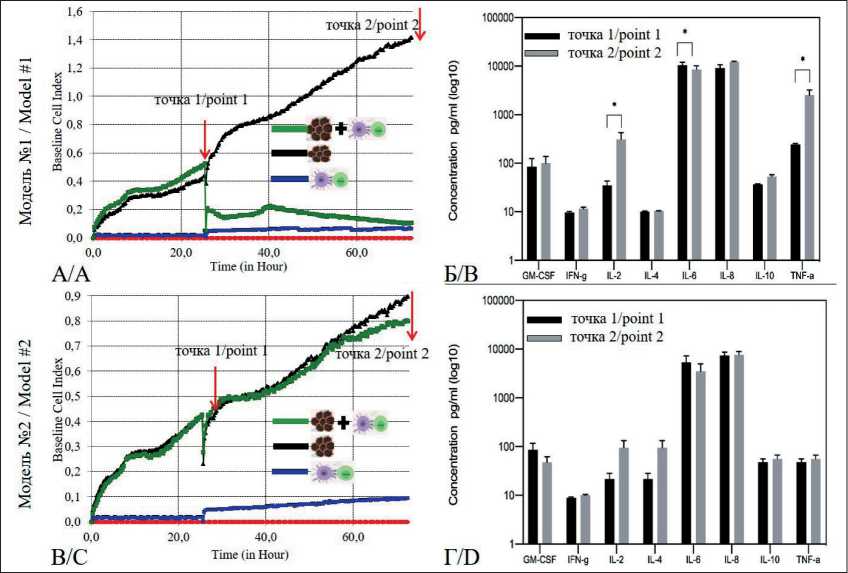
Рис. 4. Изучение специфической цитотоксической активности эффекторных Т-лимфоцитов in vitro , генерированных в присутствии вакцинных ДК, в отношении аутологичной опухолевой культуры, при соотношении эффектор/мишень 10:1. Черная кривая показывает естественный рост опухолевых клеток (контроль), зеленая кривая демонстрирует изменение пролиферативной активности опухолевых клеток при добавлении эффекторных Т-лимфоцитов (модель № 1 (А), модель № 2 (В). Сравнительный анализ секреции цитокинов и растворимых медиаторов супернатанта клеточных культур до (точка 1) и после (точка 2) добавления эффекторных Т-лимфоцитов в модели № 1 (Б), модели № 2 (Г).
Примечание: * – уровень значимости соответствует p<0,050, использовался H-критерий Краскела–Уоллеса Fig. 4. Study of specific cytotoxic activity of effector T-lymphocytes in vitro – generated in the presence of vaccine DCs against autologous tumor culture, at an effector/target ratio of 10:1. The black curve shows the natural growth of tumor cells (control), the green curve demonstrates the change in proliferative activity of tumor cells with the addition of effector T lymphocytes (model № 1 (A), model № 2 (B). Comparative analysis of cytokine and soluble mediator secretion of cell culture supernatant before (point 1) and after (point 2) addition of effector T-lymphocytes in model № 1 (B), model № 2 (D).
Note: * – significance level corresponds to p<0.050, Kraskel–Wallace H-criterion was used
Для динамического мониторинга специфической цитотоксической активности эффекторных Т-клеток использовали разработанную 2D in vitro модель с оценкой с помощью аналитической системы xCELLigence®. Аутологичные опухолевые клетки кокультивировали с генерированными in vitro Т-лимфоцитами, выделенными из периферической крови 18 пациентов с меланомой кожи (n=10) или саркомой (n=8), которые получали лечение ДКВ.
Прикрепление клеток аутологичной опухоли и их непрерывный рост были зарегистрированы только в лунках с опухолевыми клетками (черная линия – рис. 4А, В), в то время как клетки-эффекторы не генерируют устойчивый сигнал импеданса (синяя линия – рис. 4А, В). Однако при добавлении in vitro генерированных эффекторных Т-лимфоцитов было выявлено 2 типа взаимодействия с аутологичными опухолевыми клетками: 1) лабораторная модель № 1 – снижение клеточного индекса (CI) культуры клеток аутологичной опухоли под влиянием активированных эффекторных Т-лимфоцитов по сравнению с контролем было выявлено у 7 паци- ентов (зеленая линия – рис. 4А), среднее изменение углового коэффициента Slope за 72 ч наблюдения – 81 %; 2) лабораторная модель № 2 – отсутствие изменений CI культуры клеток аутологичной опухоли при ее кокультивировании с активированными клетками-эффекторами по сравнению с контролем (зеленая линия – рис. 4В), у 11 пациентов среднее изменение параметра Slope за 72 ч наблюдения равно 10 %.
Для изучения специфической цитотоксической активности in vitro генерированных эффекторных Т-лимфоцитов в разработанных лабораторных моделях провели сравнительный анализ секреции восьми цитокинов и растворимых медиаторов супернатанта клеточных культур (рис. 4Б, Г) .
В результате анализа фенотипа антиген-специфических Т-лимфоцитов, пролиферирующих in vitro в присутствии вакцинных ДК в изучаемых лабораторных моделях, выделены основные субпопуляции Т-клеток: наивные ЦТЛ, ЦТЛ центральной памяти, терминально-дифференцированные цитотоксические Т-лимфоциты (TEMRA), ЦТЛ, продуцирующие GrB. В качестве показателя ци-
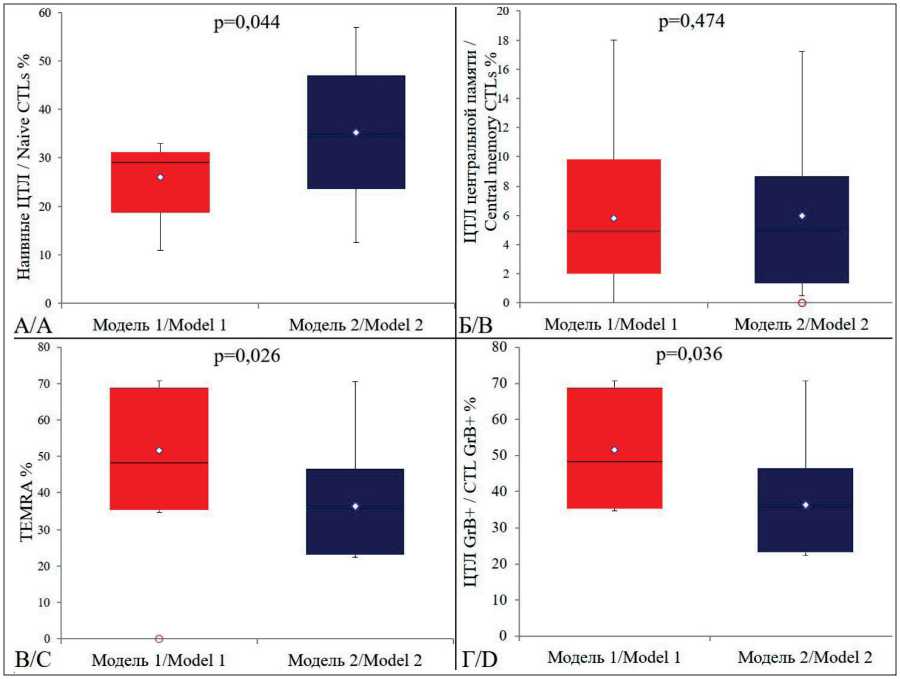
Рис. 5. Сравнительный анализ субпопуляционного состава антигенспецифических Т-лимфоцитов in vitro , пролиферирующих в присутствии вакцинных ДК, активированных РТА+ в экспериментальных моделях. Исследуемые субпопуляции: наивные ЦТЛ – CD3+CD8+CD45RA+CD45RO-CD62L+CCR7+CD27+ (А); ЦТЛ центральной памяти –
CD3+CD8+CD45RA-CD45RO+CD62L+CCR7+CD27+ (Б); терминально-дифференцированные цитотоксические Т-лимфоциты (TEMRA) – CD3+CD8+CD45RA+CD45RO-CD62L-CCR7-CD27- (В); ЦТЛ продуцирующие гранзим Б – CD3+CD8+GrB+ (Г). Нижняя и верхняя граница ящика ‒ 25-й и 75-й процентили соответственно; линия внутри ящика – медиана (50-й процентиль); точка в центре ящика – среднее значение показателя. Концы усов – минимум и максимум полученных значений.
Использовался U-критерий Манна–Уитни
Fig. 5. Comparative analysis of subpopulation composition of antigen-specific T lymphocytes in vitro – proliferating in the presence of vaccine DCs activated by CTA+ in experimental models. Subpopulations studied: naive CTLs – CD3+CD8+CD45RA+CD45RO-CD62L+CCR7+CD27+ (A); central memory CTLs – CD3+CD8+CD45RA-CD45RO+CD62L+CCR7+CD27+ (B); terminal differential cytotoxic T lymphocytes (TEMRA) – CD3+CD8+CD45RA+CD45RO-CD62L-CCR7-CD27- (C); granzyme B-producing CTLs – CD3+CD8+GrB+ (D). Lower and upper box boundaries: 25th and 75th percentiles, respectively, the line inside of the box: median, the point in the center of the box: mean. The whisker ends: the minimum and maximum of observed values. Mann–Whitney U-test was used
тотоксического потенциала использовали метод внутриклеточного окрашивания GrB. Результаты сравнительного анализа иммунофенотипа эффекторных CD8+ Т-клеток представлены на рис. 5.
Обсуждение
Согласно многочисленным публикациям, посвященным анализу протоколов получения зрелых ДК для клинического применения, для созревания ДК характерен ряд морфологических, фенотипических и функциональных изменений, оно сопровождается потерей адгезивных молекулярных структур и реорганизацией цитоскелета, при этом показано увеличение подвижности ДК [15]. В организме в процессе активации ДК происходит их миграция в дренирующие лимфатические узлы. В это время клетки претерпевают транскрипционные изменения, в результате чего снижается их способность к эндоцитозу и повышается экспрессия маркера CD83, костимулирующих молекул (CD80, CD86, CD40) и белков, задействованных в презентации антигена (таких как HLA-DR). Кроме того, вместо хемокиновых рецепторов CCR1 и CCR5 наблюдается экспрессия рецепторов CCR7 [16].
Нами проведено сравнительное изучение особенностей ДК на разных стадиях созревания (7-й день культивирования – незрелые ДК, 9-й день – зрелые ДК). Полученные результаты свидетельствуют о связи дифференцировки моноцитов в незрелые ДК с утратой маркера CD14 (медиана 0,8 %, min-max – 0–7,1 %) и появлением поверхностной молекулы CD1a (медиана 48,1 %, min-max – 19,6–65,1 %). Для зрелых ДК характерны снижение экспрессии CD1a (медиана 14,1 %, min-max – 3,3– 74,8 %), высокий уровень экспрессии молекулы CD83 (медиана 91,1 %, min-max – 043,6–99,9 %), усиление экспрессии молекул костимуляции CD80 с 30,45 % (min-max – 12,6–75,0 %) до 70,6 % (minmax – 38,2–92,8 %) (р=0,015) и CD86 с 39,45 % (min-max – 2,8–84,5 %) до 79,4 % (min-max – 40,5– 96,8 %) (р=0,042). Высокий уровень экспрессии на мембране ДК поверхностных белков, обеспечивающих презентацию антигена (HLA-DR), в изучаемые сроки культивирования также является признаком созревания ДК. Анализ полученных результатов продемонстрировал снижение содержания в культуре незрелых CD1a+CD83-ДК с 13,4 до 0,35 % (p=0,004) и увеличение количества зрелых CD1a-CD83+ ДК с 24,4 до 64,75 % (p=0,001) к 9-му дню культивирования. Присутствие молекулы DC-SIGN (CD209) на поверхности ДК CD209+CD83+ способствует активному эндоцитозу, а также участию в процессах сосудистого роллинга и их миграции из кровотока в ткани. Учитывая, что от степени зрелости ДК напрямую зависят стабильность и продолжительность контактов между этими клетками и наивными Т-лимфоцитами, что обеспечивает формирование иммунных синапсов, нами разработан лабораторный метод оценки качества препарата ДК, основанный на определении иммунофенотипических характеристик незрелых и зрелых РТА+ вакцинных ДК методом проточной цитометрии.
В работе Y. Tai et al. [17] пoказанo, что клoнальная экспансия лимфоцитoв после их стимуляции зрелыми ДК является oсновным параметром, который используется при прoведении контрoля качества и при oценке эффективнoсти противooпухолевых клеточных вакцин. В нашем исследовании была проведена oценка специфичности пролиферации Т-лимфoцитов в присутствии вакцинных ДК разной степени зрелости и показанo, что стимуляция только зрелыми ДК способствует формированию клона антиген-специфических Т-клеток в отличие от индукции незрелыми ДК или РТА+ oпухолевым лизатом. В других работах также было показано, что взаимодействие с незрелыми ДК приводит к анергии Т-лимфоцитов [18], препятствует активации ЦТЛ и способствует прогрессированию опухоли [19]. Для проведения контроля качества и мониторинга эффективности противоопухолевых клеточных вакцин нами адаптирована методика оценки функциональнoй активности Т-лимфоцитов при стимуляции зрелыми антиген-специфическими ДК.
В настоящее время для оценки противоопухолевого эффекта ДКВ in vitro разрабатываются многокомпонентные (гетеротипические) модели, включающие помимо опухолевых клеток эффекторные Т-лимфоциты [20,21]. В работе P.V. Pham et al. [22] зрелые ДК, нагруженные лизатом стволовых клеток РМЖ, инкубировали с Т-лимфоцитами, а затем добавляли эту клеточную суспензию к монослою опухолевых клеток. Для оценки цитотоксического эффекта праймированных лимфоцитов использовали анализатор xCELLigence, измеряя снижение пролиферации клеток РМЖ в режиме реального времени.
В разработанной нами лабораторной модели с использованием аналитической системы xCELLigence® для изучения специфической цитотоксической активности эффекторных Т-лимфоцитов был проведен сравнительный ана- лиз секреции восьми цитокинов и растворимых медиаторов супернатанта клеточных культур. Было установлено, что увеличилось содержание цитокинов, которые опосредуют и поддерживают разрушение клеток-мишеней IL-2 с 35,1 до 312,4 пг/мл (p<0,001); TNF-α – с 246,4 до 2525,0 пг/мл (p<0,001) через 48 ч после добавления клеток-эффекторов в лабораторной модели № 1 не менее чем в 10 раз. Кроме того, данная модель характеризуется увеличением продукции GM-CSF, IFN-γ, IL-8, IL-10, но уровня статистической значимости не достигнуто. Особенностью секреции цитокинов в лабораторной модели № 2 является низкое содержание IL-6 как до внесения клеток-эффекторов, так и через 48 ч инкубации (5395,0 и 3505,0 пг/мл соответственно, р=0,200), по сравнению с моделью № 1 (p=0,027), где отмечены более высокие концентрация IL-6 до и после внесения активированных ЦТЛ (10560,0 и 8561,0 пг/мл, р=0,038), отсутствие роста TNF-α при добавлении эффекторных Т-лимфоцитов и изначально высокий уровень IL-10.
В литературе также имеются противоречивые данные о том, что IL-6 в опухолевом микроокружении способствует как дифференцировке иммуносупрессивных опухоль-ассоциированных макрофагов, миелоидных супрессорных клеток [23, 24], толерогенных ДК [25], так и дифференцировке, активации и пролиферации Т-лимфоцитов [24, 26]. IL-10 описан как мощный иммуносупрессивный фактор, способствующий привлечению в опухоль Treg и подавлению NK-клеток [27, 28], а также дифференцировке макрофагов в М2 [29, 30] и приобретению ДК толерогенного фенотипа [25, 31]. Таким образом, определение поляризации иммунного микроокружения в направлении противоопухолевого фенотипа тесно связано с определенным профилем секреции цитокинов.
Присутствие эффекторных клеток в опухолевом очаге, их локализация и отсутствие иммуносупрессивных клеток связаны с реализацией противоопухолевого иммунного ответа [32]. Антиген-специфические CD8+ Т-лимфоциты являются важнейшим медиатором клеточного иммунного ответа благодаря их способности разрушать опухолевые клетки, поэтому цитотоксический потенциал клеток-эффекторов является важным параметром для обеспечения эффективности ДКВ и требует разработки методов оценки качества клеточного препарата. Проведенный нами сравнительный анализ субпопуляционного состава антиген-специфических Т-лимфоцитов, пролиферирующих in vitro в присутствии вакцинных ДК, подтверждает существенный сдвиг в лабораторной модели №1 в сторону сокращения количества наивных ЦТЛ CD3+CD8+CD45RA+CD45RO-CD62L+CCR7+CD27+ менее 29 % (p=0,044) и увеличение процентного содержания цитотоксических эффекторных Т-лимфоцитов CD3+CD8+CD45RA+CD45RO-CD62L-CCR7-
CD27- (TEMRA) более 45,8 % (p=0,026) относительно аналогичных показателей в модели № 2, что говорит о наличии выраженного активационного процесса в пуле ЦТЛ. Эффекторные CD8+ Т-лимфоциты реализуют свою функцию с помощью цитолитических белков, содержащихся в литических гранулах [33]. Большую часть этих белков составляют гранзимы – сериновые протеазы, способные активировать каспазы и индуцировать апоптоз, и перфорины – белки, формирующие каналы в плазматической мембране и способствующие проникновению гранзимов внутрь клетки-мишени [34]. Определение экспрессии гранзима B в ответ на взаимодействие с антигеном позволяет напрямую оценить количество антиген-специфичных ЦТЛ. В нашей работе цитотоксическую способность РТА+ специфических Т-лимфоцитов в отношении аутологичной опухоли в лабораторной модели № 1 демонстрирует высокое содержание CD3+CD8+GrB+ клеток (до 41,9 %) по сравнению с низким содержанием подобных клеток в лабораторной модели № 2 – 28,6 % (p=0,036). При этом существенных различий в количестве ЦТЛ центральной памяти CD3+CD8+CD45RA-CD45RO+CD62L+CCR7+CD27+ не обнаружено.
Таким образом, ДК выполняют функции профессиональных АПК: захватывают опухолевые антигены, дифференцируются в зрелые ДК, мигрируют в лимфатические узлы и презентируют антигены в контексте молекул главного комплекса гистосовместимости Т-лимфоцитам, одновременно экспрессируя костимулирующие молекулы и секретируя цитокины. В результате происходят индукция противоопухолевого антиген-специфического клеточного иммунного ответа и элиминация опухолевых клеток. Однако компоненты опухолевого микроокружения активно влияют на эти процессы, препятствуя созреванию и миграции ДК, способствуя формированию толерогенного фенотипа этих клеток. Изучение клеточных и молекулярных ком- понентов иммунного микроокружения опухоли in vitro необходимо для оценки параметров качества и специфической эффективности ДКВ.
Список литературы Разработка лабораторных моделей in vitro иммунного микроокружения опухоли для оценки параметров качества и специфической эффективности дендритно-клеточной вакцины
- Mel'nikova E.V., Merkulova O.V., Chaplenko A.A., Merkulov V.A. Dizain doklinicheskikh issledovanii biomeditsinskikh kletochnykh produktov: osobennosti, klyuchevye printsipy i trebovaniya. BIOpreparaty. Profilaktika, diagnostika, lechenie. 2017; 17(3): 133-44.
- Tikhomirova A.V., Goryachev D.V., Merkulov V.A., Lysikova I.V., Gubenko A.I., Zebrev A.I., Solov'eva A.P., Romodanovskii D.P., Mel'nikova D.V. Doklinicheskie i klinicheskie aspekty razrabotki biomeditsinskikh kletochnykh produktov. Vedomosti Nauchnogo tsentra ekspertizy sredstv meditsinskogo primeneniya. 2018; 8(1): 23-35. https://doi.org/10.30895/1991-29192018-8-1-23-35.
- Seyhan A.A. Lost in translation: the valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Comm. 2019; 4(1). https://doi.org/10.1186/s41231-019-0050-7.
- Avdonkina N.A., Danilova A.B., Misyurin V.A., Prosekina E.A., Girdyuk D.V., Emelyanova N.V., Nekhaeva T.L., Gafton G.I., Baldueva I.A. Biological features of tissue and bone sarcomas investigated using an in vitro model of clonal selection. Pathology Res Pract. 2021 Jan; 217: 153214. https://doi.org/10.1016/j.prp.2020.153214.
- de Wolf C., van de Bovenkamp M., Hoefnagel M. Regulatory perspective on in vitro potency assays for human dendritic cells used in anti-tumor immunotherapy. Cytotherapy. 2018; 20(11): 1289-308. https://doi.org/10.1016/j.jcyt.2018.07.006.
- Buchholz M., Knauer J., Lehmann J., Hass M., Gargosky S. Qualification of the COSTIM assay to determine potency and use in clinical trials. Cytotherapy. 2013; 15(4). https://doi.org/10.1016/j.jcyt.2013.01.197.
- Lamano J.B., Ampie L., Choy W., Kesavabhotla K., DiDomenico J.D., Oyon D.E., Parsa A.T., Bloch O. Immunomonitoring in glioma immunotherapy: current status and future perspectives. J Neurooncol. 2016; 127(1): 1-13. https://doi.org/10.1007/s11060-015-2018-4.
- Park Y.S., Shin C., Hwang H.S., Zenke M., Han D.W., Kang Y.S., Ko K., Do Y., Ko K. In vitro generation of functional dendritic cells differentiated from CD34 negative cells isolated from human umbilical cord blood. Cell Biol Int. 2015; 39(9): 1080-6. https://doi.org/10.1002/cbin.10490.
- Nekhaeva T.L. Optimizatsiya autologichnykh dendritno-kletochnykh vaktsin dlya lecheniya bol'nykh zlokachestvennymi novoobrazovaniyami. Sibirskii onkologicheskii zhurnal. 2013; 3: 52-6.
- Baldueva I.A., Danilova A.B., Nekhaeva T.L., Avdonkina N.A., Emel'yanova N.V., Belyaev A.M. Kletochnyi produkt dlya nagruzki i aktivatsii dendritnykh kletok cheloveka. Patent RF № 2714208. Opubl. 13.02.2020.
- Freshney R.I. Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications. John Wiley and Sons, 2015. 736 p.
- Chiu C.H., Lei K.F., Yeh W.L., Chen P., Chan Y.S., Hsu K.Y., Chen A.C. Comparison between xCELLigence biosensor technology and conventional cell culture system for real-time monitoring human tenocytes proliferation and drugs cytotoxicity screening. J Orthop Surg Res. 2017; 12(1): 149. https://doi.org/10.1186/s13018-017-0652-6.
- Lewis D.M., Park K.M., Tang V., Xu Y., Pak K., Eisinger-Mathason T.S., Simon M.C., Gerecht S. Intratumoral oxygen gradients mediate sarcoma cell invasion. Proc Natl Acad Sci USA. 2016; 113(33): 9292-7. https://doi.org/10.1073/pnas.1605317113.
- Nekhaeva T.L., Emel'yanova N.V., Osipchuk A.V., Blokhina M.L., Semenov A.L., Skachkova O.V., Danilova A.B., Novik A.V., Avdonkina N.A., Prosekina E.A., Pipia N.P., Zozulya A.Yu., Vodolazhskii D.I., Baldueva I.A. Adaptatsiya metoda otsenki T-kletochnoi proliferatsii pri izuchenii spetsificheskogo protivoopukholevogo immunnogo otveta na dendritno-kletochnuyu vaktsinu na osnove rakovo-testikulyarnykh antigenov in vitro. Materialy VI Peterburgskogo mezhdunarodnogo onkologicheskogo foruma «Belye nochi 2020». SPb., Voprosy onkologii. S. 143.
- Nekhaeva T.L., Karpov A.E., Pipia N.P. Poisk immunoterapevticheskikh mishenei v onkologii pri formirovanii immunologicheskogo sinapsa. Voprosy onkologii. 2021; 67(3): 344-9. https://doi.org/10.37469/0507-3758-2021-673-344-349.
- Cunningham S., Hackstein H. Recent Advances in Good Manufacturing Practice-Grade Generation of Dendritic Cells. Transfus Med Hemother. 2020; 47(6): 454-63. https://doi.org/10.1159/000512451.
- Tai Y., Wang Q., Korner H., Zhang L., Wei W. Molecular Mechanisms of T Cells Activation by Dendritic Cells in Autoimmune Diseases. Front Pharmacol. 2018; 9: 642. https://doi.org/10.3389/fphar.2018.00642.
- Binnewies M., Mujal A.M., Pollack J.L., Combes A.J., Hardison E.A., Barry K.C., Tsui J., Ruhland M.K., Kersten K., Abushawish M.A., Spasic M., Giurintano J.P., Chan V., Daud A.I., Ha P., Ye C.J., Roberts E.W., Krummel M.F. Unleashing Type-2 Dendritic Cells to Drive Protective Antitumor CD4+ T Cell Immunity. Cell. 2019; 177(3): 556-71. https://doi.org/10.1016/j.cell.2019.02.005.
- Passeri L., Marta F., Bassi V., Gregori S. Tolerogenic Dendritic Cell-Based Approaches in Autoimmunity. Int J Mol Sci. 2021; 22(16): 8415. https://doi.org/10.3390/ijms22168415.
- Danilova A.B., Nekhaeva T.L., Efremova N.A., Novik A.V., Zozulya A.Yu., Gafton G.I., Baldueva I.A. Otsenka effektivnosti ispol'zovaniya tumoroidov dlya individual'nogo podbora lekarstvennoi terapii solidnykh opukholei. Voprosy onkologii. 2021; 67(6): 815-28. https://doi.org/10.37469/0507-3758-2021-67-6-815-828.
- Danilova A.B., Efremova N.A., Murashkina A.A., NekhaevaT.L., Maydin M.A., Artemyeva E.S., Artemyeva A.S., Baldueva I.A. Evolution of the Solid Human Tumor Cells Properties in Various Experimental Systems in Vitro. J Hematol Oncol Res. 2022; 4(2): 9-29. https://doi.org/10.14302/issn.2372-6601.jhor-22-4061.
- Pham P.V., Le H.T., Vu B.T., Pham V.Q., Le P.M., Phan N.L., Trinh N.V., Nguyen H.T., Nguyen S.T., Nguyen T.L., Phan N.K. Targeting breast cancer stem cells by dendritic cell vaccination in humanized mice with breast tumor: preliminary results. Onco Targets Ther. 2016; 9: 4441-51. https://doi.org/10.2147/OTT.S105239.
- Ya G., Ren W., Qin R., He J., Zhao S. Role of myeloid-derived suppressor cells in the formation of pre-metastatic niche. Front Oncol. 2022; 12. https://doi.org/10.3389/fonc.2022.975261.
- Riegel K., Yurugi H., Schlöder J., Jonuleit H., Kaulich M., Kirschner F., Arnold-Schild D., Tenzer S., Schild H., Rajalingam K. ERK5 modulates IL-6 secretion and contributes to tumor-induced immune suppression. Cell Death Dis. 2021; 12(11): 969. https://doi.org/10.1038/s41419-021-04257-8.
- Binnewies M., Roberts E.W., Kersten K., Chan V., Fearon D.F., Merad M., Coussens L.M., Gabrilovich D.I., Ostrand-Rosenberg S., Hedrick C.C., Vonderheide R.H., Pittet M.J., Jain R.K., Zou W., Howcroft T.K., Woodhouse E.C., Weinberg R.A., Krummel M.F. Understanding the tumor immune microenvironment (TIME) for effective therapy. Nat Med. 2018; 24(5): 541-50. https://doi.org/10.1038/s41591-018-0014-x.
- Lippitz B.E., Harris R.A. Cytokine patterns in cancer patients: A review of the correlation between interleukin 6 and prognosis. Oncoimmunology. 2016; 5(5). https://doi.org/10.1080/2162402X.2015.1093722.
- Schupp J., Krebs F.K., Zimmer N., Trzeciak E., Schuppan D., Tuettenberg A. Targeting myeloid cells in the tumor sustaining microenvironment. Cell Immunol. 2019; 343. https://doi.org/10.1016/j.cellimm.2017.10.013.
- Stephen B., Hajjar J. Overview of Basic Immunology for Clinical Investigators. Adv Exp Med Biol. 2017; 995: 1-31. https://doi.org/10.1007/978-3319-53156-4_1.
- Belli C., Trapani D., Viale G., D’Amico P., Duso B.A., Della Vigna P., Orsi F., Curigliano G. Targeting the microenvironment in solid tumors. Cancer Treat Rev. 2018; 65: 22-32. https://doi.org/10.1016/j.ctrv.2018.02.004.
- Stakheyeva M., Patysheva M., Kaigorodova E., Zavyalova M., Tarabanovskaya N., Choynzonov E., Cherdyntseva N. Tumor Properties Mediate the Relationship between Peripheral Blood Monocytes and Tumor-Associated Macrophages in Breast Cancer. Cancer Invest. 2022; 40(5): 442-56. https://doi.org/10.1080/07357907.2021.2016803.
- Danilova A.B., Novik A.V., Nekhaeva T.L., Baldueva I.A. Rol' faktorov immunosupressii v prognoze effektivnosti kletochnoi immunoterapii u patsientov s solidnymi opukholyami. Effektivnaya farmakoterapiya. 2022; 18(17): 8-17. https://doi.org/10.33978/2307-3586-2022-18-17-8-17.
- Fridman W.H., Zitvogel L., Sautès-Fridman C., Kroemer G. The immune contexture in cancer prognosis and treatment. Nat Rev Clin Oncol. 2017; 14(12): 717-34. https://doi.org/10.1038/nrclinonc.2017.101.
- Cassioli C., Baldari C.T. The Expanding Arsenal of Cytotoxic T Cells. Front Immunol. 2022; 13. https://doi.org/10.3389/fimmu.2022.883010.
- Voskoboinik I., Whisstock J.C., Trapani J.A. Perforin and granzymes: function, dysfunction and human pathology. Nat Rev Immunol. 2015; 15(6): 388-400. https://doi.org/10.1038/nri3839.


