Разработка микрочиповых устройств для проведения ПЦР в геле
Автор: Курочкин В.Е., Евстрапов Анатолий Александрович, Буляница А.Л., Рудницкая Г.Е., Лукашенко Т.А., Тупик А.Н., Цымбалов А.И.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Другие приборные разработки
Статья в выпуске: 4 т.20, 2010 года.
Бесплатный доступ
Одним из современных и востребованных методов молекулярной диагностики является проведение полимеразной цепной реакции (ПЦР) в геле, имеющее ряд преимуществ по сравнению с традиционной реализацией ПЦР в жидкости. Для его осуществления разработаны и созданы макетные образцы микрочиповых устройств (картриджей-микрочипов) с полиакриламидным гелем в реакционной камере, обладающие требуемыми физико-химическими (в т. ч. оптическими) характеристиками. В статье обсуждаются особенности изготовления таких устройств.
Полимеразная цепная реакция, микрочиповое устройство, картридж-микрочип, фотолитография, кислотное травление
Короткий адрес: https://sciup.org/14264678
IDR: 14264678 | УДК: 57.088:
Текст научной статьи Разработка микрочиповых устройств для проведения ПЦР в геле
Одним из современных методов молекулярной биологии является метод полимеразной цепной реакции (ПЦР). На сегодняшний день ПЦР-анализ — самый быстрый, точный и широко распространенный метод молекулярной диагностики в лабораторной практике [1, 2]. Основы реализации полимеразной цепной реакции были разработаны американским ученым Кэри Мюллисом в 1983 г. Первые сообщения по практическому ee применению появились в 1985 г. В 1993 г. Мюл-лис за открытие метода ПЦР был удостоен Нобелевской премии. С тех пор число публикаций, посвященных ПЦР как методу исследования, занимает одно из первых мест наряду с работами, в которых применяются автоматическое определение нуклеотидной последовательности (секвенирование ДНК) или гибридизационные технологии. Появились новые разновидности амплификацион-ных технологий, например лигазная цепная реакция, "гнездовая" ПЦР (Nested PCR), мультиплексная ПЦР и т. д. [3]. Для жидкостной ПЦР выпускаются коммерческие приборы и системы: ампли-фикаторы (термоциклеры), приборы для проведения ПЦР и регистрации результатов реакции в реальном времени (ПЦР-РВ). Обычно ПЦР в таких приборах осуществляется в полипропиленовых пробирках (объем 0.2–1.5 мл) или планшетах. Кроме увеличения числа копий ДНК (этот процесс называется амплификацией) ПЦР позволяет производить множество других манипуляций с генетическим материалом (введение мутаций, сращивание фрагментов ДНК и др.) и поэтому широко используется в биологической и медицинской практике, для научных исследований и биотехно- логических применений. В частности, применение ПЦР эффективно при диагностике заболеваний (наследственных, инфекционных), для определения устойчивости к химиопрепаратам, для установления отцовства, для клонирования генов, введения мутаций, выделения новых генов.
С развитием технологий микроэлектроники появились работы по постановке ПЦР на специально созданных миниатюрных устройствах — микрочипах. В микрочипах формируются реакционные камеры, характеризующиеся высоким соотношением площади поверхности к объему, что делает возможным осуществлять быстрый и эффективный теплообмен. При этом существенное влияние на ход ПЦР оказывают свойства поверхности реактора. Первыми работами в области создания систем для ПЦР на микрочиповой платформе являются работы Криски (L.J. Kricka, Department of Pathology and Laboratory Medicine, University of Pennsylvania) [4, 5], а к пионерским работам по коммерческому использованию мик-рочиповых технологий для амплификации нуклеиновых кислот следует отнести работы Нортрапа (M.A. Northrup) с соавторами, в которых была показана возможность скоростной постановки ПЦР на микрочипе [6, 7]. Нортрап стал основателем компании Microfluidic Systems Inc. (MFSI), президентом которой он является в настоящее время. Компания обладает патентами и специализируется на производстве автоматизированных систем анализа биологических проб, в том числе для обнаружения и идентификации различных патогенов в воздушной среде. В основе разработок лежат автоматизированные микрофлюидные технологии и методы ПЦР.
В 90-х годах в Институте белка РАН был разработан способ осуществления ПЦР не в жидкости, а в тонком слое полиакриламидного геля [8, 9]. Матрица геля затрудняет диффузию молекул ДНК, так что продукты амплификации остаются локализованными вблизи соответствующей ДНК-мишени. В результате реакции образуются колонии ДНК, каждая из которых выросла из единственной исходной молекулы. Матрица геля практически не влияет на диффузию более мелких молекул (нуклеозидтрифосфатов, олигонуклеотидных праймеров) и компонентов буфера, поэтому проведение реакции в геле не приводит к снижению скорости размножения нуклеиновых кислот. Размер колонии главным образом определяется размером ДНК-мишени и плотностью геля. Число молекул в колонии определяется эффективностью применяемой системы и числом циклов ПЦР. Варьируя эти параметры, можно создавать условия для выращивания колоний определенного размера. Регистрация колоний может осуществляться специальными детектирующими системами, например флуоресцентными сканерами. Использование этого метода позволяет обнаруживать, подсчитывать и идентифицировать одиночные молекулы ДНК. Так как размножаемые молекулы пространственно разделены в полимерной матрице, значительно снижается неспецифический синтез, вызванный ошибочной гибридизацией.
Известен другой вариант проведения ПЦР в геле, запатентованный Дж. Черчем (Church) [10], в котором один из праймеров пришит к полиакриламидной матрице. Он известен под названием метод " полоний" (полимеразных колоний).
В упомянутых методах гель для ПЦР отливают либо в лунках специально подготовленных стекол (диаметр лунки 14 мм, глубина 0.4 мм) [11], либо в специальных рамочных контейнерах размером 15×15 мм (фирма MJ Research), закрепленных на стеклах для оптической микроскопии [10]. Так, в работе [12] проба, объемом 19 мкл, наносилась на специальный слайд (Erie Scientific, Portsmouth). При этом использовались камеры Grace Bio-Labs (США) [13], а герметизация устройства перед ПЦР осуществлялась минеральным маслом. Указанные решения сейчас применяются только в исследовательских лабораториях.
Проблемами, затрудняющими развитие методов ПЦР в геле, являются отсутствие соответствующего приборного обеспечения и материалов, а именно: специальных детектирующих систем, вспомогательных устройств и микрочипов. В настоящее время исследователи применяют либо дорогостоящие системы детектирования, такие как конфокальные сканирующие микроскопы, либо специальные сканеры для биочипов. При этом процедуры термоциклирования и детектирования разнесены во времени и выполняются на разных приборах. С другой стороны, наличие и доступность различных технологий, в том числе методов формирования микро- и наноструктур, позволяют изготовить практически любое устройство, ориентированное на решение задач создания и развития методик ПЦР-анализа в геле.
МИКРОЧИПОВОЕ УСТРОЙСТВО ДЛЯ ПЦР В ГЕЛЕ
Наиболее простой конструкцией для реализации ПЦР в геле является планарная конструкция, состоящая из подложки, в которой сформированы реакционные камеры и каналы для ввода пробы, герметично соединенной с защитной пластиной. В такой конструкции должны быть предусмотрены порты для ввода пробы, которые после заполнения устройства должны быть изолированы от внешней среды. Материалами для этого устройства могут быть кремний, стекло и полимеры. В кремниевых и стеклянных материалах реакционные камеры и каналы могут быть изготовлены методами фотолитографии и травления (кислотного или ионнореактивного). Метод вытравливания микроструктур в кислоте является наиболее развитым и доступным для серийного применения, но имеет определенные ограничения на глубину получаемых структур (не более 200–250 мкм). Вытравливание глубоких каналов и реакторов занимает длительное время и приводит к неоднородности получаемых структур. В полимерных материалах требуемые микроструктуры могут быть сформированы методами прессования, что подразумевает использование точных и дорогостоящих матриц или мас-тер-форм. Положительным фактором является то, что стоимость полимерных материалов на порядок ниже стоимости стеклянных и кремниевых материалов, а поэтому полимерные изделия могут быть изделиями однократного применения. Но, с другой стороны, возникает проблема утилизации таких изделий после проведения анализов. Устройства из стеклянных и кремниевых материалов могут быть изготовлены как устройства многократного применения, но в этом случае должна быть предусмотрена возможность их разборки и последующей регенерации. Последнее подразумевает применение полимерных композиций, скотча или специальных адгезивов при герметизации микроканалов и реакторов.
Отдельной задачей является модификация поверхности реакционных камер с целью пришивки геля. Способы модификации зависят от применяемых материалов, а также от свойств используемого геля.
При создании экспериментальных образцов микрочиповых устройств для ПЦР в геле был выбран вариант устройства, состоящего из трех ка- мер — для проведения реакций в исследуемом образце, а также положительного и отрицательного контроля. Формат (размеры) устройства (25 × 75 мм, толщина — до 1.9 мм) был выбран исходя из возможности регистрации результатов проведенных реакций на сканерах для биочипов. Такая привязка размеров к специальным системам детектирования не позволяет создать достаточно удобного для эксплуатации устройства. В качестве материала выбрано стекло марки К8 как наиболее дешевое и доступное для экспериментальных работ. Высокая теплопроводность стекла и его относительно малая толщина (1 мм) позволяют реализовать быстрый нагрев и охлаждение, а оптические характеристики (хорошее светопропускание и малая собственная флуоресценция (рис. 1)) — использовать для флуоресцентного детектирования. В работе приводится и обсуждается конструкция микрочипов, имеющая достаточно простую топологию.
Реакционная камера и каналы ввода пробы были
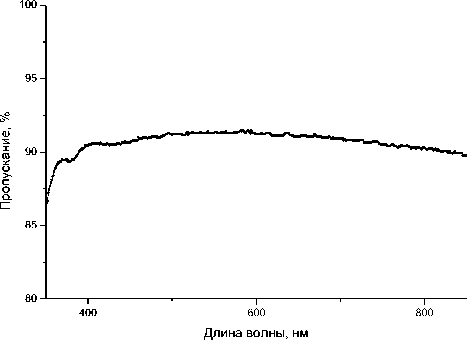
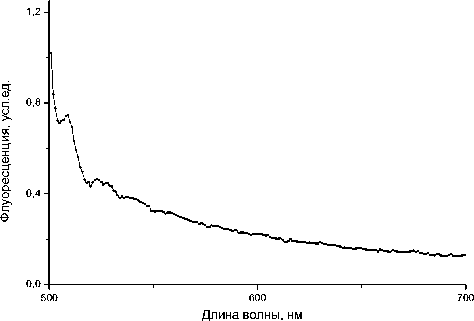
Рис. 1. Спектры светопропускания (а) и флуоресценции (б) (при возбуждении на длине волны 488 нм) стеклянной пластины с реакционными камерами сформированы методом фотолитографии и кислотного травления. Для реализации фотолитографических процессов необходимы фотолитографические маски или фотошаблоны, которые на этапе экспонирования задают необходимую конфигурацию (рисунок) покрытия. Фотолитографические маски изготавливаются на стекле с высокой оптической однородностью и различаются покрытием: эмульсионные либо с покрытием из хрома или из окиси железа. Последние две разновидности более долговечны и используются в условиях серийного производства, эмульсионные фотошаблоны предназначены для выполнения разовых работ. На этапе разработки конструкции микрочипа создается топология чипа и разрабатывается фотошаблон, который присоединяется к заготовке (стеклянной пластине с нанесенным слоем хрома толщиной 100–200 нм и слоем фоторезиста). Затем осуществляется экспонирование под УФ-излучением. Далее следует стадия проявления, в результате которой формируется заданный фотошаблоном рисунок (топология) микрочипа. После промывки и сушки фоторезиста следует процесс травления маски, затем — снова промывка и химическое удаление фоторезиста. Полученная заготовка помещается в подогреваемую ванну, где осуществляется кислотное травление стекла. Поддержание выбранной температуры позволяет контролировать процесс травления и обеспечивает получение заданных размеров микроструктур. После травления снова следует промывка и подготовка поверхности для герметизации — связывания с защитной пластиной. Формирование реакционной камеры и подводных каналов в стеклянных подложках осуществлялось на ЗАО "Светлана-полупроводники" (Санкт-Петербург). В результате работ были получены заготовки для микрочипа, фотография которых представлена на рис. 2, а.
После отливки полиакриламидного геля в реакционных камерах осуществлялась герметизация — склеивание с защитной пластиной, в которой выполнены отверстия для ввода пробы. Ряд способов герметизации: с помощью скотча фирмы 3D (Великобритания), с использованием фотоотверждаемых композиций Rite Lock (Великобритания) и полиди-метилсилоксана (ПДМС) Sylgard 184 (Corning, США) — были проверены на ингибирование ПЦР. Все эти способы и материалы являются вполне приемлемыми и дают хорошие результаты, но нами был выбран способ герметизации ПДМС, т. к. он позволяет создавать конструкции, которые впоследствии могут быть расклеены и подвергнуты химической или другой обработке с целью повторного использования. Эта процедура была апробирована при проведении исследований. Толщина пленки ПДМС при герметизации составляет 10– 15 мкм. Фотография микрочипового устройства с гелем, подготовленного для анализа, приведена на рис. 2, б.
а
б

Рис. 2. Заготовки микрочипа (а) и смонтированный картридж-микрочип для ПЦР в геле (б). 1 — защитная пластина, 2 — пластина с реакционными камерами

Ввод пробы в реакционную камеру микрочипа осуществляется путем нанесения пробы в резервуар, образованный отверстием защитной пластины и каналом подложки. При этом капиллярные силы обеспечивают распространение пробы по каналу и выход ее в реакционную камеру, в которой находится гель. Гель при этом впитывает жидкость и набухает, занимая все пространство камеры. Ввод пробы, особенно если она обладает высокой вязкостью, может производиться с использованием специальных приспособлений, например с применением перистальтического насоса с низкой скоростью потока и специального устройства для микрочипов. При этом исключается возможность контаминации, т. к. используются сменные (или одноразовые) переходные уплотнители. Для предотвращения испарения пробы при термоциклировании в отверстия защитной пластины вносили минеральное масло.
Результаты предварительных испытаний свидетельствуют о возможности использования микро-чиповых устройств для выращивания молекулярных колоний в реакционной камере с полиакриламидным гелем.
Работа выполнена в рамках Программы фундаментальных исследований Президиума РАН "Фундаментальные науки — медицине", проект "Картриджи-микрочипы для метода молекулярных колоний".


