Разработка модели и морфологическая характеристика почек при неполной (варьирующей) окклюзии мочевыводящих путей
Автор: Соснин Д.А., Кропачев А.Ю., Скляренко Г.А., Новочадов В.В.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Морфология. Патология
Статья в выпуске: 1 (17), 2008 года.
Бесплатный доступ
Разработана и применена в эксперименте на 16 белых беспородных самках крыс модель неполной (варьирующей) окклюзии нижних мочевыводящих путей. Выявлены морфологические изменения почечной паренхимы у крыс с данной моделью.
Экспериментальная модель, окклюзия мочевыводящих путей, паренхима почек, морфологические изменения почек
Короткий адрес: https://sciup.org/142148696
IDR: 142148696 | УДК: 616.61:616.63
Текст научной статьи Разработка модели и морфологическая характеристика почек при неполной (варьирующей) окклюзии мочевыводящих путей
В настоящее время достаточно хорошо изучены критерии диагностики различной почечной патологии. Рост процента нефропатий, имеющих скрытое начало и торпидное течение, привел к возникновению ощутимых диагностических трудностей ввиду малой выраженности и моносимптом-ности первых проявлений патологического процесса [5, 7]. К одной из этих патологий относится обструктивная уропатия, вызванная окклюзией нижних мочевыводящих путей. Этот процесс чаще всего оказывается связан с простатитом или доброкачественной гиперплазией предстательной железы, которые уже на ранних стадиях проявляются нарушениями акта мочеиспускания. Если острый бактериальный простатит характеризуется острым началом, то хронический простатит может протекать со скудной клинической симптоматикой [2]. Как указывает Е. В. Ефимова [3], рост заболеваний предстательной железы - это не только медицинская, но и социальная проблема, поскольку эта группа заболеваний все больше охватывает мужскую часть населения как пожилого, так и репродуктивного, и трудоспособного возраста. Доброкачественная гиперплазия, по словам Н. А. Допаткина [4], является медленно прогрессирующим заболеванием, клиническая картина которого характеризуется волнообразным течением и может сопровождаться периодами симптоматического ухудшения, стабилизации или улучшения.
Именно сложность и недостаточная изученность данной патологии делает интересным вопрос ее моделирования. Среди используемых в настоящее время моделей обструктивной уропатии многие из них воспроизводят обструкцию мочеточников, то есть окклюзию верхних мочевыводящих путей [1, 3], либо направлены на моделирование полной обструкции путем перевязки уретры. Метод M. J. Drake et al. [6] уретральной обструкции на изолированном мочевом пузыре не может дать информации о повреждении почечной паренхимы при данном процессе. Интересным является вариант моделирования окклюзии, который предложили O. Yokoyama et al. [8]. Они вводили крысам внутрипузырно и внутриурет-рально простагландин E2, что приводило к гиперактивности детрузора. Данная методика имеет недостатком сложность при выполнении, а также ее невозможно применять в хроническом эксперименте. Поэтому, с нашей точки зрения, разработка легковыполнимой модели, воспроизводящей неполную варьирующую окклюзию нижних мочевыводящих систем, является актуальной.
ЦЕДЬ РАБОТЫ
Разработать модель неполной (варьирующей) окклюзии нижних мочевыводящих путей и выявление морфологических изменений в почечной паренхиме у крыс с данной моделью.
МЕТОДИКА ИССЛЕДОВАНИЯ
Для разработки модели было использовано 16 белых беспородных самок крыс. Суть предложенной нами модели заключалась в следующем. В мочевой пузырь крыс вводиться камень, который при малом наполнении мочевого пузыря перекрывает просвет уретры, препятствуя оттоку мочи, а при большом наполнении - открывает просвет уретры, обеспечивая опорожнение мочевого пузыря. Таким образом, воспроизводится неполная варьирующая окклюзия нижних мочевыводящих путей. В ходе наших исследований нами были испробованы несколько способов формирования камня в мочевом пузыре. Наиболее удобным оказался нижеописанный способ.
В качестве материала для камня был выбран альгинатный стоматологический материал Or- thoprint highly elastic фирмы Zhemack (Италия). Этот материал представляет собой порошок, образующий при смешивании его с водой вязкую массу, застывающую в течение 1,5 мин. Данная масса эластична и не способна повредить слизистую мочевого пузыря и уретры. Кроме того, по мере агглютинации сгусток сокращает свой объем, что также имеет положительное значение в нашем эксперименте.
Введение эластика производилось под относительно неглубоким хлороформенным наркозом, хотя возможно использование других наркотических средств. Сама операция длится 1,5-2 мин. До 1 мл застывающего стоматологического материала вводится ретроградно через уретру в мочевой пузырь стеклянным шприцом без иглы (рис. 1). При этом носик шприца вводят в уретру и рукой сжимают устье уретры, обеспечивая герметичность. Шприц следует располагать под углом 60° к горизонтальной оси в сагиттальной плоскости, а после введения - продолжать сжимание уретры в течение 30 с во избежание вытекания материала до его загустевания.
Было установлено, что в течение нескольких недель камень в кислой среде мочевого пузыря растворяется и выводиться, поэтому нами предложено проводить дополнительно введение материала на 13-, 18-, 23- и 28-е сутки эксперимента. Следует отметить, что при неправильном положении шприца и большой густоте вводимого материала нередко происходит прорыв эластика из уретры в подкожную клетчатку, что крайне нежелательно. Животные выводились на 14-, 21-, 30-е сутки эксперимента под хлороформенным наркозом. Микропрепараты почек, окрашенные гематоксилином и эозином и по ван Бизону, подвергались морфометрии при помощи программы "Image Tool Ut" (были обработаны результаты по 7 животным). Считался объем коллагеновых волокон в почечной паренхиме, объемы почечного и сосудистого клубочков, мочевое пространство. Данные подвергались статистической обработке в программах "Excel 2002" и "Statistica". Морфологические показатели между различными животными сравнивались с помощью критериев Стьюдента и Манна-Уитни.
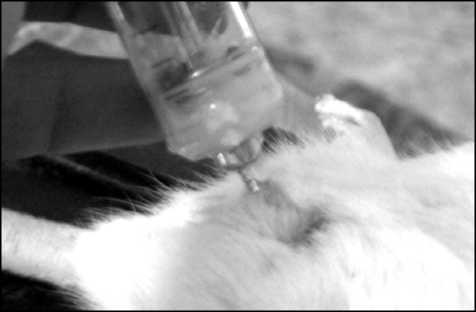
Рис. 1. Техника введения стоматологического материала в мочевой пузырь крыс через уретру
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
И ИХ ОБСУЖДЕНИЕ
На вскрытие в мочевом пузыре крыс в большинстве случаев обнаруживались от одного до нескольких камней разного диаметра (рис. 2). В почках на ранних сроках эксперимента наблюдалась лейкоцитарная инфильтрация почечной паренхимы. На более поздних сроках визуально отмечалось увеличение мочевого пространства клубочков. В паренхиме почек у выведенных на 30-е сутки окклюзии нижних мочевыводящих путей животных отмечалась атрофия эпителия почечных канальцев вплоть до деструкции последних (рис. 3). Также обнаруживались микроконкременты, обтурирующие просветы почечных канальцев.
В препаратах, окрашенных по ван Бизону, было отмечено увеличение площади и яркости участков соединительной ткани. Объемная доля соединительной ткани в почках у крыс опытной группы, по данным компьютерной морфометрии, превышала величину аналогичного показателя в контрольной группе в 2,86 раза (р <0,001). Также было отмечено увеличение мочевого пространства клубочков у части животных с окклюзией нижних мочевыводящих путей, особенно выраженное на 21-е сутки эксперимента.
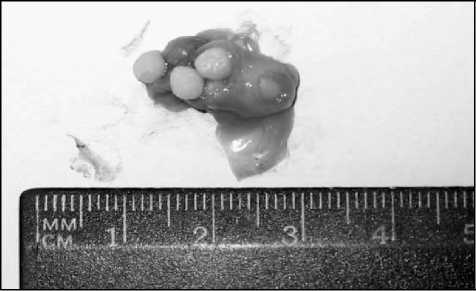
Рис. 2. Искусственные конкременты из застывшего эластика в мочевом пузыре крысы на вскрытие
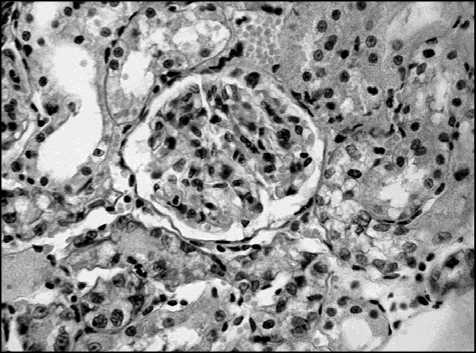
Рис. 3. Почка крысы, выведенной на 32-е сут. обструктивной уропатии. Отмечается лейкоцитарная инфильтрация, увеличение мочевого пространства клубочков, атрофия эпителия почечных канальцев и деструкция последних
I 1-2008
Обнаруженная нами лейкоцитарная инфильтрация свидетельствовала о наличии пиелонефрита, возникновение которого мы связывали с застоем мочи в чашечно-лоханочной системе. Тем самым, проведенные исследования указывали на возможный механизм повреждения почечной паренхимы при неполной варьирующей окклюзии нижних мочевыводящих путей. Увеличение мочевого пространства в почечных клубочках прямо свидетельствовало о застое мочи в нефроне, что также само по себе способно вызвать повреждения в паренхиме почек. Микроконкременты, облитерирующие просвет почечных канальцев, также являлись следствием застоя мочи в системе нефрона. Явления деструкции почечных канальцев свидетельствовали о потере функциональной активности отдельных нефронов на поздних сроках окклюзии нижних мочевыводящих путей, что при дальнейшем прогрессировании может привести к развитию хронической почечной недостаточности. Увеличение объема соединительной ткани свидетельствует о формировании неф-росклероза. Все вышеперечисленное дает нам право говорить о развитии необратимого повреждения почечной паренхимы при длительной неполной окклюзии нижних мочевыводящих путей.
ЗАКЛЮЧЕНИЕ
Разработанная нами методика является адекватной для воспроизведения обструктивной уропатии в эксперименте. Она сочетает в себе простоту технического выполнения и точность в моделировании неполной варьирующей окклюзии нижних мочевыводящих путей, которая имеет столь большое значение в клинической практике. Поэтому считаем целесообразным дальнейшее использование этой модели для изучения вопросов патогенеза и диагностики обструктивных уропатий. Следует также отметить, что морфологические изменения в почках на ранних стадиях эксперимента оказываются незначительными и вариабельными, а часть из них не может быть выявлена на светооптическом уровне. Поэтому является обоснованным дальнейшее использование электронной микроскопии для изучения морфологических изменений в почках при неполной окклюзии нижних мочевыводящих путей.


