Разработка оптического сенсорного элемента для микрофлюидных чипов на основе натриевоборосиликатного пористого стекла
Автор: Евстрапов А.А., Есикова Надежда Александровна, Рудницкая Г.Е., Антропова Т.В., Анфимова И.Н.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Исследования, приборы, методики
Статья в выпуске: 1 т.20, 2010 года.
Бесплатный доступ
Проведены работы по химической иммобилизации белка на поверхность натриевоборосиликатного пористого стекла. Измерены спектры светопропускания и флуоресценции пористых стекол на разных стадиях иммобилизации и после проведения иммунной реакции. Получены изображения поверхности стекол методом ближнепольной оптической микроскопии. Изучено влияние на иммобилизацию белка режима сушки между стадиями активации поверхности и влияние силанизации с применением ацетона и толуола. Показано, что проведение иммунной реакции приводит к изменению оптических характеристик стекла. Продемонстрирована принципиальная возможность создания сенсорного элемента на основе натриевоборосиликатного пористого стекла.
Пористое стекло, сенсорный элемент, сканирующая ближнепольная оптическая микроскопия, оптическая спектроскопия, спектрофлуориметрия
Короткий адрес: https://sciup.org/14264641
IDR: 14264641 | УДК: 543.9
Текст научной статьи Разработка оптического сенсорного элемента для микрофлюидных чипов на основе натриевоборосиликатного пористого стекла
Одним из перспективных направлений развития аналитических систем является создание компактных приборов и устройств на основе микро-флюидных чипов (МФЧ). Преимуществами таких систем по сравнению с их макроаналогами являются: малый расход реагентов и аналита, высокое быстродействие, возможность реализации одновременного анализа большого количества проб, возможность полной автоматизации всех стадий анализа, компактность, низкое энергопотребление и т. д. МФЧ позволяют проводить разнообразные манипуляции с нано-/пиколитровыми объемами пробы и реагентов, включая дозирование, перемешивание, проведение химических реакций и т. д. [1, 2]. Микроаналитические системы с новыми свойствами и высокими техническими характеристиками могут быть получены путем интегрирования в МФЧ новых функциональных элементов (например, сенсорных элементов, микронасосов, реакторов и др.).
Наиболее эффективным и высокоселективным методом обнаружения аналита в биологической пробе является постановка иммунных реакций. При создании иммуносенсоров чувствительный слой, как правило, фиксируют тем или иным способом на подложке. В МФЧ материалом для подложки являются стекло, кварц, полимеры и т. п. Авторами [3] чувствительный слой наносился на стенки основного канала МФЧ с топологией "двойной крест". Локальность иммобилизации чувствительного вещества достигалась путем ввода реагентов для каждой стадии через разные боковые каналы. Таким образом, всем стадиям иммобилизации подвергался только центральный канал. Однако наблюдалось небольшое размытие зоны иммобилизации за счет диффузии. Кроме того, необходимость предусматривать боковые каналы одноразового использования для каждой стадии обработки приводит к усложнению топологии МФЧ и увеличению его размеров. В [4] представлен сенсор на основе пористого кремния (средний диаметр пор 50 нм, глубина пор — 100 и 1000 нм) для обнаружения вирусов в окружающей среде. Диапазон детектирования 2·107–2·1010 вирусов MS2 на мл. Недостатком вышеприведенных сенсоров является то, что для их повторного использования необходимо проводить обратную реакцию. Одним из методов увеличения длительности работы сенсора является постановка и детектирование конкурентной иммунной реакции. Для этого необходима иммобилизация на подложку более сложного чувствительного слоя. Например, в [5] на чувствительный слой иммобилизуется иммунный комплекс, постепенно замещаемый с подложки в результате конкурентной реакции. Наличие детектируемого вещества в аналите определяется по количеству иммунного комплекса в растворе после проведения реакции. Чувствительность такого сенсора — до 10 пМ.
Очевидно, что применение пористых наноструктур, имеющих чрезвычайно развитую поверхность, позволяет увеличить чувствительность определения аналита, но при этом возникает ряд проблем, связанных с созданием чувствительного слоя с воспроизводимыми характеристиками и интеграцией наноструктур в МФЧ. Пористые микро-и наноструктуры могут быть сформированы в различных материалах: кремнии, стекле, полимерах. В России достаточно хорошо развиты и отработаны технологии получения пористого стекла (ПС) со сквозными порами нанометровых размеров (от 2 до 500 нм) и заданными структурными характеристиками [6, 7]. Высокая прозрачность ПС [8, 9] позволяет использовать оптические методы регистрации характеристик стекла при прохождении пробы через поры. Кроме того, ПС может быть использовано в качестве электроосмотического насоса для управления потоками жидкости в МФЧ [10], что позволяет упростить топологию микрочипа.
Целью работы являлось исследование возможности получения сенсорного элемента для МФЧ на основе ПС. Для нанесения на ПС сенсорного слоя необходимо выбрать наиболее подходящие способы активации поверхности стекла, последующей модификации и иммобилизации чувствительного вещества. Все эти стадии определенным образом влияют на оптические и структурные ха-
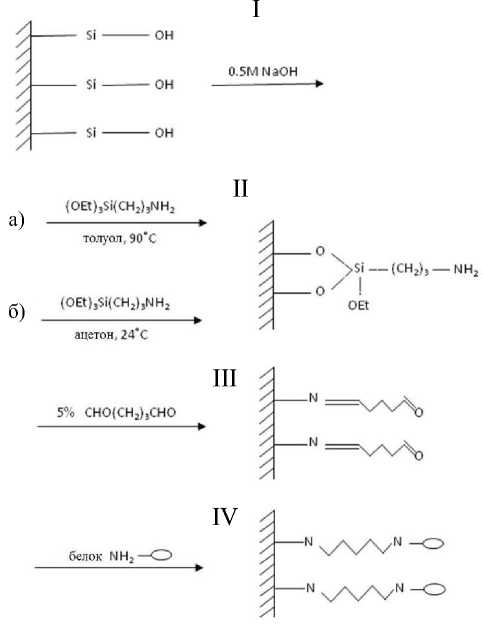
Рис. 1. Стадии иммобилизации белка (I–IV)
рактеристики образцов. Поэтому актуальным является измерение характеристик пористых стекол на разных этапах иммобилизации белка на ПС и после проведения иммунной реакции методами оптической спектрометрии и высокоразрешающей микроскопии.
ОБОРУДОВАНИЕ, МАТЕРИАЛЫ И МЕТОДЫ
Для изучения особенностей иммобилизации биологических веществ в ПС выбраны образцы, полученные из двухфазного стекла 8В (Институт химии силикатов РАН). Они обладают развитой поверхностью и высокой оптической прозрачностью в видимом и ближнем инфракрасном диапазонах (пропускание 80–93 % в диапазоне длин волн 340–850 нм для образцов толщиной 0.2 мм), позволяющей использовать оптическую спектроскопию для их изучения. Средний радиус пор 85.5 нм и удельная поверхность пор 88.8 м2/г являются подходящими для создания из этих стекол оптического сенсорного элемента, обладающего хорошей проницаемостью для жидких проб. Изучались образцы размером 8 × 8 × 0.2 мм. Толщина образцов выбрана с учетом возможности последующего использования их в качестве электроосмотического насоса для управления потоками (электроосмотический поток обратно пропорционален квадрату толщины образца).
Для создания сенсорного элемента применялось ковалентное связывание, поскольку этот вид иммобилизации биологического вещества позволяет наиболее надежно закрепить его на поверхности подложки. Недостатком этого метода является затруднение диффузии субстрата, что приводит к снижению скорости ферментной реакции и, следовательно, к увеличению времени отклика сенсора. Этот недостаток легко устраним, если организовать движение пробы через ПС с иммобилизованным чувствительным слоем за счет электроосмотического потока, вызванного внешним электрическим полем. Такой способ дает возможность значительно увеличить быстродействие сенсора.
Для получения чувствительного слоя на поверхности ПС необходимо активировать гидроксильные группы на поверхности образца, провести силанизацию, обработать поверхность бифункциональным реагентом (глутаровый диальдегид) и иммобилизовать на образец чувствительное вещество (например, белки, антигены, антитела).
На разных стадиях иммобилизации и после проведения иммунной реакции образцы исследовались методами спектрометрии, флуоресцентной спектроскопии и сканирующей ближнепольной оптической микроскопии (СБОМ).
Измерения спектров пропускания проведены на спектрофотометре Hitachi U-3410 при ширине ще-
Т (%
Т (%
ли 3 нм в спектральном диапазоне 350–850 нм. Спектры флуоресценции измерены на флуориметре Hitachi F-4010 (Hitachi, Japan) при ширине щели 5 нм, скорости сканирования 120 нм/мин и длине волны возбуждения 488 нм. Изображения поверхности образцов получены на зондовой нанолаборатории NTEGRA Solaris (ООО НТ МДТ, Россия) в режимах поперечно-силовой моды и отражения на длине волны 488 нм.
дой до нейтральной реакции, а затем сушили 3 ч при 100 ºC. Силанизации проводились двумя способами: образцы помещали a) в 10 % раствор аминопропилтриэтоксисилана (АПТС) в толуоле на 2 ч при 90 ºС, б) в 4 % раствор АПТС в ацетоне на 2 ч при 24 ºC. Далее образцы обрабатывали 5 % раствором глутарового диальдегида. Иммобилизацию белка производили путем формирования основания Шиффа между поверхностными амино-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Модификация поверхности ПС и принцип работы сенсора
Из всех методов иммобилизации биоматериала наиболее гибким и распространенным, вероятно, является метод ковалентного связывания. В каждом конкретном случае он требует тщательного выбора химических реагентов для модификации поверхности, для многих систем он обеспечивает размещение монослоя биоматериала на подложке.
Возможность ковалентного закрепления органических соединений на поверхности стекла преимущественно обусловлена наличием силанольных групп Si–OH. Необходимо помнить, что поверхность кремнеземов обычно покрыта полимо-лекулярным слоем физически адсорбированной воды, которая почти всегда препятствует модифицированию. Поэтому стандартная процедура, предшествующая модифицированию, состоит в гидроксилировании кремнезема и последующем удалении физически сорбированной воды.
Ковалентное связывание белков обычно осуществляется через функциональные группы аминокислот, не влияющих на ферментативную активность. Для пептидов и белков чаще всего поступают следующим образом. Поверхность аминируют, а затем с помощью сшивающего агента прививают белок. Для аминирования стекла нашел широкое распространение модификатор, называемый гамма-аминопропилтриэтоксисиланом H 2 N–(CH 2 ) 3 –Si(OC 2 H 5 ) 3 (АПТС). Глутаровый альдегид — бифункциональный сшивающий реагент, который при реакции с NH 2 -группами образует шиффовы основания. Таким образом подготовленную аминированную поверхность стекла обрабатывают глутаровым альдегидом, а затем проводят реакцию с белком.
На рис. 1 приведена схема иммобилизации белков на поверхность стекла. Иммобилизация проводится в статическом режиме в четыре стадии: активация поверхности (I), силанизация (II), обработка глутаровым диальдегидом (III) и непосредственно иммобилизация белка на поверхность образца (IV) [3, 11].
Для активации поверхности образцы помещали в 0.5 М раствор NaOH на полчаса, промывали во-
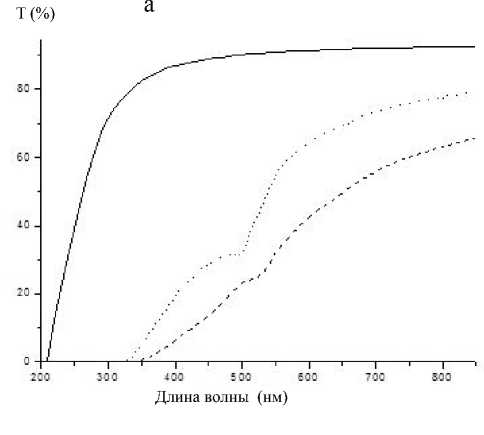
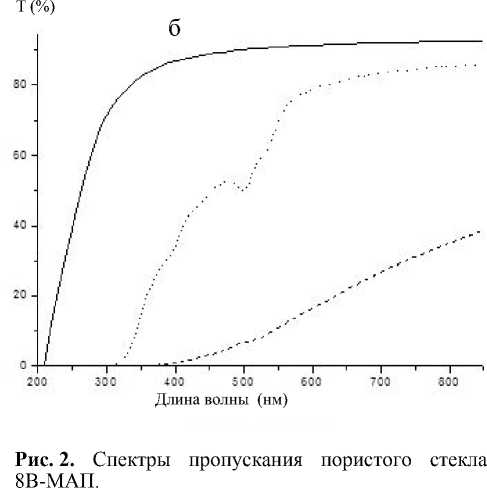
a — после силанизации с применением толуола; б — после силанизации с применением ацетона; сплошная линия — исходное пористое стекло; пунктирная — после иммобилизации иммуноглобулина; точечная — после проведения иммунной реакции
группами белка и альдегидными группами на химически модифицированной поверхности пористого стекла.
Принцип работы сенсора основан на иммунной реакции
IgG + (Ins-FITC) ↔ IgG - (Ins-FITC),
IgG — иммуноглобулин G, Ins-FITC — меченный флуоресцеином инсулин. Иммуноглобулин иммобилизуется на пористое стекло, после чего проводится иммунная реакция с меченным инсулином.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для изучения влияния времени и температуры сушки образцов пористого стекла между I и II стадиями обработки на иммобилизацию белков были изготовлены образцы со временем сушки 2 ч при 50 ºС; 1, 3 и 5 ч при 100 ºС.
Результаты измерения спектров пропускания этих образцов свидетельствуют о том, что у образца, высушенного при 50 ºС в диапазоне длин волн 550–850 нм пропускание на ~10 % ниже, чем у остальных; у образца со временем сушки 5 ч пропускание выше, чем у остальных в диапазоне 350– 600 нм. Таким образом, режим сушки образцов заметно влияет на их оптические характеристики.
После модификации поверхности глутаровым диальдегидом в спектрах пропускания образцов появляется пик поглощения на ~525 нм, хотя на спектрах раствора диальдегида этого пика нет.
На спектральных зависимостях светопропускания для образцов пористого стекла после проведения иммунной реакции (рис. 2) появились полосы поглощения флуоресцеина на 495 нм, что подтверждает успешное прохождение иммунной реакции. При этом сохраняется пик поглощения на 525 нм.
Обработка глутаровым диальдегидом, как и ожидалось, приводит к снижению прозрачности образцов. Иммобилизация иммуноглобулина приводит к дополнительному снижению прозрачности образцов. Однако после проведения иммунной реакции светопропускание образцов значительно увеличивается (на ~15 % для образцов с силаниза-цией толуолом (a) и на ~45 % для образцов с сила-низацией ацетоном (б)).
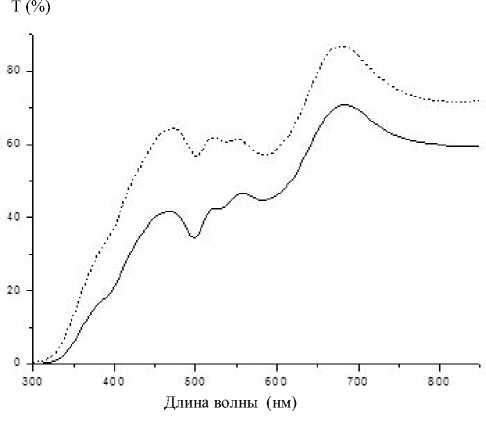
Рис. 3. Спектры пропускания пористых стекол после проведения иммунной реакции и обработки раствором Кумасси.
Сплошная линия — для силанизации образцов использовался толуол, пунктирная — ацетон
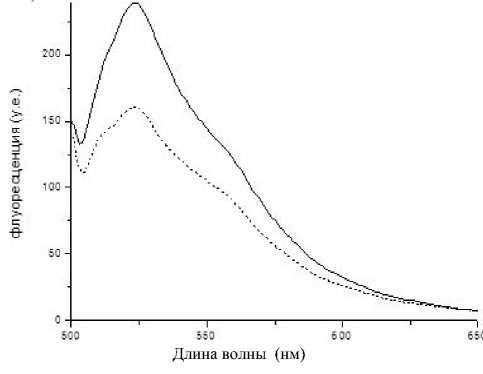
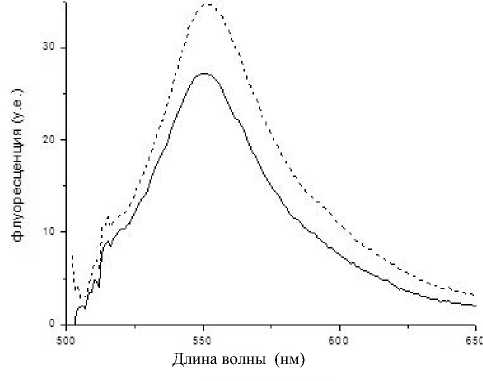
Рис. 4. Спектры флуоресценции пористого стекла 8В-МАП.
a — после иммобилизации иммуноглобулина; б — после проведения иммунной реакции; сплошная линия — при силанизации применялся толуол; пунктирная — ацетон
Проведена количественная оценка белка, связанного с поверхностью пористого стекла при помощи фотометрического определения (метод Ку-масси) [12] в растворе до и после иммобилизации. На рис. 3 приведены спектры пропускания пористых стекол после проведения иммунной реакции и обработки раствором Кумасси. При сила-низации с применением толуола (II стадия иммобилизации, вариант a)) иммобилизовалось 0.202 мг (~16 мкг/мм3 образца) белка, а при сила-низации с применением ацетона (II стадия иммобилизации, вариант б)) — 0.302 мг (~24 мкг/мм3). Таким образом, при использовании для силаниза-ции ацетона на образец ПС иммобилизуется большее количество белка, чем при использовании толуола.
Исходные двухфазные и пористые стекла не обладают флуоресценцией при длине волны возбуждения 488 нм, но при этом у глутарового диальдегида обнаружился пик флуоресценции на ~550 нм. Сравнение интенсивностей флуоресцен- ции образцов ПС после иммобилизации иммуноглобулина и после проведения иммунной реакции (рис. 4) подтверждает ранее полученный результат о том, что при использовании ацетона при силани-зации на образец иммобилизуется большее количество белка.
На рис. 5 приведены изображения поверхности образцов, полученные на сканирующем ближнепольном оптическом микроскопе в режимах поперечно-силовой моды и отражения света. Для исходного образца в обоих режимах получена практически ровная однородная поверхность на изображении 25 × 25 мкм. При увеличении разрешения (5 × 5 мкм) проявляется пористая структура, вполне соответствующая данным, полученным методом BET (Институт химии силикатов РАН). После иммобилизации инсулина на поверхности образца в режиме поперечно-силовой моды визуализированы отдельные частицы и группы частиц со средним радиусом 0.6 мкм. После проведения иммунной реакции на поверхности образца также

Рис. 5. Изображение поверхности пористого стекла 8В-МАП, полученные на сканирующем ближнепольном оптическом микроскопе.
Формат изображений 25 × 25 мкм. Поперечно-силовая мода: 1 — исходное стекло; 2 — после иммобилизации инсулина; 3 — после проведения иммунной реакции. Режим детектирования отражения света: 4 — исходное стекло; 5 — после проведения иммунной реакции.
Формат изображения 5 × 5 мкм. 6 — исходное стекло, поперечно-силовая мода
наблюдаются частицы более крупных размеров, но более однородные. На изображении поверхности образца после проведения иммунной реакции (в режиме отраженного света) кроме образовавшихся частиц проявляется оптически неоднородная поверхностная структура. Такой эффект может быть обусловлен образованием на поверхности образца относительно равномерной пленки с более крупными элементами, чем поры самого стекла. Последнее также подтверждается спектральными зависимостями светопропускания образцов, а именно тем фактом, что после проведения иммунной реакции светопропускание образцов возрастает.
ЗАКЛЮЧЕНИЕ
Пористое стекло является подходящим материалом для создания оптического сенсорного элемента для регистрации иммунной реакции.
Получение сенсорного элемента на основе ПС может быть проведено в статическом режиме в четыре стадии: активация поверхности, силанизация, обработка глутаровым диальдегидом и иммобилизация белка на поверхность стекла. Режим сушки между активацией поверхности и силанизацией оказывает существенное влияние на последующую иммобилизацию.
Согласно данным спектроскопии (метод Ку-масси) и флуориметрии при использовании для силанизации ацетона на пористое стекло иммобилизируется большее количество белка, чем при использовании толуола.
Образование на поверхности иммунного комплекса приводит к увеличению пропускания образца, что может быть применено для детектирования протекания иммунной реакции.
Результаты, полученные на сканирующем ближнепольном оптическом микроскопе, подтверждают образование комплекса на поверхности пористого стекла и увеличение оптической однородности образца в результате иммунной реакции.
Таким образом, показана принципиальная возможность создания сенсорного элемента на основе пористого стекла.
Исследования проведены в рамках проекта СПбНЦ РАН "Микрофлюидные аналитические системы с интегрированными наноструктурами (пористыми стеклами)", гранта РФФИ № 08-08-00733а "Процессы получения, структура, коллоидно-химические и оптические свойства нанораз-мерных мембран из высококремнеземных пористых стекол и их применение для создания микро-флюидных аналитических систем" и гранта для студентов, аспирантов вузов и академических институтов, расположенных на территории Санкт-Петербурга, "Применение пористых стекол в каче- стве функциональных элементов для микрофлю-идных чипов".


