Разработка персонализированного алгоритма выбора способа пластики дефекта брюшной стенки у пациентов с паховыми грыжами
Автор: Агапов М. А., Какоткин В. В., Юдина В. Д., Кадрев А. В., Гарманова Т. Н.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 2 (50), 2022 года.
Бесплатный доступ
Цель исследования - оценка эффективности персонализированного алгоритма определения методики хирургического лечения паховых грыж, позволяющего выбрать оптимальную оперативную тактику (ее модификации) в зависимости от антропометрических, клинических, инструментальных данных пациента.В ходе исследования были проанализированы результаты применения клинического алгоритма в медицинском научно-образовательном центре Московского государственного университета имени М.В. Ломоносова для пациентов с односторонними неущемленными симптомными паховыми грыжами. Проводилось сравнение частот основных послеоперационных неблагоприятных исходов исследовательской группы при использовании алгоритма и пациентов немецкого регистра Herniamed Hernia Register, для которых применяются только стандартные принципы выбора оперативного вмешательства, основные положения рекомендаций международной группы экспертов HerniaSurge Group. В ряде случаев учитывались индивидуальные исключительные факторы пациентов.Благодаря применению алгоритма удалось достичь частоты хронической боли и боли, требующей повторной операции значительно ниже средних частот немецкого регистра Herniamed (13,8% против 28,7% (p
Паховая грыжа, персонализированный подход, выбор оперативного вмешательства, операция по лихтенштейну, tapp
Короткий адрес: https://sciup.org/142235290
IDR: 142235290 | УДК: 617.55-089.844 | DOI: 10.38181/2223-2427-2022-2-5-14
Текст научной статьи Разработка персонализированного алгоритма выбора способа пластики дефекта брюшной стенки у пациентов с паховыми грыжами
Современные международные клинические рекомендации и национальные Российские клинические рекомендации [1] по лечению паховых грыж содержат в себе множество основанных на принципах доказательной медицины постулатов [2,3], которые, однако, не позволяют сформулировать единый алгоритм выбора наиболее подходящей техники операции, способа подбора сетчатого импланта, метода фиксации данного импланта и особенностей реабилитации пациента в зависимости от его индивидуальных характеристик [4,5].
С момента первой герниопластики предложено более 100 методик пластики бедренных и паховых грыж, в основном их можно разделить на ненатяжные техники, открытые ненатяжные методики с использованием сетки и лапаро-эндоскопические методики с использованием сетки. В рекомендациях международных сообществ гер-ниологов [2] утверждается, что методом выбора для пациентов с паховыми и бедренными грыжами являются ненатяжные техники с использованием сетчатых имплантов. Натяжные методы при паховой грыже могут быть предложены в случаях, когда пациент отказывается от установки сетчатого импланта, для проведения пластики небольших косых паховых грыж у детей, после совместного принятия решения с пациентом или в условиях ограниченных ресурсов, когда сетки недоступны.
Методика «затычка-лоскут» (plug-and-patch) на данный момент запрещена сообществом HerniaSurge. Хотя частота рецидивов и частота появления послеоперационных хронических болей сравнимы между методом «plug-and-patch/Prolene Hernia System» и методикой Лихтенштейна, международные клинические рекомендации настоятельно не рекомендуют «plug-and-patch/Prolene Hernia System» из-за чрезмерного количества инородного материала, необходимости во время вмешательства как переднего, так и заднего доступа, а также дополнительных материальных затрат.
Большинство мета-анализов посвящено сравнению результатов применения открытой герниопластики по Лихтенштейну и двух эндоскопических техник: TAPP и TEP. В некоторых мета-анализах проводится совместное сравнение эндоскопических техник с открытым вмешательством, в некоторых – независимое сравнение каждой из трех методик; сравнение только TAPP и открытого вмешательства по Лихтенштейну; только TEP и открытого вмешательства по Лихтенштейну. Только в одном из пяти мета-анализов по данной тематике TEP и ТАРР со- вместно сравнивали с открытой методикой по Лихтенштейну. Разницы в частоте рецидивов обнаружено не было; однако можно было отметить более низкую частоту раневой инфекции,более раннее возвращение к нормальной деятельности или работе и меньшую частоту хронического болевого синдрома при применении эндоскопических техник. Два метаанализа, сравнивающие только TEP, и один, сравнивающий только ТАРР с методом Лихтенштейна, не смогли предоставить достаточных доказательств для определения большей эффективности одного метода по сравнению с другим [6].
Мета-анализы и когортные исследования, сравнивающие лапаро-эндоскопические методики ТЕР и ТАРР, демонстрируют сопоставимые результаты. Поэтому группа HerniaSurge утверждает, что выбор методов ТЕР или ТАРР должен основываться на навыках, образовании и опыте хирурга [2].
В проспективном исследовании Köckerling с соавторами на основе регистра, сравнивающем 10 555 операций по Лихтенштейну с 6 833 операциями ТЕР при первичных односторонних паховых грыжах у мужчин [7], в ходе мультивариантного анализа не было обнаружено различий в частоте рецидивов,частоте повторных операций связанных с осложнениями. Однако было обнаружено что TEP влечет за собой меньше послеоперационных осложнений (p < 0,001), в меньшей степени ассоциирована с появлением болей в покое (p = 0,011) и болей при физической нагрузке (p < 0,001).
При сравнении TEP и ТАРР с методикой Лихтенштейна на основе реестра данных с отбором подобного по коэффициенту склонности (в двух выборках, разделенных по типу вмешательства, пациенты имеют прочие одинаковые характеристики) 57 906 пациентов с первичной односторонней пластикой паховой грыжи было выявлено значительно меньше послеоперационных осложнений, повторных операций, связанных с осложнениями, болью в покое, и болью при нагрузке при применении эндоскопических техник. С использованием ТЕР связано больше всего интраоперационных осложнений [8,9].
При оценке успеха хирургического вмешательства врачи обычно пользуются четко обозначенными конечными точками, для герниопластики таковыми являются количество рецидивов у прооперированных пациентов, количество ранних послеоперационных осложнений и хроническая послеоперационная боль. Эти исходы, однако, не позволяют определить влияние хирургического вмешательства на жизнь пациента, его функциональную активность после операции, то, насколько пациент будет ограничен в своих повседневных ритуалах и действиях после операции. Не стоит забывать, что за мерами в поддержании стерильности операционного поля и техническими тонкостями операции стоит живой человек. В последнее время появилось некоторое количество шкал по оценке качества жизни, ориентированных именно на пациентов, которым выполнялась герниопластика. В центре фокуса внимания таких шкал (HerQLes, Carolina Comfort Scale) стоит функция брюшной стенки и ощущения, возникающие в ней при различных видах физической активности, связанные с наличием сетчатого импланта [10,11]. Две вышеописанные шкалы используются как показатель выраженности болевого синдрома и дискомфорта в паховой области после герниопластики помогают объективизировать неприятные ощущения пациента: например,пациент не просто испытывает дискомфорт, данные ощущения препятствуют сексуальной активности или ходьбе.В такой ситуации нельзя говорить об успехе проведенного вмешательства, несмотря на отсутствие неблагоприятных исходов (хроническая послеоперационная боль, ранние послеоперационные осложнения, рецидив грыжи).
В данной работе последовательно предпринята попытка решения проблемы выбора методики герниопла-стики для конкретного пациента с целью не только достижения оптимального показателя рецидивов грыж, но и профилактики болевого синдрома в раннем послеоперационном периоде, хронической паховой боли обеспечения быстрого восстановления качества жизни.
При выборе вмешательства учитывались основные положения рекомендаций международной группы экспертов HerniaSurge Group и национальных российских клинических рекомендаций,собственный опыт применения различных способов герниопластики и методик фиксации сетчатого импланта [1,2,12]. Выбор оперативного вмешательства, тип, размер и способ фиксации сетки проводился по разрабатываемому персонализированному алгоритму (рис.1), который был составлен на основании современных клинических рекомендаций, мета-анализов, рандомизированных многоцентровых клинических исследований. Схема опробована в полном объеме, в ряде случаев учитывались индивидуальные исключительные факторы пациентов.Алгоритм построен таким образом, чтобы минимизировать недостатки методики по Лихтенштейну и уменьшить количество нежелательных эффектов методики, когда есть необходимость в данном виде оперативного вмешательства.
При выборе вмешательства учитывались основные положения рекомендаций международной группы экспертов HerniaSurge Group [1,2,3] и национальных российских клинических рекомендаций.
Основными показаниями для выбора в пользу вмешательства по методике Лихтенштейна были:
-
1) высокий анестезиологический риск (класс ASA>2, высокий риск сердечно-сосудистых событий по Голдману), ограничивающий использование эндотрахеаль-ного наркоза и карбоксиперитонеума;
-
2) пахово-мошоночная грыжа (в связи со сложностью проведения адекватного гемостаза в условиях лапароскопической операции);
-
3) невправимая грыжа;
-
4) ранее проведенные обширные вмешательства на брюшной полости, тазовых органах (распространенный перитонит, гемоперитонеум);
-
5) большой размер грыжевого мешка;
-
6) рецидивная грыжа после применения лапароскопических методик герниопластики.
Во всех иных ситуациях хирург, в достаточной мере владеющий лапароскопическими методиками, должен склоняться к выбору TAPP/TEP, особенно в следующих случаях: 1) односторонняя паховая грыжа у женщин; 2) пациенты с предоперационной паховой болью; 3) нарушение функции тазовых органов, невозможность обеспечения оптимальной гигиены и наличие гнойничковых эрозивных паховых высыпаний в паховой области.
Использовались только легковесные сетки,так как более легкая сетка с более крупными порами, согласно международным клиническим рекомендациям, лучше подходит для герниопластики,вызывает меньшее локальное реактивное воспаление, лучше интегрируется в ткани, не препятствует восстановлению конфигурации брюшной стенки,в отдаленной перспективе снижает риск возникновения хронической послеоперационной боли, что приводит к лучшему клиническому результату [2]. Ряд исследователей показали, что использование крупнопористых сеток в отсутствие контаминации также может противодействовать возникновению инфекционных осложнений и сером [13, 14].
Для фиксации сетчатого полипропиленового протеза размерами 10х15 мм (после придания импланту соответствующей формы) во время выполнения ТАРР применялось устройство ProTack™ 5 мм. Стандартные точки фиксации: связка Купера, задняя поверхность прямых мышц живота и передняя брюшная стенка по верхнелатеральному краю сетки. Количество точек фиксации – три.
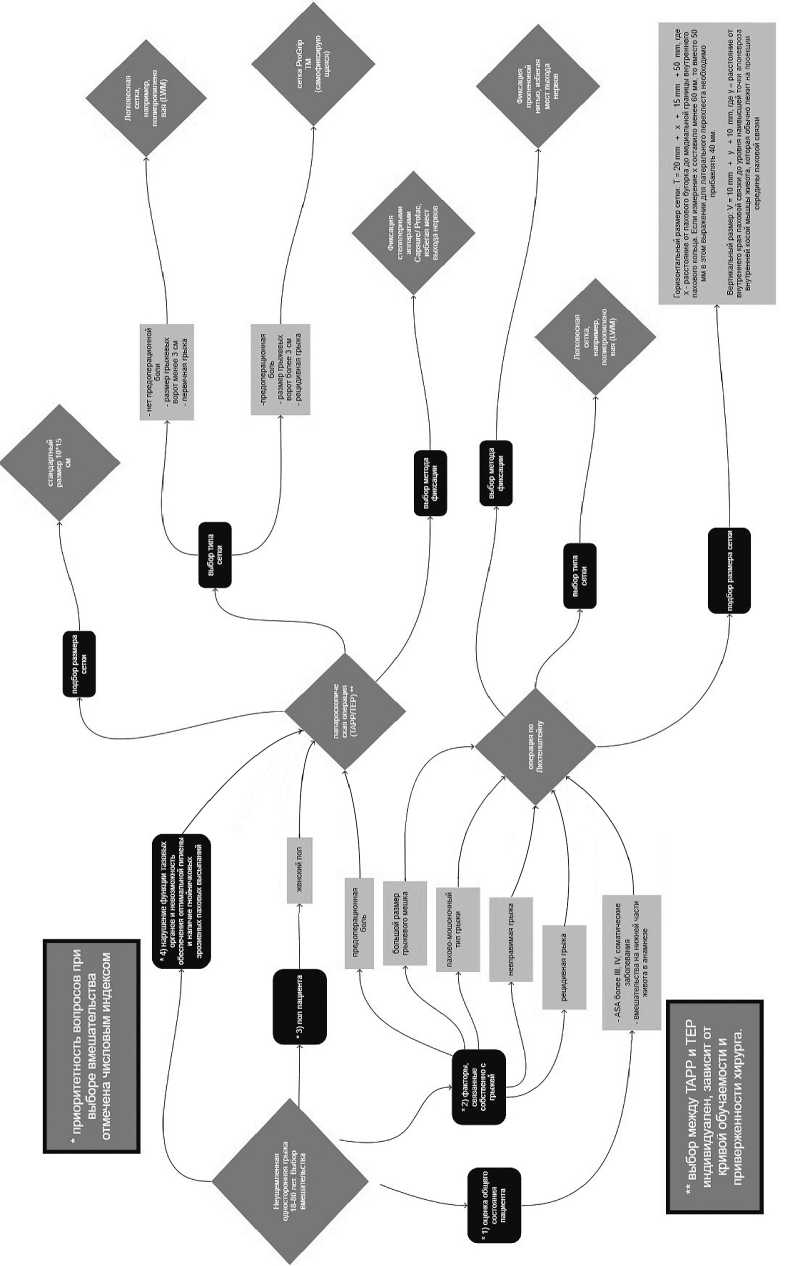
Рис. 1. Алгоритм выбора вмешательства при односторонних неущемленных грыжах Fig. 1. Algorithm for choosing an intervention for unilateral non-strangulated hernias
При выявлении у пациента болевых ощущений в паховой области или непосредственно в зоне выпячивания на дооперационном этапе,наличии рецидивной грыжи после передней методики герниопластики,а также,в случае, если размер грыжевых ворот превышал 30 мм (по данным УЗИ паховых областей на догоспитальном этапе), во время выполнения TAPP применялся сетчатый имплант ProGripTM. Данная тактика позволила избежать увеличения числа точек фиксации импланта без повышения вероятности его миграции или сворачивания.
После фиксации сетчатого импланта ушивание дефекта брюшины выполнялось с использованием ручного интракорпорального непрерывного шва Vicryl 3/0.
При выполнении гернипластики по методике Лихтенштейна фиксация сетчатого импланта выполнялась с использованием полипропиленовой мононити 2/0 по USD. При этом обязательным этапом операции являлась визуализация n. ilioinguinalis и n. iliohypogastricus с целью исключения случайного прошивания тканей в проекции прохождения нервов.
Материалы и методы
Работа проводилась на базе Медицинского научно-образовательного центра МГУ имени М.В. Ломоносова. Исследование выполнено в виде ретроспективного обсервационного анализа выборки пациентов,перенес-ших операцию по пластике паховой грыжи, с последующим сбором информации о конечных точках (рецидивы грыжи, выраженность хронической послеоперационной боли) через 1 год в виде телефонного опроса. В результате анализа данных истории болезни были собраны данные о ранних послеоперационных осложнениях. В исследование первоначально были включены 330 пациентов хирургического отделения, госпитализированные в период с 1 сентября 2018 г. по 30 апреля 2021 г. со входным диагнозом неущемленная односторонняя паховая грыжа (код по международной классификации болезней: К40.9). При поступлении испытуемые не должны были иметь ущемления грыжи, двустороннюю паховую грыжу или комбинацию паховой и бедренной грыжи.
Критерии включения в исследование:
-
1) Неущемленная односторонняя паховая грыжа (код по МКБ: К40.9). Отсутствие комбинации с бедренной грыжей. Выбор ненатяжных оперативных методик
-
2) Возраст пациента от 18 до 80 лет
-
3) Период наблюдения за пациентом составил 1 год спустя год зафиксировано наличие или отсутствие неблагоприятных исходов (хроническая послеоперационная
боль, рецидивы), функциональный статус пациентов оценен по шкалам HerQLes и Carolinas Comfort Scale
При составлении списка послеоперационных и интраоперационных осложнений, факторов риска для анализа зависимостей осложнение или фактор включались в список для анализа только в том случае, если оно встречалось в исследуемой популяции хотя бы один раз. Так как за выбранный промежуток времени при операциях по пластике грыж в МНОЦ МГУ не было отмечено общих осложнений (тромбоэмболия легочной артерии,инфаркт миокарда тромбоз, почечная недостаточность, пневмония и др.) и ряда интраоперационных осложнений (злокачественная лихорадка, повреждения органов и нервов) и послеоперационных осложнений (инфекции), они были исключены при проведении анализа зависимостей.
Для оценки эффективности персонализированного алгоритма выполнялось сравнение непосредственных результатов лечения пациентов в МНОЦ и данных международной базы данных Herniamed Register, в которой собраны данные о 490 947 пациентах, перенесших гернио-пластику) [6,9,15]
Использование в качестве группы сравнения пациентов международной базы данных Herniamed Register (Австрия, Германия, Швейцария) было обусловлено несколькими причинами. Во-первых, данный регистр является наиболее обширным среди имеющихся в открытом доступе. Во-вторых, врачи из стран, предоставляющих данные для указанного регистра,придерживаются клинических рекомендаций, распространенных на территории Европейского Союза [2], что позволяет исключить влияние национальных клинических рекомендаций на выбор тактики лечения в каждой конкретной стране. В-третьих в настоящий момент на территории Российской Федерации не существует единого регистра, позволяющего отследить исходы лечения у данной категории пациентов. Создание группы сравнения в условиях университетской клиники МГУ было признано нецелесообразным в связи с наличием большого количества факторов, влияющих на выбор хирургической тактики и отсутствием возможности рандомизации тактики выбора лечения.
Статистический анализ был выполнен с помощью программного обеспечения IBM SPSS Statistics 26.0. В качестве уровня значимости выбрано значение p ≤0,05. Расчет p для исходов лечения производился методом кси-квадратов.
Для анализа зависимостей порядковых данных и количественных данных с распределением, отличным от нормального, в двух подгруппах использовался непараметрический критерий Манна-Уитни.
Результаты и обсуждение
Средние частоты неблагоприятных исходов в лечебных центрах (согласно Herniamed Register) и частоты неблагоприятных исходов для односторонних первичных грыж, подсчитанные в нашем исследовании (n = 304) представлены в таблице 1.
Ранние послеоперационные осложнения
Отсутствие статистически значимой разницы между показателями частоты ранних послеоперационных осложнений, в частности, нарушения заживления ран и гематом области операции, вероятно, обусловлено зависимостью данных показателей в первую очередь от навыков оперирующего хирурга [2], а не от особенностей той или иной методики выполнения операции, характеристик сетчатого импланта или способа его фиксации.
Серомы
Для оценки и описания уже сформированных послеоперационных сером членами рабочей группы европейского общества герниологов рекомендована классификация, предложенная S. Morales-Conde (2012), разделяющая все серомы на 4 типа: 0-й – серома без клинических признаков, 1-й – клинически значимая серома длительностью меньше одного месяца, 2-й – серома длительностью более одного месяца, 3-й – серома более 6 месяцев, которая может потребовать лечения и вызывает боли или явления целлюлита, 4-й – серома, требующая лечения и сопровождающаяся осложнениями (самостоятельное опорожнение «глубокое» нагноение, рецидив и отрыв имплантата) [16,17]. Серома как инцидент рассматривается при 1-м или 2-м типах, а как осложнение – при 3-м и 4-м типах.
При детальном анализе показателя частоты встречаемости сером было установлено, что среди 7 диагностированных сером у пациентов МНОЦ МГУ только 1 случай мог быть отнесен к серомам 3 типа (осложнение), в то время как 4 серомы должны быть отнесены к 1 типу, 2 се-ромы – ко 2-му типу. В таком случае частота сером, как осложнений хирургического вмешательства, составит уже не 2,3%, а 0,33%.
Данные Herniamed Register не позволяют уточнить, се-ромы какого типа по классификации Morales-Conde были учтены в ходе составления регистра.
Рецидивы
Среди всей выборки пациентов было зафиксировано 5 случаев рецидива в течение года наблюдения (4%-муж-чины против 1% – женщины), медианный возраст безре-цидивных пациентов – 50, пациентов, у которых развилась рецидивная грыжа – 74,5 (p = 0, 017). Статистически значимой разницы между результатами применения алгоритма МНОЦ МГУ и данными Herniamed Register не выявлено.
Таблица
Частоты неблагоприятных исходов в лечебных центрах (согласно Herniamed Register) и в МНОЦ МГУ
Table
Rates of adverse outcomes in treatment centers (according to Herniamed Register) and in MSU MREC
|
Неблагоприятные исходы |
Herniamed Hernia Register |
МНОЦ МГУ |
P-value |
|
ранние послеоперационные осложнения |
4,03 % |
4,9% |
0,586 |
|
нарушение заживления раны |
0,2% |
0,32% |
0,108 |
|
гематома |
1,4% |
2,3% |
0,169 |
|
серома |
1,1% |
2,3 % |
0,0446 |
|
рецидивы |
1,45 % |
1,6% |
0,777 |
|
хроническая послеоперационная боль |
28,7% |
13,8% |
< 0,00001 |
|
боль, требующая повторного вмешательства |
3,8% |
0,99% |
0,0103 |
|
Оценка по шкале Carolinas Comfort Scale Mediana [25th; 75th] |
8 [8; 19] |
— |
|
|
Оценка по шкале HerQLes Mediana [25th; 75th] |
12 [12; 17] |
— |
Частота ранних рецидивов (рецидивов, выявленных в течение года после операции) зависит преимущественно от факторов, связанных с хирургическим вмешательством [18,19]. В ходе проведения крупных многоцентровых исследований была установлена корреляция между частотой рецидивов и частотой ранних послеоперационных осложнений [15,20]. При детальном изучении медицинской документации пациентов МНОЦ МГУ, у которых за время наблюдения был диагностирован рецидив грыжи, было установлено что частота послеоперационных осложнений у пациентов данной группы составила 40% (1 случай – серома 3 типа Morales-Conde, 1 случай – гематома). Тот же показатель у пациентов без рецидива составил 2,3% (p<0,05).
Увеличение риска развития рецидива после герниопла-стики при наличии послеоперационных осложнений, таких как серомы и гематомы, вероятно обусловлено следующим механизмом: формирование жидкостного скопления вокруг сетчатого импланта способствует персистенции «мертвого» пространства между материалом сетки и тканями хозяина, препятствуя инфильтрации сетки иммунными клетками макроорганизма, формированию гранулем, интеграции сетки в ткани хозяина [14,21]. Применение сетчатого импланта с макропорами теоретически способно минимизировать объем «мертвого» пространство между тканями и имплантом даже в случае развития описанных осложнений.
Хроническая послеоперационная боль
Согласно данным литературы, частота хронического болевого синдрома (длительностью более 3-х месяцев) после хирургического вмешательства по поводу паховых грыж составляет от 10-12% до 54%, а у 0,5-6% пациентов болевой синдром становится значительно снижающим качество жизни фактором,при этом ставшие «золотым стандартом» лапароскопическая трансабдоминальная преперитонеальная герниопластика (TAPP – transabdominal preperitoneal patch plasty) и тотальная экстраперито-неальная герниопластика (TEP – total extraperitoneal patch plasty) характеризуются сопоставимыми показателями послеоперационного болевого синдрома [2,22,23].
Выделяют следующие основные причины послеоперационной паховой боли: повреждение нервов, вовлечение нервов в рубцовую ткань, послеоперационное сдавление нерва, образование вокруг сетки рубцовой ткани, смещение, сморщивание, инфицирование сетки, рецидив грыжи. Хронический болевой синдром может быть проявлением нейропатической боли,ноцицептивной боли, либо сочетать в себе оба патогенетических типа [24].
Выделяют следующие факторы риска развития послеоперационной хронической боли [2]:
-
- предоперационные ((а) Молодой возраст, (b) женский пол, (с) Высокая предоперационная боль, (d) Низкий предоперационный оптимизм, (е) сниженная двигательная активность, (f) хирургия рецидивной грыжи, (g) генетическая предрасположенность (DQBI*03:02 HLA haplotype))
-
- периоперационные ((а) Небольшой опыт хирурга, (b) Открытый метод, (с) тяжелая сетка, (d) Фиксация сетки: шов (открытый), скоба (лапароскопия))
-
- послеоперационные ((а) Послеоперационные осложнения: гематома, инфекция, (b) Высокий уровень ранней (послеоперационной боли, (с) низкий болевой порог)
Частота хронической послеоперационной боли среди пациентов МНОЦ МГУ составила 13,8%, что в 2,1 раза ниже, чем показатель Herniamed Register.
С учетом перечисленных факторов риска хронической боли,вероятно следующие особенности алгоритма повлияли на данный показатель:
-
- отказ от механической фиксации сетчатого импланта у пациентов с паховой болью, выявленной на догоспитальном этапе;
-
- использование сетчатого импланта ProGripTM у па-цеинтов с рецидивными паховыми грыжами после передних пластик;
-
- использование ограниченного числа точек фиксации (не более 3-х);
-
- отказ от степлерной фиксации перитонеального лоскута после выполнения ТАРР в пользу ручного интракор-порального шва;
-
- применение легковесных сетчатых имплантов (Lightweigh mesh – LWM).
Пациенты с хронической болью в МНОЦ МГУ статистически значимо чаще чем те, кто не жаловался на хроническую боль, имели гематомы в раннем послеоперационном периоде, (15% против 2,2%, p = 0,042). Вероятно более частый хронический болевой синдром при наличии гематом может быть обусловлен следующими причинами: вовлечение нервов в рубцовую ткань после инкапсуляции гематомы, послеоперационное сдавление нерва гематомой с формированием компрессионной нейропатии, образование вокруг сетчатого импланта грубой рубцовой ткани смещение сетчатого импланта.
Боль, требующая повторного вмешательства
Острая или хроническая боль, требующая повторного хирургического вмешательства – такое осложнение, которое практически всегда обусловлено дефектом хирурги- ческой техники [2,15]. Непосредственными причинами возникновения острой послеоперационной боли такого рода может служить механическая фиксация в области прохождения нервов, будь то скобочная фиксация при выполнении эндоскопической герниопластики, или прошивание нервного пучка при выполнении герниопла-стики по методике Лихтенштейна.
Появление боли, требующей хирургического вмешательства в отсроченном периоде, может быть обусловлено сморщиванием сетки или формированием так называемой «мешомы» в области прохождения нервных волокон. Клиническим проявлением рецидива грыжи также может быть появление болевого синдрома без формирования грыжевого выпячивания [15].
Выявление у пациента в раннем послеоперационном периоде острого плохо контролируемого болевого синдрома или появление в отсроченном периоде вновь возникших болевых ощущений в области операции должно заставить оперирующего хирурга задуматься о возможной необходимости хирургической коррекции болевого синдрома.
Качество жизни и его оценка
Ранее датскими исследователями Tolver et al. из Копенгагенского университета [25] было показано, что сроки восстановления нормальной активности и трудовой деятельности напрямую зависят от предоперационных ожиданий пациента и его состояния в ранний послеоперационный период,поэтому попытки уменьшения послеоперационной боли с целью улучшения качества жизни выглядят перспективными.
Согласно данным анализа, группа пациентов МНОЦ МГУ с выявленными ранними послеоперационными осложнениями характеризировалась статистически значимым большим количеством баллов по шкале HerQLe (медиана 22 против медианы 12 у пациентов без ранних послеоперационных осложнений, р = 0,019). При этом отличия по оценке шкалы Carolinas Comfort Scale не достигали статистически значимой разницы (медиана 15,5 против медианы 8 у пациентов без ранних послеоперационных осложнений, р = 0,056).
Для пациентов,у которых отмечалась хроническая послеоперационная боль, статистически значимо выше количество баллов по шкалам HerQLes (медиана 27,75 против медианы 12 у пациентов без хронической боли, р < 0,001) и Carolinas Comfort Scale (медиана 28,5 против медианы 8 у пациентов без хронической боли, р < 0,001).
Возможность использования для оценки качества жизни пациентов после различных методик герниопла- стики таких шкал, как HerQLes, Carolinas Comfort Scale требует дальнейшего изучения.Несмотря на заявления авторов о том, что данные шкалы являются проверенным, чувствительным и надежным инструментом для оценки качества жизни [10,11], отсутствие достаточного количества клинических исследований не позволяет применять их в качестве инструмента сравнения эффективности того или иного способа достижения удовлетворительного качества жизни.
Заключение
Применение персонализированного алгоритма позволило уменьшить частоту хронического болевого синдрома уменьшить в 2,1 раз в сравнении с данными международного регистра Herniamed.
Частота неблагоприятных исходов лечения пациентов с паховыми грыжами при использовании алгоритма не отличалась от таковой в сравнении с данными регистра Herniamed.
Возможность использования для оценки качества жизни пациентов после различных методик герниопла-стики таких шкал, как HerQLes, Carolinas Comfort Scale требует дальнейшего изучения.
В связи с малым сроком наблюдения за пациентами (1 год) не представляется возможным в полной мере оценить показатель частоты рецидивов, поэтому требуется дальнейший мониторинг пациентов,вошедших в исследование.
Список литературы Разработка персонализированного алгоритма выбора способа пластики дефекта брюшной стенки у пациентов с паховыми грыжами
- Затевахин ИИ, Эттингер АП. Клинические рекомендации “Паховая грыжа” (утв. Министерством здравоохранения РФ, 2021 г.). 2021. [Zatevakhin II, Ettinger AP. National guidelines "Inguinal hernia" 2021 (In Russ.).]
- HerniaSurge Group. International guidelines for groin hernia management. Hernia. 2018 Feb;22(1):1-165. https://doi.org/10.1007/s10029-017-1668-x
- Dakin G. The SAGES Manual of Hernia Surgery. Society of American Gastrointestinal and Endoscopic Surgeons (SAGES). XV, 680. 2019. https://doi.org/10.1007/978-3-319-78411-3
- Richmond BK, Totten C, Roth JS, Tsai J, Madabhushi V. Current strategies for the management of inguinal hernia: What are the available approaches and the key considerations? Curr Probl Surg. Elsevier Inc.; 2019;56(10):100646. https://doi.org/10.1016/j.cpsurg.2019.100646
- Köckerling F, Simons MP. Current Concepts of Inguinal Hernia Repair. Visc Med. 2018;34(2):145–50. https://doi.org/10.1159/000487278
- Scheuermann U, Niebisch S, Lyros O, Jansen-Winkeln B, Gockel I. Transabdominal Preperitoneal (TAPP) versus Lichtenstein operation for primary inguinal hernia repair – A systematic review and meta-analysis of randomized controlled trials. BMC Surg. BMC Surgery 2017;17(1):1–10. https://doi.org/10.1186/s12893-017-0253-7
- Köckerling F, Stechemesser B, Hukauf M, Kuthe A, Schug- Pass C. TEP versus Lichtenstein: Which technique is better for the repair of primary unilateral inguinal hernias in men? Surg Endosc. 2016;30(8):3304–13. https://doi.org/10.1007/s00464-015-4603-1
- Köckerling F, Bittner R, Kofler M, Mayer F, Adolf D, Kuthe A, et al. Lichtenstein Versus Total Extraperitoneal Patch Plasty Versus Transabdominal Patch Plasty Technique for Primary Unilateral Inguinal Hernia Repair: A Registry-based, Propensity Score-matched Comparison of 57,906 Patients. Ann Surg. 2019;269(2):351–7. https://doi.org/10.1097/SLA.0000000000002541
- Köckerling F, Roessing C, Adolf D, Schug-Pass C, Jacob D. Has endoscopic (TEP, TAPP) or open inguinal hernia repair a higher risk of bleeding in patients with coagulopathy or antithrombotic therapy? Data from the Herniamed Registry. Surg Endosc. 2016;30(5):2073–81. https://doi.org/10.1007/s00464-015-4456-7
- Krpata DM, Schmotzer BJ, Flocke S, Jin J, Blatnik JA, Ermlich B, Novitsky YW, Rosen MJ. Design and initial implementation of HerQLes: a hernia-related quality-of-life survey to assess abdominal wall function. J Am Coll Surg. 2012 Nov;215(5):635-42. https://doi.org/10.1016/j.jamcollsurg.2012.06.412.
- Parseliunas A, Paskauskas S, Simatoniene V, Vaitekunas J, Venskutonis D. Adaptation and validation of the Carolinas Comfort Scale: a questionnaire-based cross-sectional study. Hernia. Springer Paris 2021;1(1):1-8. https://doi.org/10.1007/s10029-021-02399-4
- Галлямов Э.А., Агапов М.А., Бусырев Ю.Б., Какоткин В.В., Кубышкин В.А., Донченко К.А., Гадлевский Г.С., Чжэнхао У. Результаты различных методик фиксации сетчатого протеза при лапароскопической герниопластики (TAPP). Хирургия. Журнал им. Н.И. Пирогова. 2021;(1):34-41. [Gallyamov EA, Agapov MA, Busyrev YuB, Kakotkin VV, Kubyshkin VA, Donchenko KA, Gadlevskiy GS, Wu Z. Outcomes of various techniques of mesh prosthesis fixation in laparoscopic hernia repair. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2021;(1):34-41. (In Russ.)] https://doi.org/10.17116/hirurgia202101134
- Lake SP, Ray S, Zihni AM. Pore size and pore shape – but not mesh density – alter the mechanical strength of tissue ingrowth and host tissue response to synthetic mesh materials in a porcine model of ventral hernia repair. J Mech Behav Biomed Mater. 2015 Feb;42:186-97. https://doi.org/10.1016/j.jmbbm.2014.11.011
- Kalaba S, Gerhard E, Winder JS, Pauli EM, Haluck RS, Yang J. Design strategies and applications of biomaterials and devices for Hernia repair. Bioact Mater [Internet]. Elsevier Ltd; 2016;1(1):2–17. https://doi.org/10.1016/j.bioactmat.2016.05.002
- Köckerling F, Adolf D, Lorenz R, Stechemesser B, Kuthe A, Conze J, Lammers B, Fortelny R, Mayer F, Zarras K, Reinpold W, Hoffmann H, Weyhe D. Perioperative outcome in groin hernia repair: what are the most important influencing factors? Hernia. 2022 Feb;26(1):201-215. https://doi.org/10.1007/s10029-021-02417-5
- Muysoms FE, Antoniou SA, Bury K, Campanelli G, Conze J, Cuccurullo D, de Beaux AC, Deerenberg EB, East B, Fortelny RH, Gillion JF, Henriksen NA, Israelsson L, Jairam A, Jänes A, Jeekel J, López-Cano M, Miserez M, Morales-Conde S, Sanders DL, Simons MP, Śmietański M, Venclauskas L, Berrevoet F; European Hernia Society. European Hernia Society guidelines on the closure of abdominal wall incisions. Hernia. 2015 Feb;19(1):1-24. https://doi.org/10.1007/s10029-014-1342-5
- Morales-Conde S. A new classification for seroma after laparoscopic ventral hernia repair. Hernia. 2012 Jun;16(3):261-7. https://doi.org/10.1007/s10029-012-0911-8
- Köckerling F. Data and outcome of inguinal hernia repair in hernia registers – A review of the literature. Innov Surg Sci. 2020;2(2):69–79. https://doi.org/10.1007/s10029-022-02630-w
- Кубышкин В.А., Галлямов Э.А., Агапов М.А., Какоткин В.В., Давлятов М.Р. значение особенностей структуры и метаболизма внеклеточного матрикса в патогенезе грыж брюшной стенки. Обзор литературы. Хирургическая практика. 2020;(1):24-32. [Kubyshkin V.A., Galliamov E.A., Agapov M.A., Kakotkin V.V., Davlyatov M.R. significance of the structure and metabolism of the extracellular matrix in the pathogenesis of abdominal hernias. Review. Surgical practice. 2020;(1):24-32. (In Russ.)] https://doi.org/10.38181/2223-2427-2020-1-24-32
- Olsson A, Sandblom G, Franneby U, Sondén A, Gunnarsson U, Dahlstrand U. Do postoperative complications correlate to chronic pain following inguinal hernia repair? A prospective cohort study from the Swedish Hernia Register. Hernia. Springer Paris; 2021 Dec 11(1);1-8. https://doi.org/10.1007/s10029-021-02545-y
- Patil AR, Nandikoor S, Mohanty HS, Godhi S, Bhat R. Mind the gap: imaging spectrum of abdominal ventral hernia repair complications. Insights Imaging. Insights into Imaging; 2019;10(1):1-11. https://doi.org/10.1186/s13244-019-0730-x
- S. Scott Davis, Jr., Gregory Dakin, Andrew Bates. The SAGES Manual of Hernia Surgery. Society of American Gastrointestinal and Endoscopic Surgeons (SAGES). Springer International Publishing 2019. XV, 680. https://doi.org/10.1007/978-3-319-78411-3
- Hakeem A, Shanmugam V. Current trends in the diagnosis and management of post-herniorraphy chronic groin pain. World J Gastrointest Surg. 2011 Jun 27;3(6):73-81. https://doi.org/10.4240/wjgs.v3.i6.73
- Loos MJ, Roumen RM, Scheltinga MR. Classifying postherniorrhaphy pain syndromes follow- ing elective inguinal hernia repair. World J Surg. 2007;31(9):1760–5. discussion 1766-7
- Tolver MA, Strandfelt P, Forsberg G, Hjørne FP, Rosenberg J, Bisgaard T. Determinants of a short convalescence after laparoscopic transabdominal preperitoneal inguinal hernia repair. Surgery. 2012 Apr;151(4):556-63. https://doi.org/10.1016/j.surg.2011.08.020


