Разработка системы ввода наноколичеств пробы в масс-спектрометр
Автор: Краснов И.А., Подольская Е.П., Мурадымов М.З., Апацкая М.В., Лютвинский Я.И., Фиронов С.В., Витин А.В., Беляев К.А., Корнев Д.И., Каюмов А.А., Подтележников А.В., Галль Л.Н., Краснов Н.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии. Приборы
Статья в выпуске: 4 т.18, 2008 года.
Бесплатный доступ
Настоящая работа посвящена разработке отечественной nano-LC-MS аналитической системы. Основными функциональными блоками такой системы являются: хроматографическая установка на основе HPLC микроколоночной технологии, блок ионизации nano-ESI и времяпролетный анализатор (TOF). Реализована данная система на базе отечественного масс-спектрометра МХ-5310 (ИАнП РАН). В статье представлены результаты исследования полученной экспериментальной установки, а также проведено сравнение основных параметров с параметрами отечественных ЖХ-МС установок. Полученная установка позволяет работать с наноколичествами исходного материала. В разработанной системе хроматографическая капиллярная колонка непосредственно используется в качестве наноэмиттера, что приводит к уменьшению количества приборных узлов и снижает неизбежные потери анализируемых образцов. Система ввода установки отличается простотой исполнения, очень экономична в использовании растворителей и других расходных материалов.
Короткий адрес: https://sciup.org/14264578
IDR: 14264578 | УДК: 621.384.668.8
Текст научной статьи Разработка системы ввода наноколичеств пробы в масс-спектрометр
За последние 15 лет масс-спектрометрия стала мощным и удобным методом анализа макромолекул и биологических веществ [1–3].
Минимизация внутреннего диаметра распылительной иглы привела к появлению micro- и nanoESI-источников, которые позволяют работать со скоростью потока в несколько десятков нанолитров в минуту. Nano-ESI — усовершенствованный метод распыления небольших количеств образцов низкой концентрации (наномоль/мл). Метод обладает повышенной толерантностью к высоко аква-тированным растворам и солевым загрязнениям [4, 5]. Спектры могут быть получены из пикограмма образца, при этом не требуется специальной очистки. Переход от обычного ESI-MS к nano-ESI-MS повысил чувствительность анализа до аттомолей при идентификации белка при скоростях потока 1–4 нл/мин [4]. Повышение чувствительности и уменьшение количества анализируемого вещества считаются важнейшими преимуществами nano-ESI-источника.
Особого внимания заслуживает то, что основной проблемой, стоящей перед исследователями, является малое количество анализируемого вещества, поскольку количество пробы, особенно полученной из биологического материала, ограничено и зачастую не превышает нескольких пикомолей, причем количество компонент, содержащихся в образце, может составлять тысячи и десятки тысяч. Решением этой проблемы становится сочетание нанохроматографа с масс-спектрометром, снабженным nano-ESI источником ионизации. В настоящее время существуют решения по созданию комплексов nano-LC-ESI-MS как в нашей стране, так и за рубежом [7–10]. Эти комплексы оказываются либо слишком дороги, особенно в таких расходных материалах, как хроматографические колонки, либо обладают рядом недостатков, к которым относятся размывание пробы после элюирования ее с колонки и высокая скорость потока (100–150 мкл/мин), требуемая для успешного хроматографического анализа, но усложняющая работу источника ESI.
На сегодняшний день единственным отечественным комплексом, сочетающим жидкостной хроматограф и масс-спектрометр, снабженный источником ионов ESI, является тандем Милихром А02 (Институт хроматографии, Новосибирск)— МХ-5310 (ИАнП РАН, СПб.). Данный комплекс позволяет успешно анализировать сложные смеси при условии, что в пробе содержится примерно 200 пM анализируемого вещества, при этом минимальная скорость потока элюента, обеспечивающая эффективное разделение соединений, составляет 150 мкл/мин. Для того чтобы получить качественное распыление такого потока требуется нагрев спутного газа в источнике ионов до 150 °С. Все перечисленное значительно усложняет процедуру анализа и не позволяет проводить анализ образцов, содержащих единицы пМ соединений.
Таким образом, возникает необходимость создания отечественного комплекса nano-LC-nano-ESI-MS, который позволял бы эффективно проводить анализ сложных биологических проб, отли- чался простотой в использовании и был экономичен в расходных материалах.
Решение данной задачи может быть реализовано путем создания системы ввода пробы, которая обладала бы следующими преимуществами:
-
1) проведение анализа как в режиме хроматографирования, так и в изократическом режиме;
-
2) возможность проведения анализа при содержании в образце 1–5 пМ анализируемого вещества;
-
3) снижение скорости потока до 100– 200 нл/мин;
-
4) отсутствие нагрева и спутного газа;
-
5) отсутствие узла, приводящего к размыванию пробы.
Аналитическая система ввода наноколичеств проб (АСВНП) предназначена для внедрения уникальной отечественной технологии анализа наноколичеств образцов, имеющих биологическое происхождение, в рамках исследований, посвященных молекулярно-биологическим и физиолого-биохимическим процессам в живых системах. АСВНП представляет собой сочетание нанохро-матографической системы, метода ионизации nano-ESI и времяпролетного анализатора
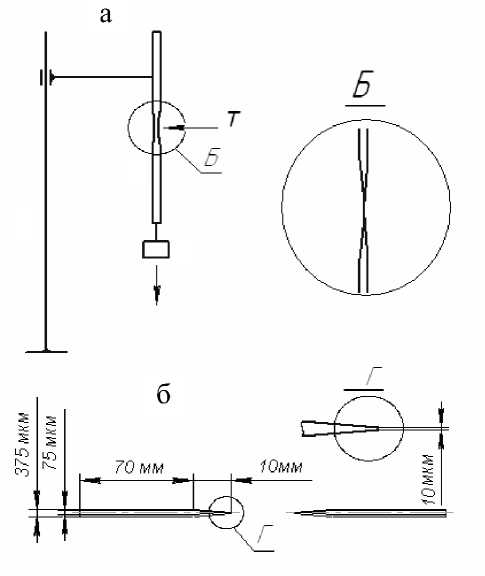
Рис. 1. Схема установки для получения капилляров с оттянутым носиком.
а — общая схема установки: капилляр с вытягивающим грузом в штативе под воздействием пламени газовой горелки Т ; б — капилляр
(АСВНП-nano-ESI-TOF), при котором хроматографическая колонка непосредственно используется в роли наноэмиттера, а сама система полностью удовлетворяет вышеперечисленным параметрам.
МАТЕРИАЛЫ И МЕТОДЫ
Насадочные колонки получали набивкой кварцевых капилляров (TSP075375, Polimicro Technologies) с ID = 75 мкм и OD = 375 мкм готовым коммерческим сорбентом Zorbax С18 (размер частиц 5–9 мкм в диаметре). Для удерживания сорбента в колонках применялось вытягивание конца капилляра под воздействием высокой температуры (рис. 1). Контроль диаметра выходящего отверстия колонки (рис. 1, б) проводился с помощью микроскопа, и этот диаметр был не более 3 мкм. Перед использованием сорбент промывали 3 раза
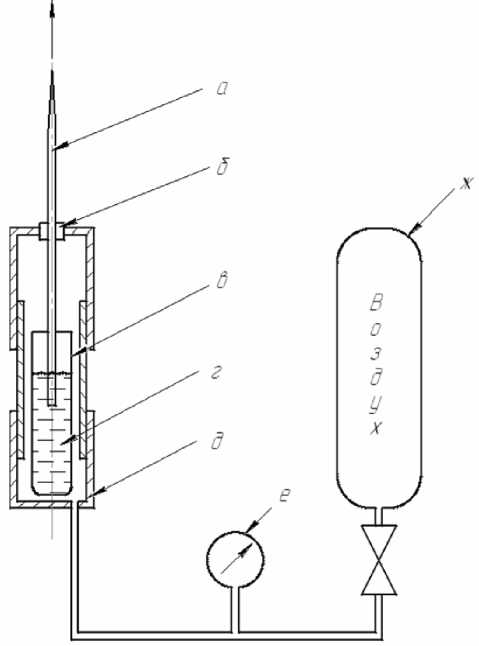
Рис. 2. Схема установки для набивки колонок гранулированным сорбентом.
а — капилляр, подготовленный для набивки гранулированным сорбентом; б — уплотнитель; в — виала, г — взвесь гранулированного сорбента (Zorbax C18) в 50 % ацетонитриле; д — корпус установки для набивки капилляров; е — манометр; ж — баллон со сжатым воздухом
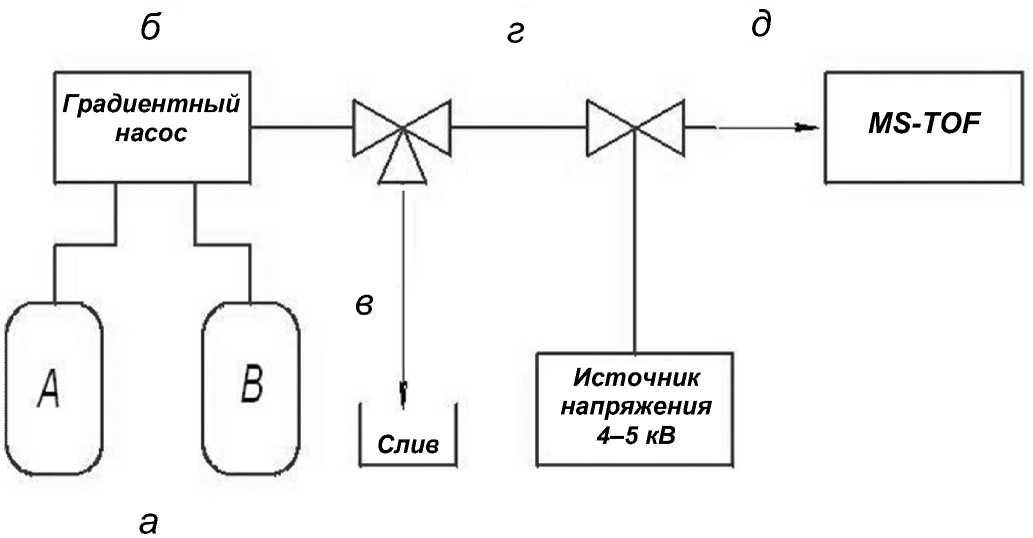
Рис. 3. Общая схема системы ввода наноколичества пробы (АСВНП) в масс-спектрометр МХ-5310.
а — растворители ( А , В ); б — насос; в — капилляр слива избытка растворителя; г — капилляр ввода образца в хроматографическую колонку; д — распыление пробы на входе масс-спектрометра
смесью вода—ацетонитрил (50:50) для удаления частиц менее 5 мкм. Набивка колонки проводилась в специально сконструированной установке (рис. 2). Установка представляет собой металлическую емкость, в которую подводился воздух под давлением 2 МПа. В это устройство помещалась виала, содержавшая взвесь сорбента в 50 % растворе ацетонитрила в воде. Капилляр погружался входным концом в виалу с взвесью сорбента, с помощью специального уплотнителя (PEAK) колонка зажималась в выходящем отверстии устройства. Под действием высокого давления жидкость с сорбентом поступала через колонку во вне установки, при этом частицы сорбента задерживались вытянутой частью капилляра, происходила набивка колонки. Далее полученная насадочная колонка промывалась 50 %-м раствором ацетонитрила в воде в течение 30 минут при скорости потока 200 мкл/мин и устанавливалась в систему ввода пробы в масс-спектрометр МХ-5310 (рис. 3).
Система ввода пробы состоит из резервуаров (а) растворителей (в качестве подвижной фазы использовались А — 0.25 % НСООН в воде и В — 0.25 % НСООН в ацетонитриле); градиентного насоса (б) со скоростью подачи растворителя 10 мкл/мин; капилляра для отвода избыточного потока растворителя (в); капилляра объемом 0.4 мкл для ввода образца в систему (г), заполненного на устройстве для заполнения колонок (в виалу вместо взвеси сорбента помещали образец) и полученной микроколонки (д) (рис. 1, б). Подведение напряжения порядка 4 кВ прямо в растворитель, подаваемый на колонку, обеспечивало распыление с эмиттера колонки на сопло масс-спектрометра МХ-5310.
Модельный хромато-масс-спектрометрический анализ проводили как с использованием описанной установки (АСВНП—МХ-5310), так и с использованием комплекса Милихром А02—МХ-5310. В качестве модельного объекта исследования был выбран триптический гидролизат БСА [8]. Количества наносимого на колонки гидролизата составили 200 пМ для комплекса Милихром А02—МХ-5310 и 1.8 пМ для комплекса АСВНП—МХ-5310. При использовании комплекса АСВНП—МХ-5310 спутный газ не подавался.
Анализ проводился в течение 10 мин в паре растворителей ацетонитрил—вода с линейным увеличением концентрации ацетонитрила в элюенте с 0 % до 70 %.
Спектры регистрировались с интервалом в 1 с в течение всего процесса хроматографирования.
Управление настройками и запись данных с масс-спектрометров проводили с помощью программы TOF control. Масс-спектры записывали с помощью программы TOF+ (программы разработаны в Лаборатории биомедицинской масс-спектрометрии ИАнП РАН [13, 16]). При этом регистрировалась величина общего ионного тока в зависимости от времени. Полученный график рассматривается как хроматограмма (зависимость интенсивности общего ионного тока от времени).
Обработку спектров проводили при помощи программного обеспечения TOF explorer v. 0.2 (ИАнП РАН). После определения центра масс масс-спектрометрических пиков к полученным данным был применен алгоритм разрешения зарядных и изотопных распределений IPEX (ИАнП РАН). Полученный список моноизотопных масс составляющих пробы был экспортирован в Excel для последующей интерпретации.
Поиск в базе SwisProt [11] осуществляли с помощью программного комплекса MASCOT [10] (Matrix Science, Великобритания), при этом использовали следующие параметры поиска: точность определения массы 50 ppm, возможные модификации — окисление метионина. Качество проведенного масс-спектрометрического анализа оценивали по степени идентификации БСА методом PMF (Peptide Mass Fingerprit) [9], являющимся наиболее распространенным при идентификации белков. Как критерии рассматривались следующие параметры:
-
• количество обнаруженных пептидов, принадлежащих БСА;
-
• процент перекрывания аминокислотной последовательности;
-
• достоверность идентификации (Score);
Для выяснения качественности проведения хроматографического анализа по полученным хроматограммам были определены параметры хроматографических пиков отдельных пептидов, такие как времена удерживания пептидов ( t r ), ширина пиков на полувысоте ( Wh ). Из их значений было рассчитано число теоретических тарелок (ЧТТ) и высота, эквивалентная теоретической тарелке (ВЭТТ), для капиллярной колонки [12, 13]:
N = 5.45(tr / Wh)2, где N — число теоретических тарелок (ЧТТ), определенное для конкретного соединения;
Табл. 1. Результаты по идентификации БСА после обработки данных LC-MS-анализа
H = L / N, где H — высота, эквивалентная теоретической тарелке (ВЭТТ); L — длина колонки.
Полученные величины усреднялись и нормализовались:
i
N cp = | E N i n \ ,
V i 7
где Ni — ЧТТ для каждого отдельного соединения;
n — число соединений;
N’ = 100 N / L, где N’ — приведенное ЧТТ для колонки длиной в 1 м.
Эти данные сравнивались с данными стандартных колонок HPLC с обращенной фазой. В частности, сравнение проводилось с колонками Pronto-sil 120-5C18 (2/75 мм, зернение сорбента 5мкм), поставляющимися к хроматографу Милихром А02.
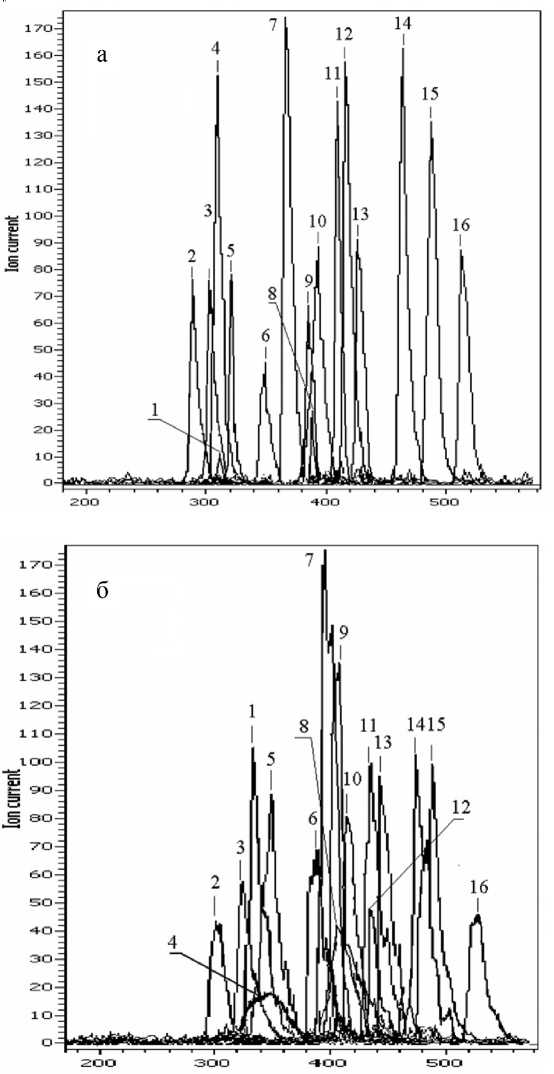
Рис. 4. Хроматограммы пептидов, принадлежащих БСА.
а — комплекс АСВНП—масс-спектрометр МХ-5310.
б — тандем Милихром А02—масс-спектрометр МХ-5310.
Пептиды, соответствующие хроматографическим пикам, представлены в табл. 2
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
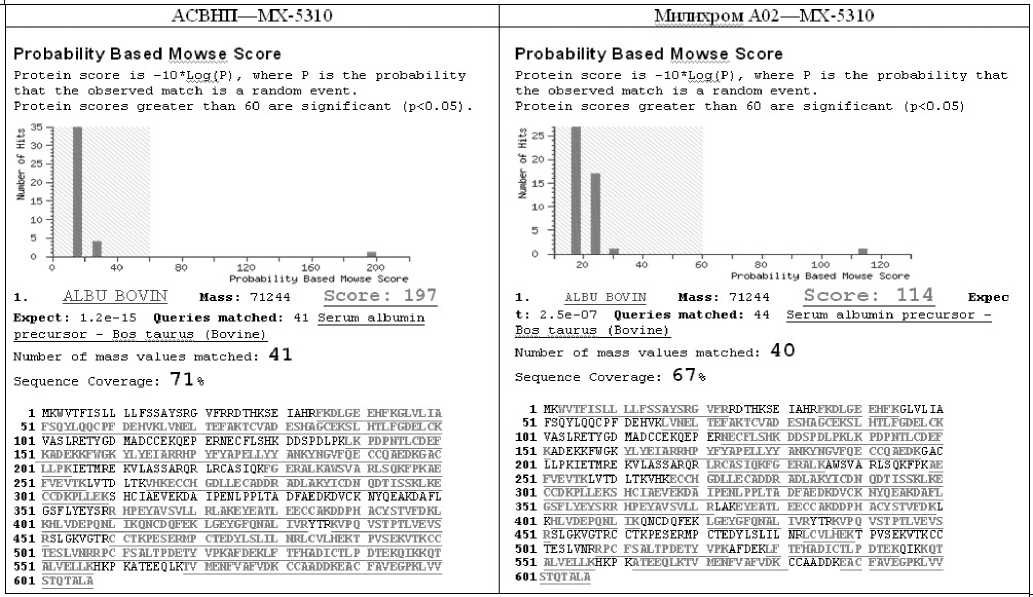
Для выяснения основных параметров полученных капиллярных колонок, входящих в состав системы ввода наноколичества пробы, был проведен тестовый хромато-масс-спектрометрический анализ смеси триптических пептидов альбумина при помощи комплексов АСВНП—МХ-5310 и Милихром А02—МХ-5310. В первую очередь проводилось сравнение полученных масс-спектрометрических данных по критериям, перечисленным выше. Результаты представлены в табл. 1. Как показано в таблице, качество анализа, проведенного с помощью комплекса АСВНП—МХ-5310 превышает качество анализа на комплексе Мили-хром А02—МХ-5310 по всем критериям, и особенно в надежности идентификации. Затем из числа пептидов, отнесенных к БСА, были выбраны те, которые надежно воспроизвелись в обоих экспериментах. Из хроматограммы общего ионного тока были выделены пики, соответствующие выходу каждого выбранного пептида (рис. 4, табл. 2), и затем для каждого пика рассчитывались основные характеристики используемых колонок (табл. 3).
По результатам, представленным в табл. 3, видно, что при применении капиллярной колонки полуширина пиков уменьшается в среднем в 2 раза, соответственно во столько же повышается эффективность колонки для каждого пептида. Высота, эквивалентная теоретической тарелке, для капиллярной колонки составила 2.7 мкм, для Prontosil 120-5C18 — 13 мкм. Приведенные эффективности составили 2.8 · 105 и 0.7 · 105 ЧТТ/м для капиллярной колонки и Prontosil 120-5C18 соответственно (табл. 4).
Табл. 2. Общие идентифицированные пептиды сывороточного альбумина быка и времена их удерживания
|
№ пика |
Время удерживания t r , с |
Молекулярная масса, Да |
Аминокислотная последовательность |
|
|
Мили-хром А02 |
АСВНП |
|||
|
1 |
338 |
281 |
688.3656 |
AWSVAR |
|
2 |
307 |
312 |
1462.5817 |
TCVADESHAGCEK |
|
3 |
332 |
305 |
1531.7738 |
LKECCDKPLLEK |
|
4 |
348 |
310 |
1442.6347 |
YICDNQDTISSK |
|
5 |
359 |
321 |
1248.6139 |
FKDLGEEHFK |
|
6 |
387 |
352 |
1001.5757 |
LVVSTQTALA |
|
7 |
398 |
365 |
1304.7088 |
HLVDEPQNLIK |
|
8 |
407 |
389 |
926.4861 |
YLYEIAR |
|
9 |
405 |
382 |
1638.9305 |
KVPQVSTPTLVEVSR |
|
10 |
414 |
393 |
1438.8045 |
RHPEYAVSVLLR |
|
11 |
434 |
411 |
1141.7070 |
KQTALVELLK |
|
12 |
435 |
422 |
1418.6864 |
SLHTLFGDELCK |
|
13 |
442 |
431 |
1162.6234 |
LVNELTEFAK |
|
14 |
480 |
464 |
1478.7881 |
LGEYGFQNALIVR |
|
15 |
492 |
489 |
1723.8273 |
MPCTEDYLSLILNR |
|
16 |
530 |
520 |
2491.2570 |
GLVLIAFSQYLQQCPFDEHVK |
Табл. 3. Числа теоретических тарелок для набивной капиллярной колонки и колонки Prontosil 120-5C18, определенные по отдельным пикам
|
№ пика |
АСВНП—МХ-5310 (набивная капиллярная колонка) |
Милихром А02—МХ-5310 (колонка Prontosil 120-5C18) |
||||||
|
t r , с |
W h , с |
ЧТТ |
ЧТТ ср. |
t r , с |
W h , с |
ЧТТ |
ЧТТ ср. |
|
|
1 |
281 |
7 |
8782.397 |
13812.3 |
338 |
10 |
6226.298 |
5363.51 |
|
2 |
312 |
7 |
10827.04 |
307 |
14 |
2620.699 |
||
|
3 |
305 |
7 |
10346.66 |
332 |
12 |
4171.672 |
||
|
4 |
310 |
8 |
8183.516 |
348 |
32 |
644.5477 |
||
|
5 |
321 |
7 |
11460.68 |
359 |
15 |
3121.784 |
||
|
6 |
352 |
8 |
10551.2 |
387 |
14 |
4164.495 |
||
|
7 |
365 |
8 |
11344.94 |
398 |
14 |
4404.601 |
||
|
8 |
389 |
7 |
16830.6 |
407 |
24 |
1567.339 |
||
|
9 |
382 |
8 |
12426.34 |
405 |
12 |
6207.891 |
||
|
10 |
393 |
8 |
13152.3 |
414 |
12 |
6486.863 |
||
|
11 |
411 |
8 |
14384.68 |
434 |
12 |
7128.751 |
||
|
12 |
422 |
8 |
15164.97 |
435 |
9 |
12731.81 |
||
|
13 |
431 |
8 |
15818.71 |
442 |
11 |
8799.453 |
||
|
14 |
464 |
8 |
18333.8 |
480 |
14 |
6406.531 |
||
|
15 |
489 |
8 |
20362.65 |
492 |
16 |
5153.316 |
||
|
16 |
520 |
8 |
23026.25 |
530 |
16 |
5980.098 |
||
Как известно, коэффициент разбавления в жидкостной хроматографии пропорционален длине колонки и квадрату ее диаметра. Для капиллярной колонки в связи с уменьшением ее диаметра концентрация компонента возрастает, что соответственно приводит к увеличению чувствительности обнаружения: концентрация определяемого компонента в максимуме пика примерно в 100 раз больше, чем для обычных колонок HPLC [19, 20]. При этом в новой системе практически автоматически происходит удаление мертвой зоны, всегда существующей в хроматографической системе, а также имеет место уменьшение времени анализа и как следствие — значительное уменьшение ширины пиков и увеличения разрешающей способности системы. Все перечисленные достоинства новой системы ввода пробы имеют особое значение при анализе сложных смесей биополимеров. К тому же наряду с набитой колонкой может быть также использован незаполненный капилляр, что позволяет проводить анализ в изократическом режиме без сложных манипуляций по отключению хроматографа. И наконец, при использовании для анализа новой системы ввода пробы исчезает потребность в напуске спутного газа даже при распылении водных растворов образцов.
Таким образом, резюмируем.
-
1. Разработана новая система ввода наноколичества пробы с набивной капиллярной колонкой (АСВНП), существенно расширяющая возможности уникального российского времяпролетного масс-спектрометра МХ-5310 при анализе биологических проб.
-
2. Система ввода отличается простотой исполнения, очень экономична в использовании растворителей и других расходных материалов, не нуждается в дополнительной системе поддува спутного газа для стабилизации распыления.
-
3. В разработанной системе непосредственно хроматографическая капиллярная колонка используется в качестве наноэмиттера, что приводит к уменьшению количества приборных узлов и снижает неизбежные потери анализируемых образцов.
-
4. Хроматографические параметры капиллярной колонки превышают параметры отечественных колонок, используемых в современной высокоэффективной жидкостной хроматографии.
-
5. Использование АСВНП при масс-спектрометрическом анализе позволяет значительно повысить качество получаемых результатов.
-
6. Использование АСВНП позволяет решить задачу анализа сверхмалых проб (пикоколичеств веществ), характерных для реальных задач работы с материалом, выделяемым из биологического сырья.
-
7. Система АСВНП легко тиражируется и может быть использована в масс-спектрометрах других типов аналогичного назначения.
Табл. 4. Сравнительные характеристики систем Милихром А02—МХ-5310 (колонка Prontosil 120-5C18) и АСВНП—МХ-5310 (набивная капиллярная колонка)
|
Характеристики |
Милихром А02—МХ-5310 (колонка Prontosil 120-5C18) |
АСВНП—МХ-5310 (набивная капиллярная колонка) |
|
Объем пробы |
50 мкл |
0.4 мкл |
|
Количество вещества, содержащегося в пробе |
200 пМ |
1.8 пМ |
|
Скорость потока подвижной фазы |
150 мкл/мин |
~100–200 нл/мин |
|
Нагрев спутного газа |
Требуется |
Спутный газ не используется |
|
ЧТТ ср. колонки |
5363.51 |
13812.3 |
|
Высота, эквивалентная теоретической тарелке |
13 мкм |
2.7 мкм |
|
Приведенная эффективность колонки |
0.7∙105 ЧТТ/м |
2.8∙105 ЧТТ/м |
|
Коммерческие преимущества |
Возможность приобрести коммерческий готовый продукт |
|


