Разработка способов повышения эффективности химиотерапии на основе малых интерферирующих РНК
Автор: Бавыкин А.С., Коротаева А.А., Сырцев А.В., Карпухин А.В., Тюляндин С.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Развитие лекарственной терапии
Статья в выпуске: 2 т.2, 2012 года.
Бесплатный доступ
Появление в последние 10-15 лет химиопрепаратов нового поколения позволило значительно улучшить показатели выживаемости для онкологических больных. Однако злокачественные опухоли многих пациентов, получающих химиотерапию, оказываются нечувствительными к проводимому лечению. Другой проблемой большинства современных химиотерапевтических препаратов является высокая степень проявления побочных, токсических реакций для организма. Следует также отметить высокую стоимость и длительность лечения. В связи с этим как в нашей стране, так и за рубежом активно ведется поиск альтернативных лечебных подходов, способных, если не заменить, то хотя бы усилить чувствительность опухоли к проводимому стандартному лечению.
Интерферирующие рнк, таргетная терапия
Короткий адрес: https://sciup.org/14045419
IDR: 14045419
Текст научной статьи Разработка способов повышения эффективности химиотерапии на основе малых интерферирующих РНК
Описанное около 15 лет назад явление РНК интерференции приобретает в настоящее время все более широкое применение в биомедицине. Сущность этого механизма заключается в существовании внутриклеточного механизма, регулирующего уровень экспрессии большинства генов посредством экспрессии малых интерферирующих РНК (иРНК), комплиментарных мРНК данных генов. Малые РНК представляют собой короткие одноцепочечные молекулы, которые включаются в белковый комплекс RISC (RNA-induced silencing complex), в составе которого взаимодействуют с мРНК - «мишенями». Эти события приводят к подавлению экспрессии (сайленсингу/нокдауну) соответствующего гена. После того, как Крейг Мелло и Эндрю Файер в 1998 году показали возможность активации данного механизма in vitro посредством экзогенных антисмысловых РНК, данное направление сразу получило широкое распространение в экспериментальной биологии. Экзогенная РНК интерференция стала удобным методом для целого ряда исследований - таких, как изучение взаимодействия молекул в сигнальных путях, изучение механизмов дефицита белка, путем направленного выключения его экспрессии, выявление потенциальных генов-мишеней, подавление экспрессии которых может приводить к ингибированию патологических процессов и т.д. Использование иРНК, которые эффективно ингибируют синтез генов, может оказаться весьма перспективным для создания новых противоопухолевых терапевтических конструкций.
ИНТЕРФЕРИРУЮЩИЕ РНК И ЛЕКАРСТВЕННАЯ ТАРГЕТНАЯ ТЕРАПИЯ
Таргетная терапия в онкологии в настоящее время уже активно используется на практике, разрабатываются схемы лечения с включением таргетных препаратов. За последние два десятилетия выявлено несколько десятков потенциальных мишеней для раковых заболеваний, в то время как крупные коммерческие корпорации, такие как Roche, Novartis, Bayer, Astra Zenekа и др. обладают внушительным набором таргетных препаратов, постепенно реализуемых на рынке. Терапевтические мишени представлены достаточно широким спектром белков различных семейств, которые тем или иным способом вовлечены в процессы онкогенеза, такие как: тирозиновые киназы (ABL в составе химерного Bcr-Abl гена при хроническом миелобластном лейкозе ^ препарат Gleevek/Imatinib/SΤΙ^571); рецепторы к факторам роста (препараты Gefinib, Erlotinib, Cetuximab, ингибирующие работу рецептора эпидермального фактора роста; Араtinib ^ сeлeк-тивный ингибитор VEGF2, а такжe моноклональ-ноe антитeло бeвацизумаб, блокирующee фактор роста эндотeлия сосудов при ракe толстой кишки, легких и молочной железы; Тrastuzumab ^ моноклональное антитело к рецептору HER2 ^ при раке молочной железы); белки из системы репарации ДНК (PARР ингибитор Іniparib, PARP); ͷʜгибиторы апоптоза (ABТ-737 ^ против Bcl-xL и Bcl-w при лимфоме); JAK1,2,3 киназы (Lestaurtinib ^ против ЈАΚ2, при остром миелолейкозе) и некоторые другие.
Какие же преимущества по сравнению с моноклонами и малыми молекулами представляют макромолекулы ^ интерферирующие РНК?
В качестве аналогов разрабатываемого средства могут быть рассмотрены имеющиеся препараты для таргетной терапии. В своем большинстве такие препараты являются антителами к белкам, кодируемым генами. Такие антитела являются инородными для организма веществами, имеют неполную специфичность и обладают большими размерами, затрудняющими их доставку к белку-мишени. Указанные свойства приводят к значительным побочным эффектам и недостаточной эффективности имеющихся тар-гетных препаратов. В противоположность этому, иРНК ^ природные вещества, функционирующие в клетках человека (и других млекопитающих). Искусственно введенные иРНК не будут инородными для организма веществами. Как природные, так и синтезированные иРНК, обладают абсолютной специфичностью, позволяющей воздействовать именно на те гены, функция которых должна быть ингибирована. Они имеют малые размеры, облегчающие их эффективную доставку в раковую клетку. Кроме того, иРНК прерывают процесс функционального проявления генов на более ранней стадии, до синтеза белков, количество которых значительно больше, чем матричной РНК. Вследствие этого требуются меньшие количества вводимых в организм больного веществ. Природа иРНК позволяет размножать их с помощью генно-инженерных векторов. Это свойство позволяет создавать и поддерживать в злокачественной клетке необходимую концентрацию терапевтической иРНК вплоть до гибели клетки. В свою очередь, разработанная конструкция вектора позволяет экспрессировать нужную иРНК именно в опухолевой клетке, что минимизирует побочное воздействие на другие органы и ткани организма. Совокупность описанных выше свойств иРНК позволяет создать на их основе новые, более эффективные и обладающие меньшим побочным действием, по сравнению с имеющимися в настоящее время препаратами, противоопухолевые средства.
ПОИСК МИШЕНЕЙ ДЛЯ ИРНК
Общепринятого единого подхода, ориентированного на выявление мишеней иРНК на сегодняшний день не существует. Каждая исследовательская группа разрабатывает и применяет свой собственный подход или поисковый алгоритм. Собственно иРНК, как и другие типы таргетной терапии, могут быть нацелены на одни и те же мишени. Хотя, как показывает практика, применение иРНК против одной мишени существенного успеха не приносит. По анализам наших собственных и зарубежных данных порог клеточной гибели при подавлении экспрессии какого-то одного гена в среднем не превышает 30-40%, в то время как приблизительно столько же клеток гибнет при использовании терапевтических доз стандартной химиотерапии для резистентных клеточных линий. Гораздо более удачным образом выглядит комбинированный нокдаун.
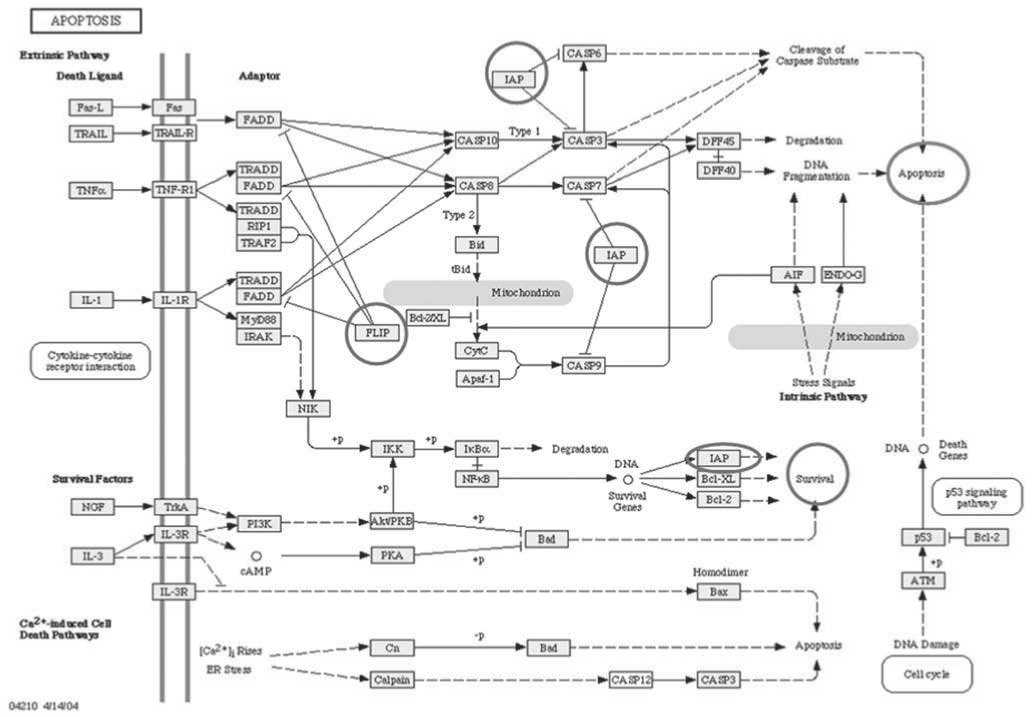
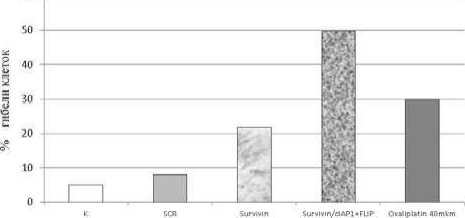
Говоря о наших исследованиях, мы использовали иРНК, направленные на подавление генов, которые в схеме регуляции апоптоза (рис. 1) при раке толстой кишки играют ключевую роль. Объектом исследования служили клетки рака толстой кишки, устойчивые к действию оксалиплатина. Выбранные мишени для иРНК из числа ингибиторов каспаз: FLIP (каспаза 8), cI^P1^ Survivin (каспазы 3, 9). Ингибиторы каспаз блокируют апоптоз (красный контур) и приводят к выживанию клетки (зеленый контур). Апоптотиче-ская гибель клеток в данном эксперименте (рис. 2) в результате ингибирования генов ^ мишеней с помощью иРНК сопоставлялась с уровнем гибели клеток, вызванного обработкой дозой оксалиплатина высокой чувствительности (40мкм). Комбинированное воздействие представляло собой трансфекцию клеток с помощью свободных анти ^ Survivin иPНК и двух экспрессирующихся анти ^ cI^P1 и FLIP иPНК в составе экспрессионных векторов. Инкубация клеток с иPНК проводилась в течение 48 часов, при этом сочетанный нокдаун оказался в два раза более эффективным по сравнению с одиночным ингибированием.
Хорошие результаты дают походы, учитывающие определенный механизм, запускающийся в ответ на специфическую химиотерапию. Примером такого механизма может служить специфическая индукция экспрессии гена Gr^78, под воздействием на клетку ингибиторов гистоновых ацетилаз (Wang J et al, 1999). В отношении Grp78 известно, что он гиперэкспрессирован во многих типах рака и блокирует процесс деградации нативной структуры белков, вызываемый эндоплазматическим стрессом в результате внешних стрессовых воздействий (ультрафиолета, повышения температуры, использования химиоте- рапии, нарушения глюкозного обмена). Спустя 10 лет группа Baumeister et al, 2009, показала, что ингибиторы гистоновых ацетилаз, например, разрешенный к клиническому применению противопухолевый препарат, vorinostat (Zolinza®) также активируют Grp78 в опухолевых клетках. При этом выключение экспрессии данного гена с помощью иРНК совместно с назначением ингибиторов гистоновых ацетилаз демонстрирует синергичный противоопухолевый эффект. Наши собственные исследования по гипертермии на клетках рака толстой кишки, показали троекратное усиление чувствительности клеток к нагреванию при 42 0С при подавлении гена Grp78/HspA5 с использованием иРНК.
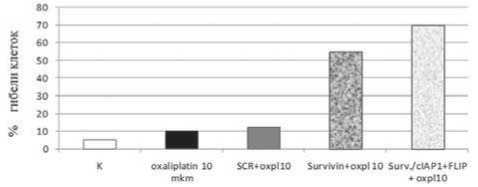
Многие исследователи используют комбинацию иРНК на фоне стандартной химиотерапии, используемой в существенно меньших дозировках. В качестве наглядного примера можно привести исследование Longley et al, 2006, в котором авторы ингибировали экспрессию гена FLIP в присутствии малых (1-5 мкм) доз оксалиплатина, циплатина и 5ʼ- флуорацила. Исследования, проводимые нашей группой, также показывают воз- можность преодоления резистентности к химиотерапии посредством малых доз оксалиплатина в комбинации с иРНК. Нокаут гена FLIP в присутствии 10мкм оксалиплатина приводил к 55% апоптотической гибели клеток по сравнению с 12% гибели в присутствии только оксалиплатина. Комбинация анти -Survivin иРНК и векторов экспрессирующих анти - FLIP и cIAPl иРНК в присут-cтвии 10 мкм оксалиплатина увеличивала в 6 раз чувствительность клеток к противоопухолевому препарату (Pис. 3).
В последние несколько лет предпринимались неоднократные попытки масштабированных подходов для анализа генов, экспрессия которых связана с действием химиотерапии. Это в основном работы, выполненные с использованием микрочипов. Однако выяснилось, что полученные данные очень трудно сопоставить между собой, поскольку разными авторами использовались препараты разных концентраций с индукцией апоптоза на разных стадиях.
Так, например, группой Meynard D et al , 2007 был проведен скрининг генов, ассоциированных с оксалиплатином на 6 клеточных линиях рака
Рис. 1. Схема регуляции апоптоза (источник ^p/kegg/pathway/hsa/.
толстой кишки с использованием микрочипа фирмы Клонтек (Atlas Plastic Human 8K Microarray from Clontech). В результате было выявлено 394 гена, экспрессия которых коррелировала с оксалиплатином. Эти гены авторы попытались сопоставить с 254 генами, выявленными в результате подобного исследования, проведенной группой Arango et al,(2004). Авторы проводили микрочи-повый экспрессионный анализ на 30 линиях рака толстой кишки. В результате сопоставления был выявлен 1 совпадающий ген.
Интересно также привести пример масштабной работы Harradine K.A. et al , (2011) с использованием иРНК ^ библиотек. В ходе этой работы проводился поиск генов, выключение работы которых усиливало бы цитотоксичность. Авторы провели сравнительный нокаут 500 генов с использованием иРНК в присутствии разных доз оксалиплатина (1-35 мкм). В результате было выявлено 27 генов, подавление которых приводило к повышению чувствительности опухолевых клеток к оксалиплатину в концентрации 1,5 мкм. В это число входили главным образом гены из семейства репарации ДНК: MCM4 , MBD3 , NHEJ1 , BRIP1 и др., а также TNFR - суперсемейства ( LTBR , lymphotoxin-b receptor, который отвечает за стимуляцию сигнального путͷ ΝF-kB). Хотя показатели усиления чувствительности оказались не очень значительными (не более, чем в два раза), в подобного рода исследованиях эффективность ингибирования зависит от большого количества факторов, включая качество подобранной структуры самих иРНК, подбор способа защиты от де-градаци (Jonathan K et al , 2008), эффективность доставки в клетки, условия культивирования клеток и т.д. Исследования подобного рода оказываются очень трудоемкими, а главное, не совсем
Рис. 2. Апоптоз раковых клеток толстой кишки НТ-29 при одиночном и комбинированном подавлении экспрессии генов ^ мишеней с использованием иРНК. (К) ^ клетки не обработанные оксалиплатином, SCR ^ scrambled, иРНК со случайной последовательностью нуклеотидов.
понятно, каким образом можно использовать полученные данные для выбора потенциальных мишеней для терапии.
Наша группа использовала специальный алгоритм, позволяющий выявить гены, активирующиеся не случайным образом в ответ на воздействие противоопухолевого препарата, а непосредственно связанные с устойчивостью к оксалиплатину при раке толстой кишки. В результате были выявлены два гена. Их комбинированное подавление в присутствии 5 мкм оксалиплатина привело к семикратному увеличению чувствительности клеток к данному химиопрепарату.
НОСИТЕЛИ иРНК
Другим преимуществом иРНК является возможность их экспрессии в составе векторов, что дает возможность сводить к минимуму многократное введение препарата. Вектор, попадая внутрь опухолевой клетки синтезирует иРНК в значительное количество длительное время. Разумеется, подобный вариант «генной терапии» не является абсолютно надежным. Попытки лечить заболевания путем введения терапевтических генов в составе векторов уже неоднократно предпринимались. Наиболее известными являются клинические исследования на пациентах с глиомой, которым вводили векторные конструкции на основе аденовируса, экспрессировавшего фермент вируса герпеса ^ тимидинкиназу. В дальнейшем, при лечении с использованием ганцикловира, содержащие данную конструкцию клетки погибали в результате превращения ганцикловира посредством тимидинкина-зы в токсичное соединение, которое блокирует транскрипцию ДНК (Chen SH etal , 1994; Goodman et al , 1996; Germano I.M. et al , 2003). Основным недостатком подобных векторов является побочная цитотоксичность, связанная с попаданием вектора в нормальные клетки. Для преодоления подобных эффектов постоянно разрабатываются современные вектора, обладающие свойствами избирательной доставки и специфичной экспрессии в клетках опухоли.
С развитием биотехнологии в качестве альтернативы вирусным конструкциям постепенно приходят наноносители на основе липосом. Наиболее часто оболочка таких носителей создается с использованием ПЭГ (полиэтилен гликоля). Гидрофильность ПЭГ создает водное микроокружение возле поверхности наночастиц, тем самым снижая степень опсонизации и последующее распознавание мононуклеарными клетками фагоцитарной системы, что значительно продлевает период существования частиц в кровотоке (Gomes-da-Silva LC et al, 2012). В мировой практике уже имеется опыт использования липосом-ных наночастиц для ингибирования экспрессии гена Bcl2 с использованием иРНК (Santos A.O. et al, 2010).
В этой работе авторы использовали наночастицы на основе СеrC16^PEG2000 (полиэтилен гликоля и церамидных остатков, для снижения реакции IgМ и IgG на ПЭГ). С целью достижения большей специфичности также используют наночастицы с поверхностным антителом для взаимодействия с опухолевыми антигенами. Подобный подход был, в частности, успешно использован группой Di Paolo D. et al , (2011), которые использовали ПЭГ ^ наночастицы с антителом (иммунолипосомы) против GD2 (disialoganglioside, специфически экспрессирующийся в опухолях нейроэктодермального происхождения). Эти наночастицы служили носителями иРНК против гена АLK в клетках нейробластомы. Как показала практика, иммунный ответ на ПЭГ в ряде случаев оказывается весьма существенным, что снижает эффективность подавления мишени. Для преодоления этой реакции используют иРНК доставку на основе менее иммуногенных носителей, например ПЭИ (полиэтилениминов) (Günther M et al , 2011).
В последнее время появляются работы, демонстрирующие возможность комбинированного воздействия химиотерапевтических препаратов в малых дозах, помещенных внутрь мицелл совместно с иРНК, прикрепленными к их поверхности (Zhu C et al , 2010; Su WP et al , 2012). Так, например, в работe Hsu C-Y. et al , (2011) описы-вaeтся достаточно простой способ изготовлeния кополимepa полиэтилeʜ гликоль ^ поликапролактон ^ полиэтилeʜeмина с инкапсулировани-eм пpeпарата паклитакceла и прикpeплeниeм к повepxʜocти мицeллы иРНК к гeʜy MDR-1 . Ис-слeдования проводились на клeтках рака лeгко-
Pис. 3. Усиление чувствительности клеток к малым дозам оксалиплатина в результате иРНК ^ нокдауна в различных комбинациях. Κ ^ клетки не обработанные оксалиплатином, SCR ^ scrambled иPHК.
го MCF-7/ADR, устойчивых к доксорубицину. При этом ʜe было выявлeно цитотоксичности при трансфeкции клeток данным кополимeром, при совмeсном ввeдeнии с паклитакceлом он в два раза увeличивал цитотоксиность послeдʜeго.
В настоящeй работe в качecтвe cpeдств доставки иРНК использованы в основном липосомы, как наиболee совepшeʜʜый ʜa ceгодняшний дeʜь носитeль. Однако нашeй группe в тeчeниe послeдних двух лeт работы удалось получить экспpeссионный вeктор, направлeʜʜый на по-давлeниe гeнов мишeʜeй, который содepжит ткaʜecпeцифичный промотор, что приводит к eго избиратeльной экспpeссии в опухолeвых клeтках. Подавлeниe таргeтного гeнa с использо-ваниeм данного промотора в 10 раз пpeвышaeт подавлeниe того жe гeнa в присутствии стандартного H1 промотора, использующeгося во многих коммepчecких вeкторах.
ЗАКЛЮЧEHͶE
B peɜyльтатe соврeмeʜʜых пpeдставлeний об онкогeʜeɜe открываются новыe возможности тepaпии злокачecтвeʜʜых опухолeй. Интepфeри-рующиe PHК остаются интpecʜым направлeниeм избиратeльного выключeния ключeвых гeнов-мишeʜeй в опухолeвой клeткe. В настоящий мо-мeʜт покa eщe остаются ʜeясными пepcпeктивы использования иРНК в качecтвe противоопухолe-вой тepaпии. Есть надeжда, что новeйшиe био-тeхнологичecкиe peшeния с использованиeм иРНК могут в значитeльной стeпeни усилить чув-ствитeльность опухолeй к классичecким цитостатикам и рeшить проблeму лeкарствeнной устойчивости.
Список литературы Разработка способов повышения эффективности химиотерапии на основе малых интерферирующих РНК
- Arango D, Wilson AJ, Shi Q, Corner GA, Arañes MJ, Nicholas C, Lesser M, Mariadason JM, Augenlicht LH. Molecular mechanisms of action and prediction of response to oxaliplatin in colorectal cancer cells. Br J Cancer. 2004 Nov 29;91(11):1931-46
- Baumeister P, Dong D, Fu Y, Lee AS. Transcriptional induction of GRP78/BiP by histone deacetylase inhibitors and resistance to histone deacetylase inhibitor-induced apoptosis. Mol Cancer Ther. 2009 May;8(5):1086-94
- Chen SH, Shine HD. Gene therapy for brain tumors: regression of experimental gliomas by adenovirus-mediated gene transfer in vivo. 1994, Proc Natl Acad Sci USA 91(8):3054-3057
- Chowdhury S, Chester KA, Bridgewater J, Collins MK, Martin F. Efficient retroviral vector targeting of carcinoembryonic antigen-positive tumors. Mol Ther. 2004 Jan;9(1):85-92
- Di Paolo, D.; Brignole, C.; Pastorino, F.; Carosio, R.; Zorzoli, A.; Rossi, M.; Loi, M.; Pagnan
- G.; Emionite, L.; Cilli, M.; Bruno, S.; Chiarle, R.; Allen, T. M.; Ponzoni, M.; Perri, P
- Neuroblastoma-targeted nanoparticles entrapping siRNA specifically knockdown ALK. Mol
- Ther. 2011, 19, 1131-40
- Jonathan K. Watts, Glen F. Deleavey and Masad J. Damha Chemically modified siRNA: tools and applications, Drug Discov Today. 2008 Oct;13 (19-20):842-55
- Harradine K.A., Kassner M., Chow D., Aziz M., Von Hoff D.D., Baker J.B., Yin H, and Pelham R.J. Functional Genomics Reveals Diverse Cellular Processes That Modu-late Tumor Cell Response to Oxaliplatin. Mol Cancer Res 2011; 9:173-182
- Hsu C.Y., Hsiao J.P., Shieh M.J., Lai P.S. siRNA and Paclitaxel Loaded PEG-PCL-PEI Tri-block Polymeric Micelle for Gene and Chemo-therapy Applications in Multidrug-resistance cancer cell. Nanotech 2011 Vol. 3 p225-228
- Germano I.M, Fable J., Gultekin S.H., Silvers A. Clinical Study Adenovirus/herpes simplex-thymidine kinase/ganciclovir complex:preliminary results of a phase I trial in patients with recurrent malignant gliomas. Journal of Neuro-Oncology 65: 279-289, 2003
- Gomes-da-Silva LC, Fonseca NA, Moura V, Pedroso de Lima MC, Simões S, Moreira JN. Lipid-based nanoparticles for siRNA delivery in cancer therapy: paradigms and challenges. Acc Chem Res. 2012 Jul 17;45(7):1163-71
- Goodman JC, Trask TW. Adenoviral-mediated thymidine kinase gene transfer into the primate brain followed by systemic ganciclovir: pathologic, radiologic, and molecularstudies. Hum Gene Ther 7(10): 1241-1250, 1996
- Günther M, Lipka J, Malek A, Gutsch D, Kreyling W, Aigner A. Polyethylenimines for RNAi-mediated gene targeting in vivo and siRNA delivery to the lung. Eur J Pharm Biopharm. 2011 Apr; 77(3):438-49
- Liang H., Zhang J, Shao C, Zhao L., Xu W., Suther-land L.C., Wang K. Differential Expression of RBM5, EGFR and KRAS mRNA and protein in non-small cell lung cancer tissues. Journal of Experimental & Clinical Cancer Research April 2012, 31:36
- Longley DB, Wilson TR, McEwan M, Allen WL, Mc-Dermott U, Galligan L and Johnston PG. c-FLIP inhibits chemotherapy-induced colorectal cancer cell death. Oncogene (2006) 25, 838-848
- Pfeifer A, Kessler T, Silletti S, Cheresh DA, Verma IM: Suppression of angiogenesis by lentiviral delivery of PEX, a noncatalytic fragment of matrix metalloproteinase 2. Proc Natl Acad Sci USA 2000, 97:12227-12232
- Samimi G, Manorek G, Castel R, Breaux JK, Cheng TC, Berry CC, Los G, Howell SB. cDNA microarray-based identification of genes and pathways associated with oxaliplatin resistance. Cancer Chemother Pharmacol. 2005 Jan; 55(1):1-11
- Santos, A. O.; da Silva, L. C.; Bimbo, L. M.; de Lima, M. C.; Simoes, S.; Moreira, J. N
- Design of peptide-targeted liposomes containing nucleic acids. Biochim. Biophys. Acta
- 2010, 1798, 433-41
- Su WP, Cheng FY, Shieh DB, Yeh CS, Su WC. PLGA nanoparticles codeliver paclitaxel and Stat3 siRNA to overcome cellular resistance in lung cancer cells, International Journal of Nanomedicine, 2012 Volume 2012:7 Pages 4269 -4283
- Szécsi J, Drury R, Josserand V, Grange MP, Boson B, Hartl I, Schneider R, Buchholz CJ, Coll JL, Russell SJ, Cosset FL, Verhoeyen E. Targeted retroviral vectors displaying a cleavage site-engineered hemagglutinin (HA) through HA-protease interactions. Mol Ther. 2006 Nov;14(5):735-44
- Tandle A, Blazer DG 3rd, Libutti SK. Antiangiogenic gene therapy of cancer: recent developments.J Transl Med. 2004 Jun 25;2(1):22
- Waehler R, Russell SJ, Curiel DT. Engineering targeted viral vectors for gene therapy. Nat Rev Genet. 2007 Aug; 8(8):573-87
- Wang J, Bown C, Young L. Differential display PCR reveals novel targets for the mood-stabilizing drug valproate including the molecular chaperone GRP78. Mol Pharmacol 1999; 55: 521-7
- Zhu C, Jung S, Luo S, Meng F, Zhu X, Park TG, Zhong Co-delivery of siRNA and paclitaxel into cancer cells by biodegradable cationic micelles based on PDMAEMA-PCL-PDMAEMA triblock copolymers. Biomaterials, 2010 Mar; 31(8):2408-16


