Разработка способов производства биологических средств на основе энтомофагов для использования в защите лесов
Автор: Сергеева Ю.А., Долмонего С.О., Загоринский А.А.
Журнал: Лесохозяйственная информация @forestry-information
Рубрика: Чтения памяти андрея игнатьевича ильинского
Статья в выпуске: 1, 2025 года.
Бесплатный доступ
Разработка способов массового разведения энтомофагов является первым этапом создания биологических средств защиты лесов на основе паразитических насекомых, эффективно регулирующих численность вредителей лесов в природных очагах их массового размножения. Разработан способ разведения яйцееда Ooencyrtus kuvanae - специализированного паразитоида непарного шелкопряда. Замачивание прошедших диапаузу яиц Lymantia dispar в растворе уксусной кислоты позволяет исключить трудозатраты на лабораторное разведение насекомого-хозяина и проводить наработку биологического средства против непарного шелкопряда. Приведены результаты разведения Trichogramma evanescens и T. semblidis, выведенных из яиц звездчатого пилильщика-ткача Acantholyda posticalis.
Паразитоиды, массовое разведение, биологические средства защиты лесов
Короткий адрес: https://sciup.org/143184115
IDR: 143184115 | УДК: 630.411 | DOI: 10.24419/LHI.2304-3083.2025.1.01
Текст научной статьи Разработка способов производства биологических средств на основе энтомофагов для использования в защите лесов
В последние годы в России возрастают требования к качеству мероприятий по сохранению лесов, повышению их биологического разнообразия и устойчивости [1]. Задачи по разработке экологически безопасных современных технологий защиты лесов определены рядом стратегических документов Российской Федерации [2–4]. Применение энтомофа-гов – одно из актуальных направлений развития экологически безопасных способов защиты лесов, обеспечивающих выполнение работ по профилактике возникновения и локализации очагов фитофагов на ранних фазах вспышек их массового размножения, в том числе на участках, где действует запрет на применение пестицидов. Это позволяет снизить общий уровень затрат на проведение защитных мероприятий за счёт пролонгированного действия биологических агентов на популяции вредителей лесов [5, 6].
Создание средства защиты лесов возможно только на основе таких биологических агентов (энтомопатогенных микроорганизмов и энтомо-фагов), которые уничтожают значительную часть природных популяций фитофагов [7]. Для разработки технологии применения энтомофагов (в основном паразитоидов) против вредителей в каждом конкретном случае проводят поиск таких эффективных видов. Затем дают оценку возможности наработки культуры паразитоида в лабораторных условиях, как правило, на хозяевах-заменителях (насекомые-хозяева). На этом этапе выполняют подбор насекомых-хозяев, осуществляют разработку условий их содержания, размножения и синхронизации жизненных циклов с энтомофагом. После успешного получения нескольких поколений паразитоида выбирают наиболее эффективного хозяина с точки зрения биологических показателей развития энтомофа-га, дают оценку себестоимости масштабирования его лабораторной популяции, разрабатывают способы хранения и накопления биоматериала. Если подтверждается экономическая целесообразность использования энтомофага в качестве основы биологического средства защиты лесов, проводится разработка технологии его применения, включающая эффективные способы массовой наработки биоматериала (параз-итоида); оптимальные параметры содержания, накопления и хранения биоматериала; условия и критерии выпуска энтомофага; способы оценки эффективности работ по его применению для защиты лесов.
Цель исследования – проанализировать результаты разработки способов массового разведения энтомофагов на примере паразитических яйцеедов.
Объекты и методы исследований
Исследования по разведению паразитоидов в лабораторных условиях проводили в 2019– 2024 гг. в лаборатории биологических методов защиты леса ВНИИЛМ. Объектами исследования были паразитические яйцееды Ooencyrtus kuvanae Howard (оэнциртус куванэ) и яйцееды рода Trichogramma.
Для поддержания культур паразитоидов осуществляли разведение насекомых-хозяев:
/ табачного бражника Manduca sexta ( Lepidoptera, Sphingidae ) – на искусственной питательной среде при температуре 25–27 °C, относительной влажности 50% и длине светового дня 17 ч;
-
^ соснового коконопряда Dendrolimus pini – на ветвях сосны при температуре 23–25 °C, относительной влажности 50% и длине светового дня 16 ч;
-
^ зерновой моли Sitotroga cerealella (сито-трога) – в климатической камере при температуре 25 °С и относительной влажности 80%, на пшенице и ячмене;
^ большой восковой моли Galleria mellonella Linnaeus, 1758 (Lepidoptera: Pyralidae) (галлерия) – на искусственной питательной среде при температуре 23–25 °C, относительной влажности 50% и длине светового дня 16 ч.
Кладки яиц непарного шелкопряда Lymantia dispar (Linnaeus, 1758) (Lepidoptera: Erebidae) хранили при температуре 0 °C.
Перед началом вылета бабочек ситотроги и галлерии в садки помещали специальные бумажные пластины, на которые бабочки откладывают яйца. Сбор яиц проводили ежедневно или через сутки: при работе с ситотрогой пластины извлекали и кисточкой счищали с них яйца. Для заражения трихограммой использовали яйца не старше 2 сут после откладки. Яйцееды рода Trichogramma на всех фазах развития содержались в климатической камере при температуре 25 °С и влажности 80% без освещения.
Для выведения яйцеедов рода Trichogramma использованы зараженные яйца звездчатого пилильщика-ткача Acantholyda posticalis (Matsumura, 1912) (Hymenoptera : Pamphiliidae), собранные в очагах вредителя Ростовской и Волгоградской областей и доставленные в лабораторию на ветвях сосны.
Для заражения яиц насекомых-хозяев их помещали в стеклянные садки объемом 0,3 л, туда же выкладывали открытую пробирку с имаго яйцеедов и закрывали плотной тканью, поверх которой располагали ватный диск, смоченный 15%-м раствором мёда. Эти садки содержали без освещения при температуре 25 °С и влажности 80%. Через сутки после заражения в садки подкладывали новые яйца насекомых-хозяев. Через 6 сут от даты заражения потемневшие яйца раскладывали по пробиркам 1^10 см, закрывали и хранили в указанных выше условиях до выхода имаго трихограммы нового поколения.
Для оценки особенностей развития трихо-грамм на хозяевах-заменителях зараженные яйца ситотроги (по 10 шт.) помещали в отдельные пробирки. После отрождения яйцеедов им давали свежие яйца ситотроги и галлерии, ежедневно подкармливали и оценивали продолжительность жизни самок. После гибели зараженные яйца извлекали, подсчитывали число самок в опыте, число зараженных ими яиц и срок отрождения из них имаго трихограмм нового поколения.
Перед заражением O. kuvanae яйца непарного шелкопряда замачивали в 9- и 70%-м растворах уксусной кислоты (CH3COOH) на 17 ч и 1 ч 5 мин соответственно. Затем промывали под струей проточной воды и высушивали на открытом воздухе. Сухие яйца помещали в садки, куда выпускали имаго O. kuvanae в соотношении паразитоид : хозяин – 1 : 10. Садок закрывали плотной тканью, сверху ткани помещали ватный диск, смоченный 25%-м раствором мёда. По мере высыхания диск смачивали. Садки содержали при 16-часовом световом периоде, температуре 25 °С и влажности 50–60%. Для сравнения эффективности разведения яйцееда на обработанных яйцах проводили также заражение необработанных яиц. Через 15 сут от даты заражения в опытных партиях отбирали по 1 000 яиц, помещали в отдельные садки и после отрождения имаго определяли долю зараженных яиц.
Эффективность наработки культуры яйцееда на обработанных яйцах оценивали по основным общепринятым биологическим показателям оэнциртуса: сроки развития (от даты заражения до начала выхода имаго), соотношение полов, плодовитость самок. Для этого на 5-е сутки после отрождения имаго оэнцир-туса методом случайной выборки из каждой зараженной партии отбирали по одной самке. Каждую самку подсаживали в контейнер, где содержалось 150 очищенных от пушка свежих яиц непарного шелкопряда (срок развития яиц – не более 1 мес. после откладки бабочками). В опыте использовали по 10 самок яйцееда в каждом варианте. Содержание самок и их кормление осуществляли по приведенному выше способу. Отродившееся поколение самки ежедневно отлавливали для исключения перезаражения яиц насекомого-хозяина в опыте. С целью получения общего результата плодовитости самок подсчитывали также число зараженных яиц с погибшими личинками оэнциртуса.
Результаты и обсуждение
Яйцеед O. kuvanae в природе заражает яйца непарного шелкопряда сразу после откладки их бабочками, т.е. массовую наработку биоматериала для расселения паразитоида в места с повышенной численностью вредителя необходимо провести к концу июля.
Для этого можно выполнить массовое разведение непарного шелкопряда в лабораторных условиях и получить в результате свежие яйца фитофага. Однако такой способ предполагает большие трудозатраты при выкармливании гусениц, а также риск потери всей лабораторной популяции, поскольку гусеницы непарного шелкопряда неустойчивы к поражению вирусной инфекцией.
Самый дешевый способ разведения O. kuvanae – на яйцах непарного шелкопряда, собранных в природе, поскольку при этом исключены затраты на лабораторное содержание насекомого-хозяина до фазы яйца. При наличии мест с повышенной численностью непарного шелкопряда в древостоях можно набрать достаточный запас биоматериала (кладок яиц), который хранят при пониженной температуре, а затем к нужному сроку проводят на таких прошедших диапаузу яйцах массовое разведение энтомофага. Однако из таких яиц значительная часть гусениц насекомого-хозяина отрождается в течение нескольких суток, яйцеед не успевает заразить все яйца, поэтому происходит резкое снижение числа получаемых особей оэнциртуса и массовая наработка биосредства невозможна.
Есть способы обработки прошедших диапаузу яиц в низкотемпературной камере при -70 °С или при тепловой обработке в течение 1 ч при 60 °С и 70–80% влажности; в результате их применения гусеница погибает. Однако из таких убитых яиц непарного шелкопряда выход имаго яйцееда уменьшается до 10% и ниже. Кроме того, при развитии нескольких поколений Ooencyrtus kuvanae на убитых яйцах его плодовитость не сразу восстанавливается и при заражении свежих яиц хозяина [8].
Нами опробовано замедление развития гусениц при хранении в замороженном состоянии и увеличение численности яйцееда на количество заражаемых яиц, выполнены обработка паром и замачивание в воде с различным временем выдерживания, а также обработка с разным периодом экспозиции химическими веществами: в 50%-м растворе спирта, в 10%-м формалине и пр. Это не дало желаемых результатов.
В результате экспериментальных работ найден способ обработки прошедших диапаузу яиц непарного шелкопряда раствором органической кислоты (уксусной, лимонной и пр.). По стоимости оптимально использовать уксусную кислоту (CH3COOH). Концентрация кислоты и время экспозиции зависят от срока хранения яиц непарного шелкопряда. Так, до середины декабря можно использовать кислоту 9%-й концентрации. С середины февраля такой концентрации уже недостаточно, так как гусеницы быстро отрождаются.
Результаты разведения яйцееда O. kuvanae на прошедших диапаузу яйцах непарного шелкопряда (с замачиванием их в кислоте разной концентрации и необработанных) приведены в табл. 1.
Доля отродившихся яйцеедов на обработанных яйцах в 5 раз выше, чем без обработки.
Таблица 1. Результаты разведения яйцееда O. kuvanae на прошедших диапаузу яйцах непарного шелкопряда в вариантах обработки уксусной кислотой
|
Номер варианта опыта |
Вариант опыта |
Доля отродившихся яйцеедов, % (min…max) |
|
1 |
Срок хранения яиц 1,5 мес. Обработка 9%-м раствором уксусной кислоты в течение 17 ч |
68,7 (64,3…75,1) |
|
2 |
Срок хранения яиц 4 мес. Обработка 9%-м раствором уксусной кислоты в течение 17 ч |
36,3 (24,8…46,2) |
|
3 |
Срок хранения яиц 8 мес. Обработка 70%-м раствором уксусной кислоты в течение 1 ч 5 мин |
75,5 (62,2…81,3) |
|
4 |
Необработанные яйца |
14,4 (6,8…21,1) |
Сравнение популяционных параметров O. kuvanae при выращивании на обработанных и необработанных яйцах хозяина показало, что основные биологические показатели энтомофага сохраняются (табл. 2).
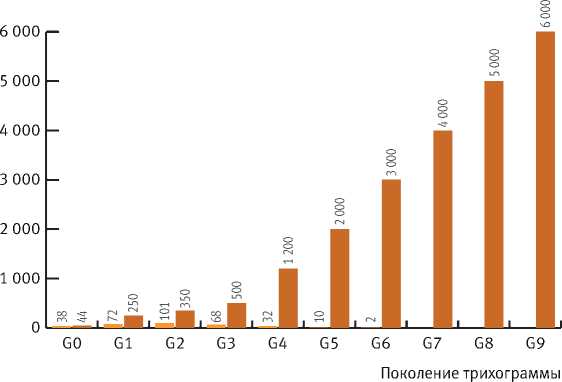
в разных поколениях (G) приведены на графике (рис. 3).
При разведении в лабораторных условиях установлено, что у T. semblidis адаптации к яйцам лабораторных насекомых-хозяев не
Таблица 2. Популяционные параметры O. kuvanae при выращивании на прошедших диапаузу яйцах непарного шелкопряда в вариантах обработки уксусной кислотой
|
Вариант опыта |
Популяционные показатели O. kuvanae |
|||
|
Срок развития (min…max), сут |
Соотношение 3 : $ (min…max) |
Срок жизни самок, сут (min…max) |
Плодовитость самок, шт. (min…max) |
|
|
1. Срок хранения яиц 1,5 мес. Обработка 9%-м раствором уксусной кислоты в течение 17 ч |
23 (18…25) |
1:2 (1 : 1,94…1 : 2,14) |
21,8 (17…25) |
95,5 (65…119) |
|
2. Срок хранения яиц 4 мес. Обработка 9%-м раствором уксусной кислоты в течение 17 ч |
23 (18…25) |
1:2 (1 : 1,93…1 : 2,15) |
21,3 (17…25) |
94,3 (59…110) |
|
3. Срок хранения яиц 8 мес. Обработка 70%-м раствором уксусной кислоты в течение 1 ч 5 мин |
23 (18…25) |
1:2 (1 : 1,94…1 : 2,13) |
21,8 (17…25) |
96,2 (72…118) |
|
4. Необработанные яйца |
23 (18…25) |
1:2 (1 : 1,96…1 : 2,12) |
21,3 (18…25) |
95,2 (77…113) |
Таблица 3. Биологические особенности природных видов рода Trichogramma при лабораторном разведении
|
Вид трихограммы |
Плодовитость самки, шт. яиц |
Срок жизни самки, сут |
Период развития до имаго в яйце хозяина, сут |
|
Trichogramma semblidis |
16–20 |
1,5–3 |
13–14 |
|
Trichogramma evanescens |
25–28 |
11–15 |
11–12 |
Таблица 4. Результаты заражения яиц насекомых-хозяев разными видами трихограмм
|
Вид насекомого-хозяина |
Поколение (G) |
Всего яиц в опыте, шт. |
Доля яиц, % |
|
|
зараженных |
отродились имаго яйцееда |
|||
|
T. evanescens |
||||
|
Сосновый шелкопряд |
G2 |
48 |
33,3 |
14,5 |
|
G3 |
36 |
41,7 |
25,0 |
|
|
Табачный бражник |
G2 |
218 |
25,2 |
22,0 |
|
G3 |
150 |
37,3 |
27,3 |
|
|
T. semblidis |
||||
|
Сосновый шелкопряд |
G2 |
56 |
12,5 |
0 |
|
Табачный бражник |
G2 |
207 |
7,2 |
0 |
Рис. 6. Самка T. evanescens с деформированными крыльями
Выводы
Отработка возможности разведения того или иного вида энтомофага в лаборатории – это длительный процесс, предполагающий работу с разными видами насекомых одновременно. Отбор насекомого-хозяина для массовой наработки популяции паразитоида проводят на основе оценки популяционных параметров развития энтомофага и стоимости таких работ.
Разработки по способам массового разведения энтомофагов позволят расширить ассортимент биологических средств и обеспечить надёжную защиту лесов от формирующихся очагов вредителей без негативного воздействия на компоненты лесных экосистем.
Работа выполнена в рамках проводимых исследований по темам НИР ФБУ ВНИИЛМ государственного задания на проведение прикладных научных исследований
Таким образом, разработан способ, позволяющий исключить трудозатраты на лабораторное разведение насекомого-хозяина и осуществлять наработку биологического средства против непарного шелкопряда. Полученные по данному способу особи O. kuvanae (рис. 1) прошли опытно-производственное испытание в очагах непарного шелкопряда в Оренбургской обл. в 2019 г.; при численности фитофага 1,0–1,5 кладки на дерево эффективность составила 81–85%.
В 2023 г. из собранных в очагах массового размножения яиц звездчатого пилильщика-ткача в Ростовской и Волгоградской областях выведено два вида трихограмм: T. evanescens и T. semblidis, которые различались по размеру, цвету и особенностям биологии (рис. 2). Определение видов подтверждено Ю.Ю. Ильинским (Институт цитологии и генетики СО РАН).
Результаты лабораторного содержания и разведения двух видов трихограмм и изменение численности их лабораторных популяций

Рис. 1. Имаго O. kuvanae перед выпуском в природу

А
Б
Рис. 2. Выведенные имаго самок T. semblidis (А) и T. evanescens (Б)
Число особей, шт.

Trichogramma sp. (желтая)
Trichogramma sp. (бурая)
Рис. 3. Результаты лабораторного разведения двух видов рода Trichogramma по поколениям
наблюдается. Уже в 3-м поколении началось сокращение популяции этого вида – из большинства зараженных яиц ситотроги и галлерии не происходило отрождения имаго. Поэтому режим содержания в темноте изменили на 17-часовую освещенность при 25 °С и влажности 70%. Однако это тоже не дало результатов, после поколения G6 популяция перестала возобновляться.
В результате исследования установлены различия в биологии двух видов трихограмм: T. evanescens оказалась более пластичным видом (табл. 3).
Лучшие адаптационные свойства T. evanes-cens подтверждают и результаты заражения яиц соснового коконопряда и табачного бражника в поколениях G2 и G3, тогда как T. semblidis не стала развиваться на этих хозяевах (табл. 4).
Визуальные наблюдения показали, что самки T. semblidis заражали яйца коконопряда и бражника. Зараженные яйца насекомых-хозяев погибали, но выход имаго яйцееда из них не происходил. Личинки T. evanescens способны развиваться в яйцах этих же видов насекомых-хозяев, при этом при первом заражении было паразитировано 25–30% предложенных яиц, а отродились яйцееды из 14–22% яиц, при повторном заражении было паразитировано уже порядка 40% яиц, выход имаго яйцееда отмечен из 25–27% яиц (рис. 4, 5).
У T. evanescens адаптация к не свойственным для нее хозяевам происходила постепенно: в начале разведения было заражено лишь 10–15% предложенных яиц, после 9-го поколения – уже 60% на галлерии и 90% на ситотроге. В поколениях G1 и G2 были единично отмечены самки с деформированными крыльями (рис. 6). В последующих поколениях наличие таких самок не наблюдалось.
В лаборатории было налажено конвейерное производство T. evanescens . В 2024 г. в Волгоградской обл. при угрозе 50%-го объедания крон сосны в очаге звездчатого пилильщика-ткача было проведено опытное применение выращенной в лаборатории T. evanescens. При однократном расселении этой трихограммы в период максимального лёта имаго фитофага средняя эффективность составила 70,2% (минимальная зараженность в выборках по ветвям – 55,0%, максимальная – 82,7%).

Рис. 4. Заражение яйца табачного бражника самками T. evanescens

Рис. 5. Отрождение T. evanescens из яйца соснового коконопряда
Список литературы Разработка способов производства биологических средств на основе энтомофагов для использования в защите лесов
- Мартынюк, А.А. О концептуальных подходах к новой редакции Лесного кодекса Российской Федерации. - Текст: электронный / А.А. Мартынюк // Лесохозяйственная информация: электронный сетевой журнал. - 2020. - № 2. - С. 5-24. 10.24419/LHI.2304-3083.2020.2.01. - Режим доступа: URL: http://lhi.vniilm.ru. DOI: 10.24419/LHI.2304-3083.2020.2.01.-
- Стратегия научно-технологического развития Российской Федерации (Указ Президента Российской Федерации от 28.02.2024 № 145 "О Стратегии научно-технологического развития Российской Федерации").
- Государственная программа Российской Федерации "Развитие лесного хозяйства" (постановление Правительства Российской Федерации от 15.04.2014 № 318).
- Стратегия развития лесного комплекса Российской Федерации до 2030 года (распоряжение Правительства Российской Федерации от 11.02.2021 № 312-р "Об утверждении Стратегии развития лесного комплекса Российской Федерации до 2030 года").
- Беднова, О.В. Биологический метод защиты леса: учебное пособие / О.В. Беднова. - Москва: изд-во МГТУ им. Н.Э. Баумана, 2023. - 140 с. EDN: GXQZNF
- Гниненко, Ю.И. Развитие биологических методов защиты леса в России / Ю.И. Гниненко // Биологическая защита растений - основа стабилизации агроэкосистем. - Вып. 6. - Краснодар, 2010. - С. 53-55.
- Гниненко, Ю.И. Биологическая защита леса: рамки эффективности искусственных эпизоотий. - Текст: электронный / Ю.И. Гниненко // Актуальные проблемы лесного комплекса. - Брянск, 2002. - Режим доступа: http://science-bsea.bgita.ru/2002/les_2002/gninenko.htm.
- Методическое руководство по применению интродуцированного яйцееда оэнциртуса куванэ против непарного шелкопряда. - Текст: электронный. - Режим доступа: http://gov.cap.ru/home/65/aris/bd/karantin/document/009-1.html.


