Разработка технологического процесса получения бактериального концентрата Lactobacillus reuteri
Автор: Семенихина В.Ф., Раскошная Т.А., Рожкова И.В., Бегунова А.В., Ширшова Т.И.
Журнал: Вестник аграрной науки @vestnikogau
Статья в выпуске: 5 (62), 2016 года.
Бесплатный доступ
В настоящее время большое внимание уделяется изучению свойств пробиотического микроорганизма Lactobacillus reuteri. Так как данный вид лактобактерий обладает широким спектром функциональных свойств, разработка импортозамещающей биотехнологии бактериального концентрата Lactobacillus reuteri, предназначенного для производства продуктов и препаратов с пробиотическими свойствами на сегодняшний день является актуальной и востребованной. Процесс получения бактериального концентрата включает в себя наращивание клеток молочнокислых бактерий в питательной среде и их отделение центрифугированием. В качестве азотистой основы для питательных сред широко используются гидролизаты белков молока. Степень гидролиза белковых субстратов и пептидный состав гидролизата зависит от многих факторов, таких как: вид и специфичность фермента, концентрация фермента и продолжительность ферментации, рН и температура ферментации и т.д. Для проведения работы по подбору питательной среды для культивирования L. reuteri проводили гидролиз обезжиренного молока и сыворотки с использованием 4 протеолитических ферментов (протосубтилин, Alcalase, Neutrase, Protamex ). Диапазон варьирования дозы вносимого фермента и продолжительность ферментации различна и подбирается для каждого процесса отдельно. Для эксперимента были выбраны две концентрации ферментов: 0,4 % и 3% от содержания белка в среде, также продолжительность ферментации 1,5 ч и 3 ч. Согласно рекомендациям производителей температура и активная кислотность процесса составляла 55°С и 7,2 ед. рН. Полученные гидролизаты были исследованы как питательные среды для накопления максимального количества клеток L. reuteri. Процесс культивирования проводили при температуре 37°С в течение (16 - 17) часов. Максимальное количество клеток получено на гидролизованном молоке при использовании протеолитического фермента Alcalase, дрожжевого экстракта, инулина и цистеина. Установлено, что наибольшее накопление клеток Lactobacillus reuteri было получено при культивировании при рН - (5,8-6,2) ед. рН и температурах (35-37) °С. Количество клеток - (9,15-9,24) lg КОЕ/см3. При исследовании влияния дозы вносимого инокулята на интенсивность размножения L. reuteri установлено, что максимальное количество клеток L. reuteri отмечалось через 6-8 часов культивирования при внесении 6-7 % инокулята. (2×109 КОЕ/см3).
Пробиотический штамм, ферменты, протосубтилин, инулин
Короткий адрес: https://sciup.org/147124350
IDR: 147124350
Текст научной статьи Разработка технологического процесса получения бактериального концентрата Lactobacillus reuteri
B последние годы наблюдается большой интерес к кисломолочным продуктам, содер^ащим микроорганизмы - пробиотики (бифидобактерии, ацидофильные молочнокислые палочки, L.rhamnosus, L.casei , пропионовокислые бактерии и др.), которые являются представителями нормальной кишечной микрофлоры человека. Lactobacillus reuteri впервые были выделены немецким микробиологом Gerhard Reuter из грудного молока и в честь нeго они и получили нaзваниe. B работах Gerhard Reuter [1] в 1960 году они были отнесены к молочнокислым бактериям, в частности, к Lactobacillus fermentum биотип 11. B 1980 году Kandler et. al [2] устaновили существенное различием ме^ду Lactobacillus reuteri и другими биотипами Lactobacillus fermentum и было предложено определить их в новый вид Lactobacillus reuteri .
Интерес к Lactobacillus reuteri начал проявляться после того, как они были выделены из ^елудочно-кишечного тракта.
B дальнейшем при исследовании основных видов микрофлоры ^елудочно-кишечного тракта человека и ^ивотных было устaновлено, что Lactobacillus reuteri является основным компонентом лактобактерий, наряду с Lactobacillus acidophilus, которые присутствуют в ^елудочно-кишечном тракте. Lactobacillus reuteri обладает высокой антимикробной активностью Продуцирует бактериоцины реутерин, реутерицин и реутециклин, которые ингибируют кишечные патогенны и стимулируют иммунную систему человека. Lactobacillus reuteri облигатная гетероферментативная молочнокислая палочка, микроаэрофил., продуцирует большое количество глюканов и фруктанов экзополисахаридов, которые рассматриваются как пребиотики. Образует конечные продукты метаболизма молочную и уксусную кислоты. B настоящее время на российском рынке бактерии вида Lactobacillus reuteri продаются в виде Б^Д, ^евательных таблеток, капель для приема внутрь, капсул для перорального приема и сухого детского питания. Кисломолочные продукты c Lactobacillus reuteri производятся только в Швеции. Препараты с Lactobacillus reuteri используются при лечении диареи у детей, а так^е для снятия коликов у новоро^денных.
Исследования последних десятилетий выявили способность молочнокислых бактерий образовывать антимикробные вещества различной природы, которые могут стать альтернативой существующим антибиотикам и консервантам. Наиболее изученной из них является группа антибактериальных пептидов – бактериоцинов, разнообразных по уровню активности, спектру и механизму действия [3,4,5]. Бактериоцины легко расщепляются ферментами пищеварительного тракта и поэтому они могут заменить традиционные химические [6,7,8].
Процесс получения бактериального концентрата включает в себя наращивание клеток молочнокислых бактерий в питательной среде и их отделение центрифугированием. При этом необходимо накопить в среде максимально возмо^ное количество активных клеток. B качестве азотистой основы для питательных сред широко используются гидролизаты белков молока. Степень гидролиза белковых субстратов и пептидный состав гидролизата зависит от многих факторов, таких как: вид и специфичность фермента, концентрация фермента и продол^ительность ферментации, рН и температура ферментации и т.д.
Целью настоящих исследований является разработка технологических ре^имов производства бактериального концентрата пробиотических культур Lactobacillus reuteri для производства функциональных молочных продуктов.
Объектом исследования является штамм Lactobacillus reuteri .
Штамм Lactobacillus reuteri хранили в заморо^енном состоянии при температуре минус 800С в растворе, содер^ащем 6% обез^иренного сухого молока и 10% глицерина. Для восстановления культуры использовали среду MRS, температуру культивирования 370С и анаэробные условия.
Для исследований были выбраны 4 протеолитических фермента (протосубтилин, Alcalase, Neutrase, Protamex).
Работы по подбору питательной среды для культивирования L. reuteri проводили поэтапно: на первом - осуществляли гидролиз обез^иренного молока и сыворотки. Диапазон варьирования дозы вносимого фермента и продол^ительность ферментации различна и подбирается для ка^дого процесса отдельно. Исходя из литературных источников и предшествующих исследований [9, 10, 11] для эксперимента были выбраны две концентрации ферментов: 0,4 % и 3%, которые зависят от содер^ания белка в среде, а так^е продол^ительность ферментации 1,5 ч и 3 ч. Согласно рекомендациям производителей, температура и активная кислотность процесса составляли 55°С и 7,2 ед. рН. Полученные гидролизаты были исследованы как питательные среды для накопления максимального количества клеток L. reuteri. Процесс культивирования проводили при температуре 37°С в течение (16 - 17) часов, доза инокулята - 5 %. После 17 часов культивирования определяли количество клеток (чашечным методом на среде MRS в анаэробных условиях).
При разработке состава питательной среды для наращивания биомассы L. reuteri использовались следующие компоненты: гидролизованное молоко, дро^^евой экстракт, инулин, сахароза и цистеин. Bсе полученные данные обрабатывались в программе Statistica 6.1[12, 13,14].
Известно, что оптимальная температура роста и рН питательной среды для молочнокислых палочек составляет (37 - 41) °С и рН= (5,4 - 6,4) ед. рН, тогда как из литературных источников, посвященных различным исследованиям с Lactobacillus reuteri , авторы используют следующие значения температур и активной кислотности для культивирования микроорганизма: 38°С и рН - 6,2 ед. рН, 37°С и рН - 6,5 ед. рН, рН – (6,0 - 6,8) ед. рН, рН - 5,8 ед. рН и 37°С[15]. Исходя из вышеизло^енного, в работе по подбору ре^имов культивирования микроорганизма Lactobacillus reuteri был взят следующий интервал значений активной кислотности рН = (5,6 - 6,6) ед. рН и температуры (32 – 41)°С. Культивирование Lactobacillus reuteri проводили в ферментерах фирмы Das Gip (Германия) на 400 мл, а затем в ферментере Prelude фирмы Biolafitt на 5 л (Франция) при постоянных значениях активной кислотности или температурах и непрерывном раскислении водным раствором NaOH с массовой долей 30%. Инокулят готовили на среде MRS и вносили в количестве 5% во всех опытах.
Через ка^дые 2 часа культивирования проводили отбор проб и определяли количество клеток Lactobacillus reuteri .
Количество клеток Lactobacillus reuteri определяли методом предельных разведений в среде ГМК-1 в анаэробных условиях и термостатировании в течение 3-5 дней при температуре 37°С в соответствии с Методическими рекомендациями по организации производственного микробиологического контроля на предприятиях цельномолочной и молочно-консервной промышленности.
Математическая обработка данных экспериментов по влиянию вида ферментов и ре^имов гидролиза показала, что такие факторы, как «вид среды», «вид фермента» и «доза фермента» оказывала значимый эффект на развитие клеток L. reuteri. Было установлено, что наибольшее количество клеток было получено на гидролизате, приготовленном на обез^иренном молоке (7,941±0,209) lg КОЕ/см3, тогда как на гидролизованной сыворотке – (6,959±0,148) lg КОЕ/см3. Результаты исследований показали, что гидролизаты, полученные с использованием ферментов Alcalase, Neutrase, протосубтилин обладали практически одинаковым воздействием на накопление клеток L. reuteri в среде. На рисунке 1 представлены данные по влиянию вида фермента на накопление клеток L. reuteri .
Наибольшее количество клеток было отмечено при культивировании в течение 16-17 ч на гидролизате, полученном с использованием 1% фермента Alcalase – (7,818±0,395) lg КОЕ/см3. Тогда как для фермента Neutrase – (7,690±0,331) lg КОЕ/см3 и Протосубтилин – (7,670±0,316) lg КОЕ/см3. Исследования показали, что при повышении дозы фермента, интенсивность развития клеток возрастала. Так^е определено, что продол^ительность ферментации среды от 1,5 до 3 часов различными ферментами не влияла на питательную ценность получаемых сред, не давая различий в количестве клеток L. reuteriТаким образом, на основании полученных данных, в дальнейших исследованиях для получения гидролизованного обез^иренного молока был выбран протеолитический фермент Alcalase, с дозой внесения 3%.
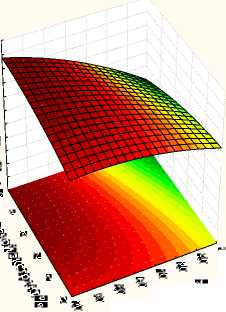
С целью оптимизации состава питательной среды был разработан 5 факторный центральный композиционный план со следующим диапазоном варьирования ингредиентов: гидролизованное молоко (30 – 100) %, дро^^евой экстракт (0 – 5) %, сахароза (0 – 5) %, инулин (0 - 1) г/дм3. Проведенные исследования показали, что добавление сахарозы угнетает рост клеток L. reuteri . На рис. 2 и 3 представлены поверхности отклика влияния содер^ания сахарозы (без добавления и при 5%) на количество клеток в питательной среде.
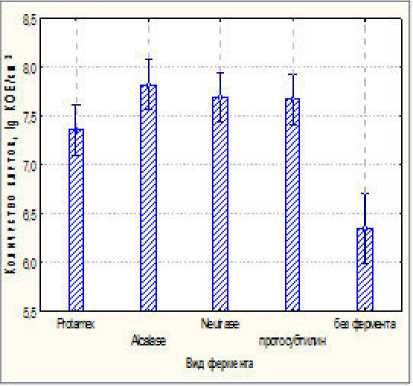
Рисунок 1 - Bлияние вида фермента на накопление клеток L.reuteri в гидролизованном обез^иренном молоке
Проведенные исследования показали, что наибольшее накопление клеток L. reuteri было получено на питательной среде без добавления сахарозы (рис.2,3)
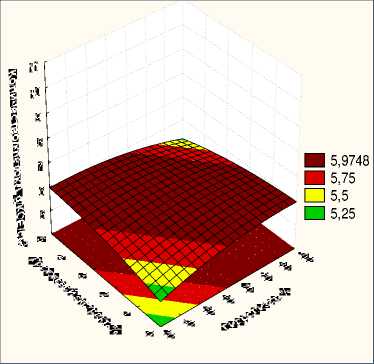
Рисунок 3 - Зависимость количества клеток . L.reuteri от концентрации компонентов в среде при «Сахароза» - 5 %
□1
□9
□9
■8
■8
%
ЗЕ
S^
Рисунок 2 - Зависимость количества клеток L.reuteri от концентрации компонентов в среде при «Сахароза» - 0%
На развитие и рост клеток в процессе культивирования влияли взаимодействие факторов «Гидролизат-Инулин» и «Дро^^евой экстракт-Цистеин». Было установлено, что с увеличением содер^ания инулина в составе питательной среды, количество клеток возрастало. Тогда как, ингредиенты дро^^евой экстракт и цистеин в составе питательной среды могут быть взаимозаменяемы (рис. 4).
Таким образом, было установлено, что добавление инулина (рис. 5), дро^^евого экстракта или цистеина в гидролизованное молоко стимулирует развитие L. reuteri, тогда как сахароза подавляет.
Наибольшее количество клеток было получено на гидролизованном молоке при использовании протеолитического фермента Alcalase в количестве 3% от содер^ания белка в среде. Оптимальный состав питательной среды, состоящий из гидролизованного молока, дро^^евого экстракта, инулина и цистеина, обеспечивал интенсивное развитие и накопление клеток Lactobacillus reuteri .
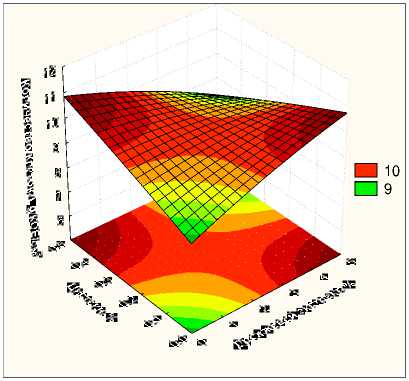
Рисунок 4 - Зависимость количества клеток L. reuteri от концентрации цистеина и дро^^евого экстракта в среде
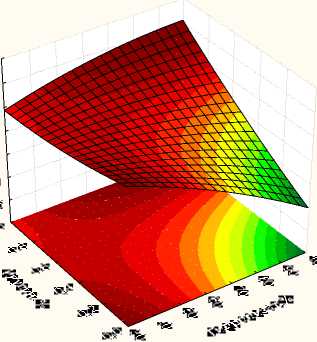
исунок - ависимостьколичества клеток L. reuteri от концентрации инулина и гидролизата в питательной среде
Проведены исследования по влиянию размно^ения Lactobacillus reuteri при культивировании при различных значениях активной кислотности (5,8; 6,0; 6,2 ед.pH) и температурах (32°С; 35°С; 37°С; 39°С; 41°С).
На рис.6 представлены данные по изменению роста L. reuteri при поддер^ании активной кислотности среды на уровне 5,8 ед. рН при различных температурах культивирования 32°С, 35°С, 37°С, 39°С и 41°С. ^нализ представленных данных показывает, что наибольшее содер^ание клеток было получено при культивировании при температуре 35°С, 37°С и достигало до 1,4×109 КОЕ/см3 и 1,5×109 КОЕ/см3 соответственно.
На рис.7 представлены данные по изменению роста L. reuteri при поддер^ании активной кислотности среды на уровне 6,0 ед. рН при различных температурах культивирования 32°С, 35°С, 37°С, 39°С и 41°С.
Наибольшее количество клеток (1,6×109 КОЕ/см3 и 2,4×109 КОЕ/см3) было отмечено при культивировании при температуре 35°С и 37°С.
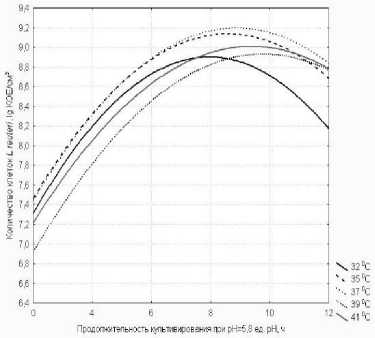
Рисунок 6 - Изменение содер^ания клеток L. reuteri в процессе культивирования при различных температурах при рН = 5,8 ед. рН
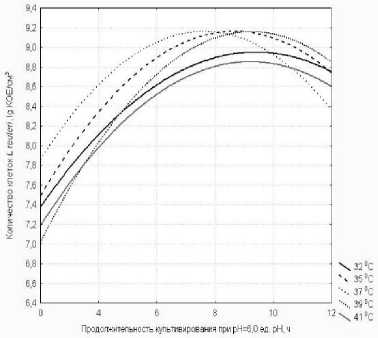
Рисунок 7 - Изменение содер^ания клеток L. reuteri в процессе культивирования при различных температурах при рН = 6,0 ед. рН
На рисунке 8 представлены данные по изменению роста L. reuteri при поддер^ании активной кислотности среды на уровне 6,2 ед. рН при различных температурах культивирования 32°С, 35°С, 37°С ,39°С и 41°С.
Исходя из данных, представленных на рисунке 8, видно, что при температуре 35°С, 37°С и активной кислотности рН = 6,2 ед. рН так^е отмечалось н высокое количество клеток в культуральной среде.
Как видно из рисунка 9 интенсивное накопление клеток происходило в течение (8 - 10) часов (при внесении 5 % инокулята), и разница в количестве клеток в стационарной фазе роста при культивировании при разных значениях активной кислотности была не велика, варьировалась в интервале (8,87 - 9,24) lg КОЕ/см3. Однако, наибольшее количество клеток было достигнуто при культивировании при более низких значениях активной кислотности, в интервале рН от 5,8 до 6,2 ед. рН. Так, при активной кислотности среды - 5,8 ед. рН, наибольшее количество клеток составило – 9,18 lg КОЕ/см3, при 6,0 ед. рН – 9,24 lg КОЕ/см3 и при 6,2 ед. рН – 9,15 lg КОЕ/см3.
По полученным данным было установлено, что наибольшее содер^ание клеток L. reuteri было достигнуто при температуре 37°С и активной кислотности 6,2 ед. рН.
Bыводы:
-
1. Наибольшее количество клеток было получено при культивировании L. reuteri в питательной среде с гидролизованным молоком при использовании протеолитического фермента Alcalase в количестве 3% от содер^ания белка в среде. Оптимальный состав питательной среды состоял из гидролизованного молока, дро^^евого экстракта, инулина и цистеина и обеспечивал интенсивное развитие и накопление клеток Lactobacillus reuteri .
-
2. При исследовании влияния активной кислотности среды и температуры культивирования L. reuteri на накопление клеток было установлено, что оптимальной температурой культивирования является температура 37°С и активная кислотность 6,2 ед. рН. Количество клеток при данных параметрах составляло 9,15 lg КОЕ/см3.
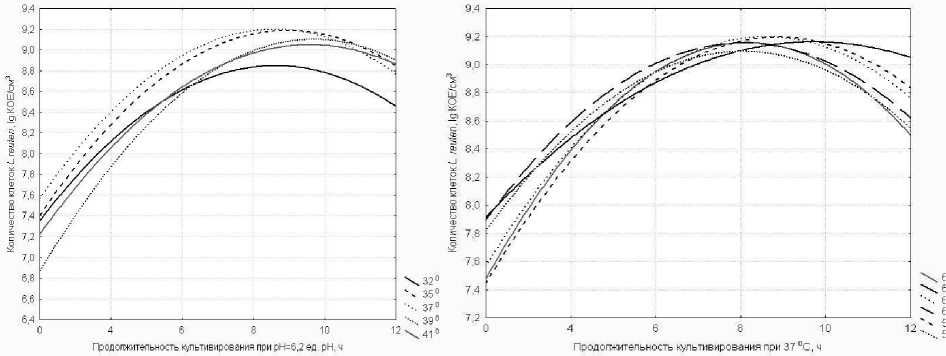
Рисунок 8 - Изменение содер^ания клеток L. Reuteri в процессе культивирования при различных температурах при рН = 6,2 ед. рН
Рисунок 9 - Изменение содер^ания клеток при культивировании при различных значениях активной кислотности
Список литературы Разработка технологического процесса получения бактериального концентрата Lactobacillus reuteri
- Reuter G. Das vorkommen von laktobazillen in lebensmitteln und ihr verhalten im mensclichen intestinaltrakt//Zbl Bac Parasit Infec Hyg I Orig. -1965. -№197(S). -P. 468-487.
- Kandler O., Stetter K., Kohl R. Lactobacillus reuteri sp. Nov. a new species of heterofermentative lactobacilli//Zbl. Bakt. Hyg. Abt. Orig. -1980. -C1. -264-269.
- Стоянова Л.Г., Устюгова Е.А., Нетрусов А.Н. 2012 Антимикробные метаболиты молочнокислых бактерий: разнообразие и свойства (обзор)//Приклад. Биохим.Микробиол. Т.48, № 3,.644-650
- Takao Mukai, Tomoko Asasaka, Eri Sato, Kenichi Mori, Mitsuyo Matsumoto, Hitoshi Ohori. Inhibition of binding of Helicobacter pylori to the glycolipid receptors by probiotic Lactobacillus reuteri//FEMS Immunology and Medical Microbiology-32(2002)-P.105-110
- Shornikova A.V., Casas I.A., Mykkanen H., Salo E. and Vesikari T. Bacteriotherapy with Lactobacillus reuteri in rotavirus gastroenteritis//1997 Pediatr. Infect. Dis.J.16 -P.1103-1107
- Устюгова Е.А., Федорова Г.Б.,Катруха Г.С., Стоянова Л.Г. 2011 Изучение антибиотического комплекса, образуемого Lactococcus lactis subsp. Lactis 194 вариант -К//Микробиология. Т.80. №5. С. 644-685
- Elizete de F.R. Pancheniak. Molecular characterization and biomass and metabolite production of Lactobacillus reuteri LPB P01-001: A potential probiotic/Elizete de F.R. Pancheniak, Maike T. Maziero, Jose A. Rodriguez-Leon, Jose L. Parada, Michele R. Spier, Carlos R. Soccol//Brazilian Journal of Microbiology. -2012. -P. 135-147
- Filipe Santos. Effect of amino acid availability on vitamin B12 production in Lactobacillus reuteri/Filipe Santos, Bas Teusink, Douwe Molenaar, Maurice van Heck, Michiel Wels, Sander Sieuwerts, Willem M. de Vos, Jeroen Hugenholtz//Applied and environmental microbiology. -V. 75. -N 12. -2009. -P. 3930-3936
- Головач, Т.Н. Закономерности гидролиза сывороточных белков экзо-и эндопротеазами/Т.Н. Головач, Н.В. Гавриленко, Н.К. Жабанос, В.П. Курченко//Труды БГУ. -2008. -Т. 3. -Ч. 1. -С. 1-15
- Головач, Т.Н. Культивирование молочнокислых бактерий в питательных средах на основе гидролизатов белков молока/Т.Н. Головач//Труды БГУ. -2010. -Т. 5. -Ч. 1. -С. 118-126
- Головач, Т.Н. Гидролиз белков молока ферментными препаратами и протеолитическими системами молочнокислых бактерий//Труды БГУ. -2012. -Т.7. -Ч 1. -С. 106-120
- Magdalena Polak-Berecka, Adam Wasko, Monicka korolowska-Wiater, Marcin Podlesny, Zdzislaw Targonski, Agnieszka Kubik-Komar. Optimization of Medium composition for enhancing growth of lactobacillus rhamnosus PEN using persponse surface methodology//Polish Journal of Microbiology, Vol.59, № 2, 2010, P. 113-118
- Раскошная Т.А. Конструирование питательной среды для культивирования пробиотического микроорганизма Lactobacillus reuteri/Т.А. Раскошная, В.Ф. Семенихина, И.В. Рожкова, А.В. Бегунова//Молочная промышленность -2015 -№4 -С. 26-27.
- CHEN Guo.Influence of Conditions on Reuterin Accumulation by the Resting Cell Biotransformation Process/CHEN Guo (陈国), YANG Daomao (杨道茂), XIAO Yaqin (肖雅琴)and CHEN Hongwen (陈宏文)//BIOTECHNOLOGY AND BIOENGINEERING Chinese Journal of Chemical Engineering. 2011. -№ 19(6). -P. 1023-1027
- Смирнов, Е.А. Совершенствование научных и разработка практических аспектов биотехнологии моновидовых бактериальных концентратов молочнокислых микроорганизмов для сыроделия/Е.А. Смирнов//Автореферат на соискание ученой степени кандидата технических наук -г. Вологда. -2011
- Бондаренко, А.Н. Влияние биостимулирования на развитие нута в условиях северо-западного прикаспия /А.Н. Бондаренко//Вестник Башкирского государственного аграрного университета. -2015. -№4. -С. 15-18
- Сергеев, В.С. Использование биопрепаратов и биоактивированных удобрений в качестве антистрессоров и биостимуляторов при возделывании зерновых культур /В.С.мСергеев, О.В. Радцева, Г.М. Рахимова, Р.Ф. Исаев//Вестник Башкирского государственного аграрного университета. -2013. -№2. -С. 21-24


