Разработка вакцины против птичьего гриппа на основе структурно модифицированных вирусов растений
Автор: Кондакова О.А., Трифонова Е.А., Архипенко М.В., Никитин Н.А., Карпова О.В., Атабеков И.Г.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Птицеводство: наука и технологии
Статья в выпуске: 4 т.52, 2017 года.
Бесплатный доступ
Птичий грипп - инфекционная вирусная болезнь, поражающая разные виды пернатых, включая домашнюю птицу (кур, индюков, уток и гусей). Вакцинация остается ключевой стратегией в предотвращении эпизоотий и эпидемий птичьего гриппа. При этом на сегодняшний день актуальная задача заключается в разработке и внедрении быстрых, безопасных и высокопроизводительных методов при производстве вакцин против гриппа. Применение рекомбинантных антигенных детерминант в вакцинных препаратах рассматривается как перспективный подход для создания универсальных, безопасных и эффективных вакцин. Одно из решений проблемы низкой иммуногенности вакцинных белков - использование вирусов растений и вирусоподобных частиц в качестве платформы для презентации антигенов и усиления иммунного ответа. Ранее нами было показано, что при нагревании палочковидного вируса табачной мозаики происходит образование частиц сферической формы (СЧ), обладающих уникальными адсорбционными и иммуностимулирующими свойствами. В представляемой работе разработана вакцина против вируса гриппа А птиц (штамм H5N1), созданная посредством сборки in vitro комплексов, включающих антигенные детерминанты вируса на поверхности СЧ. Методом непрямой иммуннофлуоресцентной микроскопии показана антигенная активность рекомбинантных вирусных белков - гемагглютинина НА и внеклеточного домена матриксного белка М2 (М2е), адсорбированных на СЧ. Полученные комплексы СЧ-HA-М2е (СЧ-HA62/284-М2е) оказались высокоиммуногенными. При иммунизации лабораторных животных подтверждено образование специфических антител к обеим антигенным детерминантам вируса гриппа А птиц. Адсорбция НА и М2е на СЧ позволила в 10 раз увеличить выработку антител к антигенам в крови иммунизированных животных. Преимущество использованного подхода при создании вакцинных препаратов - высокая эффективность, основанная на стабильности и адъювантной активности сферических частиц, безопасность и низкая себестоимость использования вирусов растений. Получение ветеринарных вакцин на основе структурно модифицированных вирусов растений позволяет создать отечественные маркерные ветеринарные вакцины для оздоровления популяции птицы в агропромышленных комплексах. Полученная вакцина может рассматриваться в качестве кандидатной рекомбинантной вакцины против вируса гриппа птиц.
Вирусы растений, вакцины, сферические частицы, вирус гриппа а, рекомбинантные белки
Короткий адрес: https://sciup.org/142214065
IDR: 142214065 | УДК: 636.5:619:615.371:[573.6.086.83+577.21 | DOI: 10.15389/agrobiology.2017.4.731rus
Текст научной статьи Разработка вакцины против птичьего гриппа на основе структурно модифицированных вирусов растений
Грипп относится к наиболее заразным и быстро распространяющимся инфекционным заболеваниям (1). Его возбудители — РНК-содер-жащие вирусы семейства Orthomyxoviridaе . Хотя природным резервуаром вируса гриппа А служат дикие птицы, эти вирусы могут заражать также домашнюю птицу и несколько видов млекопитающих, включая человека. Эпизоотии, этиологический связанные с вирусом гриппа А, наносят заметный ущерб сельскому хозяйству. В настоящее время борьба с гриппом птиц предполагает введение карантинов, а также забой инфицированных и контактировавших с ними особей, что приводит к значительным экономическим потерям. Из всех вирусов гриппа, циркулирующих среди птиц, наибольшую опасность для человека представляет штамм H5N1 в связи с большим числом случаев заражения людей при контакте с инфицированными птицами и самым высоким процентом смертельных исходов (2).
Наиболее эффективным способом профилактики эпидемий и панзоотий гриппа считается вакцинация. Для получения современных лицензированных вакцин против вирусов гриппа используют куриные эмбрионы, и производство таких вакцин для каждого штамма занимает до 6-9 мес, что в случае появления нового пандемического штамма может иметь не-
Работа выполнена при поддержке Российского научного фонда в рамках приоритетного направления деятельности РНФ «Проведение фундаментальных научных исследований и поисковых научных исследований коллективами существующих научных лабораторий (кафедр)» (грант ¹ 14-24-00007).
предсказуемые последствия. Кроме того, применение традиционных методов ограничено высокой вирулентностью штамма H5N1 для цыплят, куриных эмбрионов и потенциальной опасностью для человека.
Конструирование рекомбинантных белков рассматривается как альтернативный подход для создания универсальных, безопасных и эффективных вакцин против вируса птичьего гриппа (3). Однако в ряде работ сообщается, что наиболее перспективные для включения в вакцину вирусные белки (поверхностный белок гемагглютинин HA, который служит основной мишенью для нейтрализующих антител, и консервативный матрикс-ный белок М2) имеют низкую иммуногенность и не могут стимулировать эффективный иммунный ответ (4-7). Одно из решений проблемы — использование вирусов растений (8-10) и вирусоподобных частиц на их основе для презентации эпитопов протективных антигенов и усиления иммунного ответа (11-15).
Ранее мы показали, что при нагревании спирального вириона вируса табачной мозаики (ВТМ) до 94 °С происходит структурная перестройка вирусного белка и формируются сферические частицы (СЧ) контролируемого размера. Такие СЧ биодеградируемы, не содержат РНК и обладают высокой стабильностью. Кроме того, СЧ безопасны для человека, так как растения и животные не имеют общих патогенов (16-19). В то же время СЧ — эффективные иммуностимуляторы (11).
В настоящем исследовании для создания ветеринарной кандидат-ной вакцины использованы уникальные, не имеющие аналогов частицы — СЧ. Впервые получены комплексы СЧ—HA62/284-М2е, содержащие сферические частицы, образованные при термической перестройке ВТМ, и адсорбированные на их поверхности рекомбинантные антигены HA62/284 и М2е вируса гриппа А, и продемонстрировано сохранение антигенной специфичности рекомбинантных белков. Такие комплексы оказались высокоиммуногенными: при иммунизации лабораторных животных показана выработка специфических антител к обеим антигенным детерминантам вируса гриппа А птиц.
Цель представляемой работы заключалась в разработке рекомбинантной кандидатной вакцины нового поколения против вируса птичьего гриппа, полученной посредством сборки in vitro комплексов, включающих иммуногенные эпитопы белков НА и М2 вируса гриппа А на поверхности сферических частиц на основе вириона вируса табачной мозаики.
Методика . Вирионы ВТМ (штамм U1) выделяли из инфицированных растений Nicotiana tabacum L. сорта Samsun, как описано ранее (20). СЧ получали из очищенного препарата ВТМ (5 мг/мл) при 94 °С согласно протоколу (18).
Рекомбинантный белок, содержащий фрагмент молекулы НА вируса гриппа А (16 кДа), был сконструирован на основе штамма A/Kurgan/5/05. Синтез соответствующего фрагмента кДНК гена гемагглютинина осуществляли с помощью ПЦР с обратной транскрипцией (ОТ-ПЦР) с праймерами H562-284-P (5‘-GCGGATCCGGAGTGAAGCCTCTAATTTTA-AGAGATT-3’) и H562-284-M (5'-CGTCTAGATTATTCACTTTTCATAATTA-TTGTTGAGTCCCCT-3'). Амплифицированный фрагмент клонировали по сайтам рестрикции BamHI и XbaI в вектор pQE30 («Qiagen N.V.», Германия). Рекомбинантный белок HA62/284 был экспрессирован в клетках Escherichia coli штамма M15 и очищен по стандартной методике (21). Рекомбинантный белок массой 26 кДа, содержащий эпитоп М2е (23 а.о.) белка М2 вируса гриппа А, слитый с белком дегидрофолатредуктазой, экспрессировали и очищали согласно описанию (11). Комплексы СЧ—
HA62/284-М2е получали in vitro при инкубации белков HA62/284, M2e и СЧ в массовом соотношении 5:5:100 при 25 °С в течение 20 мин.
Образцы для электронной микроскопии готовили в соответствии с ранее описанным протоколом (22). Препараты изучали с помощью электронного микроскопа JEM-1011 («JEOL», Япония), оснащенного цифровой фотокамерой ES500W Erlangshen («Gatan», Япония). Микрофотографии анализировали в программе ImageJ (National Institutes of Health, США).
Антигенную специфичность комплекса СЧ—HA62/284-М2е исследовали методом иммунофлуоресцентной микроскопии (23). В качестве первичных антител использовали антисыворотку кролика, полученную к белку HA62/284, и мышиную антисыворотку к белку М2е вируса гриппа в разведении 1:100. В контрольных образцах стадия добавления первичных антител отсутствовала. Связывание первичных антител с комплексами детектировали при помощи вторичных ослиных антикроличьих антител, конъюгированных с флуорофором Alexa Fluor® 546 («Invitrogen», США), или вторичных куриных антимышиных антител, конъюгированных с флуорофором Alexa Fluor® 488 («Invitrogen», США). Анализ проводили с применением флуоресцентного микроскопа Axiovert 200M («Carl Zeiss», Германия) с интегрированной камерой ORCAII-ERG2 («Hamamatsu», Япония).
Иммуногенность комплексов СЧ—HA62/284-М2е изучали на самках лабораторных беспородных белых мышей в возрасте 6-8 нед массой 15-18 г, разделенных на 4 группы по 5 животных в каждой. Мышей внутрибрюшинно иммунизировали PBS (натрий-фосфатный буфер, phosphate-buffered saline; отрицательный контроль, I группа), свободными рекомбинантными белками HA62/284 и М2е (II группа), белками в смеси с адъювантом Фрейнда (III группа), комплексами СЧ—HA62/284-М2е (IV группа). Доза на одну инъекцию составляла 5 мкг HA62/284, 5 мкг М2е, 100 мкг СЧ; объем смеси, инъецируемой животному, — 0,2 мл. Всего провели 3 иммунизации с 2-недельным интервалом. Кровь для анализа брали через 1 нед после последней иммунизации.
Титр пула антисывороток определяли методом непрямого иммуно-ферментного анализа с помощью Multiscan FC («Thermo Scientific», США), как описано ранее (12). В качестве антигенов использовали белки HA62/284 и М2е в концентрации 10 мкг/мл. Титром антисыворотки считали разведение, в котором оптическая плотность продукта ферментативной реакции вдвое превышала соответствующее значение в отрицательном контроле (неиммунная мышиная сыворотка).
Результаты . Для создания кандидатной вакцины из очищенного препарата ВТМ посредством термической денатурации при 94 °С были получены частицы сферической формы. Для контроля их характеристик использовали просвечивающую электронную микроскопию (рис. 1). Размер полученных СЧ составил 612±41 нм.
А Б

Рис. 1. Электронные микрофотографии сферических частиц, полученных при термической денатурации вируса табачной мозаики. Просвечивающая электронная микроскопия (JEM-1011, «JEOL», Япония); контрастирование 2 % уранилацетатом. Увеличение ½10 000 (А) и ½200 000 (Б).
А
Б
В
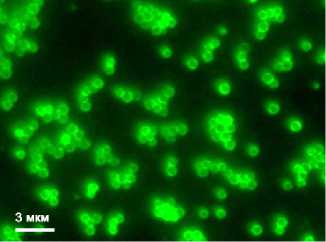
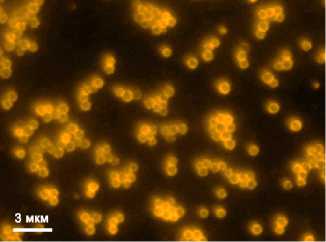
В качестве антигенов вируса гриппа А выбрали участок молекулы гемагглютинина (62-284-й а.о.) штамма A/Chicken/Kurgan/05/2005 (H5N1), содержащий основные вируснейтрализу-ющие эпитопы, и консервативный N-терминальный внеклеточный домен мат-риксного белка М2 (пептид M2e длиной 23 а.о). Гемагглютинин — один из двух основных поверхностных белков вируса гриппа. Этот белок отвечает за связывание вириона с клеточными рецепторами и слияние вирусной оболочки с клеточной мембраной. НА представляет собой главный поверхностный антиген вируса гриппа и служит основной мишенью для нейтрализующих антител. Исследования показали, что район молекулы с 62-го по 284-й а.о. содержит большинство нейтрализующих эпитопов, а также структурные элементы, необходимые для эффективного фолдинга рекомбинантного белка (24). Мембранный белок М2 формирует ионные каналы в липопротеидной оболочке вириона. Фрагмент этого белка длиной 22 а.о. (внеклеточный домен М2 — M2e) экспонируется на внешней поверхности вирусной частицы. Пептид M2e эволюционно консервативен и практически идентичен для всех вирусов гриппа, циркулировавших в популяциях животных, включая пандемические вирусы. В связи с этим он может рассматриваться как перспективный эпитоп для разработки универсальной вакцины против гриппа (25).
Рис. 2. Иммунофлуоресцентная микроскопия комплексов сферических частиц (СЧ) , полученных при термической денатурации вируса табачной мозаики, с белками HA62/284 и М2е вируса гриппа, одновременно адсорбированными на поверхности СЧ: А — белок M2е, выявленный с помощью первичных мышиных антител и вторичных антител, конъюгированных с флуорофором Alexa Fluor® 488; Б — белок HA62/284, выявленный в том же образце с помощью первичных кроличьих антител и вторичных антител, конъюгированных с флуорофором Alexa Fluor® 546; В — соответствующее изображение образца, полученное в режиме фазового контраста. Флуоресцентный микроскоп Axiovert 200M («Carl Zeiss», Германия).
В полученных in vitro комплексах СЧ—HA62/284-М2е, содержащих СЧ и рекомбинантные антигены HA62/284 и М2е вируса гриппа, белки на поверхности СЧ сохранили способность связываться со специфическими антителами к рекомбинантным белкам, что было подтверждено с помощью непрямой иммуннофлуоресцентной микроскопии с двумя различными флуорофорами. Флуоресценция на поверхности СЧ свидетельствовала о том, что оба антигена (HA62/284 и М2е) адсорбировались на одних и тех же сферических частицах и сохраняли антигенную активность в составе комплекса СЧ—HA62/284-М2е (рис. 2, А, Б). Срав нение полученных изображений в режиме флуоресценции (см. рис. 2, А, Б) и фазового контраста (см. рис. 2, В) показало, что все СЧ связаны с молекулами целевого белка, при этом агрегаты антигенных комплексов, не ассоциированные с СЧ, отсутствуют. Следовательно, в анализируемом препарате не были обнаружены СЧ, свободные от антигена. В отрицательном контроле, когда рекомбинантные белки или первичные антитела к ним не использовались, флуоресценцию не наблюдали (данные не приведены), что свидетельствовало об отсутствии неспецифического взаимодействия антивидовых антител, конъюгированных с флуорофором, с поверхностью СЧ. Таким образом, было показано, что адсорбция белков НА и М2е на поверхности СЧ не препятствует их связыванию со специфическими антителами к рекомбинантным белкам вируса гриппа А.
Оценивая способность комплексов СЧ с белками НА и М2e гриппа А птиц стимулировать специфический иммунный ответ, лабораторных мышей иммунизировали свободными белками HA62/284 и М2е или комплексом СЧ—HA62/284-М2е. В сыворотках крови мышей, иммунизированных комплексом СЧ—HA62/284-М2е, наблюдалось значительное увеличение титра антител к вирусным антигенам по сравнению с таковым при введении свободных антигенов (в отсутствие СЧ). Так, при использовании СЧ, на поверхности которых одновременно адсорбированы белки М2е и HA62/284, титр антител к белку М2е составил 2,0½105 (рис. 3, А), к белку HA62/284 — 2,4½105 (см. рис. 3, Б). В отсутствие СЧ в группах мышей, иммунизированных смесью HA62/284 и М2е, титр антисывороток был менее 4,0½104. Титры антисывороток, полученные при иммунизации мышей смесью белков HA62/284 и М2е с использованием адъюванта Фрейнда (одного из самых сильных стимуляторов иммунного ответа, применяемого только в лабораторной практике), составляли 3,0½105 и 3,6½105 (см. рис. 3, А, Б). Таким образом, адсорбция HA62/284 и М2е на поверхности СЧ значительно усиливала иммуногенность рекомбинантных белков при внутрибрюшинных инъекциях: она приводила почти к 10-кратному увеличению концентрации антител к белкам HA62/284 и М2е в сыворотке крови иммунизированных животных по сравнению с показателем при иммунизации свободными белками, что по эффективности сопоставимо с использованием адъюванта Фрейнда.
А
Б
Рис. 3. Адъювантные свойства сферических частиц (СЧ) , полученных при термической денатурации вируса табачной мозаики, в составе кандидатной вакцины — комплекса с антигенными детерминантами вируса гриппа А птиц HA62/284 и М2е (СЧ—HA62/284-М2е) (иммунофермент-ный анализ). На микропланшете иммобилизованы антигены М2е (А) и HA62/284 (Б) в концентрации 10 мкг/мл. Приведены кривые титрования антисывороток при иммунизации лабораторных мышей смесью свободных антигенов ( ♦ ), их смесью с добавлением адъюванта Фрейнда ( ■ ) и комплексом с СЧ ( ▲ ); контроль — неиммунная сыворотка (иммунизация раствором PBS (натрий-фосфатный буфер, phosphate-buffered saline) ( • ).
Важно отметить, что получение ветеринарных вакцин на основе структурно модифицированных вирусов растений (СЧ) позволяет создать отечественные маркерные ветеринарные вакцины: сферические частицы, на которые вырабатывается определенная часть антител при вакцинации комплексом СЧ—патоген (26), могут выступать и в роли маркера, что в дальнейшем позволит отличить вакцинированных птиц от носителей полевого вируса.
Итак, полученные комплексы СЧ—HA62/284-М2е могут быть основой для создания современной рекомбинантной вакцины против вируса гриппа птиц. Преимущество подобного подхода при создании вакцинных препаратов заключается в их высокой эффективности, основанной на стабильности и адъювантной активности сферических частиц, а также безопасности и низкой себестоимости использования вирусов растений. Включение в состав разработанного вакцинного препарата консервативного пептида М2е должно обеспечить защиту как от сезонных, так и от вероятных пандемических вирусов. Кроме того, это маркерная вакцина, позволяющая различать вакцинированных и невакцинированных особей, что важно для оздоровления промышленных популяций птицы.
Список литературы Разработка вакцины против птичьего гриппа на основе структурно модифицированных вирусов растений
- Nikitin N., Petrova E., Trifonova E., Karpova O. Influenza virus aerosols in the air and their infectiousness. Adv. Virol., 2014, 2014: 1-6 ( ) DOI: 10.1155/2014/859090
- Cumulative number of confirmed human cases of avian influenza A(H5N1) reported to WHO. Режим доступа: http://www.who.int/influenza/human_animal_interface/2017_02_14_tab-leH5N1.pdf?ua=1. Без даты.
- Huber V.C. Influenza vaccines: from whole virus preparations to recombinant protein technology. Expert Rev. Vaccines, 2014, 13(1): 31-42 ( ) DOI: 10.1586/14760584.2014.852476
- Treanor J.J., Wilkinson B.E., Masseoud F., Hu-Primmer J., Battaglia R., O’Brien D., Wolff M., Rabinovich G., Blackwelder W., Katz J.M. Safety and immunogenicity of a recombinant hemagglutinin Vaccine for H5 influenza in humans. Vaccine, 2001, 19(13-14): 1732-1737 ( ) DOI: 10.1016/S0264-410X(00)00395-9
- Nicholson K.G., Colegate A.E., Podda A., Stephenson I., Wood J., Ypma E., Zambon M.C. Safety and antigenicity of non-adjuvanted and MF59-ad-juvanted influenza A/Duck/Singapore/97 (H5N3) vaccine: a randomised trial of two potential vaccines against H5N1 influenza. Lancet, 2001, 357(9272): 1937-1943 ( ) DOI: 10.1016/S0140-6736(00)05066-2
- Blanchfield K., Kamal R.P., Tzeng W., Music N., Wilson J.R., Stevens J., Lipatov A.S., Katz J.M., York I.A. Recombinant influenza H7 hemagglutinins induce lower neutralizing antibody titers in mice than do seasonal hemagglutinins. Influenza Other Respir. Viruses, 2014, 8(6): 628-635 ( ) DOI: 10.1111/irv.12285
- Feng J., Zhang M., Mozdzanowska K., Zharikova D., Hoff H., Wunner W., Couch R.B., Gerhard W. Influenza A virus infection engenders a poor antibody response against the ectodomain of matrix protein 2. Virol. J., 2006, 6(3): 102 ( ) DOI: 10.1186/1743-422X-3-102
- Acosta-Ramírez E., Pérez-Flores R., Majeau N., Pastelin-Palacios R., Gil-Cruz C., Ramírez-Saldaña M., Manjarrez-Orduño N., Cervantes-Barragán L., Santos-Argumedo L., Flores-Romo L., Becker I., Isibasi A., Leclerc D., López-Macías C. Translating innate response into long-lasting antibody response by the intrinsic antigen-adjuvant properties of papaya mosaic virus. Immunology, 2008, 124(2): 186-197 ( ) DOI: 10.1111/j.1365-2567.2007.02753.x
- Lico C., Chen Q., Santi L. Viral vectors for production of recombinant proteins in plants. J. Cell Physiol., 2008, 216(2): 366-377 ( ) DOI: 10.1002/jcp.21423
- Manuel-Cabrera C.A., Márquez-Aguirre A., Rodolfo H.G., Ortiz-Lazareno P.C., Chavez-Calvillo G., Carrillo-Tripp M., Silva-Rosales L., Gutiérrez-Ortega A. Immune response to a potyvirus with exposed amino groups available for chemical conjugation. Virol. J., 2012, 9: 75 ( ) DOI: 10.1186/1743-422X-9-75
- Karpova O., Nikitin N., Chirkov S., Trifonova E., Sheveleva A., Lazareva E., Atabekov J. Immunogenic compositions assembled from tobacco mosaic virus-generated spherical particle platform and foreign antigens. J. Gen. Virol., 2012, 93(2): 400-407 ( ) DOI: 10.1099/vir.0.036293-0
- Trifonova E., Nikitin N., Gmyl A., Lazareva E., Karpova O., Atabekov J. Complexes assembled from TMV-derived spherical particles and entire virions of heterogeneous nature. J. Biomol. Struct. Dyn., 2014, 32(8): 1193-1201 ( ) DOI: 10.1080/07391102.2013.816868
- Lebel M.E., Daudelin J.F., Chartrand K., Tarrab E., Kalinke U., Savard P., Labrecque N., Leclerc D., Lamarre A. Nanoparticle adjuvant sensing by TLR7 enhances CD8+ T cell-mediated protection from Listeria monocytogenes infection. J. Immunol., 2014, 192(3): 1071-1078 ( ) DOI: 10.4049/jimmunol.1302030
- Denis J., Acosta-Ramirez E., Zhao Y., Hamelin M.E., Koukavica I., Baz M., Abed Y., Savard C., Paré C., Lopez Macias C., Boivin G., Leclerc D. Development of a universal influenza A Vaccine based on the M2e peptide fused to the papaya mosaic virus (PapMV) Vaccine platform. Vaccine, 2008, 26(27-28): 3395-4003 ( ) DOI: 10.1016/j.vaccine.2008.04.052
- Mathieu C., Rioux G., Dumas M.C., Leclerc D. Induction of innate immunity in lungs with virus-like nanoparticles leads to protection against influenza and Streptococcus pneumoniae challenge. Nanomedicine, 2013, 9(7): 839-848 ( ) DOI: 10.1016/j.nano.2013.02.009
- Атабеков И.Г., Никитин Н.А., Карпова О.В. Новый тип платформ для сборки вакцин in vitro. Вестник Московского университета, Серия 16. Биология, 2015, 4: 29-35.
- Никитин Н.А., Трифонова Е.А., Карпова О.В., Атабеков И.Г. Биобезопасность вирусов растений для человека и животных. Вестник Московского университета, Серия 16. Биология, 2016, 3: 20-26.
- Atabekov J., Nikitin N., Arkhipenko M., Chirkov S., Karpova O. Thermal transition of native tobacco mosaic virus and RNA-free viral proteins into spherical nanoparticles. J. Gen. Virol., 2011, 92(2): 453-456 ( ) DOI: 10.1099/vir.0.024356-0
- Nikitin N.A., Malinin A.S., Rakhnyanskaya A.A., Trifonova E.A., Karpova O.V., Yaroslavov A.A., Atabekov J.G. Use of a polycation spacer for noncovalent immobilization of albumin on the thermally modified virus particles. Polym. Sci. Ser. A, 2011, 53(11): 1026-1031 ( ) DOI: 10.1134/S0965545X11110083
- Трифонова Е.А., Никитин Н.А., Кирпичников М.П., Карпова О.В., Атабеков И.Г. Способ получения и характеристика сферических частиц -новых биогенных платформ. Вестник Московского университета, Серия 16, Биология, 2015, 4: 46-50.
- Zayakina O.V., Arkhipenko M.V., Kozlovsky S.V., Nikitin N.A., Smirnov A.A., Susi P., Rodionova N.P., Karpova O.V., Atabekov J.G. Mutagenic analysis of Potato Virus X movement protein (TGBp1) and the coat protein (CP): in vitro TGBp1-CP binding and viral RNA translation activation. Mol. Plant Pathol., 2008, 9(1): 37-44 ( ) DOI: 10.1111/j.1364-3703.2007.00445.x
- Nikitin N., Trifonova E., Evtushenko E., Kirpichnikov M., Atabekov J., Karpova O. Comparative study of non-enveloped icosahedral viruses size. PLoS ONE, 2015, 10(11): e0142415 ( ) DOI: 10.1371/journal.pone.0142415
- Nikitin N., Trifonova E., Karpova O., Atabekov J. Examination of biologically active nanocomplexes by nanoparticle tracking analysis. Microsc. Microanal., 2013, 19(4): 808-813 ( ) DOI: 10.1017/S1431927613000597
- Song L., Nakaar V., Kavita U., Price A., Huleatt J., Tang J., Jacobs A., Liu G., Huang Y., Desai P., Maksymiuk G., Takahashi V., Umlauf S., Reiserova L., Bell R., Li H., Zhang Y., McDonald W.F., Powell T.J., Tussey L. Efficacious recombinant influenza vaccines produced by high yield bacterial expression: a solution to global pandemic and seasonal needs. PLoS ONE, 2008, 3(5): e2257 ( ) DOI: 10.1371/journal.pone.0002257
- Deng L., Cho K.J., Fiers W., Saelens X. M2e-based universal influenza A Vaccines. Vaccines, 2015, 3(1): 105-136 ( ) DOI: 10.3390/vaccines3010105
- Trifonova E., Zenin V., Nikitin N., Yurkova M., Ryabchevskaya E., Putlyaev E., Donchenko E., Kondakova O., Fedorov A., Atabekov J., Karpova O. Study of rubella candidate vaccine based on a structurally modified plant virus. Antiviral Res., 2017, 144: 27-33 ( ) DOI: 10.1016/j.antiviral.2017.05.006


