Разработки южного научного центра ран в области криоконсервации репродуктивных клеток рыб
Автор: Белая Мария Михайловна, Красильникова Александра Андриановна, Пономарева Елена Николаевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 5-2 т.20, 2018 года.
Бесплатный доступ
В статье рассматриваются вопросы низкотемпературного консервирования репродуктивных клеток рыб сотрудниками Южного научного центра Российской академии наук. Отмечено, что удалось усовершенствовать методику замораживания спермы рыб, которая показывает стабильно высокие результаты по выживаемости и активности дефростированных сперматозоидов (80-90 %). При хранении образцов репродуктивных клеток в жидком азоте, их качество не изменяется на протяжении долгого времени. На основании проведенных исследований создан криобанк генетического материала рыб.
Биоразнообразие, криоконсервация, репродуктивные клетки, редкие и исчезающие виды рыб, криобанк
Короткий адрес: https://sciup.org/148314065
IDR: 148314065 | УДК: 576.371
Текст научной статьи Разработки южного научного центра ран в области криоконсервации репродуктивных клеток рыб
Работы выполнены в рамках реализации Гранта Президента РФ для государственной поддержки молодых российских ученых МК-159.2017.11 и ГЗ ЮНЦ РАН «Оценка современного состояния, анализ процессов формирования водных биоресурсов южных морей России в условиях антропогенного стресса и разработка научных основ технологии реставрации ихтиофауны, сохранения и восстановления хозяйственно ценных видов рыб»,
№ госрегистрации 01201354245» c использованием
Биоресурсной коллекции редких и исчезающих видов рыб ЮНЦ РАН № 73602.
Сохранение биоразнообразия естественных популяций рыб является неотъемлемой частью современной науки. В условиях катастрофического снижения численности большого количества ценных промысловых рыб в последние годы, а также в связи с нарушением видового и популяционного баланса, этот вопрос становится особенно актуальным.
В настоящее время гидрология ряда рек изменена настолько, что многие виды рыб не имеют возможности воспроизводства естественным путем [1].
Для сохранения и восполнения численности отдельных популяций рыб разработаны биотехнологии искусственного воспроизводства на различных рыбоводных предприятиях. В их основу положены принципы содержания и использования производителей из маточных стад, содержащихся на предприятии, что, в свою оче-
редь, ограничивает число особей, скрещивающихся между собой, и приводит впоследствии к инбридингу. Кроме того, в формировании маточных стад на рыбоводных заводах, особенно осетровых, отсутствуют какие-либо принципы и, зачастую, оно носит стихийный характер, что связано с нехваткой производителей.
Все это отражается на качестве (физиологическая, генетическая полноценность) молоди, выпускаемой с рыбоводных заводов [2-5]. Отмечено, что выпуск «заводской» молоди осетровых в водоемы увеличивает долю гетерозигот в популяции, а это приводит к сокращению численности и постепенной деградации потомства [6-9].
Криоконсервация остается одним из наиболее привлекательных и быстроразвивающихся направлений сохранения редких исчезающих видов. Наличие в криобанке генетически репрезентативных коллекций геномов рыб и маточных стад на рыбоводных заводах позволяет с максимальным эффектом сохранить генетическое разнообразие ценных промысловых объектов [10].
В настоящее время имеются данные о сохранении живых органелл, клеток, тканей, органов и целых организмов при сверхнизких температурах в течение длительного периода времени. Криоконсервацию широко используют для хранения спермы и эмбрионов млекопитающих, но исследований по криосохранению клеток морских гидробионтов немного.
Полученные результаты по дефростирован-ной сперме, а также по оплодотворяемости ею икры различных видов рыб нестабильны и варьируют в широких пределах (10-90 %). Тем не менее, для сохранения редких и исчезающих видов существующие методы криоконсервации их спермы пригодны для замораживания биоматериала, хранения в коллекционных банках и восстановления гидробионтов.
Однако проблема создания криотехнологий для больших объемов спермы, необходимых для формирования производственных криобанков, внедрения криотехнологий в производство решается очень медленно. Можно повысить эффективность существующей системы селекционно-племенных хозяйств и рыбоводных заводов, если использовать криотехнологии в процессе воспроизводства промысловых и заводских популяций.
Вопросами сохранения редких и исчезающих видов рыб методами низкотемпературного консервирования занимаются ученые Южного научного центра Российской академии наук (ЮНЦ РАН) с 2004 г. Разработки и достижения подтверждены патентами, ноу-хау, публикациями в ведущих российских и зарубежных изданиях [10-29].
До настоящего времени нет универсальной методики криоконсервации репродуктивных клеток рыб, что связано с их видоспецифич-ностью, обусловленной различным строением спермиев и яйцеклеток у разных видов рыб.
Способы криоконсервации различаются обычно: по составу основного криозащитного раствора и наличию дополнительных компонентов (сахара, белки, яичный желток, липиды); по скоростям охлаждения; используемому криопротектору; объему замораживаемого материала [30, 31].
Считается, что существенную роль в криоповреждении могут играть кристаллы льда, формирующиеся при замерзании криозащит-ных растворов.
Образование кристаллов льда наряду с другими негативными факторами (осмотический шок, латеральная диффузия липидов и белков, рекристаллизация при оттаивании, токсичность растворов криопротекторов) значительно снижает выживаемость клеток после процедуры замораживания-оттаивания при криоконсервации живых клеток и, в частности, сперматозоидов [32].
При поиске эффективных криозащитных составов надо учитывать не только размер и периметр кристаллов льда, образующихся при замерзании криозащитного раствора, но и форму кристаллов. Наиболее эффективны криозащит-ные растворы, при замерзании которых образуются кристаллы округлой формы, или наблюдается картина, близкая к стеклованию [33].
Сотрудниками ЮНЦ РАН разработаны оптимальные составы криосред для осетровых, карповых, белорыбицы [16, 17, 20, 22], обеспечивающие высокий уровень выживаемости дефро-стированных сперматозоидов (60-85 %) [34].
При охлаждении клеток важно избежать образования внутриклеточного льда или минимизировать процесс. При быстром замораживании (выше 100 °C/мин) внутриклеточная вода не успевает выйти из клеток, переохлаждается, что приводит к образованию кристаллов льда внутри клеток [35]. При медленном замораживании (менее 0,1 °C/мин) клетки теряют много воды, а это ведет к сжатию и лизису клеток. Поэтому для успешной криоконсервации необходим баланс между двумя негативными факторами: образованием внутриклеточного льда и осмотическими эффектами [36].
По результатам работ сотрудников ЮНЦ РАН определены оптимальные скорости замораживания для разных видов рыб. Так установлено, что для русского осетра оптимальная скорость замораживания 3 °C/мин [17], для белорыбицы – сверхскоростное замораживание на тефлоновой пластине [20], для карповых – ступенчатый режим замораживания (6 ºС/мин в течение 6 минут, 10 ºС/мин, в течение 4 минут, затем погружение в жидкий азот) [14, 37, 38, 39].
Для улучшения проникновения криораствора в клетки научные сотрудники ЮНЦ РАН разработали методику электростимуляции спермы рыб перед эквилибрацией. Так, установлено, что при воздействии прямоугольного низкочастотного сигнала на семенную жидкость, увеличивается процент живых клеток после дефростации [10, 15, 17-19].
Однако все криопротекторы оказывают токсическое воздействие на сперму рыб при длительном контакте [34, 40-43]. После размораживания часто отмечаются живые сперматозоиды, которым не хватает энергии для активации движения. Также установлено, что дефростирован-ные спермии начинают двигаться не сразу после активации водой, а спустя некоторое время [44]. Для снижения негативного влияния криопротекторов создан метод выведения токсических веществ из репродуктивных клеток [10, 17, 21].
На основе проведенных исследований сотрудниками ЮНЦ РАН усовершенствована технология криоконсервации спермы рыб (Рис. 1) [10, 17].
Из рисунка 1 видно, что качество дефрости-рованной спермы, замороженной по усовершенствованной схеме, значительно выше, чем по традиционной схеме. Сперму такого высокого качества целесообразно использовать для оплодотворения икры, а также для формирования криобанка.
Применение электростимуляции и выведения криопротектора из половых клеток после

Разбавление спермы криозащитной средой
Разбавление спермы криозащитной средой
Эквилибрация
Эл ектро стимуляция
Замораживание
Эквилибрация
Дефростирование
Замораживание
Выживаемость
50 – 60 %
Дефростирование
Выведение протектора раствором NaCl
+
Эл ектростимуляция
Выживаемость
80 – 90 %
Рис. 1. Качество спермы рыб в процессе криоконсервации с использованием усовершенствованной схемы дефростации увеличивает репродуктивные качества спермы рыб. Каждое из новых звеньев процесса криоконсервации способствует улучшению качества спермы, однако применение их в совокупности дает наилучший эффект (Рис. 2).
Однако активность и время жизни сперматозоидов являются субъективными показателями качества. Наиболее убедительными тестами успешности криоконсервации служат оплодотворение размороженными сперматозоидами и последующий анализ полученных эмбрионов.
Сначала проводят оплодотворение икры в лабораторных условиях в небольших количествах, а затем в производственных условиях на крупных партиях икры.
В лабораторных условиях получены стабильно высокие показатели оплодотворения икры дефростированной спермой осетровых рыб – 80-90 %. Показатели оплодотворения икры тех же партий нативной спермой в условиях рыбоводного завода составили 70-75 %.
Это объясняется тем, что для каждой партии спермы свойственна гетерогенность структуры. Наиболее активные спермии, способные к высокому проценту оплодотворения составляют, как правило, 25%; 60% партии – сперма среднего качества, спермии которой способны к оплодотворению, и третья составляющая 15% – нежизнеспособная сперма [45].
В процессе низкотемпературного консервирования в первую очередь гибели подвержены слабые спермии, после дефростации живыми остаются более сильные, способные к высокому уровню оплодотворения спермии. Таким образом, криоконсервация может служить способом получения элитных сперматозоидов, дающих мощное, физиологически полноценное потомство.
Это подтверждается исследованиями по оплодотворению икры в условиях рыбоводных заводов, проведенными с использованием деф-ростированной спермы русского осетра и белорыбицы [10, 20]. Отмечено, что полученное потомство по морфометрическим и физиологическим показателям не уступает нативному, а зачастую и превосходит его [10, 26, 28].
На основе усовершенствованной методики низкотемпературного консервирования половых клеток рыб начато формирование криобанка-репродуктора, основной целью которого является сохранение генетического разнообразия рыб и обеспечение рыбоводных предприятий репродуктивными клетками в необходимом количестве.
Криобанк ежегодно пополняется образцами спермы различных видов рыб. В настоящее время на долгосрочное хранение заложено более 12 л спермы ценных видов рыб (русский осетр, белуга, севрюга, стерлядь, веслонос, шип, белорыбица).
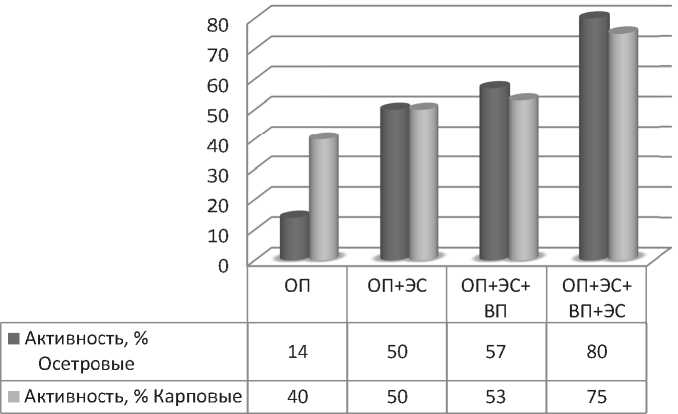
A
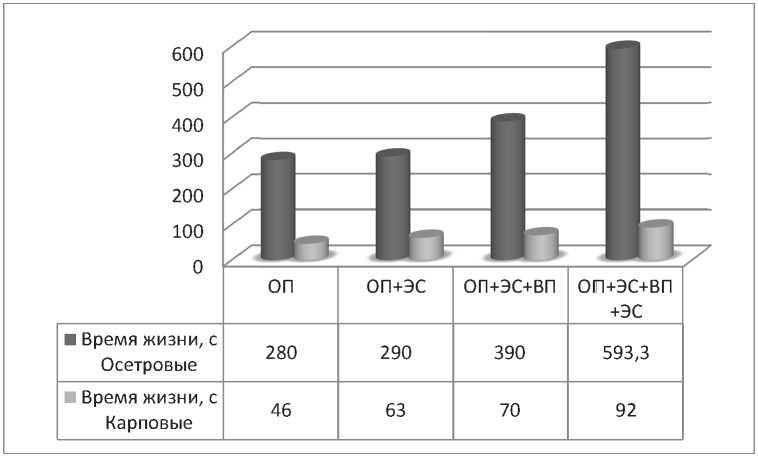
Б
Рис. 2. Изменение качества дефростированной спермы при использовании разных способов криоконсервации: А – активность дефростированной спермы, с; Б – время жизни спермиев, с;
ОП – применение оптимальных протекторов, ЭС – электростимуляция, ВП – выведение протектора из клеток
Ведется систематическая проверка качества спермы, хранящейся в криобанке. Установлено, что за это время сперма не утрачивает оплодотворяющей способности (Табл. 1).
Полученные данные сопоставимы с теоретическими расчетами времени хранения спермы, при котором не изменяется качество спермы. По мнению некоторых авторов [32] хранить образцы спермы можно сотни лет без утраты их функций.
Также сотрудники ЮНЦ РАН проводят исследования по замораживанию яйцеклеток рыб. Получены стабильные результаты по сохранению целостности оболочек икры после дефростации, а также проведены работы по оплодотворению дефростированной икры спермой [46, 47].
Сохранение репродуктивных клеток в криобанке позволяет получать необходимое количество дефростированных половых продуктов рыб в любое удобное время вне зависимости от внешних факторов. Получение свежей (нативной) спермы и икры может растягиваться на неопределенное время из-за долгого созревания производителей, также есть риск, что сперма или икра будет низкого качества или не будет получена вовсе. Криоконсервированную сперму
Таблица 1. Качество спермы стерляди после долгосрочного хранения в жидком азоте
|
Срок хранения, год |
Активность дефростированной спермы, % |
Процент оплодотворения |
|
1 |
92±2,3 |
67±3,3 |
|
2 |
90±2,0 |
69±2,7 |
|
3 |
90±1,9 |
70±2,8 |
|
4 |
90±1,8 |
67±1,9 |
|
5 |
90±2,4 |
69±2,2 |
|
6 |
90±2,1 |
70±1,7 |
можно хранить десятилетиями в жидком азоте без изменения репродуктивных показателей, в то время как нативная сохраняет свои качества в течение 3-4 суток. Ежегодное пополнение и обновление коллекции образцов репродуктивных клеток позволяет расширить генофонд воспроизводимых видов рыб; дает возможность выбора половых клеток с высокими репродуктивными качествами для проведения селекционных работ и товарного выращивания рыб.
Список литературы Разработки южного научного центра ран в области криоконсервации репродуктивных клеток рыб
- Подушка, С.Б. Кризис заводского воспроизводства в России и возможные пути его преодоления / С.Б. Подушка // Научно-технический бюллетень лаборатории ихтиологии ИНЭНКО. - 2007. № 12. - С. 5-15.
- Алтухов, Ю.П. Генетика популяций и сохранение биоразнообразия / Ю.П. Алтухов // Соросовский общеобразовательный журнал, 1995. № 1. - С. 32-43.
- Алтухов, Ю.П. Перепроизводство молоди рыбоводными заводами как причина деградации волжского стада русского осетра / Ю.П. Алтухов, А.Н. Евсюков // ДАН СССР. - 2001. - Т. 380, № 2. - С. 273-275.
- Рябова, Г.Д. О возможном влиянии рыбоводства на генетические и биологические характеристики севрюги / Г.Д. Рябова, М.В. Офицеров, В.О. Климонов // Состояние и перспективы научно-практических разработок в области марикультуры России. - М.: ВНИРО, 1996. - С. 269-274.
- Рябова, Г.Д. Влияние рыбоводства на генотипические и фенотипические характеристики волжской поздней яровой севрюги / Г.Д. Рябова, В.О. Климонов, К.И. Афанасьев // Аквакультура осетровых рыб: достижения и перспективы развития. - М.: ВНИРО, 2006. - С. 213-216.


