Развитие изокортекса крысы в антенатальном и постнатальном онтогенезе
Автор: Бонь Е.И.
Журнал: Тюменский медицинский журнал @tmjournal
Статья в выпуске: 1 т.23, 2021 года.
Бесплатный доступ
В настоящей работе проведен анализ и обобщение данных литературы о развитии изокортекса крысы в антенатальном и постнатальном онтогенезе. Сведения о сроках созревания нейронов изокортекса дают фундаментальную основу для дальнейших исследований его развития и влияние на этот процесс различных эндогенных и экзогенных факторов.
Крысы, изокортекс, нейроны, онтогенез
Короткий адрес: https://sciup.org/140303372
IDR: 140303372 | DOI: 10.36361/2307-4698-2020-23-1-31-34
Текст научной статьи Развитие изокортекса крысы в антенатальном и постнатальном онтогенезе
Лабораторная крыса являются частым объектом исследований центральной нервной системы, в том числе коры больших полушарий головного мозга (изокортекса). Для адекватной интерпретации полученных данных и правильной экстраполяции их на человека необходимы ясные представления об антенатальном и постнатальном онтогенезе изокортек-са у этих животных.
В антенатальном и раннем постнатальном периоде развития организма преобладают процессы пролиферации и дифференцировки нервных элементов с усложнением их структуры, снижается плотность расположения нейронов и глии, нервные клетки укрупняются, дифференцируются по форме и величине. В цитоплазме нейронов формируются глыбки хроматофильного вещества (тигроида), уменьшаются число ядрышек и размеры ядра, увеличиваются размеры перикариона, число и длина отростков и усложняется их ветвление. Данные изменения обусловлены характером функциональных требований, предъявляемых к центральной нервной системе в процессе созревания организма [1, 2, 3, 4, 5, 10, 18, 19, 20, 22].
В онтогенезе изокортекса головного мозга крысы выделяют четыре периода развития [4, 7].
Первый период длится до рождения и представляет собой этап закладки коры и интенсивной клеточной пролиферации. Так, к 15-м суткам внутриутробного развития происходит выделение коры из переднего мозгового пузыря конечного мозга. При этом закладка коры представлена 16-20 рядами клеток различной степени дифференцировки с преобладанием нейробластов. На 16-й день пренатального онтогенеза, по сравнению с предыдущим сроком, толщина закладки неокортекса возрастает на 86. Между закладкой коры и клетками, расположенными вблизи полостей желудочков, отмечается появление нервных волокон. На 17-е сутки толщина стенки возрастает на 83%, по сравнению с 16-суточными эмбрионами. В коре полушарий отмечается дифференцировка кле- ток молекулярного и наружного зернистого слоев. На 18-е сутки эмбриогенеза стенка конечного мозга белой крысы утолщается еще на 18%, что объясняется увеличением числа нейронов в коре, особенно в наружных зернистом и пирамидных слоях [4, 5, 6, 7, 21].
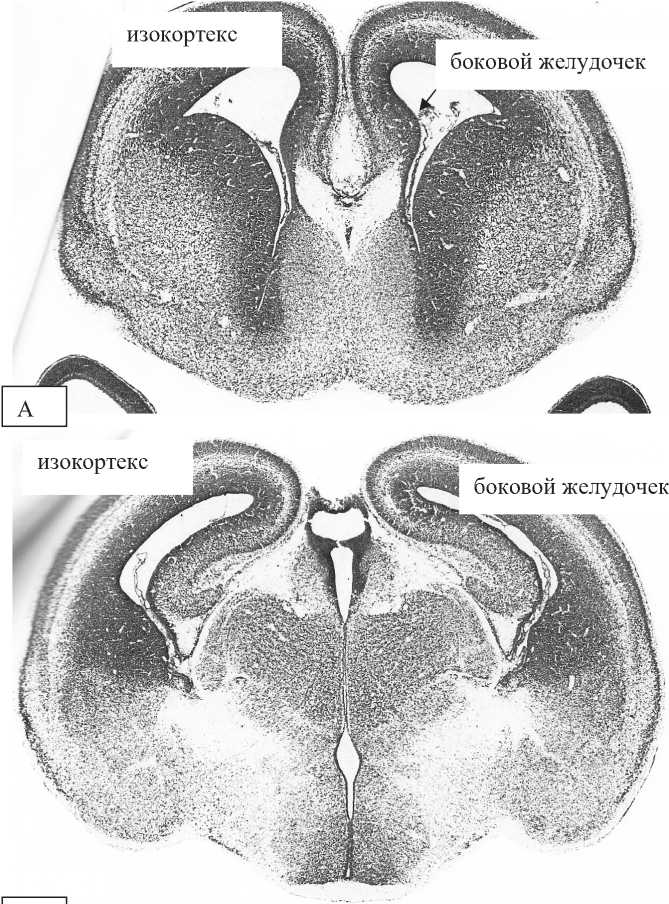
На 19-е сутки внутриутробной жизни толщина неокортекса белой крысы увеличивается на 11%, что связано с нарастанием числа нейронов во всех слоях коры и обособлением ее внутреннего зернистого слоя (рисунок 1).
При этом клетки наружного и внутреннего пирамидных слоев находятся на разных стадиях дифференцировки. Слой полиморфных клеток выражен слабо, в нем выявляются единичные фигуры митоза.
На 20-е сутки эмбриогенеза клетки пирамидных слоев находятся на разных стадиях дифференцировки, среди них наблюдается нарастание зрелых форм, что характерно в эти сроки для всех слоев. На внутренней поверхности полиморфного слоя определяется пластинка белого вещества. В связи с нарастанием процесса дифференцировки структурных элементов коры полушарий толщина неокортекса увеличивается на 4%, по сравнению с эмбрионами 19-х суток [4, 5, 6, 14].
Второй период онтогенеза коры головного мозга крысы занимает первые 10 дней после рождения, его обычно называют ростовым периодом. На протяжении первых 10 дней постнатального развития мозг крысы интенсивно растет в орально – каудальном направлении, а в высоту и ширину – меньше. Толщина коры головного мозга новорожденного крысенка равно 0,590,74 мм. Увеличение ее толщины происходит как за счет роста тел нейронов, так и нейропиля [4, 14, 16].
Цитоархитектонически кора мозга новорожденных крысят (21 сутки) крайне незрелая: в соматосенсорной области новой коры можно различить комплекс 2-6-го слоев и 7-й слой (рисунок 2).
На рисунках 1 и 2 представлены аналогичные формации изокортекса. Уровень по отношении к линии Брегма меняется за счет роста головного мозга крысы.
Б
Рисунок 1 – Головной мозг 19-суточного эмбриона крысы. А – 3 мм рострально от линии Брегма, Б – 1,8 мм рострально от линии Брегма [15]
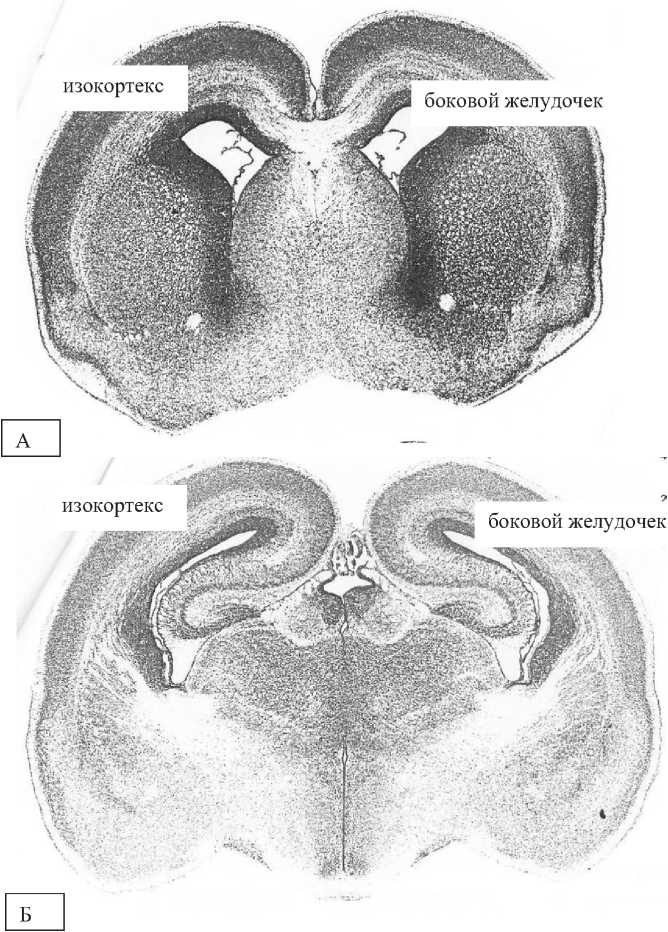
Рисунок 2 – Головной мозг новорожденной крысы. А – 3,8 мм рострально от линии Брегма, Б – 2 мм рострально от линии Брегма [15]
Пирамидные нейроны слабо дифференцированы, они имеют лишь верхушечные дендриты, базальные – лишь в виде зачатков, а их аксоны не имеют коллатералей. У двухдневного крысенка в коре мозга выделяются все слои, имеющиеся у взрослого животного, но в верхнем этаже коры клетки еще тесно прилежат друг к другу. Они имеют узкий ободок цитоплазмы, их ядра округлой или овальной формы, мало различающиеся по размерам в разных слоях коры. К 7-дневному возрасту величина ядер и клеточных тел более вариабельна, особенно в 5 и 3 слоях. Форма ядер округлая или овальная. В цитоплазме четко выделяется эндоплазматическая сеть, в которой возрастает количество цистерн [4, 11, 12].
С 6-го по 10-й день постнатального развития происходят интенсивные процессы дифференцировки в коре головного мозга крысы: в цитоплазме нейронов появляются отчетливо выраженные глыбки хроматофильного вещества, растут дендриты и шипики на них. К 7 дню образуются первые синапсы, что можно наблюдать при электронной микроскопии [4, 6].
Третий период (с 11-го по 20-й день) является периодом продолжающегося роста мозга. В этот период завершается рост дендритов и тел нейронов. Достигает своей дефинитивной величины толщина коры головного мозга, усложняется структура нейронов и межнейрональных связей, созревают субмикроскопические структуры синапсов. На 14 сутки в коре цитоархитектонически определяются все слои, которые имеются в мозгу взрослого животного, но ширина слоев продолжает возрастать, преимущественно за счет верхних. К 14 суткам отмечается значительное уменьшение плотности расположения нейронов. Они имеют выраженное хроматофильное вещество в цитоплазме. Увеличивается число и протяженность дендритов, Количество синапсов увеличивается, усложняются их ветвления, а их субмикроскопическая структура становится похожей на таковую у взрослой крысы.
Рост тел нейронов в коре завершается к 17-20 суткам. Становится постоянным их ядерно–цитоплазматиче-ское отношение. Основная масса дендритов к 18-22 дню по своей протяженности и разветвленности достигает показателей взрослых животных. Дефинитивным к этому возрасту становится и количество шипиков на дендритах. Быстрое увеличение количества дендритов в коре совпадает с резким возрастанием содержания калия в мозге. Это происходит на 15-25 сутки постнатального развития. Количество синапсов особенно возрастает к концу 2-й недели в зрительной коре, что связано с прозреванием крысят и увеличением зрительной афферентации. После 20го дня постнатального развития содержание ДНК в коре головного мозга крысы практически не изменяется. РНК на протяжении третьего периода продолжает интенсивно накапливаться. Причем ее метаболизм крайне чувствителен к различным внешним воздействиям. Обмен гамма-аминомасляной кислоты (ГАМК), более всего ассоциирующийся с метаболизмом в дендритах и аксонах нейронов на этом этапе развития, особенно высок. При этом скорость образования ГАМК превышает интенсивность ее использования. Условные рефлексы у крысы становятся устойчивыми с 23-24 дня [4, 5, 11, 12, 21].
Четвертый период приходится на 21-40 сутки постнатального развития. В этом периоде увеличение массы мозга проходит очень медленно. Основным процессом является интенсивная миелинизация в коре, откуда и его название – период миелогенеза . Миелинизация является одним из важных физиологических процессов, которые происходят во время созревания головного мозга. Начало миелинизации совпадает с ростом активности ферментов сфингомиелиназы и цереброзидазы. Сфингомиелин, цереброзиды и сульфатиды – это основные липиды, входящие в состав миелина и являющиеся его маркерами. Результаты ряда исследований подчеркивает важнейшую функцию эндогенной опиоидной системы в контроле развития олигодендроцитов и сроков миелинизации. Вмешательство в эти регуляторные системы могут нарушить нормальный процесс созревания мозга в критические этапы формирования миелина.
К началу данного периода достигается максимум числа нейронов в коре мозга крысы, толщина коры становится в 2,6 раза больше, чем у новорожденных крыс. Количество синапсов продолжает расти, но еще не достигает уровня, присущего взрослому животному. Вплоть до 45 суток происходит постоянное накопление цереброзидов в мозгу, максимальная же их концентрация достигается к концу 1-го года после рождения [4, 5, 6, 14].
Половозрелыми животные становятся к двум месяцам. Однако развитие мозга крысы полностью завершается только к 90-м суткам после рождения, когда в коре головного мозга завершается процесс миелинизации.
Таким образом, в постнатальном развитии коры головного мозга крысы можно выделить несколько ключевых моментов, доступных для исследования и несущих информацию о нормальном развитии. Это 7 сутки после рождения, когда образуются синапсы, что можно наблюдать при электронной микроскопии, 14 сутки, когда в коре цитоархитектонически определяются все слои, которые имеются в мозгу взрослого животного, 40 сутки, когда завершается миелинизация, и 90 сутки, когда полностью завершается рост головного мозга и его коры [4, 5, 6, 7, 12, 14, 21].
Молекулярно-генетические механизмы развития коры головного мозга.
В процессе гистогенеза нервной ткани – стадии пролиферации и дивергентной дифференцировки (т.е. развитие клеток в определенном направлении) нейроэпителиальных предшественников – медуллобластов и их превращение в нейробласты и глиобласты – преимущественное значение имеют генетические факторы и позиционная информация (специализация клетки определяется контактными взаимосвязями с соседними низкодифференцированными предшественниками). Генетически и фенотипически детермированные предшественники нейронов оказывают выраженные взаимные трофические влияния (т.е. влияния с помощью выделения таких веществ, как цитокины или кейлоны) в процессе своего развития [8, 9, 13, 17].
Сложностью структуры коры головного мозга и упорядоченностью в ней межклеточных связей обусловлены особенности генной регуляции ее онтогенеза. Гены не содержат точных инструкций процесса образования коры, а обеспечивают скорее общие направления развития. Сначала в клетках, из которых в будущем образуется кора, активируется ген Emx1. В момент, когда стволовые клетки начинают свое деление, выстраиваясь в несколько еще одинаковых слоев, начинается экспрессия гена Lhx2. Он задает дальнейшее направление их развития – превращение в те или иные типы нейронов. Кодируемый им белок при этом синтезируется в разных количествах, а ранее однородные слои с этого момента начинают приобретать специфические черты. Количество выработанного клеткой белка определяет дальнейшую ее специализацию, в каждом из слоев запускается своя цепочка биохимических реакций, зависящая от изначальной активности гена Lhx2. Для расслоения одинаковых клеток используется показатель количества, кодируемого одним геном белка, в зависимости от чего клетка направляется по тому или иному пути развития. Задержка экспрессии гена Lhx2 приводит к тому, что вместо неокортекса развивается обонятельная, трехслойная, и более примитивная кора [8, 9, 13, 17]
Важную роль в процессе развития коры головного мозга играет микроРНК. Они принимают участие в транскрипционной и посттранскипционной регуляции экспрессии генов, участвующих в гистогенезе коры головного мозга крысы путём РНК-интерференции. МикроРНК кодируются ядерной ДНК и участвуют в подавлении активности генов, чья экспрессия нежелательна для нормальной дифференцировки нервных клеток: они комплементарно спариваются с участками мРНК и ингибируют их трансляцию. Также имеются данные, указывающие на возможность взаимодействия микроРНК непосредственно с ДНК в процессе РНК-зависимого метилирования ДНК, которое является одним из ключевых механизмов репрессии генов, аллельного исключения и предотвращения активности транспозонов [9, 13].
МикроРНК играют центральную роль в координации транскрипции матричной РНК и стабильности почти всех известных биологических процессов, включая развитие центральной нервной системы. Разнообразные формы микроРНК обеспечивают гибкий контроль экспрессии мРНК развивающихся клеток мозга, что является необходимым условием функциональной специализации нейронов, так как постоянный поток информации требует адаптации нейронов к сигналам окружающей среды. МикроРНК, управляющие созреванием клеток коры головного мозга крыс действуют на различные наборы генов. Известно, что двуцепочечные молекулы РНК (дцРНК) могут активировать гены. Мишенями дцР-НК являются промоторы генов, которые потенциально могут увеличить транскрипцию связанных генов. Были выделены ряд микроРНК-кодирующих генов, вовлеченных в процессы миграции, дифференциров- ки и созревания нейронов. Экспрессия данных генов имеет значительные последствия для развития нейронных структур [8, 9, 17].
Нейронные микроРНК вовлечены в различные этапы формирования нейронных связей, включая дендритогенез (miR-132, miR-134 и miR-124), образование синапса и его созревание (в эти процессы вовлечены miR-134 и miR-138) на втором этапе онтогенеза коры головного мозга крысы. Исследования показали, что некоторые микроРНК экспрессируются на протяжении дифференцировки нервных клеток, а другие – только в зрелых нейронах или синапсах. Таким образом, с помощью микроРНК происходит регуляция развития и функционирования нервной системы, начиная от ее закладки и пролиферации стволовых нервных клеток на протяжении всего онтогенеза. Нарушения экспрессии микроРНК лежат в основе нейродегенеративных заболеваний [9].
Таким образом, изложенные в настоящей статье сведения о развитии изокортекса крысы в антенатальном и постнатальном онтогенезе дают фундаментальную основу для дальнейших исследований его развития в норме и в условиях экспериментальной патологии.
Список литературы Развитие изокортекса крысы в антенатальном и постнатальном онтогенезе
- Бонь Е. И., Зиматкин С. М. Анатомические особенности коры мозга крысы // Новости медико-биологических наук. 2016. Т. 14. № 4. С. 49-54.
- Бонь Е. И., Зиматкин С. М. Изменения хроматофилии цитоплазмы больших пирамидных нейронов новой коры мозга крысы в постнатальном онтогенезе // Вестник Смоленской государственной медицинской академии. 2019. № 1. С. 10-16.
- Бонь Е. И., Зиматкин С. М. Микроскопическая организация изокортекса крысы // Новости медико-биологических наук. 2017. № 4. С. 80-88.
- Зиматкин С. М., Бонь Е. И. Строение и развитие коры головного мозга крысы: монография. Гродно, ГрГМУ, 2019. 155 с.
- Оленев С. Н. Развивающийся мозг. Л.: Наука. 1978. 220 с.
- Попова Э. Н. Морфология приспособительных изменений нервных структур: монография. Москва. Изд. Медицина. 1976. С. 62-82.
- Alvarez-Bolado G., Swanson L. W. Developmental brain maps: Structure of the embryonic rat brain. Elsevier, Amsterdam, 1986. 289 p.
- Borgonovo J., Capella P., Seltzer A., Sosa M. A. Expression of coat proteins changes during postnatal development in selected areas of the rat brain // Int J Dev Neurosci. 2012. V. 30 (4). P. 333-341.
- Chen K., Rajewsky N. The evolution of gene regulation by transcription factors and microRNAs // Nat. Rev. Genet. 2007. V. 8 (2). P. 93-103.
- Chugani H. T. Imaging Brain Metabolism in the Newborn // J Child Neurol. 2018. V. 33 (13). P. 851-860.
- Jiang X., Nardelli J. Cellular and molecular introduction to brain development // Neurobiol Dis. 2016. V. 92. P. 3-17.
- Kolb B., Mychasiuk R., Muhammad A., Gibb R. Brain plasticity in the developing brain // Prog Brain Res. 2013. V. 207. P. 35-64.
- Liscovitch N., Chechik G. Specialization of gene expression during mouse brain development // PLoS Comput Biol. 2013. V. 9 (9). P. 10-19.
- Mancinelli S., Lodato S. Decoding neuronal diversity in the developing cerebral cortex: from single cells to functional networks // Curr Opin Neurobiol. 2018. V. 53. P. 146-155.
- Paxinos G., Watson C. The Rat Brain in stereotaxic coordinates. Academic Press, Australia, 1998. 242 p.
- Penz O. K., Fuzik J., Kurek A. B., Romanov R., Larson J. Protracted brain development in a rodent model of extreme longevity // Sci Rep. 2015. V. 29. P. 5-14.
- Primiani C. T., Ryan V. H., Rao J. S., Cam M. C. Coordinated gene expression of neuroinflammatory and cell signaling markers in dorsolateral prefrontal cortex during human brain development and aging // PLoS One. 2014. V. 10. P. 1-8.
- Su L. D., Xie Y. J., Zhou L., Shen Y., Hu Y. H. LGI1 is involved in the development of mouse brain // Cerebellum. 2015. V. 14 (1). P. 12-14.
- Sutherland-Foggio H. Developing the Brain-Early Illustrations of Cerebral Cortex and Its Gyri // Pediatr Neurol. 2017. V. 75. P. 6-10.
- Tamnes C. K., Walhovd K. B., Dale A. M., Østby Y., Grydeland H., Richardson G. Brain development and aging: overlapping and unique patterns of change // Neuroimage. 2013. V. 68. P. 63-74.
- Van Essen D. C., Donahue C. J., Glasser M. F. Development and Evolution of Cerebral and Cerebellar Cortex // Brain Behav Evol. 2018. V. 91 (3). p. 158-169.
- Wierenga L. M., van den Heuvel M. P., van Dijk S., Rijks Y., de Reus M. A., Durston S. The development of brain network architecture // Hum Brain Mapp. 2016. V. 37 (2). P. 717-29.


