Реакции дыхания на активацию ГАМКа- и ГАМКв-рецепторов парафациальной респираторной группы специфическими агонистами
Автор: Ковалева Т.Е., Ведясова О.А.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 1, 2019 года.
Бесплатный доступ
Цель. Сравнительный анализ роли ГАМКА- и ГАМКВ-рецепторов парафациальной респираторной группы (пФРГ) в центральных механизмах регуляции дыхания у взрослых крыс. Материалы и методы. На наркотизированных уретаном крысах исследовали реакции внешнего дыхания и диафрагмальной мышцы на микроинъекции в область пФРГ растворов мусцимола и баклофена (10-6 М, 200 нл). Инъекции осуществляли через стеклянную микроканюлю по стерео-таксическим координатам. Регистрировали спирограмму и электромиограмму (ЭМГ) диафрагмы в исходном состоянии и в течение 60 мин после микроинъекции указанных агонистов ГАМКА- и ГАМКВ-рецепторов. Результаты. Микроинъекции в пФРГ агониста ГАМКА-рецепторов мусцимола оказывали на дыхание тормозное действие, которое развивалось с коротким латентным периодом. У крыс снижалась минутная вентиляция легких за счет изменений дыхательного объема и частоты дыхания, увеличивалось время вдоха и выдоха. На ЭМГ диафрагмы уменьшалась амплитуда осцилляций, увеличивалась длительность инспираторных залпов и межзалповых интервалов...
Парафациальная респираторная группа, гамка-рецепторы, гамкв-рецепторы, мусцимол, баклофен, внешнее дыхание, электромиограмма диафрагмы
Короткий адрес: https://sciup.org/14116360
IDR: 14116360 | УДК: 612.28 | DOI: 10.34014/2227-1848-2019-1-68-75
Текст научной статьи Реакции дыхания на активацию ГАМКа- и ГАМКв-рецепторов парафациальной респираторной группы специфическими агонистами
Введение. В последние годы главным объектом при изучении центральных механизмов регуляции дыхания является ростральная вентролатеральная медуллярная область, в частности парафациальная респираторная группа (пФРГ), нейроны которой обеспечивают различные аспекты деятельности дыхательного центра [1–3]. В пределах пФРГ локализованы преинспираторные ней- роны [4], участвующие в центральной хеморецепции [5] и совместно с нейронами комплекса пре-Бетцингера генерирующие инспираторную активность [6]. Также в пФРГ имеются экспираторные нейроны Е2-типа, обеспечивающие активную экспирацию [7]. Активность дыхательных нейронов пФРГ контролируется тормозными и возбуждающими нейромедиаторами, например ацетил- холином [8], ГАМК [9, 10], глутаматом [11], глицином [12] и нейромодуляторами, такими как гастрин-рилизинг пептид и нейромедин В [13]. Среди перечисленных регуляторов наибольший интерес вызывают тормозные нейроактивные аминокислоты, особенно ГАМК, которая имеется во всех отделах дыхательного центра и принимает участие в формировании ритма и паттерна дыхания. В исследованиях на взрослых животных показано, что на уровне пФРГ влияние ГАМК на дыхание реализуется с участием ГАМКА-рецепторов [9, 12]. Что касается ГАМКВ-рецепторов, то вопрос об их участии в формировании респираторной активности ранее не изучался.
Цель исследования. Сравнительный анализ роли ГАМК А - и ГАМК В -рецепторов парафациальной респираторной группы в центральных механизмах регуляции дыхания у взрослых крыс.
Материалы и методы. Поставлены две серии острых экспериментов на половозрелых беспородных крысах массой 250–300 г, наркотизированных уретаном (1,5 г/кг, внутрибрюшинно) в строгом соответствии с этическими правилами использования лабораторных животных в научно-исследовательских целях. В ходе операции проводили трахеостомию, обнажали крышу черепа и открывали подход к диафрагмальной мышце через разрез на левом боку животного. Затем крыс переносили в стереотаксический прибор СЭЖ-3, фиксировали голову и высверливали трепанационное отверстие в окципитальной кости для доступа к пФРГ. В первой серии опытов (n=8) осуществляли микроинъекции в пФРГ раствора специфического агониста ГАМКА-рецепторов мусцимола, во второй (n=9) – специфического агониста ГАМК B -рецепторов баклофена (Sigma Aldrich). Растворы с концентрацией 10-6 М готовили разведением в искусственной спинномозговой жидкости ex tempore и вводили в пФРГ уни-латерально в объеме 200 нл через стеклянную канюлю с диаметром кончика 20–25 мкм при помощи микрошприца МШ-1. Стереотаксические координаты пФРГ: 11,3 мм каудаль-нее bregma ; 2,3 мм латеральнее срединного шва; 9,4 мм вглубь от дорсальной поверхности мозжечка [9].
Регистрировали внешнее дыхание с помощью электронного спирографа, подсоединенного к трахеотомической трубке, и электромиограмму (ЭМГ) диафрагмальной мышцы, которую отводили стальными биполярными электродами, соединенными с усилителем электромиографа. Выходные сигналы от спирографа и электромиографа подавались на аналогово-цифровой преобразователь, затем на компьютер и записывались в программе PowerGraph 3.2 Professoinal (ООО «Интероптика-С»). Запись велась непрерывно в исходном состоянии и в течение 60 мин после микроинъекции. По спиро-граммам оценивали минутный объем дыхания (МОД, мл-1), дыхательный объем (ДО, мл), длительность вдоха (Ti, с), объемную скорость инспираторного потока (Vi, мл/c), длительность выдоха (Te, с), частоту дыхания (ЧД, мин-1). На ЭМГ диафрагмы определяли длительность инспираторных залпов (ДЗ, с), межзалповые интервалы (МЗИ, с), амплитуду осцилляций (отн. ед.).
Результаты экспериментов обрабатывали в программе SigmaPlot 12.5 (Systat Software Inc.). Использовали Normality Test Shapiro– Wilk и Paired t-test, статистически значимыми считали различия при p<0,05.
Результаты и обсуждение. Основным эффектом микроинъекций в пФРГ крыс раствора селективного агониста ГАМКА-ре-цепторов мусцимола было угнетение легочной вентиляции, на что указывало снижение МОД в течение всего срока наблюдений (табл. 1). Следует отметить, что вклад частотных и объемных параметров спирограммы в данную реакцию был неоднозначным. Характерно, что на 1-10-й мин активации ГАМКА-рецепторов снижение МОД имело наибольшую выраженность (26,0 % от исходного уровня; p<0,01) и было обусловлено существенным уменьшением ДО (на 23,5 %; p<0,01). Однако эффект уменьшения ДО отличался кратковременностью, и в последующие сроки экспозиции изменения МОД начинали определяться преимущественным вкладом ЧД. Так, на 40-й мин действия ГАМКА-агониста МОД уменьшался по сравнению с исходным уровнем на 17,9 % (p<0,05), что было связано с ростом общей продолжительности дыхательного цикла и снижением ЧД на 9,5 % (p<0,05). Обращает на себя внимание тот факт, что на фоне активации ГАМКА-рецепторов в области пФРГ динамика ЧД определялась изменением длительности не только экспираторной, но и инспираторной фазы. На 1-й мин после микро- инъекции мусцимола ЧД незначительно увеличивалась, что обеспечивалось укорочением Ti на 14,9 % (p<0,01), в более поздние сроки действия мусцимола ЧД закономерно уменьшалась за счет пролонгации как Te, так и Ti на 10,2 (p<0,05) и 12,3 % (p<0,01) соответственно.
Таблица 1
Изменение параметров паттерна внешнего дыхания и ЭМГ диафрагмы у крыс после микроинъекций мусцимола (10-6 М) в пФРГ
|
Параметр |
Исх. |
1-я мин |
5-я мин |
10-я мин |
20-я мин |
30-я мин |
40-я мин |
50-я мин |
60-я мин |
|
Ti, c |
0,33± |
0,27± |
0,34± |
0,35± |
0,35± |
0,35± |
0,37± |
0,35± |
0,35± |
|
0,02 |
0,02** |
0,02** |
0,02* |
0,02 |
0,01 |
0,01** |
0,01 |
0,01 |
|
|
Te, с |
0,51± |
0,51± |
0,50± |
0,48± |
0,51± |
0,50± |
0,54± |
0,56± |
0,57± |
|
0,04 |
0,04 |
0,04* |
0,04 |
0,04 |
0,05 |
0,03* |
0,04* |
0,05 |
|
|
Vi, мл/с |
1,90± |
2,02± |
1,34± |
1,28± |
1,49± |
1,40± |
1,53± |
1,75± |
1,74± |
|
0,14 |
0,21 |
0,12* |
0,13** |
0,21* |
0,17* |
0,11 |
0,13 |
0,16 |
|
|
ЧД, мин-1 |
74,01± |
77,81± |
73,13± |
74,35± |
71,50± |
72,54± |
66,97± |
67,27± |
66,10± |
|
5,20 |
4,63* |
3,74 |
4,65 |
4,61 |
5,49 |
3,31* |
3,42* |
3,83* |
|
|
ДО, мл |
0,61± |
0,54± |
0,45± |
0,44± |
0,51± |
0,48± |
0,55± |
0,60± |
0,61± |
|
0,05 |
0,04* |
0,04* |
0,04** |
0,06 |
0,05 |
0,04 |
0,04 |
0,04 |
|
|
МОД, мл-1 |
44,85± |
41,93± |
32,63± |
32,07± |
36,80± |
35,09± |
37,29± |
40,46± |
40,34± |
|
3,92 |
3,38 |
2,14* |
2,84** |
5,99* |
5,00 |
3,41* |
3,34 |
4,39 |
|
|
МЗИ, с |
0,51± |
0,51± |
0,49± |
0,48± |
0,51±0,04 |
0,50± |
0,54± |
0,56± |
0,57± |
|
0,04 |
0,04 |
0,04 |
0,04* |
0,05 |
0,03 |
0,04* |
0,05* |
||
|
ДЗ, с |
0,35± 0,03 |
0,28± 0,02** |
0,37± 0,03 |
0,37± 0,02 |
0,37± 0,03 |
0,38± 0,03 |
0,41± 0,03* |
0,39± 0,03 |
0,38± 0,03 |
|
Амплитуда осцилляций, |
0,21± 0,02 |
0,21± 0,02 |
0,19± 0,02 |
0,19± 0,02* |
0,19± 0,02 |
0,18± 0,02* |
0,18± 0,02 |
0,19± 0,02 |
0,18± 0,02 |
|
отн. ед. |
Примечание. * – p<0,05; ** – p<0,01 (достоверные различия с исходным уровнем).
Важным показателем, подтверждающим вклад ГАМКергических структур пФРГ в деятельность инспираторных механизмов дыхательного центра, является изменение объемной скорости инспираторного потока (Vi). Достаточно быстро, уже на 5-й мин после микроинъекции мусцимола, Vi уменьшалась на 29,3 % (p<0,05) от исходного уровня, и данная тенденция сохранялась до 40-й мин наблюдений (табл. 1, рис. 1а).
Реакциям внешнего дыхания соответствовали изменения ЭМГ диафрагмы (табл. 1, рис. 1б). На первых минутах после микроинъекции мусцимола на ЭМГ отмечалось уменьшение длительности инспираторных залпов и амплитуды их осцилляций в сочетании с укорочением межзалповых интервалов. По мере действия мусцимола частота залпов диафрагмальной активности уменьшалась, а сами залпы и интервалы между ними увеличивались, что является электрофизиологическим коррелятом ослабления ритмики дыхания на фоне активации ГАМКА-рецепторов пФРГ.
i, мл/с
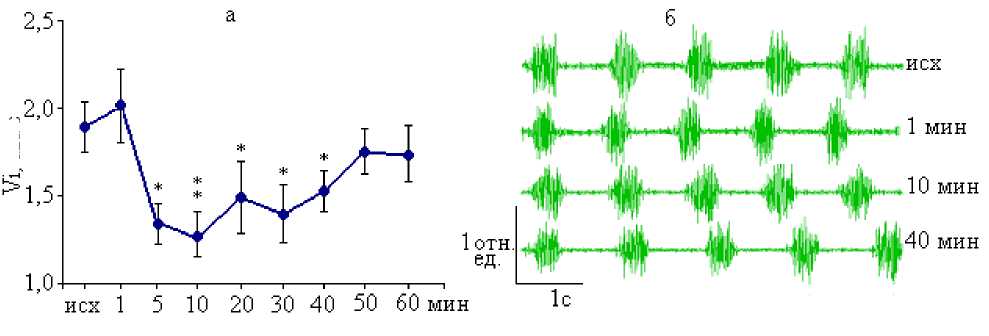
Рис. 1. Респираторные реакции на микроинъекции раствора мусцимола (10-6 М) в пФРГ: а – объемная скорость инспираторного потока; б – суммарная ЭМГ диафрагмы.
Достоверные различия с исходным уровнем при: * – р<0,05; ** – р<0,01
Микроинъекции раствора специфического агониста ГАМК В -рецепторов баклофена в пФРГ крыс также оказывали выраженное угнетающее влияние на легочную вентиляцию (табл. 2). Изменения отдельных параметров паттерна внешнего дыхания, отмеченные в экспериментах с баклофеном, совпадали по направленности с эффектами мусцимола, однако имели место некоторые различия. Во-первых, латентные периоды респираторных эффектов баклофена были более продолжительными, при этом максимальные изменения спирограммы, как и ЭМГ диафрагмы, наблюдались после 30-й мин экспозиции. Одним из объяснений такой растянутой во времени динамики реакций может быть механизм активации метаботропных ГАМКВ-ре-цепторов, включающий в себя сложный каскад обменных процессов и путей передачи сигнала в постсинаптических структурах [15].
Во-вторых, изменения МОД после микроинъекции баклофена в пФРГ, в отличие от мусцимола, в течение всего времени наблюдений определялись отклонением амплитудных параметров спирограммы, а именно ДО, уровень которого закономерно уменьшался (рис. 2а). Так, в конце экспозиции баклофена МОД у крыс снижался на 28,6 % (p<0,01) от исходного уровня (49,12±2,68 мл-1) и составлял 35,08±4,87 мл-1. В это же время достигалось минимальное значение ДО (0,49±0,07 мл), что соответствовало его уменьшению на 24,0 %
(p<0,05) от исходного уровня (0,65±0,05 мл). С этим коррелировало снижение амплитуды осцилляций диафрагмальной активности в среднем на 21,6 % (p<0,05), что хорошо видно на интегрированной ЭМГ (рис. 2б). Что касается временных параметров спирограм-мы, то при активации ГАМК В -рецепторов пФРГ значимо изменялась только величина Ti, которая наиболее выраженно (на 16,8 %; p<0,001) увеличивалась с 30-й по 60-ю мин регистрации. На ЭМГ диафрагмы в эти сроки наблюдалась пролонгация инспираторных залпов на 17,3 % (p<0,05), что совпадало с динамикой Ti. Значения ЧД и Te при воздействии баклофена на пФРГ достоверно не менялись (табл. 2). Величина Vi при этом закономерно уменьшалась в течение всего эксперимента с наибольшим эффектом во второй половине экспозиции. Минимальное значение Vi (1,43±0,24 мл/c; p<0,01) отмечалось на 60-й мин и было на 33,7 % ниже исходного уровня (рис. 2в).
Полученные экспериментальные данные в целом согласуются с современными представлениями о важной роли ГАМКергиче-ских механизмов парафациального региона в регуляции ритма и паттерна дыхания [9, 10]. В настоящей работе выявлено, что в регуляции дыхания нейронами пФРГ участвуют два класса ГАМК-рецепторов – ГАМК А и ГАМК В , которые вносят неоднозначный вклад в формирование респираторных реакций.
Таблица 2
Изменение параметров паттерна внешнего дыхания и ЭМГ диафрагмы у крыс после микроинъекций баклофена (10-6 М) в пФРГ
|
Параметр |
Исх. |
1-я мин |
5-я мин |
10-я мин |
20-я мин |
30-я мин |
40-я мин |
50-я мин |
60-я мин |
|
Ti, c |
0,31± |
0,31± |
0,31± |
0,34± |
0,33± |
0,36± |
0,35± |
0,36± |
0,36± |
|
0,01 |
0,02 |
0,01 |
0,01* |
0,01* |
0,01* |
0,01** |
0,01*** |
0,02** |
|
|
Te, с |
0,49± |
0,49± |
0,44± |
0,47± |
0,46± |
0,48± |
0,50± |
0,49± |
0,50± |
|
0,05 |
0,06 |
0,06 |
0,06 |
0,05 |
0,07 |
0,05 |
0,06 |
0,05 |
|
|
Vi, мл/с |
2,15± |
1,94± |
1,78± |
1,77± |
1,74± |
1,55± |
1,56± |
1,43±0, |
1,43±0, |
|
0,22 |
0,19 |
0,15* |
0,19* |
0,22** |
0,17* |
0,18** |
19** |
23** |
|
|
ЧД, мин-1 |
76,19± 4,33 |
76,94± 5,49 |
81,64± 6,51 |
75,91± 4,68 |
77,47± 5,14 |
73,60± 4,87 |
71,88± 3,74 |
72,37± 4,38 |
71,21± 4,28 |
|
ДО, мл |
0,65± 0,05 |
0,59± 0,04 |
0,56± 0,04** |
0,59± 0,05* |
0,56± 0,06* |
0,55± 0,05* |
0,54± 0,05* |
0,51± 0,06* |
0,50± 0,07* |
|
МОД, мл-1 |
49,12± |
45,50± |
45,35± |
44,89± |
43,32± |
40,24± |
38,54± |
36,40± |
35,08± |
|
2,68 |
3,36* |
3,95 |
4,35 |
4,16** |
4,21* |
3,65** |
3,91** |
4,87** |
|
|
МЗИ, с |
0,31± |
0,48± |
0,45± |
0,47± |
0,46± |
0,48± |
0,49± |
0,49± |
0,50± |
|
0,05 |
0,06 |
0,06 |
0,06 |
0,05 |
0,07 |
0,05 |
0,06 |
0,05 |
|
|
ДЗ, с |
0,49± 0,01 |
0,32± 0,02 |
0,32± 0,01 |
0,34± 0,01** |
0,33± 0,01* |
0,36± 0,01* |
0,35± 0,01** |
0,36± 0,01*** |
0,36± 0,01** |
|
Амплитуда |
0,29± |
0,27± |
0,27± |
0,26± |
0,25± |
0,23± |
0,23± |
0,23± |
0,23± |
|
осцилляций, отн. ед. |
0,03 |
0,03 |
0,03 |
0,03* |
0,02* |
0,02* |
0,02* |
0,02** |
0,02* |
Примечание. * – p<0,05; ** – p<0,01; *** – p<0,001 (достоверные различия с исходным уровнем).
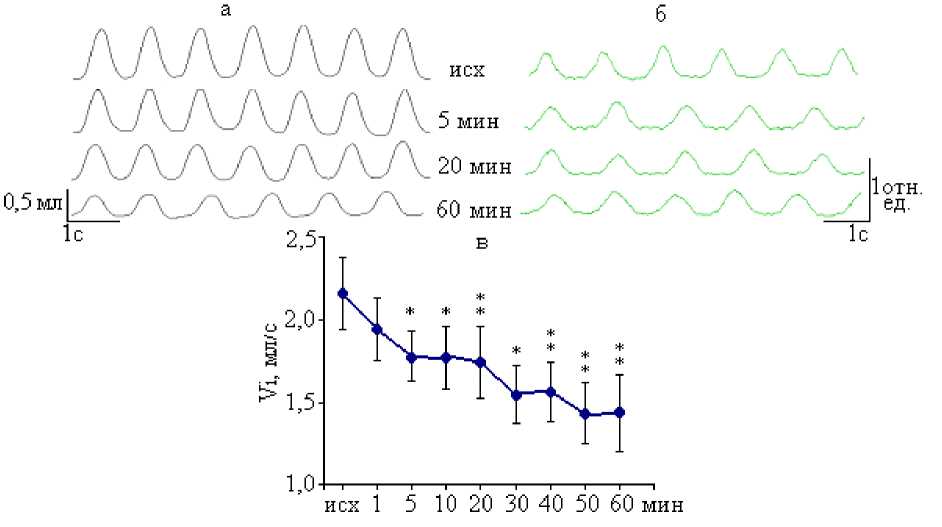
Рис. 2. Респираторные реакции на микроинъекции раствора баклофена (10-6 М) в пФРГ: а – спирограммы; б – интегрированные ЭМГ диафрагмы; в – объемная скорость инспираторного потока. Достоверные различия с исходным уровнем при: * – р<0,05; ** – р<0,01
Во-первых, эффекты активации этих рецепторов различаются по влиянию на дыхательный цикл. При действии агониста ГАМК А -рецепторов мусцимола наблюдалась пролонгация обеих фаз дыхания, тогда как при активации ГАМК В -рецепторов баклофеном удлинялся только вдох. Изменение вдоха в обоих случаях можно объяснить ГАМКер-гическим торможением преинспираторных нейронов пФРГ, которые совместно с аналогичными клетками комплекса пре-Бетцингера составляют основной респираторный ритмо-генератор [2]. Характерное для микроинъекций мусцимола увеличение фазы выдоха, вероятно, обусловлено торможением Е2 экспираторных нейронов, наличие которых в пФРГ описано в ряде работ [7, 11].
Во-вторых, различия в действии агонистов ГАМК А - и ГАМК В -рецепторов касаются скорости формирования респираторных реакций, которая при микроинъекциях мусцимола была больше. Скорее всего это связано с тем, что ГАМК А -рецепторы являются ионотропными и составляют единый комплекс с ионофором, поэтому вызываемое лигандом изменение конформации рецептора ведет к быстрому открыванию каналов для ионов Cl- и моментальной гиперполяризации постсинаптической мембраны [15]. Метаботропные ГАМК B -ре-цепторы имеют иную кинетику мембранных процессов. Их активация ведет к развивающемуся с задержкой слабому, но длительному торможению, тормозной постсинаптический потенциал в этом случае длится несколько сотен миллисекунд [16]. Этот механизм объясняет более позднее развитие ответов системы дыхания на введение в пФРГ баклофена.
При наличии различий в изменениях временных показателей дыхания, микроинъекции ГАМКА- и ГАМКВ-агонистов оказывали сходное влияние на амплитудные параметры спирограммы и ЭМГ диафрагмы. При активации обоих классов ГАМК-рецепторов происходило уменьшение дыхательного объема и амплитуды осцилляций в залпах диафрагмальной активности. Оценивая эти изменения, необходимо напомнить, что во многих публикациях отмечается особая роль пФРГ в регуляции экспираторной фазы дыхательного цикла, в частности в формировании активной экспирации [1, 3]. Что касается участия парафациального региона в регуляции инспирации, то обычно его объясняют активацией хеморецепторов ретротрапециевидно-го ядра [4], нейроны которого переслаиваются с нейронами пФРГ [12]. Наши данные об изменении дыхательного объема и продолжительности вдоха при микроинъекциях агонистов ГАМК в пФРГ свидетельствуют об участии этой области мозгового ствола посредством ГАМКА- и ГАМКВ-рецепторов в модуляции активности механизмов, обеспечивающих процессы формирования не только экспираторного, но и инспираторного моторного выхода. Морфологической основой этих процессов могут быть связи пФРГ с комплексом пре-Бетцингера [17], являющимся основным генератором инспираторного ритма, а также с комплексом Бетцингера [11, 18] и каудальной вентральной респираторной группой [5], которые содержат проприобульбарные и бульбоспинальные экспираторные нейроны.
Заключение. Таким образом, участие пФРГ в регуляции дыхания опосредуется ионотропными ГАМКА- и метаботропными ГАМКВ-рецепторами, которые включены в процессы торможения нейронных структур, контролирующих как временные, так и объемные характеристики паттерна дыхания. При этом ГАМК А -рецепторы в области пФРГ вносят вклад в регуляцию экспирации и инспирации, тогда как ГАМКВ-рецепторы преимущественно участвуют в модуляции инспираторной активности дыхательного центра.
Список литературы Реакции дыхания на активацию ГАМКа- и ГАМКв-рецепторов парафациальной респираторной группы специфическими агонистами
- Feldman J.L., Del Negro C.A., Gray P.A. Understanding the rhythm of breathing: So near, yet so far. Ann. Rev. Physiol. 2013; 75: 423-452.
- Onimaru H., Homma I. A novel functional neuron group for respiratory rhythm generation in the ventral medulla. J. Neurosci. 2003; 23 (4): 1478-1486.
- Pisanski A., Pagliardini S. The parafacial respiratory group and the control of active expiration. Respir. Physiol. Neurobiol. 2018. URL: https://www.ncbi.nlm.nih.gov/pubmed/29933053 (дата обращения: 10.12.2018). DOI: 10.1016/j.resp.2018.06.010
- Abbott S.B., Stornetta R.L., Coates M.B., Guyenet P.G. Phox2b-expressing neurons of the parafacial region regulate breathing rate, inspiration, and expiration in conscious rats. J. Neurosci. 2011; 31 (45): 16410-16422.
- Silva J.N., Tanabe F.M., Moreira T.S., Takakura A.C. Neuroanatomical and physiological evidence that the retrotrapezoid nucleus/parafacial region regulates expiration in adult rats. Respir. Physiol. Neurobiol. 2016; 227: 9-22.
- Onimaru H., Ikeda K., Kawakami K. Phox2b, RTN/pFRG neurons and respiratory rhythmogenesis. Respir. Physiol. Neurobiol. 2009; 168 (1-2): 13-18.
- De Britto A.A., Moraes D.J. Non-chemosensitive parafacial neurons simultaneously regulate active expiration and airway patency under hypercapnia in rats. J. Physiol. 2017; 595 (6): 2043-2064.
- Boutin R.C., Alsahafi Z., Pagliardini S. Cholinergic modulation of the parafacial respiratory group. J. Physiol. 2017; 595 (4): 1377-1392.
- Huckstepp R.T., Cardoza K.P., Henderson L.E., Feldman J.L. Role of parafacial nuclei in control of breathing in adult rats. J. Neurosci. 2015; 35 (3): 1052-1067.
- Vedyasova O.A., Kovaleva T.E. Role of GABAA receptors of parafacial respiratory group in control of respiration in rats. Bull. Exp. Biol. Med. 2018; 165 (6): 711-714.
- Fortuna M.G., West G.H., Stornetta R.L., Guyenet P.G. Betzinger expiratory-augmenting neurons and the parafacial respiratory group. J. Neurosci. 2008; 28 (10): 2506-2515.
- Pagliardini S., Janczewski W.A., Tan W., Dickson C.T., Deisseroth K., Feldman J.L. Active expiration induced by excitation of ventral medulla of adult anesthetized rats. J. Neurosci. 2011; 31 (8): 2895-2905.
- Li P., Janczewski W.A., Yackle K., Kam K., Pagliardini S., Krasnow M.A., Feldman J.L. The peptidergic control circuit for sighing. Nature. 2016; 530 (7590): 293-297.
- Misgeld U., Bijak M., Jarolimek W. A physiological role for GABAB receptors and the effects of baclofen in the mammalian central nervous system. Prog. Neurobiol. 1995; 46 (4): 423-462.
- Belan P.V., Kostyuk P.G. Glutamate-receptor-induced modulation of GABAergic synaptic transmission in the hippocampus. Pflugers Arch. 2002; 444 (1): 26-37.
- Cherubini E., Conti F. Generating diversity at GABAergic synapses. Trends Neurosci. 2001; 24 (3): 155-162.
- Bochorishvili G., Stornetta R.L., Coates M.B., Guyenet P.G. Pre-Betzinger complex receives glutamatergic innervation from galaninergic and other retrotrapezoid nucleus neurons. J. Comp. Neurol. 2012; 520 (5): 1047-1061.
- Smith J.C., Abdala A.P., Rybak I.A., Paton J.F. Structural and functional architecture of respiratory networks in the mammalian brainstem. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2009; 364 (1529): 2577-2587.


