Реакция гороха на инокуляцию ризосферными АЦК-утилизирующими бактериями в присутствии эндомикоризного гриба Glomus intraradices
Автор: Белимов А.А., Демчинская С.В., Сафронова В.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Растительно-микробные взаимодействия
Статья в выпуске: 3 т.47, 2012 года.
Бесплатный доступ
В вегетационном опыте с генотипами гороха, контрастными по эффективности образования эндомикоризного симбиоза (высокоэффективный генотип 8599 и низкоэффективный генотип 1025), растения выращивали в присутствии или в отсутствие эндомикоризного гриба Glomus intraradices CIAM8 и инокулировали ассоциативными бактериями Pseudomonas brassicacearum Am3 или Pseudomonas putida Bm3, содержащими 1-аминоциклопропан-1-карбоксилат (содержащими АЦК) дезаминазу. Инокуляция генотипа 8599 штаммом Am3 повысила биомассу побегов и корней на 60 % у немикоризованных растений. У микоризованных растений оба штамма обусловили увеличение биомассы побегов на 40 %, а также биомассы корней на 40 % (штамм Am3) и 70 % (штамм Bm3). Влияния микоризы и бактерий на рост у генотипа 1025 не обнаружили. При микоризации генотипа 8599 ассоциативные бактерии снизили содержание азота в побегах на 20 %, но в отсутствие микоризы повысили содержание фосфора у генотипа 1025 на 25 % (штамм Am3) и 50 % (штамм Bm3). При высокой и одинаковой степени развития микоризных структур у обоих генотипов гороха штамм Bm3 снизил обилие арбускул и везикул в корнях растений у генотипа 8599. Микоризация растений способствовала усилению ростстимулирующего действия бактерий у генотипа 8599. Полученные результаты представляют интерес для эффективного использования биопрепаратов и селекции сортов, обладающих высокой симбиотрофностью.
Арбускулярная микориза, ацк дезаминаза, инокуляция, растительно-микробные взаимодействия, ризосфера, симбиоз
Короткий адрес: https://sciup.org/142133317
IDR: 142133317 | УДК: 631.46:579.64:581.138.1:581.133:57.044
Текст научной статьи Реакция гороха на инокуляцию ризосферными АЦК-утилизирующими бактериями в присутствии эндомикоризного гриба Glomus intraradices
Образование симбиоза с эндомикоризными грибами порядка Glo-males (арбускулярная микориза) у большинства сельскохозяйственных культур — важный фактор улучшения минерального, в особенности фосфорного, питания растений и повышения их продуктивности. Однако в результате селекции на фоне применения высоких доз минеральных удобрений симбиотрофность растений снижается (1). Это препятствует развитию ресурсосберегающих и экологически безопасных подходов в растениеводстве, основанных на биологических принципах и использовании растительно-микробных симбиозов. В качестве положительного примера можно привести сорт гороха Триумф, который создан в результате скрещиваний сорта Classic с высокосимбиотрофным генотипом К-8274 (2), однако поиску и селекции высокосимбиотрофных генотипов растений пока не уделяется должного внимания.
Другим подходом для повышения эффективности эндомикоризного симбиоза может быть усиление положительных взаимодействий симбионтов с ассоциативными ростстимулирующими бактериями. Известно, что микоризные грибы активно взаимодействуют с широким спектром бактерий, образуя единую систему, которая по аналогии с ризосферой названа микосферой (3). Важными механизмами положительного воздействия бактерий на микоризу и микоризованные растения служат продукция биологически активных веществ, мобилизация питательных элементов почвы, фиксация атмосферного азота и биоконтроль фитопатогенных грибов (2, 4).
Поэтому перспективной представляется совместная инокуляция растений эндомикоризными грибами и ростстимулирующими бактериями. Максимальный эффект на рост пшеницы получен при инокуляции растений смесью бактерий Pseudomonas fluorescens и грибов Glomus mossae (5) или G . intraradices (6). Бактерия Enterobacter sp. повышала рост побегов и содержание N и Р в растениях люцерны, инокулированных грибом G . mossae (7). Синергический эффект на рост корней клевера получен при инокуляции бактерией Brevibacillus brevis и G . mossae (8). Однако имели место и неудачные попытки повысить эффективность эндомикоризного симбиоза с помощью ассоциативных бактерий у ряда сельскохозяйственных культур, например у кукурузы (9), ячменя (10), картофеля (9) и гороха (11). Это указывает на необходимость более глубокого изучения механизмов взаимодействия симбиотрофных партнеров и факторов, определяющих реакцию растений на инокуляцию.
Многие ассоциативные бактерии содержат фермент 1-аминоцикло-пропан-1-карбоксилат (АЦК) дезаминазу, благодаря которому бактерии снижают образование фитогормона этилена из АЦК и стимулируют рост растений. Этилен вовлечен во многие процессы роста и развития растений и играет важную роль в регуляции образования симбиотических структур, а именно азотфиксирующих клубеньков и эндомикоризы (12). Положительная роль АЦК-утилизирующих бактерий в процессах роста, питания и устойчивости растений к абиотическим стрессам подтверждена многими исследованиями (13, 14). Однако их влияние на симбиоз растений с эндомикоризными грибами изучено недостаточно. Было показано, что штамм Ps . putida UW4 улучшал рост корней и побегов, увеличивал площадь листьев и их фотосинтетическую активность, а также встречаемость микоризной инфекции и обилие арбускул в корнях огурца, колонизированных грибом Gigaspora rosea (15). В описываемых опытах мутант штамма UW4, не обладающий АЦК-дезаминазной активностью, не оказывал положительного действия на растения огурца. Это свидетельствовало о важной роли бактериальной АЦК дезаминазы в образовании эффективного эндомикоризного симбиоза. В то же время в экспериментах с горохом не было обнаружено аддитивных эффектов при совместной инокуляции АЦК-ути-лизирующим штаммом Ps . brassicacearum Am3 и G . intraradices BEG141 (11). Весьма вероятно, что высокая вариабельность в эффективности симбиоза обусловлена сложностью взаимодействия микро- и макросимбионтов, обладающих индивидуальными наборами свойств, вовлеченных в образование и функционирование растительно-микробной системы.
Цель работы состояла в изучении роли ассоциативных бактерий, содержащих АЦК дезаминазу, во взаимодействии растений с эндомикоризными грибами.
Методика. В эксперименте использовали штаммы ассоциативных бактерий Ps. brassicacearum Am3 и Ps. putida Bm3, обладающие соответственно относительно высокой и низкой активностью фермента АЦК дезаминазы in vitro (16), и штамм эндомикоризного гриба G. intraradices CIAM8, образующий эффективный симбиоз с горохом (17). Инокулюм G. intraradices CIAM8 получали посредством выращивания микоризованных растений суданской травы (Sorghum sudanense) в стерилизованной почве и приготовления смеси почвы и корней с общей интенсивностью микоризной инфекции 80 %. В контрольных вариантах для инокуляции использовали почвенно-корневую смесь, не содержащую эндомикоризных грибов. Растительными объектами были контрастные по эффективности ростовой реакции на эндомикоризу генотипы гороха (Pisum sativum L.) из коллекции Всероссийского НИИ растениеводства (ВИР, г. Санкт-Петербург): 8599 (высокоэффективный) и 1025 (низкоэффективный) (17).
Вегетационный опыт проводили в летний период (июнь-август, г. Санкт-Петербург) в теплице с естественным световым и температурным режимом. Растения выращивали в сосудах, содержащих 2,5 кг стерилизованной дерново-подзолистой почвы. Характеристика почвы: Собщ — 2,5 %, Х общ. — 0,2 %, Р подв. — 6 мг Р 2 О 5 /100 г, К подв — 7 мг К 2 О/100 г; рН солевой вытяжки — 6,0. Удобрения вносили в следующем количестве (мг/кг почвы): NH4NO3 — 30, KCl — 200, MgSO4 — 60, H3BO3 — 3, MnSO4 — 3, ZnSO4 — 3, Na2MoO4 — 1,5. Для создания естественных условий роста растений вносили клубеньковые бактерии Rhizobium leguminosarum bv. vi-ciae CIAM1026 (коллекция ВКСМ, Всероссийский НИИ сельскохозяйственной микробиологии), образующие азотфиксирующий симбиоз с горохом (106 кл/г почвы).
Семена гороха стерилизовали, скарифицировали концентрированной H2SO4 в течение 30 мин и проращивали в течение 3 сут. В каждый сосуд помещали 4 проростка, которые инокулировали суспензиями ассоциативных бактерий (108 клеток на проросток). Почвенно-корневую смесь, содержащую или не содержащую G . intraradices CIAM8, предварительно вносили в сосуды слоем под проростки в количестве 25 г/сосуд. Влажность почвы поддерживали на уровне 60-70 % от полной влагоемкости. Растения выращивали в течение 45 сут до фазы начала образования бобов.
В конце эксперимента корни отмывали в воде и окрашивали анилиновым синим в молочной кислоте после обесцвечивания 15 % раствором КОН (18). Образцы корней микроскопировали и определяли встречаемость микоризной инфекции (F), обилие арбускул в образце (М), обилие арбускул в микоризованных фрагментах (m), обилие везикул в образце (V) и обилие везикул в микоризованных фрагментах (v) по методу Травло (18). Растения высушивали, взвешивали и измеряли содержание общего азота методом Кьельдаля на автоматическом анализаторе Kjelteck-AUTO («Tecator», Швеция) и содержание общего фосфора колориметрически по интенсивности окраски восстановленного фосфорно-молибденового комплекса (19).
Экспериментальные данные обрабатывали стандартными методами расчета доверительных интервалов и t -критерия Стьюдента, а также методом двухфакторного дисперсионного анализа ( F -критерий Фишера) (20).
Резуёътаты . Инокуляция штаммом Ps. brassicacearum Am3 повысила
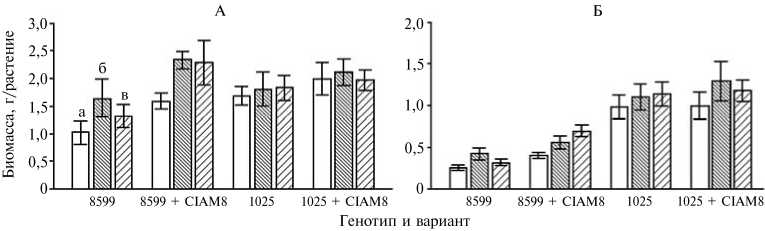
Сухая биомасса побегов (А) и корней (Б) у контрастных по эффективности ростовой реакции на эндомикоризу растений гороха Pisum sativum L. генотипов 8599 и 1025, инокулированных эн-домикоризным грибом Glomus intraradices CIAM8 и ассоциативными бактериями: а — контроль (без инокуляции), б — инокуляция штаммом Pseudomonas brassicacearum Am3, в — инокуляция Ps. putida Bm3. Вертикальными отрезками обозначен доверительный интервал при Р = 0,05 (вегетационный опыт, г. Санкт-Петербург—Пушкин).
1. Характеристика контрастных по эффективности ростовой реакции на эндомикоризу генотипов гороха Pisum sativum L. 8599 и 1025 по изучаемым показателям (средние значения для всех вариантов инокуляции, вегетационный опыт, г. Санкт-Пе-тербург—Пушкин)
|
Показатель |
\Генотип 8599| Генотип 1025 |
|
|
Масса побега, г/растение |
1,7 |
1,9* |
|
Масса корня, г/растение |
0,45 |
114*** |
|
Содержание N, мг/г биомассы |
26,8 |
27,1 |
|
Накопление N, мг/растение |
45 |
51** |
|
Содержание P, мг/г биомассы |
11,8 |
16,2*** |
|
Накопление P, мг/растение |
20 |
31*** |
|
Встречаемость микоризной инфекции (F), % |
63 |
60 |
|
Обилие арбускул, %: M |
42 |
44 |
|
m |
64 |
70 |
|
Обилие везикул, %: V |
28 |
32 |
|
v |
63 |
69 |
П р и м е ч а н и е. Описание генотипов см. в разделе «Методика». M и V — соответственно обилие арбускул и везикул в образце, m и v — соответственно обилие арбускул и везикул в микоризованном фрагменте.
*, ** и *** Различия между генотипами гороха по t -критерию Стьюдента существенны соответственно при Р < 0,05, Р < 0,01 и Р < 0,001.
биомассу побегов и корней на 60 % у немикоризованных растений гороха генотипа 8599 (рис.). У микоризованных растений указанного генотипа оба штамма ассоциативных бактерий обусловили увеличение биомассы побегов на 40 %, биомассы корней — соответственно на 40 % (штамм Am3) и 70 % (штамм Bm3). Влияние бактерий на рост гороха генотипа 1025 не было статистически значимым (см. рис.). Микоризация корней грибом G. intraradices CIAM8 улучшала рост побегов и корней только у генотипа 8599, который по средним показателям всех вариантов опыта существенно отличался от генотипа 1025 по ростовой реакции на микоризацию (табл. 1). По лученные результаты хорошо согласуются с данными литературы о более высоком потенциале генотипа 8599 в отношении образования эффектив
ного симбиоза с эндомикоризными грибами (17).
2. Содержание (мг/г биомассы) и накопление (мг/растение) азота и фосфора в побегах у контрастных по эффективности ростовой реакции на эндомикоризу генотипов гороха Pisum sativum L. при инокуляции ассоциативными бактериями и эндомикоризным грибом Glomus intraradices CIAM8 (вегетационный опыт, г. Санкт-Петербург—Пушкин)
|
Вариант опыта |
N |
P |
|
|
содержание! накопление |
содержание |
накопление |
|
|
Г е |
н о т и п 8599 |
||
|
Контроль (без инокуляции) |
26ab 27a |
14a |
15a |
|
Pseudomonas brassicacearum Am3 |
24a 39b |
11a |
18a |
|
Ps . putida Bm3 |
31b 41bc |
12a |
16a |
|
G . intraradices CIAM8 |
31b 49cd |
12a |
18a |
|
G . intraradices CIAM8 + Ps . brassicacearum Am3 |
25a 57d |
11a |
27b |
|
G . intraradices CIAM8 + Ps . putida Bm3 |
24a 56d |
12a |
27b |
|
Г е |
н о т и п 1025 |
||
|
Контроль (без инокуляции) |
26a 43a |
12a |
21a |
|
Ps . brassicacearum Am3 |
25a 46a |
15 ab |
28b |
|
Ps . putida Bm3 |
26a 48ab |
18b |
34c |
|
G . intraradices CIAM8 |
30a 60c |
19b |
37c |
|
G . intraradices CIAM8 + Ps . brassicacearum Am3 |
27a 58c |
18b |
37c |
|
G . intraradices CIAM8 + Ps . putida Bm3 |
28a 55cb |
15ab |
29b |
П р и м е ч а н и е. Описание генотипов см. в разделе «Методика». Неодинаковые латинские буквы означают, что между вариантами инокуляции для индивидуального генотипа гороха имеются существенные различия по F -критерию Фишера (Р < 0,05).
При микоризации генотипа 8599 ассоциативные бактерии снизили содержание азота в побегах примерно на 20 %. Это, вероятно, происходило за счет эффекта разбавления биомассой, поскольку накопление азота в инокулированных бактериями растениях не отличалось от такового в контрольных (табл. 2). В отсутствие микоризы повышение накопления азота в инокулированных растениях у генотипа 8599 можно объяснить увеличением биомассы побегов в результате стимулирующего действия бактерий на рост растений. Повышение содержания фосфора в растениях было существенным только при инокуляции генотипа 1025 монокультурами Ps. putida Bm3 и G. intraradices CIAM8 (см. табл. 2). В этих вариантах получены максимальные значения накопления фосфора побегами. Улучшение фосфорного питания может быть связано со стимулирующим действием бактерий на рост корней у микоризованного генотипа 8599, а также с их способностью растворять труднодоступные для растений фосфаты (16). Обращает на себя внимание тот факт, что повышение содержания фосфора у генотипа 1025 при микоризации не способствовало усилению роста растений. Известно, что снабжение растений фосфором — не единственный механизм положительного действия микоризы на растения, а эффективная интеграция симбиотических партнеров обусловлена комплексом положительных эффектов, включая ассимиляцию других питательных элементов, обмен биологически активными веществами, оптимизацию водного питания и защиту от неблагоприятных факторов среды (2). Следует отметить, что нами получены оригинальные данные о способности АЦК-утилизирующих бактерий повышать содержание фосфора у гороха, поскольку в предыдущих исследованиях эти бактерии не влияли или снижали содержание фосфора у разных генотипов гороха (15, 21) и рапса (22).
3. Показатели микоризообразования у контрастных по эффективности ростовой реакции на эндомикоризу генотипов гороха Pisum sativum L. при инокуляции ассоциативными бактериями и эндомикоризным грибом Glomus intraradices CIAM8 (вегетационный опыт, г. Санкт-Петербург—Пушкин)
|
Вариант опыта |
Встречаемость микоризной инфекции (F), % |
Обилие арбускул, % |
Обилие везикул, % |
||
|
M |
m |
V |
v |
||
|
Г е н о т и п 8599 G . intraradices CIAM8 65a 50a 76a 37a 74a G . intraradices CIAM8 + Pseudomonas brassicacearum Am3 66a 42a 64ab 26ab 60ab G . intraradices CIAM8 + Ps . putida Bm3 58a 33b 53b 20b 75b Г е н о т и п 1025 G . intraradices CIAM8 66a 49a 72a 33a 67a G . intraradices CIAM8 + Ps . brassicacea- rum Am3 64a 46a 70a 34a 74a G . intraradices CIAM8 + Ps . putida Bm3 50a 38a 68a 30a 68a |
|||||
П р и м е ч а н и е. Описание генотипов см. в разделе «Методика». M и V — соответственно обилие арбускул и везикул в образце, m и v — соответственно обилие арбускул и везикул в микоризованном фрагменте. Неодинаковые латинские буквы означают, что между вариантами инокуляции для индивидуального генотипа гороха имеются существенные различия по F -критерию Фишера (Р < 0,05).
Результаты микроскопирования выявили высокую степень развития микоризных структур при инокуляции грибом G. intraradices CIAM8 у обоих генотипов гороха (табл. 3), при этом генотипических различий в показателях микоризообразования не обнаружили (см. табл. 1). В вариантах без внесения в почву эндомикоризного гриба образования микоризы корней не отмечали. Ассоциативные бактерии не повлияли на параметры микоризообразования, за исключением снижения обилия арбускул и везикул штаммом Ps. putida Bm3 в корнях у генотипа 8599. Несмотря на это рост растений улучшался относительно варианта с инокуляцией эндомикоризным грибом (см. рис.). Похожие результаты, а именно одновременное уменьшение микоризации корней под действием бактерий и усиление роста растений, наблюдали ранее в опытах с пшеницей, ассоциативной бактерией Ps. fluorescens и грибом G. mossae (6). Было показано также, что в микоризованных растениях люцерны стимуляция роста и повышение содержания азота и фосфора штаммом Enterobacter sp. не сопровождались усилением микоризации корней (7). Отметим, что интенсивность образования микоризных структур и ростовые реакции растений на эндомико-ризные грибы часто не коррелируют, более того, в некоторых случаях гриб может проявлять паразитические свойства (9, 23).
Положительный эффект изучаемых бактерий проявлялся на генотипе гороха 8599, который более эффективно взаимодействовал с эндо-микоризным грибом. При этом ростстимулирующее влияние в большей степени наблюдали на микоризованных растениях. Ранее нами было показано, что стимуляция роста рапса штаммом Ps . putida Bm3 прекращалась при фосфорном дефиците, который вызывал снижение биосинтеза этилена в растениях и нивелировал эффект бактериальной АЦК дезаминазы на этот фитогормон и рост растений (22). Однако содержание фосфора и эффект G . intraradices CIAM8 на потребление фосфора у отзывчивого на инокуляцию генотипа гороха 8599 были ниже, чем у генотипа 1025 (см. табл. 2) при одинаковой степени развития микоризообразующих структур (см. табл. 1). Поэтому генотипические различия в реакции гороха на АЦК-утилизирующие бактерии нельзя объяснить улучшением фосфорного питания микоризованных растений. Важная роль АЦК дезаминазы изучаемых штаммов во взаимодействии с растениями была нами ранее показана с использованием чувствительного к этилену мутанта гороха E2( sym5) (16) и дефектного по гену АЦК дезаминазы мутанта Ps . brassi-cacearum Am3 (24). В условиях in vitro штамм Ps. brassicacearum Am3 обладает более высокой (в 2,5 раза) активностью АЦК дезаминазы, чем штамм Ps . putida Bm3 (16). В нашем опыте с горохом в отсутствие микоризы только этот штамм стимулировал рост, что косвенно свидетельствует о вовлеченности АЦК дезаминазы в стимуляцию роста растений. Возможно, эндомикоризный гриб повышал интенсивность биосинтеза этилена или чувствительность растений к этилену (11), что положительно повлияло на реакцию растений на АЦК-утилизирующие бактерии. Для проверки этой гипотезы необходимо сравнить изучаемые генотипы по продукции и чувствительности к этилену у микоризованных и немикоризованных растений.
Таким образом, нами впервые показано, что действие ассоциативных АЦК-утилизирующих бактерий на рост и питание растений гороха зависит от присутствия эндомикризы в корнях. Микоризация растений способствовала усилению ростстимулирующего действия бактерий. Проявление аддитивного эффекта АЦК-утилизирующих бактерий и эндомикориз-ного гриба на рост и питание у растения гороха во многом определяется его генотипом. Вероятно, отзывчивость на инокуляцию АЦК-утилизирую-щими бактериями и эндомикоризным грибом — взаимосвязанные свойства. Доказательство наличия такой взаимосвязи может быть полезным для селекции сортов, обладающих высоким симбиотическим потенциалом одновременно в отношении ростстимулирующих бактерий и эндомикориз-ных грибов.
Л И Т Е Р А Т У Р А
-
1. Т и х о н о в и ч И.А., П р о в о р о в Н.А. Симбиозы растений и микроорганизмов: молекулярная генетика агросистем будущего. СПб, 2009.
-
2. S h t a r k O.Y., B o r i s o v A.Y., Z h u k o v V.A., P r o v o r o v N.A., T i k h o n o-v i c h I.A. Intimate associations of beneficial soil microbes with the host plants. In: Soil microbiology and sustainable crop production. Springer Science+Business Media B.V., Dordrecht, The Netherlands, 2010: 119-196.
-
3. D e B o e r W., F o l m a n L.B., S u m m e r b e 11 R.C., B o d d y L. Living in a fun-
gal world: impact of fungi on soil bacterial niche development. FEMS Microbiol. Rev., 2005, 29: 795-811.
-
4. F r e y - K l e t t P., G a r b a y e J., T a r k k a M. The mycorrhiza helper bacteria revisited. New Phytol., 2007, 176: 22-36.
-
5. B e h n O. Influence of Pseudomonas fluorescens and arbuscular mycorrhiza on the growth, yield, quality and resistance of wheat infected with Gaeumannomyces graminis . J. Plant Dis. Protect., 2008, 115: 4-8.
-
6. J a d e r l u n d L., A r t h u r s o n V., G r a n h a l l U., J a n s s o n J.K. Specific interactions between arbuscular mycorrhizal fungi and plant growth-promoting bacteria: as revealed by different combinations. FEMS Microbiol. Lett., 2008, 287: 174-180.
-
7. T o r o M., A z c o n R., B a r e a J.M. The use of isotopic dilution techniques to evaluate the interactive effects of Rhizobium genotype, mycorrhizal fungi, phosphatesolubilizing rhizobac-teria and rock phosphate on nitrogen and phosphorus acquisition by Medicago sativa . New Phytol., 1998, 138: 265-273.
-
8. V i v a s A., B a r e a J.M., A z c o n R. Interactive effect of Brevibacillus brevis and Glomus mosseae , both isolated from Cd contaminated soil, on plant growth, physiological mycorrhizal fungal characteristics and soil enzymatic activities in Cd polluted soil. Environ. Pollut., 2005, 134: 257-266.
-
9. V o s a t k a M., G r y n d l e r M. Treatment with culture fractions from Pseudomonas putida modifies the development of Glomus fistulosum mycorrhiza and the response of potato and maize plants to inoculation. Appl. Soil Ecol., 1999, 11: 245-251.
-
10. Á å ë è ì î â À.À., Ñ å ð å á ð å í í è ê î â à Í.Â., Ñ ò å ï à í î ê Â.Â. Âçàèìîäåéñò-âèå àññîöèàòèâíûõ áàêòåðèé è ýíäîìèêîðèçíîãî ãðèáà ñ ÿ÷ìåíåì ïðè ñîâìåñòíîé èíî-êóëÿöèè. Ìèêðîáèîëîãèÿ, 1999, 68(1): 122-126.
-
11. E n g q v i s t L.G., M å r t e n s s o n A., O r l o w s k a E., T u r n a u K., B e l im o v A.A., B o r i s o v A.Y., G i a n i n a z z i - P e a r s o n V. For a successful pea production on polluted soils, inoculation with beneficial microbes requires active interaction between the microbial components and the plant. Acta Agric. Scand., B, 2006, 56: 9-16.
-
12. G u i n e l F.C., G e i l R.D. A model for the development of the rhizobial and arbuscular mycorrhizal symbioses in legumes and its use to understand the roles of ethylene in the establishment of these two symbioses. Can. J. Bot., 2002, 80: 695-720.
-
13. Á å ë è ì î â À.À., Ñ à ô ð î í î â à Â.È. ÀÖÊ äåàìèíàçà è ðàñòèòåëüíî-ìèêðîáíûå âçàèìîäåéñòâèÿ (îáçîð). Ñ.-õ. áèîë., 2011, 3: 23-28.
-
14. G l i c k B.R., C h e n g Z., C z a r n y J., D u a n J. Promotion of plant growth by ACC deaminase-producing soil bacteria. Eur. J. Plant Pathol., 2007, 119: 329-339.
-
15. G a m a l e r o E., B e r t a G., M a s s a N., G l i c k B.R., L i n g u a G. Interactions between Pseudomonas putida UW4 and Gigaspora rosea BEG9 and their consequences for the growth of cucumber under salt-stress conditions. J. Appl. Microbiol., 2010, 108: 236-245.
-
16. B e l i m o v A.A., S a f r o n o v a V.I., S e r g e y e v a T.A., E g o r o v a T.N., M a tv e y e v a V.A., T s y g a n o v V.E., B o r i s o v A.Y., T i k h o n o v i c h I.A., K l u-g e C., P r e i s f e l d A., D i e t z K.-J., S t e p a n o k V.V. Characterisation of plant growth-promoting rhizobacteria isolated from polluted soils and containing 1-aminocyclopropane-1-carboxylate deaminase. Can. J. Microbiol., 2001, 47: 642-652.
-
17. ß ê î á è Ë.Ì., Ê ó ê à ë å â À.Ñ., Ó ø à ê î â Ê.Â., Ö û ã à í î â Â.Å., Í à ó ì ê è-í à Ò.Ñ., Ï ð î â î ð î â Í.À., Á î ð è ñ î â À.Þ., Ò è õ î í î â è ÷ È.À. Ïîëèìîð-ôèçì ôîðì ãîðîõà ïîñåâíîãî ïî ýôôåêòèâíîñòè ñèìáèîçà ñ ýíäîìèêîðèçíûì ãðèáîì Glomus sp. â óñëîâèÿõ èíîêóëÿöèè ðèçîáèÿìè. Ñ.-õ. áèîë., 2000, 3: 94-102.
-
18. Ç î ë ü í è ê î â à Í.Â., Â î ð î á ü å â Í.È. Ìåòîäû èññëåäîâàíèÿ ãðèáîâ, îáðàçóþ-ùèõ ñ ðàñòåíèÿìè ìèêîðèçó àðáóñêóëÿðíî-âåçèêóëÿðíîãî òèïà. ÑÏá, 1992.
-
19. Â î ñ ê ð å ñ å í ñ ê à ÿ Î.Ë., À ë ÿ á û ø å â à Å.À., Ï î ë î â í è ê î â à Ì.Ã. Áîëü-øîé ïðàêòèêóì ïî áèîýêîëîãèè. ×. 1. Éîøêàð-Îëà, 2006.
-
20. Ë à ê è í Ã.Ô. Áèîìåòðèÿ. Ì., 1990.
-
21. S a f r o n o v a V.I., S t e p a n o k V.V., E n g q v i s t G.L., A l e k s e y e v Y.V., B e l i m o v A.A. Root-associated bacteria containing 1-aminocyclopropane-1-carboxylate deaminase improve growth and nutrient uptake by pea genotypes cultivated in cadmium supplemented soil. Biol. Fertil. Soils, 2006, 42: 267-272.
-
22. B e l i m o v A.A., S a f r o n o v a V.I., M i m u r a T. Response of spring rape to inoculation with plant growth-promoting rhizobacteria containing 1-aminocyclopropane-1-carboxy-late deaminase depends on nutrient status of the plant. Can. J. Microbiol., 2002, 48: 189-199.
-
23. H u i y i n g L., S m i t h F.A., D i c k s o n S., H o l l o w a y R.E., S m i t h S.E. Plant growth depressions in arbuscular mycorrhizal symbioses: not just caused by carbon drain? New Phytol., 2008, 178: 852-862.
-
24. B e l i m o v A.A., D o d d I.C., S a f r o n o v a V.I., H o n t z e a s N., D a v i e s W.J. Pseudomonas brassicacearum strain Am3 containing 1-aminocyclopropane-1-carboxylate deaminase can show both pathogenic and growth-promoting properties in its interaction with to-
mato. J. Exp. Bot., 2007, 58: 1485-1495.
ГНУ Всероссийский НИИ сельскохозяйственной микробиологии Россельхозакадемии,
Поступила в редакцию 7 февраля 2012 года
196608 г. Санкт-Петербург—Пушкин-8, ш. Подбельского, 3,
REACTION OF PEA PLANTS ON INOCULATION BY RHIZOSPHERE 1-AMINOCYCLOPROPANE-1-CARBOXYLATE (ACC) UTILIZING BACTERIA IN THE PRESENCE OF ENDOMYCORRHIZAL FUNGUS Glomus intraradices
A.A. Belimov, S.V. Demchinskaya, V.I. Safronova
S u m m a r y
In pot experiment with pea genotypes contrasting for efficiency of endomycorrhizal symbiosis (high-efficient genotype 8599 and low-efficient genotype 1025), the plants were grown in the presence or in the absence of endomycorrhizal fungus Glomus intraradices CIAM8 and inoculated with associative bacteria Pseudomonas brassicacearum Am3 or Pseudomonas putida Bm3 containing ACC deaminase. The inoculation of 8599 genotype with Am3 strain increases the biomass of shoots and roots by 60 % for plants without mycorrhiza. In plants with mycorrhiza both strains determined the increased shoot biomass by 40 %, and also root biomass by 40 % (Am3 strain) and by 70 % (Bm3 strain). The influence of mycorrhiza and bacteria on the growth of genotype 1025 is insignificant. After mycorrhization of genotype 8599 the associative bacteria reduced the nitrogen content in shoots by 20 %, but in the absence of mycorrhiza they raised the phosphorus content in genotype 1025 by 25 % (Am3 strain) and by 50 % (Bm3 strain). At a high and similar degree of mycorrhiza development in both pea genotypes the Bm3 strain decreased the number of arbuscles and vesicles in roots of genotype 8599. These results are of interest for more effective application of biopreparations and breeding of the varieties with high symbiotrophity.
Научные собрания

метаболическая и
ВСЕРОССИЙСКАЯ КОНФЕРЕНЦИЯ МОЛОДЫХ УЧЕНЫХ «СТРАТЕГИЯ ВЗАИМОДЕЙСТВИЯ МИКРООРГАНИЗМОВ
И РАСТЕНИЙ С ОКРУЖАЮЩЕЙ СРЕДОЙ»
(г. Саратов, ИБФРМ РАН, 25-27 сентября 2012 года)
В работе конференции будут рассматриваться актуальные проблемы экологии и симбиологии микробов и растений: биоразнообразие микробных и растительных сообществ и их функционирование в природе; механизмы взаимодействия партнеров в симбиозах и ассоциациях; генетическая интеграция в растительно-бактериальных симбиозах; мик робная коммуникация и ее роль во взаимодействии с макроорганизмом-хозяином; разнообразие микробных метаболитов и их влияние на организм человека и животных; адаптация микроорганизмов и растений к воздействию неблагоприятных природных факторов.
В рамках конференции планируется проведение следующих секций:
-
■ Биоразнообразие микробных и растительных сообществ и их функционирование
-
■ Адаптация микроорганизмов и растений к действию биотических и абиотических факторов окружающей среды
-
■ Механизмы взаимодействия партнеров в симбиозах и ассоциациях
-
■ Растительно-микробные симбиозы: метаболическая и генетическая интеграция
-
■ Микробная коммуникация и ее роль во взаимодействии с макроорганизмом-хозяином
-
■ Микробные метаболиты и их влияние на организм человека и животных
-
■ Микроорганизмы и растения в биомедицинских исследованиях
-
■ Современные физико-химические методы в физиолого-биохимических исследованиях
Контакты и информация: , ,
СЕМИНАР «СОВРЕМЕННЫЕ МЕТОДЫ ПРОТЕОМНОГО АНАЛИЗА»
Компания «Био-Рад Лаборатории» на базе Института биоорганической химии имени академиков М.М. Шемякина и Ю.А. Овчинникова РАН (г. Москва) бесплатно проводит ежемесячные семинары, позволяющие получить практический опыт проведения всех этапов протеомного анализа.


