Рецептор эпидермального фактора роста как мишень молекулярно-направленной терапии у непредлеченных пациентов с немелкоклеточным раком легкого
Автор: Сакаева Дина Дамировна, Гордиев Марат Гордиевич
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Фундаментальная онкология и экспериментальная медицина
Статья в выпуске: 3 (19), 2016 года.
Бесплатный доступ
Рецептор эпидермального фактора роста (EGFR) - один из наиболее важных и наиболее изученных сигнальных путей, регулирующий рост, выживаемость, пролиферативную активность и дифференцировку клеток у млекопитающих [1]. В тоже время EGFR и семейство белков - эпидермальных факторов роста, играют центральную роль в патогенезе и прогрессии различных видов опухолей [2]. В 80-х годах прошлого века была выдвинута гипотеза о том, что данный сигнальный путь может стать мишенью для лекарственной терапии [1]. В настоящее время существует 3 поколения ингибиторов тирозинкиназ (ИТК) EGFR. Препараты данного класса активно используются в клинической практике для лечения больных распространенным HMPJ1 с наличием мутации гена EGFR. Исследования этих препаратов продолжаются. В данном обзоре освещены возможности использования ИТК в 1-й линии терапии распространенного НМРЛ, а также в адъювантном режиме.
Egfr мутация, итк, нмрл
Короткий адрес: https://sciup.org/140222653
IDR: 140222653 | DOI: 10.18027/2224-5057-2016-3-11-17
Текст научной статьи Рецептор эпидермального фактора роста как мишень молекулярно-направленной терапии у непредлеченных пациентов с немелкоклеточным раком легкого
Впервые кровоизлияние в опухоль гипофиза описал Baily в 1898 году [1].
По данным аутопсий, частота встречаемости микроаденом гипофиза у людей, не имевших характерного анамнеза,– 3–27%, по данным разных авторов. Макроаденомы встречаются у 0,3–0,5% «здоровых» людей [2–6].
Риск увеличения объема опухоли (не кровоизлияния) достигает 14% для микроаденом и 30% для макроаденом за 1,8–6,7 лет [7–9].
Размер половины макроаденом увеличивается в среднем на 10% за 32 месяца [10].
Риск кровоизлияния в опухоль гипофиза составляет от 0,4 до 7% за период от 2 до 6 лет [7, 11, 12] и может достигать 9,5% за 5 лет [10].
В 80% случаев кровоизлияние в аденому гипофиза – первое проявление заболевания [13, 14].
Риск кровоизлияния в опухоль гипофиза в 5,4 раза выше риска кровоизлияния в другую внутричерепную опухоль [15].
Существуют собственные «внутренние» опухолевые факторы, повышающие риск кровоизлияния. К ним относятся агрессивность роста опухоли и васкулопатия опухолевых сосудов [16–22]. Для опухолевых артерий характерно не- постоянство развития, неполноценность базальной мембраны, расширенные периваскулярные пространства, инфильтрированные плазматическими белками и эритроцитами [23].
МАТЕРИАЛЫ И МЕТОДЫ
Для проведения данного исследования мы проанализировали 97 случаев кровоизлияний в опухоли гипофиза, произошедшие в различные сроки (от первых суток до более 12 мес) до поступления пациента в наш стационар или до его амбулаторной консультации. То есть нам представилась возможность наблюдать результаты перенесенных кровоизлияний в различные сроки, исходно не участвуя в лечении пациента и принятии решений о выборе лечебной тактики. Необходимо принимать во внимание допущение, что нам удалось наблюдать «полный» спектр «острых» ситуаций и что число случаев, когда пациенты не переживают кровоизлияние без оказания помощи и соответственно не попадают в наше поле зрения, незначительно. То есть «истинная» ситуация статистически не отличается от полученных нами результатов.
Пациенты были распределены на несколько групп:
-
1) Пациенты, подвергшиеся только консервативному лечению (n=37)
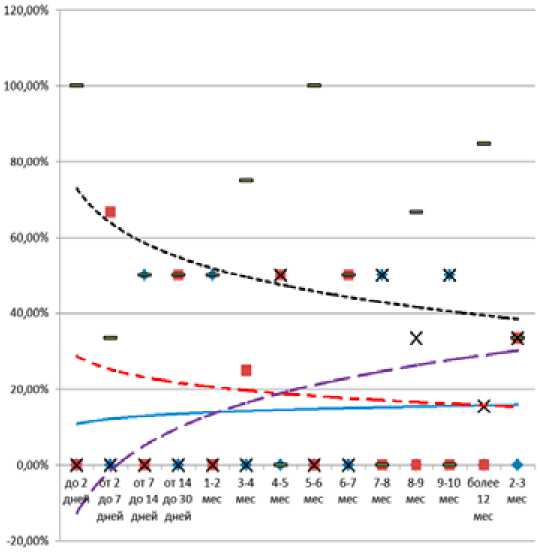
Рис. 1. Изменение зоны кровоизлияния в зависимости от его давности
-
♦ Хирурпезеское лечение бесструктурные ма<СЫ - бСССЗруКТурНЫВ массы
-
■ ХирурТИЧССКОС ЛСЧСННГ - ДИффуТНОС ПрОЛИЗЫ ЯЛ НЫР
-
— Хирургическое лечение - Лизированная Кровь
X Хирургичсоос лечение - прозрачная жидкое зь - прозрачная жидкость
— Логарифмическая (Хирургическое лечение • бесструктурные массы • 6rccipywiypwe массы)
-
— — Лагарифмичесиля (Хирурси^гскг* лечение ■ Диффузное пропип*ание)
-
- —• Логарифмическая (Хирургическое лечение • Лизированная кровь)
— - Логарифмическая (Хирургическое лечение • прозрачная жидкость -прозрачная жидкость)
-
2) Пациенты, подвергшиеся хирургическому лечению (n=45)
-
3) Пациенты с крупными постгеморрагическими кистами (n=15) составили группу «эксклюзивных» наблюдений, не подпадающих под общую статистику, но интересных в плане демонстрации вариантов кровоизлияний и течения заболевания.
Случаи острых кровоизлияний, когда пациент был доставлен в ИНХ и оперирован по срочным показаниям, оказались единичными. Группа пациентов, получавших консервативное лечение, была составлена из пациентов, перенесших острое кровоизлияние вне ИНХ и не поступивших в ИНХ в течение первого месяца. Лечение почти всех пациентов этой группы согласовывалось с авторами исследования в максимально близкие к моменту кровоизлияния сроки. В процессе проведения лечения оценивалась динамика состояния пациентов, и принималось решение о необходимости проведения хирургического лечения. Фактически эта группа пациентов была сформирована из пациентов, у которых после проведенного курса терапии отпала необходимость в хирургическом лечении. В группе пациентов, подвергшихся хирургическому лечению, собраны пациенты, оперированные в отделении транссфеноидальным доступом. Пациенты этой группы сопоставимы по основным показателям с пациентами группы «консервативного лечения».
За время сбора материала в отделении было выполнено всего несколько транскраниальных вмешательств по поводу опухолей, в строму которых произошло кровоизлияние. В основном это были гигантские опухоли. Они были включены в третью группу наблюдений.
Основные статистические закономерности кровоизлияний в опухоли гипофиза были установлены в ходе анализа первых двух групп пациентов. Данные о пациентах третьей группы были использованы для описания редко выявляющихся особенностей.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфологические особенности кровоизлияний
Тинкториальные свойства ткани аденомы гипофиза не зависят от ее гормональной активности. В нашей серии наблюдений 81% образцов опухоли имели эозинофильную окраску.
Макроскопически в первые дни очаг кровоизлияния представлен либо лизированной кровью, либо диффузным пропитыванием ткани опухоли. В дальнейшем содержимое очага кровоизлияния перерождается в бесструктурные массы или в кисту с прозрачной жидкостью. Некрозы в опухоли перестают выявляться после первого месяца от момента кровоизлияния в опухоль (рис. 1).
Микроскопическая картина трансформации очага кровоизлияния носит закономерный характер. К концу первого месяца после кровоизлияния некротическая ткань в очаге кровоизлияния начинает замещаться фиброзом, как результат развивающихся процессов регенерации и организации тканей в очаге. Также закономерным является отложение кристаллов холестерина и кальцинатов в очаге кровоизлияния, что является проявлением дегенерации тканей. Кристаллы холестерина были выявлены в одном наблюдении при давности кровоизлияния 1–2 мес, каль-цинаты – в двух наблюдениях при давности кровоизлияния более 12 мес.
Выявляющаяся лимфоидная инфильтрация и периваскулярные структуры, вероятно, носят случайный и вторичный характер, отражая непостоянно возникающую реакцию на кровоизлияние ткани, окружающей очаг. Лимфоидная инфильтрация в ткани опухоли была выявлена в одном наблюдении при давности кровоизлияния 4–5 мес, периваскулярные структуры – при давности кровоизлияния более 8 мес.
Ангиоматоз выявлялся в подавляющем числе наблюдений (73,33%). При этом не наблюдалось никакой разницы в его выявлении в зависимости от «свежести» кровоизлияния по данным морфологического исследования. Выявление признаков ангиоматоза в большинстве наблюдений позволяет предполагать, что его наличие является характерной особенностью (или предрасполагающим фактором) аденом, в строму которых происходят кровоизлияния. Не исключено, что в случаях, когда ангиоматоз не выявляется в ткани опухоли, это является проявлением трансформации сосудов после произошедшего в её строму кровоизлияния.
Малая частота выявления фактора роста эндотелия сосудов (VEGF) очевидно является подтверждением того, что развитие ангиоматоза в этой группе опухолей не обусловлено экспрессией VEGF в строме опухоли. В большинстве наблюдений – 15 (65,2%) экспрессия VEGF оказалась отрицательной. В 4 случаях (17,4%) она оказалась положительной и в 4 (17,4%) – сомнительной.
Отдельного обсуждения и изучения требует феномен значительной экспрессии VEGF в ткани аденогипофиза, прилегающего к опухоли, в строму которой происходит кровоизлияние. Не исключено, что именно это и есть основной стимул неоангиогенеза в опухоли.
Проведенное иммуногистохимическое исследование позволяет предположить, что предрасполагающим фактором к кровоизлиянию в опухоль гипофиза является умеренная пролиферативная активность (высокий уровень циклина D1 – белка, участвующего в регуляции клеточного цикла, и умеренно выраженная экспрессия EGFR – эпидермального фактора роста) на фоне активного неоангиогенеза. Повышение уровня циклина D1 и умеренно выраженная экспрессия EGFR, уровень Ki-67 <5%, являются проявлением умеренной пролиферативной активности аденом гипофиза.
В нашей серии ИГХ-наблюдений из 23 случаев экспрессия циклина D1 была выявлена в 21 наблюдении (91,3%). При этом митозы в клетках опухолей выявлялись только в 11 (24,4%) из 45 случаев. Экспрессия EGFR выявлялась в 12 случаях (52,2%) и в 3 случаях (13,0%) она оказалась сомнительной. Ki-67 в большинстве случаев не превышал 5%. Только в одном наблюдении его уровень составил 10%. Еще одним подтверждением склонности исследованных опухолей к пролиферации является отсутствие экспрессии p53 – маркера апоптоза. Среди удалённых опухолей, в строму которых произошло кровоизлияние, экспрессия p53 была выявлена только в 1 случае из 23 (4,3%). Мы столкнулись либо с истинным отсутствием маркера, либо с экспрессией мутированной формы белка, неспособной регулировать апоптоз и не определяющейся нашей тест-системой (рис. 2).
Плотность ткани опухоли при ее диффузном пропитывании кровью после произошедшего в неё кровоизлияния часто повышается. В первые дни после кровоизлияния плотность ряда опухолей оказывалась настолько высокой, что полное их удаление без риска повреждения капсулы и медиальных стенок кавернозных синусов представлялось невозможным. Доля плотных опухолей прогрессивно уменьшается по мере увеличения сроков давности кровоизлияния. Этот факт может быть использован для обоснования проведения отсроченной операции в случаях, когда зрительные и глазодвигательные функции нарушены незначительно.
ВЫВОДЫ
Установлены морфологические особенности опухолей, в строму которых происходят кровоизлияния. Эти особенности подтверждают одну из гипотез апоплексии аденом гипофиза, а также выявляют феномен повышенной секреции факторов неоангиогенеза в ткани аденогипофиза, прилегающей к аденоме. Экспрессия фактора роста эндотелия сосудов (VEGF) не в строме опухоли, а в окружающей её ткани аденогипофиза, требует дополнительного изучения. Возможно это один из предрасполагающих к кровоизлиянию факторов.
Крайне высокая плотность ткани имбирированной опухоли в первые дни после кровоизлияния делает её радикальное удаление без риска повреждения капсулы и медиальных стенок кавернозных синусов рискованным или невозможным, что является обоснованием отсроченной операции.
А
БВ
Г
Д
Е
Ж
З
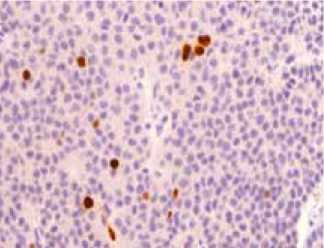
И
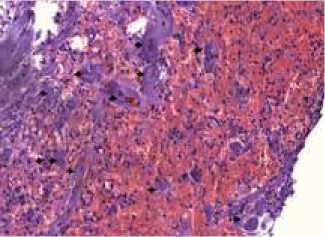
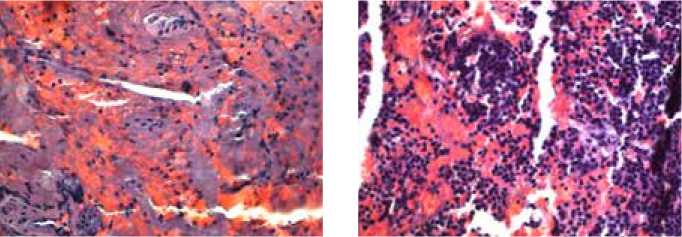
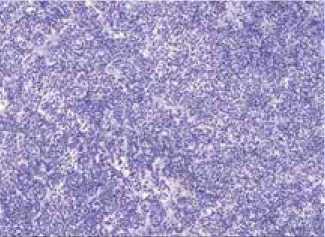
Рис. 2. Микроскопические особенности зоны кровоизлияния
А – Ангиоматоз в строме опухоли гипофиза. В строме опухоли наряду с множественными очагами кровоизлияния (красного цвета) стрелками указаны многочисленные разнокалиберные сосуды.
Б – Фиброз стромы опухоли.
В – Периваскулярные структуры в строме опухоли.
Г – Отсутствие экспрессии p53 в опухоли гипофиза. В микропрепарате не выявлено ни одной метки p53.
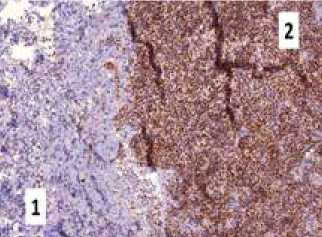
Д – Выраженная экспрессия циклина D1 в ткани опухоли. В строме опухоли (2) выявлено значительное накопление циклина D1, в отличие от ткани аденогипофиза (1), где выявлены единичные метки.
Е – Экспрессия EGFR в строме опухоли гипофиза. В строме опухоли (2) выявлена значительная экспрессия EGFR. В ткани аденогипофиза (1) экспрессия EGFR также выявлена, но менее выраженная. 3 – капсулы опухоли.
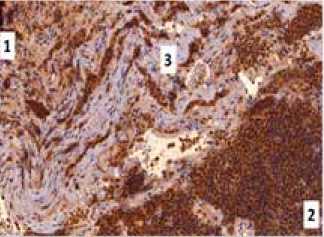
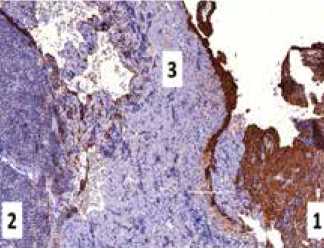
Ж, З – Экспрессия VEGF в аденогипофизе и строме опухоли гипофиза.
В ткани аденогипофиза (1) выявлена выраженная экспрессия VEGF. Его экспрессия выявлена в меньшем объеме в строме опухо ли (2), в основном в проекции вновь образованных сосудов (З). 3 – капсула опухоли.
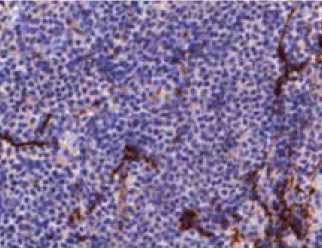
И – Индекс пролиферативной активности Ki-67. Уровень Ki-67–5% – подтверждение невысокой пролиферативной активности опухоли.
Список литературы Рецептор эпидермального фактора роста как мишень молекулярно-направленной терапии у непредлеченных пациентов с немелкоклеточным раком легкого
- D.S. Salomon, R. Brandt, F. Ciardiello, N. Normanno «Epidermal growth factor-related peptides and their receptors in human malignancies», Crit. Rev. Oncol. Hematol., 19 (1995), pp. 183-232.
- Oda K., Matsuoka Y., Funahashi A., Kitano FI. (2005). «A comprehensive pathway map of epidermal growth factor receptor signaling». Mol. Syst. Biol. 1 (1): 2005.0010.
- Gazdar A. F. et al. «Inhibition of EGFR Signaling: All Mutations Are Not Created Equal Trends» Mol Med 2004; 10:481-486.
- Sharma S. et al. «Epidermal growth factor receptor mutations in lung cancer». Nat Rev Cancer 2007; 7:169-81.
- B.M. Моисеенко, С. А. Проценко, И. И. Семенов. Современная Онкология № 1, том 12, 2010, 60-66.
- Практические рекомендации по лечению злокачественных опухолей. Портал Российского общества клинической онкологии rosoncoweb.ru , 06.06.16, URL: http://www.rosoncoweb.ru/standarts/RUSSC0/01.pdf
- M. Reck, S. Popat, N. Reinmuth, D. De Ruysscher, K. M. Kerr and S. Peters, «Metastatic non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up». Ann Oncol (2014) 25 (suppl 3): III27-III39.
- Masters et al. «Systemic Therapy for Stage IV Non-Small-Cell Lung Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update». JCO August 31,2015,1-30.
- NCCN Guidelines. Портал национальной всеобщей онкологической сети nccn.org. [Электронный ресурс], 06.06.16, URL: http://www.nccn.org/professionals/physician_ gls/pdf/nscl.pdf NCCN Guidelines. Portal nacional'noj vseobshhej onkologicheskoj seti nccn.org. [Jelektronnyj resurs], 06.06.16, URL: http://www.nccn.org/professionals/physician_gls/pdf/ nscl.pdf
- Tony S. Mok, Yi-Long Wu, Sumitra Thongprasert, Chih-Hsin Yang, Da-Tong Chu, Nagahiro Saijo, et al. «Gefitinib or Carboplatin-Paclitaxel in Pulmonary Adenocarcinoma», N Engl J Med 2009; 361:947-957.
- Han J.Y., Park K., Kim S.W. et al. First-signal: first-line single-agent Iressa versus gemcitabine and cisplatin trial in never-smokers with adenocarcinoma of the lung. J Clin Oncol. 2012; 30:1122-8.
- Maemondo M., Inoue A., Kobayashi K. et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med. 2010; 362:2380-8.
- Mitsudomi T., Morita S., Yatabe Y. et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WTJOG 3405): an open label, randomised phase 3 trial. Lancet Oncol. 2010; 11:121-8.
- Zhou C., Wu Y. L., Chen G. et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomized, phase 3 study. Lancet Oncol. 2011; 12:735-42.
- Rosell R., Carcereny E., Gervais R. et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomized phase 3 trial. Lancet Oncol. 2012; 13:239-46.
- Cesare Gridelli, Fortunato Ciardiello, Ciro Gallo, Ronald Feld, Charles Butts et al. First-Line Erlotinib Followed Epidermal growth factor receptor as target of molecular-targeted therapy in patients with primary non-small cell lung cancer by Second-Line CisplatinGemcitabine Chemotherapy in Advanced Non-Small-Cell Lung Cancer: The TORCH Randomized Trial J Clinical Oncol. Vol 30 Num 242012:3002-3011.
- Lecia V. Sequist, James Chih-Hsin Yang, Nobuyuki Yamamoto, Kenneth O'Byrne et al. Phase III Study of Afatinib or Cisplatin Plus Pemetrexed in Patients With Metastatic Lung Adenocarcinoma With EGFR Mutations. J Clin Oncol 2013; Vol. 31 Num 27:3327-3334;
- Wu Y.L., Zhou C., Hu C.P. et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol. 2014; 15:213-222.
- Сервис Национального Института Здоровья США//Портал ClinicalTrials.gov , 20.10.15. URL: https://clinicaltrials.gov/ct2/results?term=chemotherapy+and+ TKI+NSCLC&Search=Search
- Wu Y. L., Lee J. S., Thongprasert S., Yu C. J., Zhang L., Ladrera G. et al. Intercalated combination of chemotherapy and erlotinib for patients with advanced stage non-small-cell lung cancer (FASTACT-2): a randomised, double-blind trial. Lancet Oncol. 2013 Jul; 14(8):777-86.
- Kanda S. et al. Phase II study of gefitinib and inserted cisplatin plus docetaxel as a first-line treatment for advanced nonsmall cell lung cancer haboring an epidermal growth factor receptor activating mutation. ASCO 2013, abs 8064 J Clin Oncol 31,2013 (suppl; abstr 8064).
- S. Sugawara, S. Oizumi, K. Minato et al. Randomized phase II study of concurrent versus sequential alternating gefitinib and chemotherapy in previously untreated non-small cell lung cancer with sensitive EGFR mutations: NEJ005/TCOG0902Ann Oncol (2015) 26 (5): 888-894.
- O.lshimoto, S. Oizumi, K. Minato et al. Randomized phase II study of concurrent versus sequential alternating gefitinib and chemotherapy in previously untreated non-small cell lung cancer (NSCLC) with sensitive EGFR mutations: NEJ005/TCOG0902. Annals of Oncology 25 (Supplement 4): iv426-iv470,2014.
- Ying Cheng, Haruyasu Murakami, Pan-ChyrYang, Jianxing He, Kazuhiko Nakagawa et al. Randomized Trial of Gefitinib with and without Pemetrexed as First-Line Therapy in East-Asian Patients with Advanced NS NSCLC with EGFR Mutations. Journal of Thoracic Oncology, Vol. 10, Sup 2,2015, S206 (ORAL 17.02).
- D’Angelo S.P. et al. Distinct Clinical Course of EGFR-Mutant Resected Lung Cancers J Thorac Oncol. 2012; 7:1815-1822.
- Karen Kelly, Nasser K. Altorki, Wilfried E. E. Eberhardt, Mary E. R. O’Brien et al. Adjuvant Erlotinib Versus Placebo in Patients With Stage IB-IIIA Non-Small-Cell Lung Cancer (RADIANT): A Randomized, Double-Blind, Phase III Trial. J Clin Oncol. V. 33, Num. 34,2015:1-8
- Сервис Национального Института Здоровья США//Портал ClinicalTrials.gov , 07.06.16. URL: https://clinicaltrials.gov/ct2/show/NCT02511106?term=ADAU RA&ran k=1
- Pasi A. Jänne, James Chih-Hsin Yang, Dong-Wan Kim, David Planchard, Yuichiro Ohe, Suresh S. et al. AZD9291 in EGFR Inhibitor-Resistant Non-Small-Cell Lung Cancer, N Engl J Med 2015; 372:1689-1699
- Catherine A. Eberlein, Daniel Stetson, Aleksandra A. Markovets, et al. Acquired Resistance to the Mutant-Selective EGFR Inhibitor AZD9291 Is Associated with Increased Dependence on RAS Signaling in Preclinical Models. Cancer Res; 75(12) June 15, 2015, 2489-2500


