Рецидивирующее течение тромбоэмболии легочной артерии и острый инфаркт миокарда без подъема сегмента ST: актуальные проблемы диагностики и лечения (клинический случай)
Автор: Попонина Т. М., Попонина Ю. С., Рябов В. В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 1 т.39, 2024 года.
Бесплатный доступ
Представлен клинический случай пациента с рецидивирующим течением тромбоэмболии легочной артерии (ТЭЛА) и острым инфарктом миокарда без подъема сегмента ST (ИМБПST). Недооценка данных анамнеза, клинического течения немассивной ТЭЛА под маской синкопе привела к развитию массивной ТЭЛА и клинической смерти пациента. В статье обсуждаются маски немассивной ТЭЛА, принципы лечения и вторичной профилактики венозных тромбоэмболических осложнений (ВТЭО) у пациента с острым ИМБПST.
Тромбоэмболия легочной артерии, маски тромбоэмболии легочной артерии, острый коронарный синдром без подъема сегмента st, инфаркт миокарда без подъема сегмента st
Короткий адрес: https://sciup.org/149144782
IDR: 149144782 | УДК: 616.131-005.755-036.65:616.127-005.8]-07-08 | DOI: 10.29001/2073-8552-2024-39-1-194-201
Текст научной статьи Рецидивирующее течение тромбоэмболии легочной артерии и острый инфаркт миокарда без подъема сегмента ST: актуальные проблемы диагностики и лечения (клинический случай)
УДК 616.131-005.755-036.65:616.127-005.8]-07-08
Тромбоэмболия легочной артерии (ТЭЛА) занимает третье место в мире по распространенности, уступая только инфаркту миокарда (ИМ) и инсульту [1]. Несмотря на внедрение в практику как национальных [2], так и европейских рекомендаций по диагностике и лечению острой легочной эмболии [3], ТЭЛА по-прежнему является одной из основных причин высокой смертности пациентов [4, 5]. Клинические признаки и симптомы острой ТЭЛА неспецифичны; выделяют 5 синдромов: легочно-плевральный, кардиальный, абдоминальный, церебральный и почечный [6]. У некоторых пациентов, поступивших с предварительным диагнозом острого коронарного синдрома (ОКС), на этапе госпитализации подтверждается наличие только ТЭЛА. Но нередко встречается сочетание ТЭЛА и ОКС.
Описание случая
Пациент К., 56 лет, доставлен в кардиологическое отделение через 3 ч от начала симптомов с жалобами на внезапно возникшую одышку смешанного характера в покое, неинтенсивный сухой кашель, общую слабость, головокружение, синкопе. Болевой синдром (резчайшая боль за грудиной и по всей грудной клетке) купирован на догоспитальном этапе (ДГЭ).
За 3 мес. до госпитализации отметил появление асимметричного отека правой стопы и голени, сухой кашель, к врачам не обращался. За 2 нед. до госпитализации возникла одышка смешанного характера при умеренной физической нагрузке, впервые потерял сознание по дороге на работу.
Транспортирован в ОГАУЗ «Областная клиническая больница» г. Томска, где было проведено инструментальное и лабораторное обследование пациента: регистрация электрокардиограммы (ЭКГ), рентгенография органов грудной клетки, магнитно-резонансная томография головного мозга для исключения мозгового инсульта, забор крови для проведения общего анализа крови и определения биохимических показателей.
Пациент был осмотрен неврологом, травматологом, терапевтом, которыми был поставлен диагноз «Черепно-мозговая травма», пациент направлен на дальнейшее обследование и лечение к участковому терапевту поликлиники по месту жительства. В связи с жалобами на одышку и кашель был направлен на бронхоскопию: патологии не найдено.
Через 2 нед. пациент вышел на работу (работает водителем): внезапно появилась резчайшая боль за грудиной и по всей грудной клетке, которая сопровождалась выраженной одышкой и потерей сознания. Бригада скорой медицинской помощи приехала через 10 мин после ее вызова; пациент очнулся до приезда бригады: сердечно-легочная реанимация (СЛР) не проводилась. На ДГЭ была зарегистрирована ЭКГ, дан клопидогрел – 300 мг, аспирин – 250 мг, нитроспрей, в/в введен морфин, неф-ракционированный гепарин 4000 Ед в/в, пациент доставлен в приемное отделение Регионального сосудистого центра с диагнозом «Острый коронарный синдром без подъема сегмента ST» (ОКСБПST).
Пациент рос и развивался соответственно возрасту. Из вредных привычек – курение по 20 сигарет в день в течение 30 лет по настоящее время. Страдает артериальной гипертензией (АГ) в течение 10 лет: максимальное повышение артериального давления (АД) – до 160–170/100 мм рт. ст., принимает лизиноприл по 10 мг/ день. Случаев внезапной сердечной смерти, ТЭЛА среди родственников первой линии, со слов пациента, не было. Наследственность по сердечно-сосудистым заболеваниям не отягощена.
При поступлении: общее состояние средней степени тяжести, сознание – оглушение, нормостенического телосложения, температура тела – 36,6 °С, кожа физиологической окраски, цианоз губ; пальпация грудной клетки – болевые точки не определяются, при сравнительной перкуссии легких – звук легочный, одинаковый на симметричных участках, дыхание жесткое, хрипов нет, частота дыхательных движений (ЧДД) – 24/мин. Периферическая сатурация крови SpO2 – 98%. Границы сердца в пределах нормы. Тоны сердца приглушены, ритмичные, 86 уд/мин, акцент 2-го тона на легочной артерии; АД – 104/68 мм рт. ст. Живот мягкий, не вздут, при пальпации безболезненный. Печень не увеличена, не выступает из-под нижнего края реберной дуги; размеры печени по Курлову 10–9–8 см, нижний край печени острый, ровный, мягкоэластической консистенции. Пузырные симптомы отрицательные. Асимметричный отек правой голени и правой стопы.
На ЭКГ при поступлении в приемное отделение (рис. 1): синусовый ритм, частота сердечных сокращений (ЧСС) 86 уд/мин. Синдром S1Q3T3. Переходная зона – между V5 и V6. Поворот сердца вокруг продольной оси по часовой стрелке (правым желудочком вперед). Неполная блокада правой ножки пучка Гиса; отрицательный зубец Т в отведениях III, aVF, V1–V5. Изменения на ЭКГ были расценены только как проявление ОКСБПST, хотя имеются явные признаки перегрузки правого желудочка (ПЖ): синдром S1Q3T3, описанный S. McGinn и P.D. White в 1935 г. [7]; наличие неполной блокады правой ножки пучка Гиса (rsR в V1 и V2, появление уширенного зубца S в V5 и V6); появление выраженного зубца S в V5 и V6, снижение амплитуды зубца R в отведениях V5 и V6 с уменьшением отношения R/S; смещение переходной зоны влево [8].
При эхокардиографии (ЭхоКГ) установлены дилатация правого предсердия (ПП) и ПЖ, снижение сократимости ПЖ, а также компрессия левого желудочка (ЛЖ) (прогиб межжелудочковой перегородки в полость ЛЖ). Зон гипокинеза ЛЖ не выявлено. Трикуспидальная недостаточность 2-й степени. Фракция выброса ЛЖ – 66%. Увеличение систолического давления в ПЖ (СДПЖ) до 112 мм рт. ст. В верхушке ПЖ – тромбоз? Нижняя полая вена 26 мм, не реагирует на вдох. Перикард – без изменений.

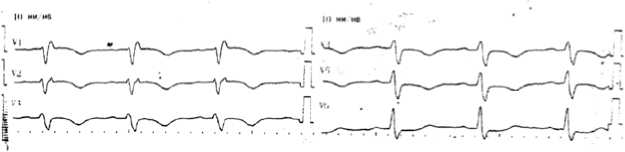
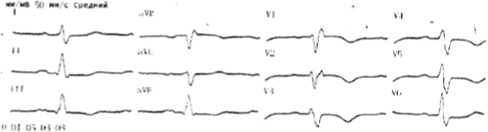
Рис. 1. Электрокардиограмма пациента К. при поступлении
Fig. 1. ECG K. on admission
При рентгенографии органов грудной клетки найдены пневмофиброз, признаки легочной АГ 1–2-й степени и легочной венозной гипертензии 1-й степени (перераспределение кровотока в верхние отделы легких).
Проведены общеклинический и биохимический анализы крови: выявлен лейкоцитоз (21,0 × 109/л), остальные показатели общего анализа крови и плазменного гемостаза находились в пределах референсных значений. Тропонин I составил 0,082 нг/мл (референсные значения 0,00–0,04 нг/мл, пороговое значение для ИМ – 0,5 нг/мл). Зарегистрировано незначительное повышение АСТ до 52,9 Ед/л (референсные значения – 0–37 Ед/л), АЛТ – до 53,4 Ед/л (референсные значения – 0–42 Ед/л), МВ-Кре-атинкиназы (МВ-КК) – до 31,2 Ед/л (референсные значения – 0,00-25,00 Ед/л) при нормальных значениях КК – 107,00 Ед/л (референсные значения – 38–195,00 Ед/л), а также выраженное повышение уровня глюкозы до 22,6 ммоль/л (референсные значения – 3,5–5,7 ммоль/л), креатинина – до 138 мкмоль/л (референсные значения креатинина для мужчин – 44–115 мкмоль/л) при снижении расчетной скорости клубочковой фильтрации (рСКФ) по CKD-EPI до 49 мл/мин/1,73 м2. У пациента выявлено повышение уровня общего холестерина до 5,0 ммоль/л, другие показатели липидного спектра не были определены в связи с отсутствием возможностей.
С учетом наличия у пациента факторов риска ишемической болезни сердца (ИБС): мужской пол, курение, АГ, гиперхолестеринемия, сахарный диабет, гиподинамия; появления жгучих болей за грудиной с иррадиацией по всей грудной клетке, сопровождавшихся изменениями на
ЭКГ (отрицательный зубец Т в отведениях III, aVF, V1 –V5), наличия резорбционно-некротического синдрома поставлен диагноз острого глубокого перегородочного не Q-ИМ [9], фоновое заболевание: АГ III стадии, контролируемая АГ. Риск IV (очень высокий). Гиперхолестеринемия. Впервые выявленный сахарный диабет. Хроническая болезнь почек (ХБП) IIIа стадии (креатинин – 138 мкмоль/л, рСКФ – 49 мл/мин/1,73 м2). Целевой уровень (ЦУ) систолического АД от < 140 мм рт. ст. до 130 мм рт. ст. при переносимости, ЦУ диастолического АД < 80 мм рт. ст. до 70 мм рт. ст. По шкале GRACE риск внутригоспитальной летальности для пациента составил более 11%, риск летального исхода – высокий; риск 6-месячной летальности составил от 2 до 5%, риск летального исхода – средний (145 баллов), в связи с чем пациенту экстренно была проведена инвазивная коронарная ангиография (иКАГ); выявлены гемодинамически значимые стенозы в передней нисходящей артерии (ПНА) > 75% в проксимальной трети, I диагональной артерии (I ДА) 70%, медианной артерии (МА) 70%, правой коронарной артерии (ПКА) 60% в проксимальной трети (рис. 2); выполнено чрескожное коронарное вмешательство (ЧКВ) со стентированием проксимального сегмента ПНА стентом с лекарственным покрытием «Xience Xpedition» 3 × 23 мм.
На ЭКГ, зарегистрированной через 30 мин после ЧКВ, динамики не выявлено. Проводилась общепринятая терапия острого ИМ у пациента. Через 1 сут после ЧКВ пациент чувствовал себя лучше, жалоб активно не предъявлял, в связи с чем был выведен из палаты интенсивной терапии (ПИТ) в отделение.
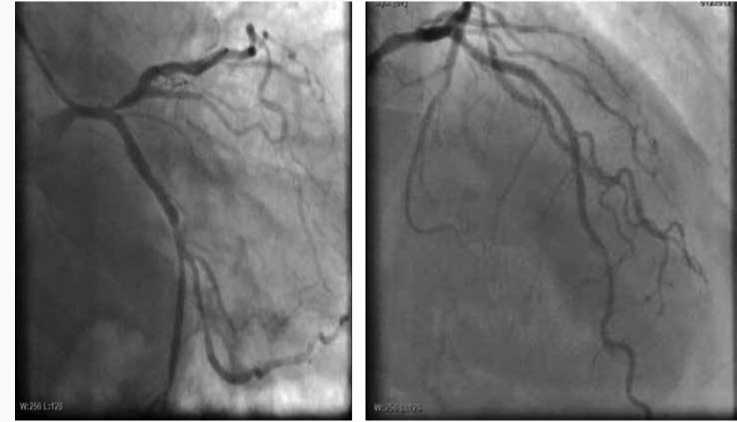
Рис. 2. Коронарограммы пациента К. при поступлении
Fig. 2. Coronarograms of К. on admission
Однако после наложения давящей повязки на место пункции бедренной артерии после проведения ЧКВ появился отек правой нижней конечности от паха до голеностопного сустава.
В этот же день пациент потерял сознание, пульсация на сонных артериях и экскурсия грудной клетки отсутствовали, была начата СЛР, сознание было восстановлено. Переведен в ПИТ для дальнейшего лечения. Общее состояние – тяжелое. Сохраняются сухой кашель, одышка в покое: ЧДД 24/мин. ЧСС 62/мин. Аускультативная картина в легких, сердце – прежняя. Выявлено увеличение печени: 12–11–10 см; симптом Плеша положительный.
На ЭКГ (рис. 3): синусовый ритм, ЧСС 62 уд/мин. В динамике – трансформация положительных зубцов Т в отрицательные в отведениях II, V6, увеличение амплитуды отрицательных зубцов Т в отведениях III, aVF, V1 –V5, что свидетельствовало об увеличении ЭКГ-признаков перегрузки ПЖ. С учетом синкопе, сопровождавшихся кашлем, одышкой; появления отека правой ноги (от паха до голеностопного сустава); симптомов правожелудочковой недостаточности (клинических, ЭКГ, ЭхоКГ) поставлен диагноз массивной ТЭЛА. Пациенту с ухудшением гемодинамики на фоне проводимой антикоагулянтной терапии рекомендуется проведение тромболитической терапии (I класс) [3].
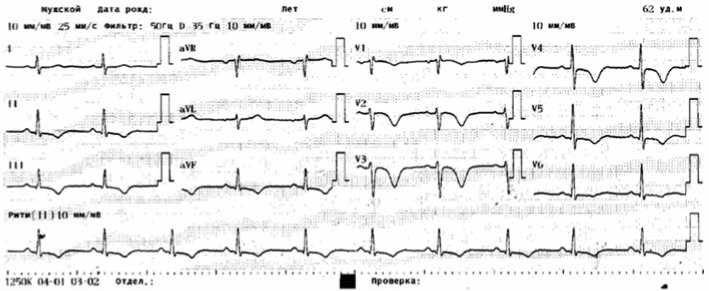
Рис. 3. Электрокардиограмма пациента К. после проведения сердечно-легочной реанимации
Fig. 3. ECG К. after cardiopulmonary resuscitation
Проведена тромболитическая терапия (ТЛТ) стрептокиназой в/в 100 000 Ед/ч в течение 15 ч. В ПИТ взята кровь: в динамике выявлено повышение МВ-КК – до 40,0 Ед/л и КК – до 1026,00 Ед/л; снижение уровня глюкозы с 22,6 ммоль/л при поступлении до 13,0 ммоль/л, креатинина – со 138 мкмоль/л до 110 мкмоль/л; Д-димер более 250 нг/мл (норма менее 250 нг/мл); количество лейкоцитов повышено до 17,5 × 109/л, остальные показатели ОАК и плазменного гемостаза – в пределах референсных значений. После окончания инфузии стрептокиназы уменьшилась одышка: ЧДД – 20/мин, ЧСС – 68 уд/мин, АД – 120/80 мм рт. ст., сатурация О2 – 98%. При проведении спиральной компьютерной томографии (СКТ) с контрастированием сосудов легких подтверждена массивная двусторонняя ТЭЛА с вовлечением в процесс дистальных отделов главных легочных артерий, восходящей и нисходящей ветвей с обеих сторон, а также справа верхнедолевой и ее сегментарных ветвей S1, S3, среднедолевой ветви, сегментарных ветвей S6, S8, S10 и слева – верхнедолевой ветви и ветвей S3, S4-S5, S8, S9-S10, S9.
КТ- признаки инфаркт-пневмоний в S6 справа и S3 слева. Легочно-артериальная гипертензия I степени. Пневмофиброз. Эмфизема (рис. 4). Выявлен источник ТЭЛА – тромбоз глубоких вен (ТГВ) правой нижней конечности (бедренно-подколенно-берцовый) при проведении ультразвукового исследования (УЗИ) вен. После проведения ТЛТ зарегистрирована ЭКГ (рис. 5) и проведена ЭхоКГ.
На ЭКГ после проведения ТЛТ (см. рис. 5) ритм синусовый, правильный, 53/мин; в динамике уменьшились степень выраженности неполной блокады правой ножки пучка Гиса, а также амплитуда зубца S в I, V5–V6 и зубца T в II, III, avF, V2–V4, трансформация отрицательных зубцов T в положительные в отведениях V5–V6, что свидетельствует об уменьшении ЭКГ-признаков перегрузки ПЖ.
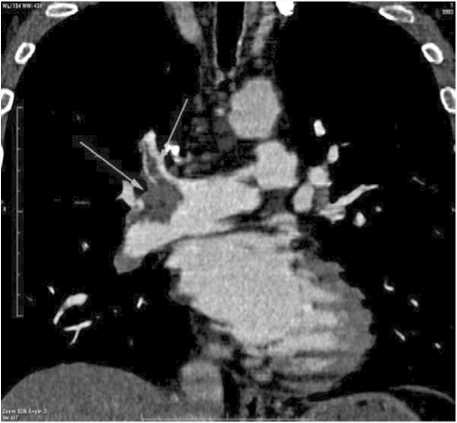
Рис. 4. СКТ-ангиопульмонография пациента К. Fig. 4. CT angiopulmonography of patient К
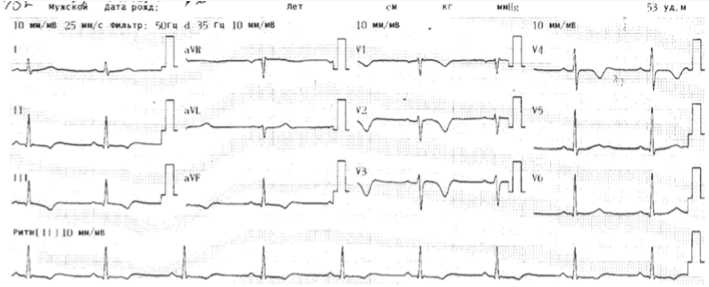
Рис. 5. Электрокардиограмма пациента К. после проведения тромболитической терапии
Fig. 5. ECG К. after after thrombolytic therapy
На ЭхоКГ после проведения ТЛТ выявлена положительная динамика: уменьшились размеры правых камер, улучшилась сократимость ПЖ, хотя она и остается сниженной; исчезла компрессия ЛЖ; снизилось СДПЖ со 112 мм рт. ст. при поступлении до 48 мм рт. ст. Уменьшилась степень трикуспидальной регургитации со 2-й до 1-й. Нижняя полая вена – 19 мм, на вдох реагирует. При проведении УЗИ сонных и бедренных артерий выявлены гемодинамически незначимые стенозы до 20–25%. Проведена оценка риска смерти пациента К. в ближайшие 30 сут: риск смерти – высокий, так как у пациента зафиксирована клиническая смерть, успешная СЛР; на фоне массивной ТЭЛА нет необходимости подсчитывать индекс PESI и определять биомаркеры у больных ТЭЛА с гипотонией и шоком; риск смерти таких пациентов – высокий. Пациенту был поставлен следующий комбинирован- ный диагноз, сочетанные заболевания: 1. ИБС: Острый первичный глубокий перегородочный не Q–ИМ. Атеросклероз коронарных артерий (стеноз проксимальной трети ПКА 60%, стеноз проксимальной трети ПНА 75%, стеноз IДА 70%, стеноз МА 70%). Операция: Стентирование проксимальной трети ПНА стентом «Xience Xpedition» 3 × 23 мм. 2. ТГВ правой нижней конечности. Осложнение: Массивная двусторонняя ТЭЛА, рецидивирующее течение, высокий риск смерти. Инфаркт-пневмония S6 справа, S3 слева. ЛВГ 1-й ст. ЛАГ 1-2-й ст. Неполная блокада правой ножки пучка Гиса. Фоновое заболевание: Гипертоническая болезнь III стадии, контролируемая АГ. Гиперхолестеринемия. Атеросклероз сонных и бедренных артерий, гемодинамически незначимый. Сахарный диабет 2-го типа, целевой уровень гликированного гемоглобина менее 6,5%. ХБП II стадии (креатинин – 110 мкмоль/л, рСКФ – 64 мл/мин/1,73 м2). ЦУ САД от < 140 мм рт. ст. до 130 мм рт. ст. при переносимости, ЦУ ДАД от < 80 мм рт. ст. до 70 мм рт. ст. Риск 4. Интенсивная терапия: Непрямой массаж сердца, искусственная вентиляция легких мешком Амбу, тромболитическая терапия стрептокиназой.
Пациенту на госпитальном этапе после проведения ТЛТ был назначен ривароксабан по 15 мг × 2 раза в день; меропенем – по 1,0 г на физиологическом растворе в/в × 3 раза в день; продолжено лечение клопидогре-лом 75 мг/день и аспирином 100 мг/день; бисопрололом 5 мг/день; рамиприлом 5 мг/день; аторвастатином 80 мг/день; пантопразолом 40 мг/день; метформином 1000 мг/день.
Пациент был выписан в удовлетворительном состоянии на 19-е сут с рекомендациями наблюдения у кардиолога и приема в амбулаторных условиях следующих препаратов: продолжить прием фиксированной комбинации клопидогрела 75 мг и аспирина 100 мг – 1 т. утром × 1 раз в день в течение 1 мес. с последующим переходом на клопидогрел 75 мг/день; продолжить прием ривароксабана – по 15 мг × 2 раза в день в течение 3 нед. от начала приема данной дозы, а затем принимать по 20 мг × 1 раз в день во время еды (долговременно); а также принимать бисопролол – по 5 мг × 1 раз в день; пантопра-зол – по 40 мг × 1 раз в день; метформин – по 1000 мг × 1 раз в день.
Обсуждение
Почему пациенту К. не был поставлен диагноз ТЭЛА на ДГЭ или в первые сутки поступления в кардиологическое отделение? Нередко массивная ТЭЛА развивается на фоне рецидивирующего течения тромбоэмболии мелких ветвей легочной артерии [2]. Рецидивирующее течение может проявляться немотивированными обмороками, коллапсами, повторными эпизодами одышки, как у пациента К.; опасность летального исхода существует вследствие развития в конечном итоге массивной ТЭЛА. Немассивная ТЭЛА может скрываться под масками других заболеваний, описанных А.В. Виноградовым и Ф.Е. Новиковым в 1979 г., и предшествовать развитию массивной ТЭЛА [6]:
– Повторные «немотивированные» обмороки, коллапс, нередко сочетающийся с ощущением нехватки воздуха и тахикардией.
– Повторные «пневмонии» неясной этиологии, часть которых протекает как плевропневмония. Однако в отличие от истинной пневмонии при ТЭЛА наблюдается иной порядок проявления симптомов: вначале возникает боль, а через 1–2 дня появляется лихорадка.
– Атипичные приступы стенокардии, протекающие с затруднением дыхания и последующим повышением температуры тела. При ЭКГ-контроле не выявляются признаки коронарной недостаточности. Возможно появление ЭКГ-признаков перегрузки ПЖ.
– «Беспричинная» лихорадка, не поддающаяся антибактериальной терапии.
– Пароксизмальная одышка с ощущением нехватки воздуха и тахикардией.
– Появление или прогрессирование сердечной недостаточности, резистентной к лечению.
– Появление и прогрессирование симптомов подострого или хронического легочного сердца при отсутствии анамнестических указаний на хронические заболевания бронхолегочного аппарата.
– Быстропреходящие (в течение 2–3 сут) сухие плевриты, экссудативный плеврит, особенно с геморрагическим выпотом. Истинный плеврит длится обычно в течение 2–3 нед.
Описаны модифицируемые и немодифицируемые факторы риска для возникновения венозных тромбоэмболических осложнений (ВТЭО) [2, 3, 10]. Выявление факторов риска развития ВТЭО важно не только для своевременной диагностики ТЭЛА, но также для оценки риска рецидивирующего течения и выбора длительности назначения противотромботической терапии. Факторами, предрасполагающими к ТЭЛА, у пациента К. являются ТГВ; атеросклероз коронарных, сонных и бедренных артерий, верифированный при проведении инструментального обследования; гиподинамия (работает водителем автотранспорта); курение; АГ; сахарный диабет. На амбулаторном этапе пациент описывает асимметричный отек правой стопы и голени; возникновение синкопе, сопровождавшихся приступами немотивированной одышки, кашлем, болевым синдромом в грудной клетке.
Внезапно возникшая одышка – одна из наиболее частых жалоб при ТЭЛА: одышка усиливается, если пациент из горизонтального положения встает или садится из-за уменьшения венозного возврата крови к сердцу. При наличии ТЭЛА уменьшается сердечный выброс, снижается АД, а также может возникнуть относительная коронарная недостаточность. При сердечной недостаточности одышка уменьшается, если пациент из горизонтального положения садится, а при заболеваниях легких одышка не меняется при изменении положения тела пациента.
Для оценки клинической вероятности ТЭЛА используются пересмотренная шкала Geneva и шкала P.S. Wells [3]: у пациента К. клиническая оценка вероятности ТЭЛА согласно упрощенной двухуровневой Женевской шкале – ТЭЛА вероятна (3 балла); по упрощенной версии P.S. Wells – ТЭЛА вероятна (2 балла).
Недооценены были и данные инструментального обследования. К ЭКГ-паттернам ТЭЛА относятся признаки перегрузки ПП и ПЖ; инверсия зубцов Т в отведениях V1–V4; QR-паттерн в отведении V1; S1Q3T3-паттерн (синдром McGinn – White); неполная или полная блокада правой ножки пучка Гиса; синусовая тахикардия; суправентрикулярные нарушения ритма вплоть до фибрилляции предсердий, которые можно объяснить перегрузкой ПП; а также нарушения атриовентрикулярной проводимости как следствие гипоксии миокарда.
Изменения на ЭКГ пациента К. были расценены только как проявление ОКСБПST, хотя имелись явные признаки перегрузки ПЖ, о чем подробно описано выше. К ЭхоКГ-паттернам ТЭЛА относятся расширение ПЖ; парадоксальное движение межжелудочковой перегородки (за счет объемной перегрузки ПЖ); утолщение передней стенки ПЖ и межжелудочковой перегородки; перикардиальный выпот; шунтирование крови справа налево через овальное окно [3, 11].
При поступлении в стационар пациенту К. была проведена ЭхоКГ, выявлены ЭхоКГ-паттерны перегрузки ПЖ, описанные выше, но, к сожалению, они были недооценены, как впрочем и клиническая картина пациента: наличие асимметричного отека правой голени и стопы, акцент 2-го тона на легочной артерии у пациента с АГ!
Тем не менее о сложности своевременной прижизненной диагностики ТЭЛА свидетельствуют данные A.T. Cohen и соавт. [12]: из > 370 тыс. умерших пациентов от ВТЭО в 2004 г. 34% больных умерли внезапно или в течение нескольких часов после острого события, прежде чем терапия могла быть начата или могла бы подействовать. В оставшейся группе у 59% больных ТЭЛА как причина смерти была диагностирована посмертно, и только у 7% умерших диагноз ТЭЛА был поставлен правильно при жизни.
Трудности диагностики ТЭЛА у пациента К. были обусловлены также наличием многососудистого поражения с гемодинамически значимыми стенозами коронарных артерий, выявленными при и-КАГ: резчайшая боль за грудиной с широкой иррадиацией, сопровождавшаяся синкопе, одышкой на ДГЭ, может быть объяснена как ТЭЛА вследствие снижения сердечного выброса, так и ИМ.
Пациенту К. с ИМ и рецидивирующей ТЭЛА назначена в стационаре тройная противотромботическая терапия. Врач должен ответить на следующие вопросы: на какой срок должна быть назначена тройная терапия пациенту К.? Как долго пациент К. должен принимать антикоагулянт? В какой дозе пациент К. должен принимать антикоагулянт через 6 мес.? Для определения длительности лечения противотромботическими препаратами рекомендуется оценка риска не только ишемических, но и геморрагических событий [3]. У пациента высок риск как ишемических событий, рассчитанный по шкале GRACE (см. выше), так и кровотечений.
Факторы риска кровотечения, согласно рекомендациям Европейского общества кардиологов, включают в себя: 1) пожилой возраст (в особенности > 75 лет); 2) предшествующее кровотечение (если оно не связано с обратимой или излечимой причиной) или анемия; 3) активное онкологическое заболевание; 4) наличие в анамнезе геморрагического или ишемического инсульта; 5) хроническое заболевание почек или печени; 6) сопутствующую антитромбоцитарную терапию или нестероидные противовоспалительные препараты (по возможности следует избегать); 7) другие серьезные острые или хронические заболевания; 8) плохой антикоагулянтный контроль [3].
У пациента имеются следующие факторы риска кровотечения: ХБП, сахарный диабет 2-го типа, антитромбо-цитарная терапия, что свидетельствует о высоком риске кровотечения.
Американские эксперты для оценки риска кровотечений с целью принятия решения о продлении приема антикоагулянтов при профилактике рецидивов ВТЭО предлагают учитывать следующие факторы риска: 1) возраст > 65 лет); 2) возраст > 75 лет; 3) кровотечения в анамнезе; 4) онкологическое заболевание; 5) метастазы; 6) почечная недостаточность; 7) печеночная недостаточность; 8) тромбоцитопения; 9) наличие в анамнезе инсульта; 10) сахарный диабет; 11) анемия; 12) антиагрегантная терапия; 13) плохой антикоагулянтный контроль (для пациентов, получающих антагонисты витамина К); 14) комор-бидность; 15) недавняя операция; 16) частые падения; 17) злоупотребление алкоголем; 18) прием нестероидных противовоспалительных препаратов [13]. Авторы классифицировали риск кровотечения у пациента на антикоагулянтной терапии как низкий (отсутствие факторов риска кровотечения; 0,8% годовой риск больших кровотечений), умеренный (один фактор риска кровотечения; 1,6% годовой риск большого кровотечения) или высокий (два или более фактора риска кровотечения; ≥ 6,5% годовой риск большого кровотечения) [13].
Согласно классификации американских экспертов, у пациента К. в связи с наличием сахарного диабета, приема антиагрегантной терапии высокий риск кровотечений. Риск кровотечений у пациентов следует периодически пересматривать (например, 1 раз в год у пациентов с низким риском и каждые 3 или 6 мес. у пациентов с высоким риском кровотечения) [3, 13]. В связи с наличием высокого риска как ишемических, так и геморрагических осложнений пациенту был рекомендован прием тройной противотромботической терапии в течение одного месяца с последующим переходом на двойную противотром-ботическую терапию в составе клопидогрела 75 мг/день и ривароксабана в дозе 20 мг/день.
У пациента с рецидивирующим течением ТЭЛА рекомендуется продолжать пероральное лечение антикоагулянтами в течение неопределенного времени, то есть более 3 мес. (класс рекомендаций I, уровень доказательности В). При решении о продолжении антикоагулянтной терапии после ТЭЛА у пациента без онкопатологии следует назначать уменьшенную дозировку ривароксабана (10 мг 1 раз/сут) через 6 мес. применения антикоагулянтов в терапевтических дозировках (IIaA) [3].
Почему же мы рекомендовали пациенту через 6 мес. продолжить прием ривароксабана в дозе 20 мг/день? В рандомизированном двойном слепом исследовании фазы 3 Einstein Choice 3 396 пациентов с верифицированным диагнозом ТГВ или ТЭЛА, принимавших от 6 до 12 мес. антикоагулянтную терапию, были распределены на 3 группы для приема ривароксабана один раз в сутки (в дозах 20 мг или 10 мг) или 100 мг аспирина в течение 12 мес. [14]. Риск рецидивов ВТЭО был значительно ниже в обеих группах ривароксабана, чем при применении аспирина, без значительного увеличения частоты кровотечений. В зависимости от соотношения риска рецидива ТГВ или ТЭЛА и риска кровотечения у конкретного пациента врач выбирает дозу 20 мг или 10 мг для продленной вторичной профилактики ВТЭО.
В Инструкции по медицинскому применению ривароксабана записано, что у пациентов с рецидивирующим течением ТГВ или ТЭЛА на фоне приема противотром-ботической терапии необходимо назначать ривароксабан в дозировке 20 мг один раз в день в качестве вторичной профилактики ВТЭО для долговременного (скорее всего пожизненного) приема [15].
Заключение
Рассмотренный в данной публикации клинический случай рецидивирующего течения ТЭЛА (от немассивной ТЭЛА под маской синкопе, нераспознанной на амбулаторном этапе, до массивной ТЭЛА и клинической смерти в стационаре после проведенного высокотехнологичного лечения (ЧКВ) в связи с развившимся ИМ) свидетельствует в очередной раз о трудностях диагностики ТЭЛА. С целью обеспечения оптимального взаимодействия госпитального и амбулаторного этапов при лечении пациентов после ТЭЛА рекомендуется разработка модели маршрутизации пациента (I класс). Рекомендован осмотр пациентов через 3–6 мес. после острой ТЭЛА (I класс). Пациентам с рецидивирующими ВТЭО, не связанными с наличием основного временного / обратимого фактора риска, рекомендуется продолжать пероральное лечение антикоагулянтами в течение неопределенного времени (I класс) [3].
Список литературы Рецидивирующее течение тромбоэмболии легочной артерии и острый инфаркт миокарда без подъема сегмента ST: актуальные проблемы диагностики и лечения (клинический случай)
- Raskob G.E., Angchaisuksiri P., Blanco A.N., Buller H., Gallus A., Hunt B.J. et al. Thrombosis: a major contributor to global disease burden. Arterioscler. Thromb. Vasc. Biol. 2014;34(11):2363-2371. https://doi.org/10.1161/ATVBAHA.114.304488.
- Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений. Флебология. 2015;9(4)2:3-52.
- Konstantinides S.V., Meyer G., Becattini C., Bueno H., Geersing G.J., Harjola V.P. et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur. Respir. J. 2019;54(3):1901647. https://doi.org/10.1183/13993003.01647-2019.
- Jimenez D., de Miguel-Diez J., Guijarro R., Trujillo-Santos J., Otero R., Barba R. et al. Trends in the management and outcomes of acute pulmonary embolism: analysis from the RIETE registry. J. Am. Coll. Cardiol. 2016;67(2):162-170. https://doi.org/10.1016/j.jacc.2015.10.060.
- Ebner M., Kresoja K.P., Keller K., Hobohm L., Rogge N.I.J., Hasenfuß G. et al. Temporal trends in management and outcome of pulmonary embolism: a single-centre experience. Clin. Res. Cardiol. 2020;109(1):67-77. https://doi.org/10.1007/s00392-019-01489-9.
- Покровский А.В. (ред.). Клиническая ангиология: Руководство. В двух томах. Т. 2. М.: ОАО Издательство «Медицина»; 2004:888.
- McGinn S., White P.D. Acute cor pulmonale resulting from pulmonary embolism. JAMA. 1935;104(17):1473-1480. https://doi.org/10.1001/jama.1935.02760170011004.
- Орлов В.Н. Руководство по электрокардиографии. М.: МИА; 2020:560.
- Collet J.P., Thiele H., Barbato E., Barthélémy O., Bauersachs J., Bhatt D.L. et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur. Heart J. 2021;42(14):1289-1367. https://doi.org/10.1093/eurheartj/ehaa575.
- Панченко Е.П., Балахонова Т.В., Данилов Н.М., Комаров А.Л., Кропачёва Е.С., Саидова М.C. и др. Диагностика и лечение тромбоэмболии легочной артерии: клинические рекомендации Евразийской ассоциации кардиологов для практических врачей (2021). Евразийский кардиологический журнал. 2021;(1):44-77. https://doi.org/10.38109/2225-1685-2021-1-44-77.
- Коков Л.С. (ред.). Тромбоэмболия легочной артерии. Классическая диагностика, новейшие методы профилактики и лечения: руководство для врачей. М.: РАН, 2022:378.
- Cohen A.T., Agnelli G., Anderson F.A., Arcelus J.I., Bergqvist D., Brecht J.G. et al. Venous thromboembolism (VTE) in Europe - The number of VTE events and associated morbidity and mortality. Thromb. Haemost. 2007;98(4):756-764. https://doi.org/10.1160/TH07-03-0212.
- Kearon C., Akl E.A., Ornelas J., Blaivas A., Jimenez D., Bounameaux H. et al. Antithrombotic therapy for VTE disease: CHEST Guideline and Expert Panel Report. Chest. 2016;149(2):315-352. https://doi.org/10.1016/j.chest.2015.11.026.
- Weitz J.I., Lensing A.W.A., Prins M.H., Bauersachs R., Beyer-Westendorf J., Bounameaux H. et al.; EINSTEIN CHOICE Investigators. Rivaroxaban or aspirin for extended treatment of venous thromboembolism. N. Engl. J. Med. 2017;376(13):1211-1222. https://doi.org/10.1056/NEJMoa1700518.
- Бурлева Е.П., Кременевский О.М. Пролонгированная антикоагулянтная терапия венозных тромбоэмболических осложнений: решенные вопросы и спорные позиции. Флебология. 2019;13(1):42- 51. https://doi.org/10.17116/flebo20191301142.


