Редис Моховский - источник MSИ MF-линий при селекции на гетерозис
Автор: Федорова М.И., Заячковская Т.В., Домблидес Е.А., Домблидес А.С.
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 3-4 (28-29), 2015 года.
Бесплатный доступ
На основе гибридных и инбредных потомств сортопопуляции редиса Моховский с использованием ЦМС-ogura выделено девять линий со 100%-ной ms и подобраны полностью фертильные закрепители. Путем тестирования мультиплексной ПЦР подтверждено наличие цитоплазмы Ogura в ms-линиях и отсутствие таковой в mf-линиях. Создан исходный линейный материал для практической селекции редиса на гетерозис.
Редис моховский, цмс-ogura, гибридные комбинации, инбредные линии, потомства, мультиплексная пцр
Короткий адрес: https://sciup.org/14025156
IDR: 14025156 | УДК: 635.152:631.527.52
Текст научной статьи Редис Моховский - источник MSИ MF-линий при селекции на гетерозис
В озможность создания гибридов первого поколения, превосходящих исходные образцы, как по урожайности, так и по скороспелости показана многими исследователями (Крючков А.В., 1997;
Артемьева А.М., 1983). В настоящее время исследования по изучению гетерозиса редиса, редьки, брюквы и др. овощных культур этого семейства ведутся в большинстве развитых стран Европы, Японии, Китае, странах СНГ (Барашева Г.М., 2000; Зубик И.Н., 2005; Бунин М.С., 2002).
На селекционной станции им. Н.Н. Тимофеева показана возможность получения гибридов F1 на основе самонесовместимости, превосходящих по продуктивности и по содержанию витамина С стандартные образцы (Барашева Г.М., 2000). В селекции F1 гибридов капустных овощных культур используют мужскую стерильность и самонесовме-стимость (Bonnet A., 1975; Бунин М. С., 1994; Зубик И.Н., 2005).
В настоящее время ряд зарубежных компаний Monsanto (США),
Syngenta (Швейцария), Bayer CropScience (Германия), Limagrain (Франция), Rijk Zwaan (Нидерланды), Sakata, TAKII (Япония) предлагают гибриды F1 редиса, созданные на основе мужской стерильности – Донар, Тарзан, Ровер, Таурус и др. В Государственный реестр селекционных достижений РФ на 2014 год включено 28 гибридов F1 редиса, в основном иностранной селекции (Нидерланды, Франция и др.). В России селекционную работу по созданию гибридов ведут ВНИИО, селекционная станция им. Н.Н. Тимофеева и ВНИИССОК. Во ВНИИ овощеводства выделены стерильные формы растений (Оgu-ЦМС) и создан перспективный линейный материал для селекции редиса на гетерозис (Янаева Д.А., 2010; Янаева Д.А., Ховрин А.Н., 2013).
Большой научный и практический интерес для гетерозисной селекции различных видов растений семейства Brassicaceae L. имеет использование формы дайкона в качестве донора Ogu-ЦМС. Во ВНИИССОК исследования по передаче ЦМС-Оgu от дайкона редису проводятся с использованием исходных линий и гибридных комбинаций многих сортовых и гибридных популяций редиса, в том числе сортопопуляции Моховский. Оценка потомств комбинаций скрещивания фертильных линий с линией ЦМС-Оgu показала, что в ряде гибридных поколений наблюдается 100% фертильность. Большинство сортов и селекционных форм редиса, участвовавших в скрещиваниях, имеют доминантный по фертильности генотип, и подобранные для скрещивания с Оgu-ЦМС опылители подходят для выделения из них закрепителя стерильности. Выявлены особенности наследования и характер проявления основных морфобиологических признаков растений гибридных потомств (Бунин М.С., Кириллова А.Б., 1997; Даньков А.М., 2001; Заячковская Т.В., Федорова М.И., Степанов В.А., 2005).
ЦМС-формы, относящиеся к определенному типу стерильности, характеризуются своим типом митохондриальной ДНК (мтДНК) и системой ядерного генетического контроля. Большинство митохондриальных генов, обуславливающих ЦМС, имеет химерную природу и содержит также их наличие и расположение в митохондриальном геноме позволяет дифференцировать различные типы цитоплазмы с использованием молекулярных маркеров. В 2010 Zhao H.X. и соавторы предложили способ идентификации типа цитоплазмы у образцов рапса с использованием мультиплексной ПЦР (Zhao H.X. et al., 2010). Этот метод позволял идентифицировать сразу пять основных типов: Ogura, Ogu-NWSU-AF, Nap, Pol, Cam. В 2014году этот метод был опробован и на других представителях семейства Капустные (Домблидес Е.А. и др, 2014).
Материалы и методы
Исследования проводили в условиях защищенного грунта ВНИИС-СОК. Изучаются ms и mf линии, инбредные потомства и гибридные комбинации сортопопуляции редиса Моховский, созданные с использованием формы дайкона с ЦМС-Ogura – MS Gensuke. Проведена оценка гибридных комбинаций msxmf, бек-кросированных и инбредных потомств сортопопуляции Моховский разных поколений инбридинга (I1-I4).
Маточные корнеплоды выращивали по общепринятой методике. При уборке проводили качественный и количественный учет урожая, био- метрические исследования, изучали основные морфобиологические признаки листовой розетки и корнеплода и их изменчивость (коэффициент вариации, V%). Оценку растений по признаку ЦМС проводили в фазу массового цветения в пределах потомства и индивидуально по растениям. Для скрещиваний выделяли хорошо развитые семенные растения, изолированные в фазу бутонизации индивидуальными изо- логическим параметрам. Методы работы – использован инбридинг, кроссбридинг, беккросс, сетпкросс, отбор и молекулярное тестирование путем мультиплексной ПЦР.
Выделение ДНК. Выделение ДНК проводили из молодых листьев и/или бутонов с использованием набора реагентов «Сорб-ГМО-Б»
х AT компании «Cинтол» (Москва, Россия). Амплификация ДНК. В работе использовали следующие праймеры: P11 5’gaaacgggaagtgaca- • at3’, P12 5’gcattattttctcggtccat3’, P21 5’agctgtctggagggaatc3’, P22
5’gcggtctcacgcactaatc3’, P32 5’acga-catcaaggaggaac3’, atp9-5’ 5’cccga-gatgttagaaggtgc3’, atp9-3’5’caaaaag-gccatcattgggg3’. Тотж для пары праймеров atp9-5’ и atp9-3’была 60°С, для всех остальных 54°С.
Продукты амплификации разделяли в 1,7% агарозном геле в 0,5ЧТВЕ-буфере.
Секвенирование продуктов амплификации. Секвенирование продуктов амплификации, полученных с праймерами Р11 и Р12, проводили в научно-производственной компании «Синтол» (Москва, Россия). Сравнительный анализ и поиск гомологичных последовательностей проводили по базе NCBI . Множественные выравнивания последовательностей проводили, используя программу, доступную в Интернете: Mega5 v4.0.2 (.
Результаты исследований
Сорт Моховский – единственный среди сортимента сорт со съедобными салатными листьями. Создан в период развития индустрии орбитального питания для космонавтов в 80-ые годы. Во ВНИИССОК в это время ученые работали в направле- новые открытые рамки считывания, такие как orf222, orf224, orf138, orf 263, характерные для разных типов. Изучение нуклеотидной последовательности этих генов/локусов, а ляторами; опыление проводили вручную. Инбредные и гибридные потомства от скрещивания msxmf оценивали по признаку ms в период массового цветения и по морфобио- нии выведения сортов скороспелых, быстрорастущих овощных культур, у которых были бы пригодны «и вершки, и корешки». Сорт Моховский и стал пищей для космонавтов.
В связи с 50-летием российской космонавтики в 2011 году памятные медали были вручены ученым ВНИ-ИССОК, которые принимали участие в деле развития космонавтики (Пивоваров В.Ф., Примак А. П., Федорова М.И., Тареева М.М., 2011).
Сорт создан индивидуальносемейственным отбором из гибридной комбинации Бисер х Перл, относится к белым круглым редисам европейского подвида с неопушен-ными съедобными листьями, среднеранний (25-28 суток). Универсальный по способам выращивания: в условиях пониженной освещенности защищенного грунта в зимне-весенний период (январь-февраль); в пленочных теплицах и под малогабаритными укрытиями (март-апрель) и в открытом грунте во всех зонах районирования культуры. Розетка листьев полуприподнятая, лист зеленый. Два первых настоящих листа цельные, последующие листья лировидно-раздельные; форма листовых долек удлиненно-овальная, край листа волнистый, гладкий.
Черешки тонкие, светло-зеленые. Неопушенные листья используются в пищу и содержат до 100 мг% аскорбиновой кислоты при низком содержании нитратов (319-530 мг/кг). Корнеплоды белые, округлые, плотные, без горечи, с нежной недряб-нующей мякотью, массой 20-35 г. Основная форма корнеплода округлая (90%), постоянно сопутствующие сорту формы: плоскоокруглая (5%) и удлиненно-округлая (5%), индекс формы 0,75-1,14. Головка корнеплода маленькая, плоская, нежная, белая и светло-зеленая. Осевой корешок тонкий с небольшим количеством боковых корней, донце округлое. Корнеплоды могут храниться в холодильнике при температуре 3…5°С до 45 суток, не снижая вкусовых качеств. При многоразовой уборке корнеплоды можно оставлять в грунте до 30 суток. При этом качество и вкус остаются высокими. Корнеплоды содержат 4,7-5,2% сухого вещества, 2,3-3,2% моносахаров, до 40% аскорбиновой кислоты; слабо чувствительны к накоплению нитратов (270-500 мг/кг).
Урожайность в пленочных теплицах при площади питания 42 и 49 см2 составляет 4,2-4,8 кг/м2, в открытом – 18,6 т/га. Семена округлой и округло-плоской формы, желтые. Масса 1000 семян 8,5-12 г. Урожайность семян составляет 0,42-0,72 т/га.
В результате анализа семенных растений гибридных и инбредных потомств по признаку ms, созданных ранее, выделены стерильные формы и фертильные линии различных сор-топопуляций редиса (Федорова М.И., Заячковская Т.В., 2011). Полученные потомства сортопопуля-ции Моховский изучали по морфобиологическим признакам корнеплода и листовой розетки. За период исследований создано и изучено более 170 потомств сортопопуляции Моховский. Из-за разных сроков цветения семенных растений для опыления стерильных форм нередко использовали фертильные растения из комбинаций скрещивания или гибридных популяций. В связи с этим исследовали гибридные комбинации двух групп, полученные с использованием опылителей
1. Характеристика комбинаций скрещивания и инбредных потомств сортопопуляции Моховский по морфобиологическим признакам
|
Посевной номер |
Название комбинации скрещивания |
Высота листовой розетки |
Индекс формы корнеплода |
Рассеченность листовой п ластинки |
||
|
Х, см |
V, % |
Х, см |
V, % |
|||
|
комбинации скрещивания со 100% ms |
||||||
|
10 |
83-3msх98-3mf |
23,21 |
7,66 |
1,00 |
8,71 |
2-3 доли |
|
85/379/13 |
85-5msх98-2mf |
19,56 |
10,06 |
1,13 |
11,69 |
2-3 доли |
|
79/382/13 |
79-1msх98-1mf |
22,49 |
9,34 |
1,11 |
13,80 |
2-3 доли |
|
14 |
79-2msх98-1mf |
24,05 |
13,58 |
1,30 |
14,19 |
2-3 доли |
|
72/378/13 |
72-1msх98-2mf |
21,17 |
11,92 |
1,25 |
14,81 |
2-3 доли |
|
11 |
83-2msх98-3mf |
22,31 |
9,11 |
1,06 |
19,71 |
2-3 доли |
|
12 |
70-1ms98-2mf |
25,46 |
9,97 |
1,33 |
27,55 |
2-3 доли |
|
83/388/13 |
83-2msх98-3mf |
17,48 |
9,56 |
1,37 |
10,23 |
2-3 доли |
|
54/12 |
455-1msх455-2mf |
20,32 |
10,26 |
1,21 |
11,43 |
2-3 доли |
|
100%-ные mf опылители |
||||||
|
19/14 |
89/08 |
22,47 |
7,33 |
1,19 |
13,06 |
3-4 доли |
|
20/14 |
94/08 |
23,19 |
6,19 |
1,22 |
10,27 |
3-4 доли |
|
24/14 |
637-2/11 |
30,43 |
10,42 |
1,10 |
5,22 |
2-3 доли |
|
2514 |
91/08 |
26,69 |
5,96 |
1,16 |
16,93 |
2-4 доли |
|
98/385/13 |
3mf 98/05 |
15,36 |
13,52 |
1,06 |
5,45 |
2-3 доли |




инбредных потомств сортопопуля-ции Моховский (1) и опылителей инбредных потомств, выделенных из гибридных популяций (2).
По трехлетним данным (2012-2014 годы) выявлены различия морфобиологических параметров между группами потомств. Растения потомств поколений инбридинга, в 50% случаев характеризовались небольшой листовой розеткой (17,521см). У большинства комбинаций (87%) 2-ой группы растения характеризуются более высокой листовой розеткой (21-36,2 см). Изменчивость признака высоты листовой розетки в обеих группах низкая – 8-10% (табл.1). Листовая розетка растений потомств 1-ой группы в 70% гибридных комбинаций образована слабо рассеченными листьями (2-3 доли). У растений 63% потомств 2-ой группы большее число листьев (от пяти до восьми), они более рассеченные, имеют от двух до пяти долей в 61% потомств. Во всех изученных потом-ствах корнеплоды округлой формы, белой окраски. Признак формы корнеплода мало изменчив – в 65% потомств коэффициент вариации от 7,9% до 15,1%.

Изучение проявления стерильности в гибридных комбинациях позволило оценить используемые в качестве опылителей инбредные потомства как потенциальных закрепителей стерильности. Разное происхождение потомств, используемых в качестве опылителей, оказало влияние на степень стерильности гибридных комбинаций и сохранение стерильности в следующих поколе- ниях. Так, при использовании в скрещиваниях фертильных форм из сортовой популяции разных поколений инбридинга, степень стерильности в большинстве потомств увеличивалась, и лишь в пяти комбинациях из 20 наблюдалось снижение процента стерильности. В случае же опыления растениями, взятыми из гибридных популяций, увеличение степени стерильности полученных потомств не
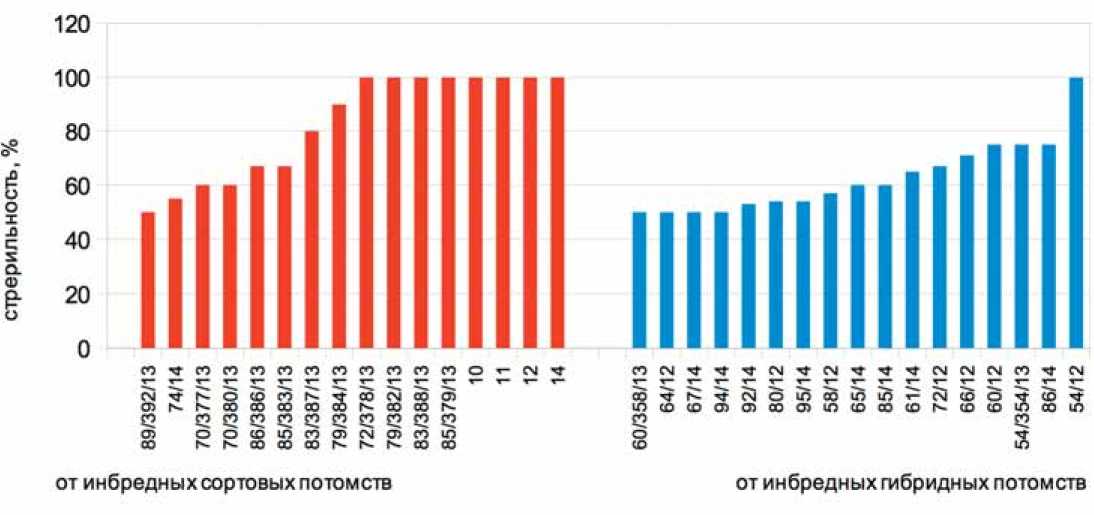
Рис. 1. Проявление стерильности в комбинациях скрещивания от инбредных потомств сортовых и гибридных популяций.
ВЦ
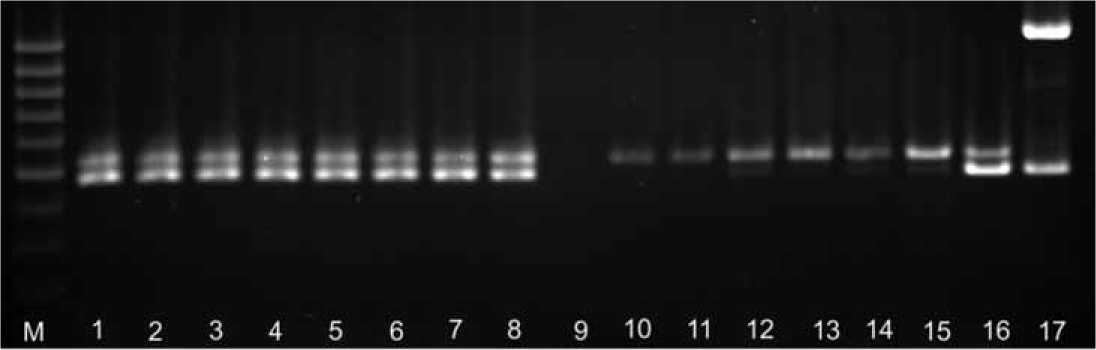
Рис. 2. Мультиплексная ПЦР.
Потомства: 1. 85/37913 S, 2. 79/382/13 S, 3. 86/386/13 F, 4. 86/386/13 S, 5. 70/380/13 F, 6. 70/380/13 S, 7. 60/358/13
F, 8. 60/358/13 S, 9. К-, 10. 19/14 F, 11. 20/14 F, 12. 24/14 F, 13. 25/14 F, 14. 98/385/13 F 15. Ushiki-Gensuke F, 16. MS-
Gensuke S, М – маркером молекулярных масс 100 bp DNA ladder (MBI FERMENTAS, Латвия), 17. Контроль цитоплазмы
-
1 .0 Ogu-NWSUAF.
наблюдалось. Большинство полностью стерильных потомств получено в группе комбинаций от инбред-ных потомств сортовых популяций (рис.1).
В результате из числа изученных потомств выделено девять комбинаций скрещивания с закрепленной 100%-ной ms – №№ 83/388/13; 79/382/13; 72/378/13; 85/379/13; 10/14, 11/14, 12/14, 14/14, 54/12 и исходные опылители для закрепления ms от инбредного потомства №3mf 98/05.
Растения выделенных потомств со 100%-ной ms обладают малой и средней по высоте листовой розеткой – от 17,5 до 25,5 см со слабой изменчивостью этого признака (V=7,7-13,6%), небольшим числом слабо рассеченных (на 2-3 доли) листьев в розетке. Корнеплоды округлой формы, с индексом 1,01,37; белой окраски. Вариабельность формы корнеплода, в основном, невысокая и составила 8,8-14,8% (табл.1).
Изучение изменчивости основных морфобиологических признаков растений инбредных потомств закрепителей ms в скрещиваниях показало, что опылители различались преимущественно высотой листовой розетки. Инбредные потомства разных поколений инбри- динга характеризовались в 67% случаев малой и средней высотой листовой розетки (до 25см); потомства опылителей, полученные из гибридных популяций, в 77% случаев имели листовую розетку высотой 2542 см. Изменчивость этого признака в обеих группах опылителей средняя (<15%).
Исходная отцовская линия-опылитель №3mf 98/05, из которой получены все отцовские формы для закрепления стерильности 100% (№№83/388/13; 79/382/13; 72/378/13; 85/379/13; 10/14, 11/14, 12/14, 14/14) характеризуется крупной листовой розеткой — 27,6см, корнеплодами округлой формы (I=1,1), белой окраски. Листья среднерассеченные на 2-4 доли со светло-зелеными черешками длиной 7-9 см. На основе исходной линии-опылителя №3mf 98/05 выделены как возможные закрепители стерильности инбредные потомства №№19/14, 20/14, 24/14, 25/14.
Включенные в данное исследование потомства сортопопопуля-ции Моховский №№85/379/13, 79/382/13, 86/386/13, 70/380/13, 60/358/13, 19/14, 20/14, 24/14, 25/14, 385/14 протестированы с использованием мультиплексной ПЦР для идентификации типа сте- рильности цитоплазмы. Для внутреннего контроля присутствия в суммарных препаратах ДНК митохондриальной ДНК использовали пару праймеров atp9-5’ и atp9-3’. Ампликоны размером 200 п.н. присутствовали во всех исследуемых образцах, подтверждая наличие мтДНК в суммарных препаратах ДНК. Новый образец протестировал мультиплексной ПЦР с использованием одновременно трех пар праймеров (P11 и P12, P21 и P22, P21 и P32). По комбинации полученных продуктов идентифицируют одновременно несколько типов цитоплазмы: продукты размером 465 п.н. и 500 п.н. – тип цитоплазмы Ogura, 747 п.н. и 500 п.н. – тип Polima, 1102 п.н. и 800 п.н. – тип Napus, 800 п.н. и 500 п.н. – тип цитоплазмы Cam, а 465 п.н. и 1102 п.н. – тип Ogu-NWSUAF. У всех стерильных потомств амплифицирова-лись продукты 465 п.н. и 500 п.н., диагностируя тип стерильности Ogura. У фертильных потомств редиса, гибридного происхождения – 86/386/13, 70/380/13, 60/358/13, полученных при скрещивании со стерильными материнскими формами, фрагмент размером 465 п.н. ампли-фицировался с такой же интенсивностью, как и у стерильных потомств – 85/379/13, 79/382/13 (рис.2). Это свидетельствует о присутствии у этих потомств цитоплазмы Ogura, однако отсутствие внешнего проявления стерильности обусловлено присутствием в ядерном геноме генов – восстановителей фертильности (Rf). У предполагаемых закрепителей стерильности – 19/14, 20/14, 24/14, 25/14 присутствовал только продукт 500 п.н., а размером 465 п.н. отсутствовал (рис. 2), что подтверждало отсутствие у них стерильной цитоплазмы.
По результатам расшифровки последовательности продукта размером 465 п.н. у стерильных потомств редиса и дайкона MS-Gensuke, который использовали в качестве контроля цитоплазмы Ogura , подтверждено наличие в них участка 417 п.н. на 100% гомологичного с митохондриальным геном orf138 – типа А (всего выделяют девять типов гена orf138 от A до I), причем этот продукт был абсолютно идентичен у всех изученных потомств.
Заключение
Сортопопуляция Моховский является по своей природе оригинальным источником для селекции на гетерозис. Для создания гибридов F1 отобраны перспективные ms (№№ 83/388/13; 79/382/13; 72/378/13; 85/379/13; 10/14, 11/14, 12/14, 14/14, 54/12) и mf-линии (№№19/14, 20/14, 24/14, 25/14) сортопопуляции Моховский, которые протестированы мультиплексной ПЦР. Подтверждено наличие цитоплазмы Ogura в ms-линиях и отсутствие таковой у линий mf. Изменчивость основных морфобиологических признаков гибридных комбинаций позволила оценить опылители инбредных потомств из сортовых и гибридных популяций редиса, как потенциальных родоначальников линий закрепителей стерильности при получении гетерозисных гибридов F1 на основе ЦМС-Ogura. Показана возможность использования гибридных популяций для получения ms линий.
RADISH CV. MOKHOVSKIY IS A SOURCE OF MS- AND MF-LINES AT BREEDING FOR HETEROSIS
Fedorova M.I., Zayachkovskaya T.V., Domblides E.A., Domblides A.S.
Federal State Budgetary Scientific Research Institution
«All-Russian Scientific Research Institute of vegetable breeding and seed production» 143080, Russia, Moscow region, Odintsovo district, p. VNIISSOK, Selectionnaya street, 14
Список литературы Редис Моховский - источник MSИ MF-линий при селекции на гетерозис
- Артемьева А.М. Общая и специфическая комбинационная способность самонесовместимых инбредных линий капусты белокочанной//Бюлл. ВИР. -Л.,1983. -Вып. 187. -С. 58-59.
- Барашева Г.М. Наследование инбредными линиями редиса основных хозяйственных признаков и элементного состава//Автореф. дис. канд. с.-х. наук.-М.,2000. -21 с.
- Бунин М.С. Мужская стерильность сельскохозяйственных растений семейства Brassicaceae L. и ее использование в селекции//С.-х. биология, сер. Биология растений. -1994. -№1. -С.20-31.
- Бунин М.С., Кириллова А.Б. Использование мужской стерильности в селекции гетерозисных гибридов корнеплодных овощных культур вида Raphanus sativus L. Гетерозис сельскохозяйственных растений. Международный симпозиум. -М. 1997. -Т.5, XII. -С.94-96.
- Бунин М.С. Новые овощные культуры России//МСХ РФ. -М.: «Росинформагротех», 2002. -С.150-155.
- Даньков А.М. Исходный материал для селекции редиса по основным хозяйственно ценным признакам//Канд.дисс.-М.,2001.
- Домблидес Е.А., Домблидес А.С., Заячковская Т.В., Бондарева Л.Л.Диагностика типа ЦМС с использованием мультиплексной ПЦР//Сборник трудов 8-ой Международной научно-практической конференции с международным участием «Молекулярная диагностика 2014», М. -Т.2. -С.435-436.
- Заячковская Т. В., Федорова М. И., Бунин М.С., Степанов В. А., Заячковский В. А. Исходный материал редиса для селекции на гетерозис.//Современное состояние и перспективы развития селекции и семеноводства овощных культур. Международный симпозиум (9-12 августа 2005).-М., 2005. -Т. 2. -С. 137-145.
- Крючков А.В. Селекция гибридов F1//В кн.: Селекция и семеноводство/М.: Колос, 1997. -Гл.12. -С.106-147.
- Пивоваров В.Ф., Примак А.П., Федорова М.И., Тареева М.М. Космические овощи ВНИИССОК//Овощи России. -2011. -№ 2. -С.59-64.
- Федорова М.И., Заячковская Т.В. Использование мужской стерильности типа Ogura в селекции редиса на гетерозис//Овощи России. -2011. -№ 4. -С.22-31.
- Янаева Д. А. Создается банк линий для получения гетерозисных гибридов редиса//картофель и овощи. М. -2010. -№8. -С. 24-26.
- Янаева Д. А., Ховрин А.Н. Редис европейский: селекция и технология выращивания//Картофель и овощи. -М., 2013. -№4.
- Bonnet A. Introduction and utilization of a cytoplasmatic male sterility in early European varieties of radish-Raphanus sativus L.//Ann. Amelior. Plantes. -1975. -V. 25. -№4. -P. 381-397.
- Zhao H.X., Li Z.J., Hu S.W., Sun G.L., Chang J.J., Zhang Z.H. Identification of cytoplasm types in rapeseed (Brassica napus L.) accessions by multiplex PCR assay//Theor. Appl. Genet. 2010. -V. 121. -P. 643-650.


