Редкие иммуноопосредованные нежелательные явления: клиническая характеристика, подходы к диагностике и лечению
Автор: Жукова Л.Г., Пасечнюк О.С., Польшина Н.И., Хачатурян Э.А., Гречухина К.С.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S1 т.14, 2024 года.
Бесплатный доступ
Внедрение иммунотерапии позволило при ряде злокачественных опухолей (ЗНО) значимо увеличить продолжительность жизни пациентов в сравнении с «классической» химиотерапией. Способность иммунотерапевтических препаратов активировать Т-лимфоциты позволяет, с одной стороны, добиться противоопухолевого эффекта, с другой — может приводить к развитию иммуноопосредованных нежелательных явлений (иоНЯ). Наиболее распространенными иоНЯ являются эндокринные (гипо- или гипертиреоз), гастроинтестинальные (колит, гепатит) и дерматологические (зуд, сыпь) реакции. Редкие, но потенциально угрожающие жизни иоНЯ требуют особого внимания. Особое место занимает перекрестный синдром, включающий миокардит, миастению и миозит, который отличается быстрыми темпами прогрессирования и высокой летальностью. Миокардит проявляется болями в груди, одышкой и тахикардией, с повышением уровня тропонина — важного диагностического маркера. Сопутствующие миозит и миастения гравис проявляются миалгией и слабостью конечностей. Для разрешения этих иоНЯ требуется применение высоких доз глюкокортикостероидов (ГКС) и иногда плазмафереза. Среди неврологических иоНЯ особо выделяют энцефалит и синдром Гийена-Барре. Энцефалит проявляется различными общемозговыми симптомами: изменениями психического статуса, головной болью, судорогами и т. д. Синдром Гийена-Барре при этом проявляется мышечной слабостью и парестезиями. Диагностика включает люмбальную пункцию, электроэнцефалограмму и ряд лабораторных исследований. Лечение основано на высоких дозах ГКС, при резистентности к ГКС — использование ритуксимаба. Офтальмологические иоНЯ могут проявляться сухостью глаз, увеитом и невритом зрительного нерва, иногда приводя к серозной отслойке сетчатки. Для диагностики требуется доступность узкоспециализированных методов, таких как офтальмоскопия и оптическая когерентная томография. Лечение включает топические и местные инъекционные ГКС. Редкие иоНЯ подчеркивают необходимость междисциплинарного подхода в лечении ЗНО, учитывая сложности диагностики и ведения подобных пациентов. Эта проблема становится все более актуальной с расширением показаний к применению иммунотерапии, что требует разработки эффективных методов управления этими особыми и иногда фатальными осложнениями.
Иммунотерапия, нежелательные явления, иммуноопосредованные нежелательные явления
Короткий адрес: https://sciup.org/140307169
IDR: 140307169 | DOI: 10.18027/2224-5057-2024-14-3s1-53-62
Текст научной статьи Редкие иммуноопосредованные нежелательные явления: клиническая характеристика, подходы к диагностике и лечению
Иммунотерапия (ИТ) значительно изменила подходы к лечению различных злокачественных опухолей, таких как меланома, рак почки, немелкоклеточный рак легкого и гепатоцеллюлярный рак. В настоящее время применяются препараты, блокирующие CTLA-4 (ипилимумаб) или PD-1/PD-L1 (пембролизумаб, пролголимаб, ниволумаб и атезолизумаб) как в монотерапии, так и в комбинации между собой (например, ипилимумаб + ниволумаб), с тар-гетными или химиопрепаратами [1].
Одной из характерных черт опухолевых клеток является их способность ускользать от иммунного надзора. Иммунотерапия направлена на восстановление способности иммунной системы распознавать опухолевые клетки, что проявляется клиническим противоопухолевым эффектом. Ингибиторы контрольных точек активируют механизм ингибирования апоптоза Т-лимфоцитов, снижают истощение периферических Т-эффекторных клеток и усиливают активацию CD8 + лимфоцитов, что в свою очередь способствует гибели опухолевых клеток [2,3].
Из-за неспецифической активации иммунной системы могут возникать иммуноопосредованные нежелательные явления (иоНЯ). Эти реакции могут затрагивать любые органы и системы, и классифицируются по критериям CTCAE. [4]. На сегодняшний день клинические предикторы развития иоНЯ не установлены, однако в литературе появляются данные о возможной генетической предрасположенности. Например, Noha и соавторы описали восемь генов, полиморфизмы которых связаны с повышенным риском развития иоНЯ [5]. Сроки развития иоНЯ варьируют от нескольких дней до месяцев уже после завершения ИТ. Наибольший опыт в отношении характера и времени развития накоплен при применении ипилиму-мамаба — первого из одобренных к применению представителя ингибиторов контрольных точек иммунитета. Так, установлено, что при его применении дерматологические и гастроинтестинальные проявления возникали в первую очередь (через 3–5 недель от начала терапии), и их частота снижалась к 10-й неделе, в то время как эндо-кринопатии и гепатотоксичность развивались позже, как правило, между 6-й и 8-й неделями, а пневмонит — только на 10–12 неделе [6–9]. Отсроченные иоНЯ могут возникать в течение 90 и более дней после завершения терапии. Они, вероятно, возникают в результате замедленного выведения препаратов, несмотря на их короткий период полувыведения, что может объяснять отсрочен-ность проявлений [10].
Учитывая уникальность спектра иоНЯ, необходимы специализированные подходы к их раннему выявлению и коррекции. Первые рекомендации по управлению иоНЯ были разработаны Европейским обществом клинической онкологии, за которыми последовали рекомендации других международных организаций и сообществ, таких как ASCO, NCCN и RUSSCO. Общие принципы ведения иоНЯ включают [11–13]:
-
• глюкокортикостероиды (ГКС) — основа лечения большинства иоНЯ;
-
• большинство иоНЯ 1-й степени позволяет продолжить терапию под тщательным наблюдением (за исключением некоторых случаев гематологической, сердечной и неврологической токсичности);
-
• при развитии иоНЯ 2-й степени следует приостановить терапию и возобновить ее при разрешении иоНЯ до 1-й степени или менее. Если симптомы сохраняются в течение недели, необходимо добавить глюкокортикостероиды;
-
• при развитии иоНЯ 3-й степени терапию необходимо приостановить, а также немедленно назначить глюкокортикостероиды в высоких дозах (преднизолон или метилпреднизолон). Минимальная продолжительность терапии ГКС составляет от 4 до 6 недель и может быть продлена до 8 недель, особенно при ио-пневмонитах или гепатитах. При рефрактерности к ГКС-тера-пии (т. е. при отсутствии разрешения симптомов в течение 48–72 часов с начала терапии) следует назначить
инфликсимаб. В отдельных случаях, при отсутствии терапевтических альтернатив, может рассматриваться возвращение к иммунотерапии, однако это требует строгого контроля за состоянием пациента;
-
• иоНЯ 4-й степени требуют отмены иммунотерапии, за исключением случаев эндокринопатий, которые могут контролироваться специальной заместительной терапией.
Наиболее распространенные иоНЯ включают эндокринные (гипо-/гипертиреоз), дерматологические (сыпь, зуд) и гастроинтестинальные (гепатит, колит). Однако существуют редкие иоНЯ, которые наблюдаются менее чем в 1% случаев и требуют особого внимания в научной среде из-за высокой смертности и трудностей диагностики (Рисунок 1). При этом некоторые исследования показывают, что развитие редких иоНЯ связано с увеличением частоты объективного ответа и выживаемости без прогрессирования у пациентов по сравнению с теми, у кого иоНЯ не развились [14–17].
ПЕРЕКРЕСТНЫЙ СИНДРОМ: МИОКАРДИТ, МИАСТЕНИЯ И МИОЗИТ
Миокардит является редким, но жизнеугрожающим осложнением терапии ингибиторами контрольных точек, с частотой встречаемости от 0.27% до 1.14% и смертностью 25–50% [19,20]. Нередко ему сопутствуют миозит и/или миастения гравис (МГ), образуя так называемый перекрестный синдром. Развитие триады «М» предсказывает крайне неблагоприятный исход с высокой летальностью [20].
Самыми частыми симптомами миокардита являются боли в груди, одышка, сердцебиение, усталость, отеки ног, синкопальные или пресинкопальные состояния. При этом клиническая картина может варьировать от бессимптомных лабораторных отклонений и находок на ЭКГ до развития декомпенсированной сердечной недостаточности [21]. Наиболее частый лабораторный маркер миокардита — повышение тропонина, встречается в 94% случаев [22]. Важно учитывать, что в диагностике миокардита предпочтительно определение именно тропонина I, так как тропонин T, будучи менее специфичным для повреждения кардиомиоцитов, может быть также повышен при миозите [23]. Реже отмечается повышение мозгового натрийуретического пептида (NT-proBNP) (66%), а также воспалительных маркеров крови. Различные нарушения сердечного ритма могут быт выявлены на ЭКГ: тахиарти-мии, АВ-блокады, инверсии зубца T и другие. Отклонения на ЭКГ определяются в 89% случаев ио-миокардита [22]. Эхокардиография позволяет определить наличие снижении фракции выброса левого желудочка и нарушения локальной сократимости сердечной стенки. Важно понимать, что вышеперечисленные отклонения не являются специфическими для ио-миокардита и могут также выявляться при самостоятельной сердечной патологии, например, ОКС, что делает диагностику миокардита не-
РЕДКИЕ ИММУНООПОСРЕДОВАННЫЕ НЕЖЕЛАТЕЛЬНЫЕ ЯВЛЕНИЯ: КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА, ПОДХОДЫ К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ
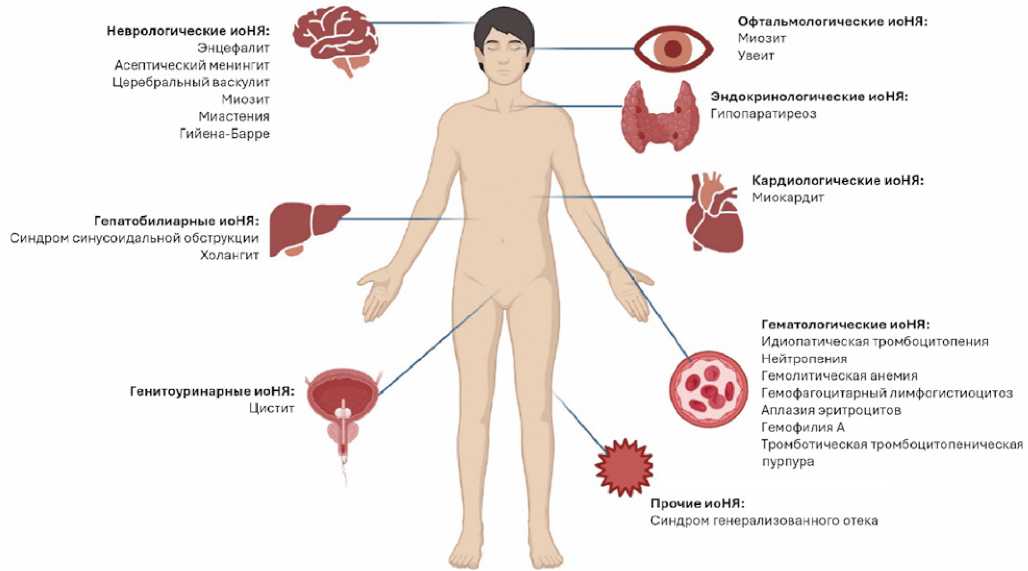
Рисунок 1. Представлены схематично редкие иоНЯ, адаптировано [18]
простой клинической задачей, а сам миокардит — «диагнозом исключения». Более специфическими методами подтверждения воспалительного повреждения миокарда являются магнитно-резонансная томография (МРТ) сердца или 68Ga-DOTATOC-ПЭТ-КТ. В то же время золотым стандартом подтверждения диагноза миокардита остается морфологический — посредством проведения эндомиокардиальной биопсии. Принимая во внимание ограниченную доступность подобных диагностических процедур даже в условиях многопрофильных стационаров, разработаны диагностические критерии миокардита, опубликованные в консенсусе интернационального общества кардиоонкологов по кардиоваскулярной токсичности противоопухолевой терапии [23]. Согласно данным критериями, диагноз миокардита считается подтверждённым при наличии морфологической верификации, или сочетания повышения тропонина с МР-картиной, характерной для миокардита, или сочетания повышения тропонина с двумя малыми критериями, к которым относятся: наличие клинических проявлений, желудочковые аритмии и/или нарушения проводимости, снижение ФВ, наличие другого иоНЯ (в частности, миастении или миозита), CMR-картина, подозрительная в отношении миокардита. Тем не менее при клиническом ухудшении пациента предлагается начинать терапию согласно алгоритмам лечения миокардита, не дожидаясь подтверждения диагноза [23].
Терапия миокардита заключается в пульс-терапии метилпреднизолоном и возможном назначении микофенолата мофетила при резистентном течении.
Миозит — не менее редкое иоНЯ с частотой развития около 1 % [21]. Клиническая картина миозита представ- лена миалгиями, слабостью проксимальных отделов конечностей, и такими миастеническими симптомами как птоз век, что затрудняет дифференциальный диагноз с миастенией гравис. Миозит (как и МГ) становится жизнеугрожающим при вовлечении респираторных мышц. Лабораторно при миозите определяются повышенные креатинфосфокиназа, трансаминазы и альдолаза, поэтому биохимический анализ крови с включением этих показателей должен быть первым тестом при клиническом подозрении на это иоНЯ. Для последующего уточнения диагноза назначаются электромиография и биопсия мышц. Как и для других иоНЯ, ключевую роль в лечении этого осложнения играет преднизолон, назначаемый в высоких дозах, а при стероид-рефрактерности может быть рассмотрено применение плазмафереза, в/в иммуноглобулина и микофенолата мофетила [21]. Примечательно, что биопсия мышц может служить не только для подтверждения диагноза, но и для поиска потенциальных терапевтических мишеней, при неэффективности стандартной иммуносупрессивной терапии [24].
Иммуноопосредованная МГ проявляется схожими с миозитом жалобами, однако клиническая картина более часто включает бульбарную симптоматику и парез лицевых мышц [25]. Исследование антител к ацетилхолиновому рецептору и к мышечно-специфической тирозинкиназе (ан-ти-MuSK) используется в диагностике этого иоНЯ, однако положительный результат выявляется существенно реже, чем при классической миастении гравис [26]. При отрицательных антителах назначается электромиография. Оценка функции внешнего дыхания является обязательной в мониторинге пациента с миастенией для своевремен- ной диагностики вовлечения респираторной мускулатуры. Помимо преднизолона, в лечении МГ рекомендован ингибитор холинэстеразы пиридостигмин. При тяжелой МГ также используются плазмаферез, в/в применение иммуноглобулина [21].
Каждое из иоНЯ по отдельности, а в особенности их сочетание могут иметь фульминантное течение с быстрым прогрессированием симптомов. Вкупе с высокой летальностью это определяет критическую важность диагностики данного синдрома на ранних стадиях. Выявление любого из элементов триады в отдельности требует высокой настороженности относительно развития остальных ее элементов и низкого порога принятия решения о назначении дополнительных диагностических тестов. Терапия синдрома должна проводиться мультидисциплинарной командой с включением онколога, невролога, кардиолога и ревматолога.
ЭНЦЕФАЛИТ
Несмотря на относительно низкую частоту возникновения неврологических иммуноопосредованных нарушений, которая составляет от 4 до 6% при монотерапии анти-CTLA4 и анти-PD-1, и около 12% при комбинированной терапии, их развитие представляет собой угрожающее жизни состояние. Одним из наиболее серьезных типов неврологических иоНЯ является иммуноопосредованный энцефалит, который составляет примерно 13% от общего числа случаев [27–29]. Уровень смертности в данной группе остается высоким и варьирует от 5 до 32% по различным литературным данным [30,31]. В рамках ретроспективного анализа, охватывающего более 1800 пациентов, было установлено, что частота серьезных неврологических иоНЯ (степени 3–5) составила 2,2% среди пациентов, получавших ингибиторы CTLA-4, 1,0% среди тех, кто применял ингибиторы PD-1/PD-L1, и 2,8% среди пациентов на комбинированной терапии [32].
Клинические проявления энцефалита включают изменения психического статуса, а также могут проявляться головной болью, слабостью, лихорадкой и судорогами. Показано, что энцефалит чаще развивается у пациентов со злокачественными новообразованиями легких, в то время как другие неврологические иоНЯ чаще наблюдаются у пациентов с меланомой. Как правило, энцефалит возникает в течение 8 недель с момента начала терапии; однако имеются отдельные клинические случаи, свидетельствующие о развитии энцефалита на протяжении 6 месяцев от начала терапии и даже после ее завершения [33–35].
Важное значение в диагностике иммуноопосредован-ного энцефалита имеет люмбальная пункция, по результатам которой в спинно-мозговой жидкости могут быть выявлены признаки воспаления, повышенный уровень белка и лимфоцитарный плеоцитоз, что, в свою очередь, требует тщательного дифференциального диагноза с инфекционным энцефалитом [29,31]. К дополнительным, но информативным методам диагностики относятся магнитно-резонансная томография головного мозга с внутривенным контрастированием и электроэнцефалография. К сожалению, в ряде случаев результаты этих исследований могут находиться в пределах нормы, что значительно усложняет процесс диагностики и требует участия мульти-дисциплинарной команды [36].
Основные методы лечения включают использование высоких доз глюкокортикостероидов, что является базовым для любого тяжелого иоНЯ. Некоторые литературные источники подчеркивают значимость назначения ритук-симаба в ситуациях, устойчивых к стероидной терапии, когда лечение в течение 7–14 дней не привело к улучшению состояния [37].
ПЕРИФЕРИЧЕСКАЯНЕЙРОПАТИЯ ГИЙЕНА-БАРРЕ
Частота возникновения синдрома Гийена-Барре составляет примерно 0,1–0,3% и описана как при моноиммунотерапии, так и при комбинированной ИТ [34]. Уровень смертности остается на достаточно высоком уровне (11–27%), а патогенез данного состояния не является полностью изученным. Предполагается, что антигены Шванновских клеток обладают структурным сходством с опухолевыми неоантигенами, что описано в литературе, например, при лечении меланомы [38,39].
Клинические проявления включают прогрессирующую мышечную слабость, гипо- или арефлексию и парестезии. Классический синдром Гийена-Барре, как правило, связан с предшествующим инфекционным триггером, который вызывает иммуноопосредованную демиелинизацию периферических нервов. Тем не менее, синдром Гийена-Барре в контексте иоНЯ имеет ряд специфических клинических особенностей. Согласно данным опубликованного исследования, 79% случаев синдрома Гийена-Барре развиваются у мужчин [36]. Медиана времени до появления данного иоНЯ составила 8,2 недели после первого введения иммунотерапии, что значительно превышает время, необходимое для развития синдрома Гийена-Барре, возникающего на фоне инфекционного процесса. Анализ ликвора демонстрирует воспалительные изменения у 63,9% пациентов, с отмеченным повышением уровня белка и типичной альбуминно-цитологической диссоциацией. В связи с этим таким пациентам наряду с классической высокодозной терапией ГКС рекомендуется проведение плазмафереза. Согласно опубликованным данным, это приводит к разрешению симптомов у 70% пациентов [29].
ОФТАЛЬМОЛОГИЧЕСКИЕ НЕЖЕЛАТЕЛЬНЫЕ ЯВЛЕНИЯ
Офтальмологические иммуноопосредованные нежелательные явления возникают относительно редко и могут сочетаться с другими системными НЯ. Их общая частота
РЕДКИЕ ИММУНООПОСРЕДОВАННЫЕ НЕЖЕЛАТЕЛЬНЫЕ ЯВЛЕНИЯ: КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА, ПОДХОДЫ К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ
составляет примерно 1% — 2,8%, однако раннее выявление этих явлений имеет решающее значение для предотвращения значительного ухудшения зрения и потери качества жизни пациентов [40]. Показано, что офтальмологические иммуноопосредованные НЯ часто ассоциированы с развитием НЯ в других локализациях, таких как кожа (10,4%), эндокринная система (9,0%) и нервная система (8,5%) [41]. Чаще всего они регистрируются у пациентов, получающих лечение по поводу меланомы (более 60% случаев), рака легкого (20%) и рака почки [42].
К наиболее распространенным офтальмологическим им-муноопосредованным нежелательным явлениям относятся:
-
• сухость глаз, проявляющаяся жжением, зудом, покраснением и ощущением песка в глазах. В тяжелых случаях это может привести к перфорации роговицы [43];
-
• гипотония или макулярный отек, при котором пациенты отмечают размытость изображения;
-
• неврит зрительного нерва, вызывающий зрительные нарушения, такие как скотомы или выпадение полей зрения [44,45];
-
• серозная отслойка сетчатки [46];
-
• увеит, среди которого выделяют четыре формы [47]:
-
— передний увеит (передний циклит, ирит или иридоциклит), при котором воспаляются структуры передней камеры глаза. Он характеризуется светобоязнью, нечеткостью зрения и болью/дискомфортом. Типичные признаки воспаления передней камеры включают конъюнктивальную конгестию, отек роговицы, кератиновые преципитаты, наличие клеток и бликов, а также синехии радужки [48];
-
— промежуточный увеит, связанный с воспалением стекловидного тела, проявляющийся нечеткостью зрения и плавающими помутнениями;
-
— задний увеит (ретинит, нейроретинит, хориорети-нит или хориоидит), касающийся воспаления сетчатки, сосудов сетчатки и сосудистой оболочки глаза. Основные симптомы включают вспышки света, плавающие помутнения и потерю зрения;
-
— панувеит, возникающий при воспалении более чем в одном из вышеописанных отделов [49].
В опубликованном ретроспективном анализе было установлено, что частота иммуноопосредованного увеита составляет 0,45% среди всех пациентов, получавших анти-PD-1/PD-L1, анти-CTLA-4 или комбинацию анти-PD-1 + анти-CTLA-4, в то время каку пациентов с меланомой этот показатель достигает 1,2%, что почти в три раза выше [42]. Клинические факторы риска включают предшествующие эпизоды увеита или другие воспалительные заболевания глаза: у 38,9% пациентов с известным анамнезом переднего увеита наблюдались рецидивы заболевания после начала иммунотерапии [50]. Наличие травмы глаза или хирургического вмешательства также связано с повышенным риском развития иммуноопосредо-ванного увеита [51]. Риск возникновения увеита значительно увеличивается при комбинированной иммунотерапии. Например, среди пациентов раком легкого риск развития увеита был более чем в семь раз выше при использова- нии комбинации ипилимумаба и ниволумаба по сравнению с пациентами, получавшими моноиммунотерапию [52]. Наиболее вероятно, что основной вклад в развитие увеита вносит анти-CTLA-4. При монотерапии ипилиму-мабом увеит развивается в среднем в три раза быстрее, чем при использовании других иммунопрепаратов [50].
Иммуноопосредованный увеит обычно диагностируется клинически при исключении других причин, таких как инфекционные или аутоиммунные заболевания, а также с учетом временной связи с началом иммунотерапии. В качестве дополнительного инструмента для дифференциации диагноза могут быть использованы критерии Naranjo. Хотя на сегодняшний день они не валидированы и применяются преимущественно в научных исследованиях, они могут быть полезны для врачей-клиницистов при оценке вероятности развития иоНЯ [53,54]. Лабораторные исследования должны включать определение антинуклеарных антител (ANA), антинейтрофильных цитоплазматических антител (ANCA), антител к двуцепочечной ДНК (dsDNA) и ревматического фактора, а также антигенов HLA-B27, HLA-B51, сывороточного ангиотензин-превра-щающего фермента (ACE) для исключения истинных аутоиммунных заболеваний [55,56]. Всем пациентам с неинфекционными увеитами выполняется биомикроскопия глазного дна или офтальмоскопия в условиях медикаментозного мидриаза для выявления изменений на глазном дне, мониторинга и выбора оптимальной тактики лечения. Дополнительно рекомендуется оптическое исследование сетчатки с использованием компьютерного анализатора (оптическая когерентная томография) для количественной и качественной оценки макулярного отека, изменений сетчатки и хориоидеи, состояния зрительного нерва и мониторинга эффективности лечения [57].
При переднем увеите в качестве первой линии терапии рекомендуются топические ГКС [58,59]. Местные способы введения стероидов при иммуноопосредованном увеите не ограничиваются глазными каплями. К местной терапии относятся также субконъюнктивальные, перибуль-барные, ретробульбарные инъекции, интравитреальные имплантаты дексаметазона и инъекции триамцинолона в периокулярное пространство [60]. При развитии заднего увеита в первой линии лечения назначаются системные ГКС. При тяжелых формах увеита могут быть назначены другие иммуносупрессанты, используемые в стандартных клинических ситуациях, резистентных к стероидам. В терапии увеита также применяются азатиоприн, микофенолат мофетила, циклоспорин С и метотрексат. Исследования, непосредственно сравнивающие профили безопасности препаратов для иммуноопосредованного увеита, отсутствуют; однако опубликованные данные о ювенильном увеите при идиопатическом артрите указывают на то, что метотрексат является препаратом выбора благодаря своей эффективности при благоприятном профиле безопасности [61–63].
САХАРНЫЙ ДИАБЕТ
Сахарный диабет (СД) 1 типа, индуцированный иммунотерапией, встречается менее чем в 1% случаев. Как правило, такая форма сахарного диабета клинически проявляется в широком временном диапазоне: от нескольких недель до 12 месяцев после начала терапии. В литературе встречаются случаи, описывающие развитие жизнеугрожающих осложнений, таких как диабетический кетоацидоз [64,65]. Согласно недавнему систематическому анализу, подавляющее большинство (71%) случаев диабета 1 типа, вызванного иммунотерапией, возникает в результате монотерапии анти-PD-1 препаратами, тогда как в комбинированных режимах это нежелательное явление наблюдается лишь в 15% случаев [66].
Для своевременного выявления данного иоНЯ требуется контроль уровня глюкозы в плазме крови натощак перед каждым введением иммунотерапии, поскольку уровень глюкозы входит в стандартную панель биохимического анализа крови перед проведением терапии. В случае выявления гипергликемии у пациента необходимо дополнительно определить уровень С-пептида, антител к декарбоксилазе глутаминовой кислоты (GAD) и уровень антител к островковым клеткам. Ведение пациентов с диабетом, индуцированным иммунотерапией, включает необходимость модификации образа жизни и диеты, а также возможное назначение инсулина. При возникновении данного осложнения следует критически подходить к назначению глюкокортикостероидов, так как они обладают гипергликемическим эффектом.
ГЕМАТОЛОГИЧЕСКАЯ ТОКСИЧНОСТЬ
Несмотря на то, что гематологическая токсичность традиционно ассоциируется с лечением классическими цитостатиками, она может также возникать в результате иммунотерапии, что наблюдается в менее чем 5% случаев
-
[67,68]. В ряде случаев диагностика этих иоНЯ представляет значительную сложность, учитывая, что современные схемы лечения часто включают сочетание иммунотерапии с таргетными препаратами и классической химиотерапией. Гематологические иоНЯ, как правило, затрагивают один гемопоэтический росток, но проявляются в разнообразных формах, среди которых можно выделить иммунопосредованную нейтропению, приобретённую гемофилию А и тромботическую тромбоцитопеническую пурпуру [69–73]. Большинство цитопений, возникающих на фоне иммунотерапии, характеризуются тяжёлым течением (44–89% — G4). Гематологические иоНЯ могут проявляться в течение 6–8 недель с начала терапии, однако этот срок может варьироваться в зависимости от описанных клинических случаев [74,75]. Пациентам с подозрением на гематологические иоНЯ необходимо проведение анализа периферической крови с микроскопией мазка, прямого антиглобулинового теста, определения маркеров гемолиза, проведения вирусной серологии, а при необходимости — пункции или трепан-биопсии костного мозга.
К числу прочих редких иоНЯ относятся синдром синусоидальной обструкции (при котором поражаются мельчайшие печеночные венулы), иммунопосредованный холангит, тяжёлые формы эндокринопатий (например, гипопаратиреоз), неинфекционный цистит, синдром генерализованного отека и другие. Вероятно, это далеко не полный спектр нежелательных явлений, известных на сегодняшний день, и данный список будет лишь пополняться.
Иммунотерапия получает всё больше показаний и применяется как в неоадъювантных, так и в адъювантных режимах, что подразумевает, что в ближайшие несколько лет научное сообщество продолжит расширять свои знания о иммунопосредованных нежелательных явлениях и, в перспективе, научится точнее предсказывать их развитие и разработает эффективные методы управления этими особыми и, к сожалению, пока иногда фатальными осложнениями.
Список литературы Редкие иммуноопосредованные нежелательные явления: клиническая характеристика, подходы к диагностике и лечению
- Darnell E.P., Mooradian M.J., Baruch E.N. et.al. Immune-Related Adverse Events (irAEs): Diagnosis, Management, and Clinical Pearls. Curr Oncol Rep 2020;22(4):39-39. https://doi.org/10.1007/S11912-020-0897-9
- Francisco L.M., Salinas V.H., Brown K.E., et al. PD-L1 regulates the development, maintenance, and function of induced regulatory T cells. J Exp Med 2009;206(13):3015-29. https://doi.org/10.1084/JEM.20090847
- Amarnath S., Mangus C.W., Wang J.C.M., et al. The PDL1-PD1 Axis Converts Human Th1 Cells Into Regulatory T Cells. Sci Transl Med 2011;3(111):111ra120. https://doi.org/10.1126/SCITRANSLMED.3003130
- Vaddepally R., Doddamani R., Sodavarapu S., et al. Review of Immune-Related Adverse Events (irAEs) in Non-Small-Cell Lung Cancer (NSCLC)-Their Incidence, Management, Multiorgan irAEs, and Rechallenge. Biomedicines 2022;10(4):790. https://doi.org/10.3390/BIOMEDICINES10040790
- Abdel-Wahab N., Diab A., Yu R.K., et al. Genetic determinants of immune-related adverse events in patients with melanoma receiving immune checkpoint inhibitors. Cancer Immunol Immunother 2021;70(7):1939-49. https://doi.org/10.1007/S00262-020-02797-0
- Nishino M., Ramaiya N.H., Awad M.M., et al. PD-1 Inhibitor-Related Pneumonitis in Advanced Cancer Patients: Radiographic Patterns and Clinical Course. Clin Cancer Res 2016;22(24):6051-60. https://doi.org/10.1158/1078-0432.
- Delaunay M., Cadranel J., Lusque A., et al. Immune-checkpoint inhibitors associated with interstitial lung disease in cancer patients. Eur Respir J 2017;50(2):1700050. https://doi.org/10.1183/13993003.00050-2017
- Naidoo J., Wang X., Woo K.M., et al. Pneumonitis in Patients Treated With Anti-Programmed Death-1/Programmed Death Ligand 1 Therapy. J Clin Oncol 2017;35(7):709-717. https://doi.org/10.1200/JCO.2016.68.2005
- Weber J.S., Kähler K.C., Hauschild A. Management of immune-related adverse events and kinetics of response with ipilimumab. J Clin Oncol 2012;30(21):2691-7. https://doi.org/10.1200/JCO.2012.41.6750
- Gettinger S.N., Horn L., Gandhi L., et al. Overall Survival and Long-Term Safety of Nivolumab (Anti-Programmed Death 1 Antibody, BMS-936558, ONO-4538) in Patients With Previously Treated Advanced Non-Small-Cell Lung Cancer. J Clin Oncol 2015;33(18):2004-12. https://doi.org/10.1200/JCO.2014.58.3708
- Schoenfeld S.R., Aronow M.E., Leaf R.K., et al. Diagnosis and Management of Rare Immune-Related Adverse Events. Oncologist 2020;25(1):6-14. https://doi.org/10.1634/theoncologist.2019-0083
- Puzanov I., Diab A., Abdallah K., et al. Managing toxicities associated with immune checkpoint inhibitors: consensus recommendations from the Society for Immunotherapy of Cancer (SITC) Toxicity Management Working Group. J Immunother Cancer 2017;5(1):95. https://doi.org/10.1186/S40425-017-0300-Z
- Brahmer J.R., Lacchetti C., Schneider B.J., et al. Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: American Society of Clinical Oncology Clinical Practice Guideline. J Clin Oncol 2018;36(17):1714-68. https://doi.org/10.1200/JCO.2017.77.6385
- Kuusisalo S., Koivunen J.P., Iivanainen S. Association of Rare Immune-Related Adverse Events to Survival in Advanced Cancer Patients Treated with Immune Checkpoint Inhibitors: A Real-World Single-Center Cohort Study. Cancers (Basel) 2022;14(9):2276. https://doi.org/10.3390/cancers14092276
- Moslehi J.J., Salem J.E., Sosman J.A., et al. Increased reporting of fatal immune checkpoint inhibitor-associated myocarditis. Lancet 2018;391(10124):933. https://doi.org/10.1016/S0140-6736(18)30533-6
- Wang D.Y., Salem J.E., Cohen J.V., et al. Fatal Toxic Effects Associated With Immune Checkpoint Inhibitors: A Systematic Review and Meta-analysis. JAMA Oncol 2018;4(12):1721-8. https://doi.org/10.1001/jamaoncol.2018.3923
- Park B.C., Narayanan S., Gavraldis A., et al. Rare immune-related adverse events in patients with melanoma: incidence, spectrum, and clinical presentations. Oncoimmunology 2023;12(1):2188719. https://doi.org/10.1080/2162402X.2023.2188719
- Javaid A., Bennett C., Rao A., Spain L. Rare Immune-Related Adverse Events (irAEs): Approach to Diagnosis and Management. Pharmaceut Med 2024;38(1):25-38. https://doi.org/10.1007/S40290-023-00508-5
- Haanen J., Obeid M., Spain L., et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2022;33(12):1217-38. https://doi.org/10.1016/J.annonc.2022.10.001
- Palaskas N., Lopez-Mattei J., Durand J.B., et al. Immune Checkpoint Inhibitor Myocarditis: Pathophysiological Characteristics, Diagnosis, and Treatment. J Am Heart Assoc 2020;9(2):e013757. https://doi.org/10.1161/JAHA.119.013757
- Brahmer J.R., Lacchetti C., Schneider B.J., et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: American society of clinical oncology clinical practice guideline. J Clin Oncol 2018;36(17):1714-68. https://doi.org/10.1200/JCO.2017.77.6385
- Mahmood S.S., Fradley M.G., Cohen J.V., et al. Myocarditis in patients treated with immune checkpoint inhibitors. J Am Coll Cardiol 2018;71(16):A699. https://doi.org/10.1016/S0735-1097(18)31240-3
- Herrmann J., Lenihan D., Armenian S., et al. Defining cardiovascular toxicities of cancer therapies: an International Cardio-Oncology Society (IC-OS) consensus statement. Eur Heart J 2022;43(4):280-99. https://doi.org/10.1093/eurheartj/ehab674
- Nelke C., Pawlitzki M., Kerkhoff R., et al. Immune Checkpoint Inhibition-Related Myasthenia-Myositis-Myocarditis Responsive to Complement Blockade. Neurol Neuroimmunol Neuroinflamm 2023;11(1):e200177. https://doi.org/10.1212/NXI.0000000000200177
- Albarrán-Artahona V., Laguna J.C., Gorría T., et al. Immune-Related Uncommon Adverse Events in Patients with Cancer Treated with Immunotherapy. Diagnostics (Basel) 2022;12(9):2091. https://doi.org/10.3390/diagnostics12092091
- Huang Y.T., Chen Y.P., Lin W.C., et al. Immune Checkpoint Inhibitor-Induced Myasthenia Gravis. Front Neurol 2020;11:528324. https://doi.org/10.3389/fneur.2020.00634/bibtex
- Larkin J., Chmielowski B., Lao C.D., et al. Neurologic Serious Adverse Events Associated with Nivolumab Plus Ipilimumab or Nivolumab Alone in Advanced Melanoma, Including a Case Series of Encephalitis. Oncologist 2017;22(6):709-718. https://doi.org/10.1634/theoncologist.2016-0487
- Kao J.C., Brickshawana A., Liewluck T. Neuromuscular Complications of Programmed Cell Death-1 (PD-1) Inhibitors. Curr Neurol Neurosci Rep 2018;18(10):63. https://doi.org/10.1007/S11910-018-0878-7
- Marini A., Bernardini A., Gigli G.L., et al. Neurologic Adverse Events of Immune Checkpoint Inhibitors: A Systematic Review. Neurology 2021;96(16):754-66. https://doi.org/10.1212/WNL.0000000000011795
- Thouvenin L ., Olivier T., Banna G., et al. Immune checkpoint inhibitor-induced aseptic meningitis and encephalitis: a case-series and narrative review. Ther Adv Drug Saf 2021;12:20420986211004745. https://doi.org/10.1177/20420986211004745
- Müller-Jensen L., Zierold S., Versluis J.M., et al. Characteristics of immune checkpoint inhibitor-induced encephalitis and comparison with HSV-1 and anti-LGI1 encephalitis: A retrospective multicentre cohort study. Eur J Cancer 2022;175:224-235. https://doi.org/10.1016/J.EJCA.2022.08.009
- Dubey D., David W.S., Reynolds K.L., et al. Severe Neurological Toxicity of Immune Checkpoint Inhibitors: Growing Spectrum. Ann Neurol 2020;87(5):659-669. https://doi.org/10.1002/ANA.25708
- Velasco R., Villagrán M., Jové M., et al. Encephalitis Induced by Immune Checkpoint Inhibitors: A Systematic Review. JAMA Neurol 2021;78(7):864-873. https://doi.org/10.1001/jamaneurol.2021.0249
- Johnson D.B., Manouchehri A., Haugh A.M., et al. Neurologic toxicity associated with immune checkpoint inhibitors: a pharmacovigilance study. J Immunother Cancer 2019;7(1):134. https://doi.org/10.1186/S40425-019-0617-X
- Martins F., Sofiya L., Sykiotis G.P., et al. Adverse effects of immune-checkpoint inhibitors: epidemiology, management and surveillance. Nat Rev Clin Oncol 2019;16(9):563-580. https://doi.org/10.1038/S41571-019-0218-0
- Salam S., Lavin T., Turan A. Limbic encephalitis following immunotherapy against metastatic malignant melanoma. BMJ Case Rep 2016;2016:bcr2016215012. https://doi.org/10.1136/bcr-2016-215012
- Thompson J.A., Schneider B.J., Brahmer J., et al. Management of Immunotherapy-Related Toxicities, Version 1.2019. J Natl Compr Canc Netw 2019;17(3):255-289. https://doi.org/10.6004/jnccn.2019.0013
- Xu M., Nie Y., Yang Y., et al. Risk of Neurological Toxicities Following the Use of Different Immune Checkpoint Inhibitor Regimens in Solid Tumors: A Systematic Review and Meta-analysis. Neurologist 2019;24(3):75-83. https://doi.org/10.1097/NRL.0000000000000230
- Li Y., Zhang X., Zhao C. Guillain-Barré Syndrome-Like Polyneuropathy Associated with Immune Checkpoint Inhibitors: A Systematic Review of 33 Cases. Biomed Res Int 2021;2021:9800488. https://doi.org/10.1155/2021/9800488
- Abdel-Rahman O., Oweira H., Petrausch U., et al. Immune-related ocular toxicities in solid tumor patients treated with immune checkpoint inhibitors: a systematic review. Expert Rev Anticancer Ther 2017;17(4):387-394. https://doi.org/10.1080/14737140.2017.1296765
- Anquetil C., Salem J.E., Lebrun-Vignes B., et al. Evolving spectrum of drug-induced uveitis at the era of immune checkpoint inhibitors results from the WHO’s pharmacovigilance database. J Autoimmun 2020;111:102454. https://doi.org/10.1016/j.jaut.2020.102454
- Bomze D., Meirson T., Hasan Ali O., et al. Ocular Adverse Events Induced by Immune Checkpoint Inhibitors: A Comprehensive Pharmacovigilance Analysis. Ocul Immunol Inflamm 2022;30(1):191-197. https://doi.org/10.1080/09273948.2020.1773867
- Nguyen A.T., Elia M., Materin M.A., et al. Cyclosporine for Dry Eye Associated With Nivolumab: A Case Progressing to Corneal Perforation. Cornea 2016;35(3):399-401. https://doi.org/10.1097/ICO.0000000000000724
- Hahn L., Pepple K.L. Bilateral neuroretinitis and anterior uveitis following ipilimumab treatment for metastatic melanoma. J Ophthalmic Inflamm Infect 2016;6:14. https://doi.org/10.1186/S12348-016-0082-3
- Wilson M.A., Guld K., Galetta S., et al. Acute visual loss after ipilimumab treatment for metastatic melanoma. J Immunother Cancer 2016;4:66. https://doi.org/10.1186/S40425-016-0170-9
- Zhang H., Houadj L., Wu K.Y., Tran S.D. Diagnosing and Managing Uveitis Associated with Immune Checkpoint Inhibitors: A Review. Diagnostics (Basel) 2024;14(3):336. https://doi.org/10.3390/diagnostics14030336
- Bloch-Michel E., Nussenblatt R.B. International Uveitis Study Group recommendations for the evaluation of intraocular inflammatory disease. Am J Ophthalmol 1987;103(2):234-235. https://doi.org/10.1016/S0002-9394(14)74235-7
- Chang C.J., Chen S.J., Hwang D.K., Liu C. Bilateral anterior uveitis after immunotherapy for malignant melanoma. Taiwan J Ophthalmol 2018;8(3):173-175. https://doi.org/10.4103/tjo.tjo_88_17.
- Deschenes J., Murray P.I., Rao N.A., Nussenblatt R.B. International Uveitis Study Group (IUSG): clinical classification of uveitis. Ocul Immunol Inflamm 2008;16(1):1-2. https://doi.org/10.1080/09273940801899822
- Sun M.M., Kelly S.P., Mylavarapu BS A.L., et al. Ophthalmic Immune-Related Adverse Events after Anti-CTLA-4 or PD-1 Therapy Recorded in the American Academy of Ophthalmology Intelligent Research in Sight Registry. Ophthalmology 2021;128(6):910-919. https://doi.org/10.1016/J.ophtha.2020.11.001
- Braun D., Getahun D., Chiu V.Y., et al. Population-Based Frequency of Ophthalmic Adverse Events in Melanoma, Other Cancers, and After Immune Checkpoint Inhibitor Treatment. Am J Ophthalmol 2021;224:282-291. https://doi.org/10.1016/J.AJO.2020.12.013
- Zhou L., Wei X. Ocular Immune-Related Adverse Events Associated With Immune Checkpoint Inhibitors in Lung Cancer. Front Immunol 2021;12:701951. https://doi.org/10.3389/FIMMU.2021.701951
- Guex-Crosier Y. Do Naranjo Criteria Still Apply to Ipilimumab-induced Uveitis? Klin Monbl Augenheilkd 2016;233(4):356. https://doi.org/10.1055/S-0042-104249
- Naranjo C.A., Busto U., Sellers E.M., et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1981;30(2):239-245. https://doi.org/10.1038/CLPT.1981.154
- Boyd S.R., Young S., Lightman S. Immunopathology of the noninfectious posterior and intermediate uveitides. Surv Ophthalmol 2001;46(3):209-233. https://doi.org/10.1016/S0039-6257(01)00275-2
- Pasadhika S., Rosenbaum J.T. Ocular Sarcoidosis. Clin Chest Med 2015;36(4):669-683. https://doi.org/10.1016/J.CCM.2015.08.009
- Regatieri C.V., Alwassia A., Zhang J.Y., et al. Use of optical coherence tomography in the diagnosis and management of uveitis. Int Ophthalmol Clin 2012;52(4):33-43. https://doi.org/10.1097/IIO.0B013E318265D439
- Parikh R.A., Chaon B.C., Berkenstock M.K. Ocular Complications of Checkpoint Inhibitors and Immunotherapeutic Agents: A Case Series. Ocul Immunol Inflamm 2021;29(7-8):1585-1590. https://doi.org/10.1080/09273948.2020.1766082
- Mazharuddin A.A., Whyte A.T., Gombos D.S., et al. Highlights on Ocular Toxicity of Immune Checkpoint Inhibitors at a US Tertiary Cancer Center. J Immunother Precis Oncol 2022;5(4):98-104. https://doi.org/10.36401/JIPO-22-14
- Martens A., Schauwvlieghe P.P., Madoe A., et al. Ocular adverse events associated with immune checkpoint inhibitors, a scoping review. J Ophthalmic Inflamm Infect 2023;13(1):5. https://doi.org/10.1186/S12348-022-00321-2
- Dick A.D., Rosenbaum J.T., Al-Dhibi H.A., et al. Guidance on Noncorticosteroid Systemic Immunomodulatory Therapy in Noninfectious Uveitis: Fundamentals Of Care for UveitiS (FOCUS) Initiative. Ophthalmology 2018;125(5):757-773. https://doi.org/10.1016/j.ophtha.2017.11.017
- Karim R., Sykakis E., Lightman S., Fraser-Bell S. Interventions for the treatment of uveitic macular edema: a systematic review and meta-analysis. Clin Ophthalmol 2013;7:1109-1144. https://doi.org/10.2147/OPTH.S40268
- Heiligenhaus A., Minden K., Tappeiner C., et al. Update of the evidence based, interdisciplinary guideline for anti-inflammatory treatment of uveitis associated with juvenile idiopathic arthritis. Semin Arthritis Rheum 2019;49(1):43-55. https://doi.org/10.1016/j.semarthrit.2018.11.004
- De Filette J.M.K., Pen J.J., Decoster L., et al. Immune checkpoint inhibitors and type 1 diabetes mellitus: a case report and systematic review. Eur J Endocrinol 2019;181(3):363-374. https://doi.org/10.1530/EJE-19-0291
- Mellati M., Eaton K.D., Brooks-Worrell B.M., et al. Anti-PD-1 and Anti-PDL-1 Monoclonal Antibodies Causing Type 1 Diabetes. Diabetes Care 2015;38(9):e137-138. https://doi.org/10.2337/DC15-0889
- Godwin J.L., Jaggi S., Sirisena I., et al. Nivolumab-induced autoimmune diabetes mellitus presenting as diabetic ketoacidosis in a patient with metastatic lung cancer. J Immunother Cancer 2017;5:40. https://doi.org/10.1186/S40425-017-0245-2
- Delanoy N., Michot J.M., Comont T., et al. Haematological immune-related adverse events induced by anti-PD-1 or anti-PD-L1 immunotherapy: a descriptive observational study. Lancet Haematol 2019;6(1):e48-е57. https://doi.org/10.1016/S2352-3026(18)30175-3
- Michot J.M., Lazarovici J., Tieu A., et al. Haematological immune-related adverse events with immune checkpoint inhibitors, how to manage? Eur J Cancer 2019;122:72-90. https://doi.org/10.1016/J.EJCA.2019.07.014
- Mullally W.J., Cooke F.J., Crosbie I.M., et al. Case Report: Thrombotic-Thrombocytopenic Purpura Following Ipilimumab and Nivolumab Combination Immunotherapy for Metastatic Melanoma. Front Immunol 2022;13:871217. https://doi.org/10.3389/FIMMU.2022.871217
- Zaremba A., Kramer R., De Temple V., et al. Grade 4 Neutropenia Secondary to Immune Checkpoint Inhibition - A Descriptive Observational Retrospective Multicenter Analysis. Front Oncol 2021;11:765608. https://doi.org/10.3389/FONC.2021.765608
- Kramer R., Zaremba A., Moreira A., Ugurel S., et al. Hematological immune related adverse events after treatment with immune checkpoint inhibitors. Eur J Cancer 2021;147:170-181. https://doi.org/10.1016/J.EJCA.2021.01.013
- Delyon J., Mateus C., Lambert T. Hemophilia A induced by ipilimumab. N Engl J Med 2011;365(18):1747-1748. https://doi.org/10.1056/NEJMC1110923
- Noseda R., Bertoli R., Müller L., Ceschi A. Haemophagocytic lymphohistiocytosis in patients treated with immune checkpoint inhibitors: analysis of WHO global database of individual case safety reports. J Immunother Cancer 2019;7(1):117. https://doi.org/10.1186/S40425-019-0598-9
- Davis E.J., Salem J.-E., Young A., et al. Hematologic Complications of Immune Checkpoint Inhibitors. Oncologist 2019;24(5):584-588. https://doi.org/10.1634/theoncologist.2018-0574
- Martin M., Nguyen H.M., Beuvon C., et al. Immune Checkpoint Inhibitor-Related Cytopenias: About 68 Cases from the French Pharmacovigilance Database. Cancers (Basel) 2022;14(20):5030. https://doi.org/10.3390/cancers14205030.


