Редокс-зависимые процессы в неоплазме при прогрессировании рака шейки матки
Автор: Долгова Динара Ришатовна, Антонеева Инна Ивановна, Сидоренко Екатерина Геннадьевна, Генинг Татьяна Петровна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Фундаментальная биология и медицина
Статья в выпуске: 3, 2012 года.
Бесплатный доступ
Изучено изменение параметров системы «перекисное окисление липидов – антиоксиданты» и экспрессия bcl-2, Ki-67 в опухолевой ткани больных раком шейки матки на разных стадиях опухолевого процесса. Показано, что в неоплазме больных с распространенным опухолевым процессом наблюдается накопление ТБК-активных продуктов перекисного окисления липидов наряду с истощением ферментов 1 звена антиоксидантной защиты (СОД, каталазы), а также увеличение экспрессии bcl-2, Ki-67 в паренхиме и строме опухолевой ткани РШМ.
Рак шейки матки, оксидативный стресс
Короткий адрес: https://sciup.org/14112818
IDR: 14112818 | УДК: 616-066.6:618.11-006.6:612.014.462:612.11
Текст научной статьи Редокс-зависимые процессы в неоплазме при прогрессировании рака шейки матки
Введение. Рак шейки матки (РШМ), несмотря на наличие сформировавшихся классических подходов в профилактике, диагностике и лечении, продолжает оставаться важнейшей проблемой онкологии, занимая второе место среди злокачественных новообразований женских репродуктивных органов [2; 20]. На протяжении 20 лет в Российской Федерации в соответствии с общей тенденцией развитых индустриальных стран отмечено постепенное снижение заболеваемости РШМ (стандартизированный показатель – 10,8) [14], однако четко прослеживается рост заболеваемости РШМ среди молодых женщин в возрастной группе до 40 лет, особенно заметный среди женского населения моложе 29 лет [13].*
В Ульяновской области заболеваемость РШМ за период 2005–2009 гг. имеет выраженную тенденцию к увеличению. Прирост заболеваемости за последние 5 лет составил 6,1 тыс. на 100 тыс. населения, в России – 0,9 тыс. на 100 тыс. [1].
Биологическое поведение опухолей, в том числе РШМ, остается в достаточной степени непредсказуемым даже для больных с одинаковой стадией заболевания. До настоящего времени одной из проблем в диагностике дисплазии и РШМ является отсутствие достоверных критериев, позволяющих объективизировать полученные патоморфологиче-ские данные и использовать их в качестве прогностических факторов при оценке течения РШМ [8; 12].
По современным представлениям, состояние системы «перекисное окисление липидов – антиоксиданты» (ПОЛ-АО) в организме играет важную роль в развитии опухолевого процесса. Накапливающиеся в литературе данные о молекулярных механизмах действия различных свободнорадикальных молекул свидетельствуют об их участии в регуляции роста и дифференцировки клеток [17]. Это стимулирует интерес к изучению роли свободных радикалов в регуляции пролиферации опухолевых клеток в процессе развития неоплазмы [23]. Злокачественный рост, который является болезнью регуляции, в первую очередь регуляции размножения и дифференцировки, может сопровождаться изменениями или сбоями в работе системы ПОЛ-АО [4]. Автором кислородно-перекис-ной концепции канцерогенеза Б.Н. Лю высказано предположение о том, что результаты любых воздействий, интенсифицирующих свободнорадикальные процессы, должны проявиться прежде всего в клетках неоплазмы, поскольку именно они наиболее подготовлены к переходу в указанное состояние и, следовательно, объективно чувствительнее к подобным воздействиям [10; 11].
Постоянное образование прооксидантов в живых системах уравновешено той же скоростью их дезактивации антиоксидантами. Антиоксидантные ферменты (АОФ), контролируя концентрацию радикалов, могут выступать в качестве регуляторов пролиферации. Длительное локальное повышение антиоксидантной активности одновременно стимулирует свободнорадикальное окисление. Подобное физиологическое состояние клеток, сопряженное с нарушением нормальной регуляции свободнорадикальных реакций, называют «окислительным стрессом», являя-ющимся универсальным механизмом клеточных повреждений [9; 22].
Цель исследования. Оценка редокс-за-висимых процессов в неоплазме при прогрессировании рака шейки матки.
Материалы и методы. Материалом для данного исследования послужила опухолевая ткань от 60 больных РШМ и 20 больных с доброкачественными новообразованиями половых органов. Больные находились на обследовании и лечении в гинекологическом отделении Ульяновского областного клинического онкологического диспансера в 2009– 2011 гг. У всех больных диагноз был подтвержден гистологическим исследованием. Стадирование осуществляли по системе FIGO. В первую клиническую группу вошли пациентки с начальным опухолевым процес- сом (Ia), во вторую – с местноограниченным процессом (Ib-IIa), в третью – с распространенным процессом (IIb-IV). Гомогенат опухоли готовился на Tris-HCl-буфере (рН=7,4).
Интенсивность ПОЛ оценивали по уровню вторичного продукта – малонового диальдегида (МДА) в тесте с тиобарбитуровой кислотой [2]. Активность супероксид-дисму-тазы (СОД) определяли по М. Nishikimi в модификации Е.Е. Дубининой [5; 21], каталазы, глутатион-редуктазы – по А.И. Карпищенко [6]; глутатион-S-трансферазы – по W.H. Habig [16]. Активность ферментов и содержание МДА в гомогенатах опухолевой ткани пересчитывалась на мг белка, определенного по методу Брэдфорда [15].
Иммуногистохимическое исследование было выполнено с использованием моно- и поликлональных антител для выявления онкобелков Bcl-2, Ki67 (фирма Dako). Bcl-2 обнаруживался с помощью моноклональных антител к Bcl-2, клон Bcl-2/100/D 5, IgGi (NCL-bcl-2 Novocastra) в разведении 1:80 при инкубации 60 мин. Положительной считалась реакция при цитоплазматической и мембранной окраске более 10 % опухолевых клеток. Пролиферативная активность опухоли оценивалась как процент Ki-67-положительных клеток от общего числа опухолевых клеток. Bcl-2 обнаруживался с помощью моноклональных антител к bcl-2, клон Bcl-2/100/D 5, IgGi (NCL-bcl-2 Novocastra) в разведении 1:80 при инкубации 60 мин. Положительной считалась реакция при цитоплазматической и мембранной окраске более 10 % опухолевых клеток.
Для оценки достоверности различий данных в двух группах использовался непараметрический критерий Манна-Уитни (Stata 6.0).
Результаты и обсуждение. В опухолевой ткани у больных 1-й группы уровень МДА составил 3,39±0,199 мкмоль/мг белка, во 2-й группе – 3,47±0,224 мкмоль/мг белка, в 3-й – 3,26±0,179 мкмоль/мг белка, что значимо (p<0,05) отличалось от уровня МДА в ткани внешне неизмененной шейки матки (2,11±0,131 мкмоль/мг белка) (рис. 1).
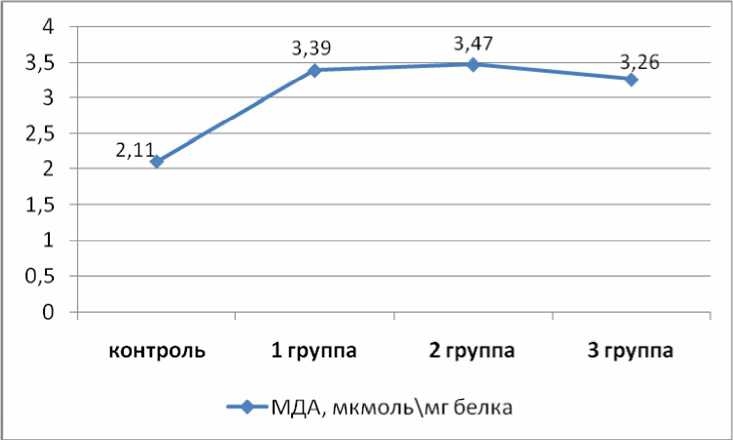
Рис. 1. Содержание МДА в опухолевой ткани при прогрессировании РШМ
Ключевым ферментом антиперекисной защиты клеток считают СОД, инактивирующую супероксид-анион-радикал и работающую в клетке в каскаде с ферментами, способными разлагать перекись водорода, – каталазой и пероксидазой. Активность СОД в опухолевой ткани, значимо повышенная (p<0,05) по отношению к группе сравнения у пациенток с начальным РШМ (3,21±0,246 усл. ед./мг белка против 0,71±0,169 усл. ед./мг белка), снижается на стадии Ib-IIa до 1,91±0,177 усл.ед./мг белка и продолжает снижаться на стадиях IIb-IV (1,52±0,567 усл. ед./мг белка). Сходная динамика активности имела место и для ка- талазы опухолевой ткани. Незначительно повышенная (p>0,05) на начальной стадии заболевания (0,13±0,005 ммоль/мг белка против 0,12±0,003 ммоль/мг белка в контроле) активность каталазы последовательно и значимо (р<0,05) снижалась на последующих стадиях заболевания (0,09±0,003 ммоль/мг белка и 0,07±0,003 ммоль/мг белка при местноограниченном и распространенном опухолевом процессах соответственно).
Установлено существенное и значимое (p<0,05) возрастание активности ферментов глутатионовой группы при прогрессировании РШМ (рис. 2).
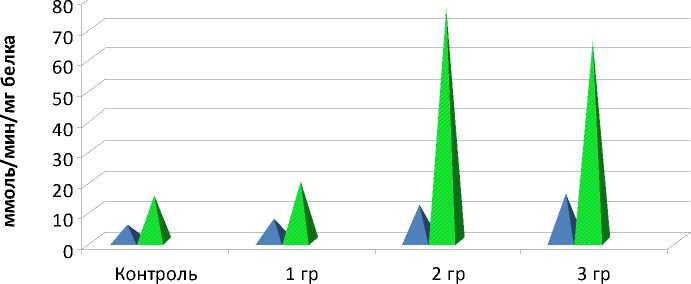
■ ГР ■ ГТ
Рис. 2. Активность глутатион-зависимых ферментов в опухолевой ткани больных на разных стадиях РШМ
Активность ГР при РШМ Ia стадии составила 7,23±0,389 ммоль/мин/мг белка, при Ib-IIa стадиях – 11,83±0,818 ммоль/мин/мг белка, при IIb-IV стадиях – 15,44±0,330 ммоль/мин/мг белка против 5,63±0,192 ммоль/мин/мг белка в контроле. Активность ГТ при Ia РШМ составила 19,41±1,985 ммоль/мин/мг белка; при Ib-IIa стадиях она достигает 76,09±4,894 ммоль/мин/мг белка против 15,24±0,286 ммоль/мин/мг белка в контроле, оставаясь достоверно высокой (р<0,05) и при IIb-IV стадиях (65,46±1,826 ммоль/мин/мг белка).
Таким образом, по мере прогрессирования опухолевого процесса при снижении активности СОД и каталазы имело место увеличение активности глутатион-зависимых ферментов. Существует мнение, что подобная динамика ферментативного звена антиоксидантной системы в злокачественных клет- ках указывает на ведущую роль ГТ и ГР в инактивации пероксидов [3; 19]. Кроме того, снижение активности СОД и каталазы может свидетельствовать о снижении генерации Н2О2, ингибирующей размножение клеток, в динамике прогрессии РШМ. Повышение содержания ГТ и ГР при одновременном снижении активности каталазы и СОД усиливает диспропорцию образования О2 и Н2О2.
Иммуногистохимический анализ показал, что во внешне неизмененной шейке матки Ki-67+ клетки в эпителии составили 7,6±3,2 %, в строме – 3,0±0,4 %. В 1-й группе пациенток Ki-67 экспрессировали 93,3±3,2 % клеток в эпителии и 66,7±1,7 % клеток в строме, у пациенток 2-й группы – в 91,6±4,8 % и 40,0±1,4 % соответственно. В 3-й группе больных экспрессия Ki-67 в клетках эпителия составила 88,9±4,5 %, в клетках стромы – 66,7±3,1 % (рис. 3).
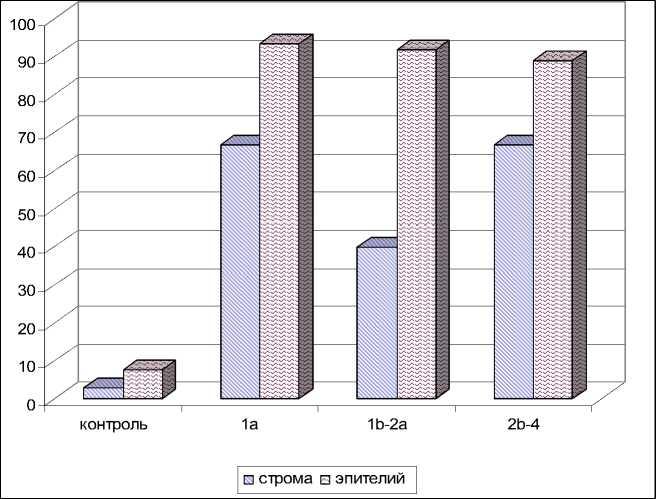
Рис. 3. Экспрессия Ki-67 в эпителии и строме шейки матки в динамике опухолевой прогрессии
Во внешне неизмененной шейке матки Bcl-2 экспрессировали 23,4±2,7 % в эпителии и 9,6±2,8 % клеток в строме. Наблюдаются значимое усиление экспрессии Bcl-2 в эпителии при местноограниченном процессе по сравнению с начальным РШМ (66,7±5,8 против 33,3±2,5 %) и внешне неизмененной шейкой матки и последующее снижение экс- прессии при распространенном процессе до 33,3±3,1 % (рис. 4). Динамика экспрессии Bcl-2 в строме аналогичная. При начальном РШМ Bcl-2+ клетки составили 7,4±2,1 %, при местно-ограниченном процессе – 12,6±4,2 %, при распространенном опухолевом процессе – 8,0±2,6 %.
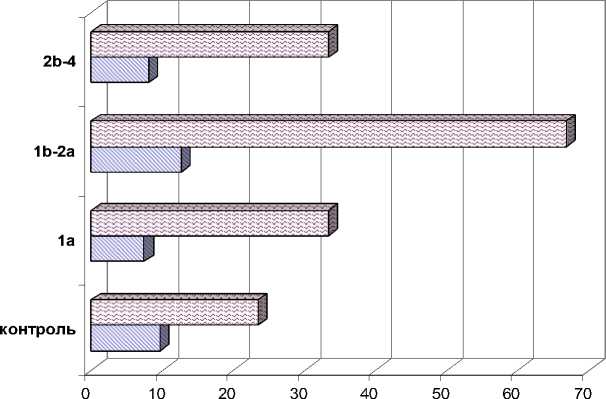
□ строма 0 эпителий
Рис. 4. Экспрессия Bcl-2 в эпителии и строме шейки матки в динамике опухолевой прогрессии
Таким образом, прогрессирование РШМ сопровождается повышением пролиферативной активности раковых клеток, наиболее выраженной при местно-ограниченном процессе. Также отмечено увеличение уровня Bcl-2, что говорит об усилении антиапопто-тического фактора, что объясняет высокий злокачественный потенциал этих новообразований.
Заключение. Опухолевая трансформация сопровождается изменениями внутриклеточного метаболизма, в том числе образования и утилизации АФК. Нами показаны повышение активности СОД и каталазы в опухолевой ткани на стадии Iа и снижение их антиоксидантной активности при прогрессировании РШМ (Ib-IV стадиях). При этом наблюдается усиление активности ферментов глутатионовой системы – ГТ, ГР – и повышение уровня МДА. Снижение активности СОД – фермента, катализирующего в митохондриях реакцию дисмутации О 2 с образованием Н 2 О 2 , а также повышение активности глутатион-зависимых ферментов, ГТ и ГР, участвующих в разложении перекисей, может свидетельствовать о том, что количество супероксидного анион-радикала, усиливающего пролиферацию, возрастает, а количество Н 2 О 2 , ингибирующей клеточную пролиферацию, значительно снижено.
Данные литературы свидетельствуют о том, что пролиферативный индекс служит независимым прогностическим показателем 5-летней общей и безрецидивной выживаемости пациенток РШМ [18; 19]. Нами установлено, что количество клеток Ki-67+ на всех клинических стадиях РШМ в эпителии значимо выше (р<0,05) по сравнению с внешне неизмененной шейкой матки и достоверно не изменяется при прогрессировании опухоли. Количество клеток, экспрессирующих Ki-67 в строме опухоли, также достоверно выше на всех клинических стадиях заболевания по сравнению с внешне неизмененной шейкой матки.
Более чем в 2 раза повышен уровень экспрессии bcl-2 при местно-ограниченном процессе по сравнению с начальным и распространенным процессом. По мере нарастания неопластических изменений экспрессия bcl-2 уменьшается; таким образом, не выявлено прямой связи высокой пролиферативной активности эпителиальных клеток со сверхэкспрессией bcl-2.
Полученные результаты позволяют предположить, что при прогрессировании РШМ на фоне оксидативного стресса возникают популяции клеток со сниженным содержанием Н 2 О 2 и высокой пролиферативной активностью.
-
1. Андреева, Л.И. Модификация метода определения перекисей липидов в тесте с тиобарби-туровой кислотой / Л.И. Андреева, Л.А. Кожемякин, А.А. Кишкун // Лабораторное дело. – 1988. – №11. – С. 41–43.
-
2. Антонеева, И.И. Анализ заболеваемости раком шейки матки в Ульяновской области / И.И. Антонеева, Е.Г. Сидоренко, Т.П. Генинг // Креативная хирургия и онкология. – 2011. – №2. – С. 33–35.
-
3. Горожанская, Э.Г. Роль глутатион-зави-симых пероксидаз в регуляции утилизации липо-пероксидов в злокачественных опухолях / Э.Г. Го-рожанская, В.Б. Ларионова, Г.Н. Зубрихина // Биохимия. – 2001 – Т. 66, вып. 2. – С. 273–278.
-
4. Горожанская, Э.Г. Содержание глутатиона и активность глутатиона-S-трансферазы как фактор прогноза эффективности лекарственной терапии больных раком яичников / Э.Г. Горожан-ская, В.Б. Ларионова, Г.Н. Зубрихина // Российский онкологический журн. – 2002. – №5. – С. 29–32.
-
5. Дубинина, Е.Е. Биологическая роль супероксидного анион-радикала и супероксиддис-мутазы в тканях организма / Е.Е. Дубинина // Успехи современной биологии. – 1989. – Т. 108, вып. 1 (4). – С. 3–18.
-
6. Карпищенко, А.И. Медицинские лабораторные технологии и диагностика : справ. : в 2 т. / А.И. Карпищенко. – СПб. : Интермедика, 1999. – 564 с.
-
7. Кезик, В. Скрининг рака шейки матки / В. Кезик // Практическая онкология. – 2009. – Т. 30, №2. – С. 59–61.
-
8. Козаченко, А.В. Новые направления в диагностике и лечении микрокарциномы шейки матки / А.В. Козаченко // Акушерство и гинекология. – 2006. – Прил. 2. – С. 56–59.
-
9. Крыжановский, Г.Н. Введение в общую патофизиологию / Г.Н. Крыжановский. – М. : РГМУ, 2000. – 71 с.
-
10. Лю, Б.Н. Физико-химические и биокибернетические аспекты онкогенеза / Б.Н. Лю, Е.М. Шайхутдинов. – Алма-Ата : Гылым, 1991. – 270 с.
-
11. Лю, Б.Н. Старение, возрастные патологии и канцерогенез (кислородно-перекисная концепция) / Б.Н. Лю. – Алматы : КазНТУ, 2003. – 706 с.
-
12. Пожарисский, К.М. Значение иммуногистохимических методик для определения характера лечения и прогноза опухолевых заболеваний / К.М. Пожарисский, Е.А. Самсонова, В.П. Тен // Архив патологии. – 2005. – №2. – С. 13–17.
-
13. Ременник, Л.В. Злокачественные новообразования женских половых органов в России / Л.В. Ременник, Е.Г. Новикова, В.Д. Мокина // Российский онкологический журн. – 1997. – №6. – С. 4–8.
-
14. Чиссов, В.И. Злокачественные новообразования в России накануне XXI века как медицинская и социальная проблема / В.И. Чиссов, В.В. Старинский, Л.В. Ременник // Российский онкологический журн. – 1998. – №3. – С. 8–20.
-
15. Bradford, M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. – 1976. – Vol. 72. – Р. 248–254.
-
16. Habig, W.H. Glutathione-S-transferase: а novel kinetic mechanism in which the major reaction pathway depends on substrate concentration / W.H. Habig, M.J. Pabst, W.B. Jakoby // J. Biol. Chem. – 1974. – Vol. 249 (22). – Р. 7140–7147.
-
17. Harris, S.R. Oxidative stress contributes to the antiproliferative effects of flavone acetic acid on endothelial cells / S.R. Harris, N.J. Panaro, U.P. Thorgeirsson // Anticancer. Res. – 2000. – Vol. 20, №4. – P. 2249–2254.
-
18. Keating, J.T. Ki-67, ciclin E and pl6INK4 are complementary surrogate biomarkers for human pappilomavirus-related cervical neoplasia / J.T. Keating, A. Cvico, S. Riethdorf // Am. J. Surg. Pathol. – 2001. – Vol. 25. – P. 421–426.
-
19. Liu, S.S. Anti-apoptotic proteins, apoptotic significance in cervical carcinoma / S.S. Liu, B.K. Tsang, A.N. Cheungetal // Europ. J. Cancer. – 2001. – Vol. 37. – P. 1104–1110.
-
20. Molecular detection of human papillomavirus in women with minorgrade cervical cytology abnormalities / A. Vince et al. // J. Clin. Virol. – 2001. – Vol. 20, №1–2. – P. 11–16.
-
21. Nishikimi, M. The occurrence of superoxide anion in the reaction of reduced phenacine-methosulfate and molecular oxygen / M. Nishikimi, N. Appa, K. Yagi // Biochem. Biophys. Res. Com-mun. – 1972. – Vol. 46. – P. 849–854.
-
22. Superoxide radical production stimulates retroocular fibroblast proliferation in Graves oph-talmopathy / H.B. Burch et al. // Int. J. Biochem. – 1998. – Vol. 20. – P. 569–580.
-
23. Suzuki, Y. Rapid and specific reactive oxygen species generation via NADPH-oxidase activation during FAS-mediated apoptosis / Y. Suzuki, Y. Ono, Y. Hirabayashi // FEBS Lett. – 1998. – Vol. 425, №2. – P. 209–212.
REDOX-DEPENDENT PROCESSES OF NEOPLASM IN THE CERVICAL CANCER PROGRESSION
D.R. Dolgova1, I.I. Antoneeva1, 2, E.G. Sidorenko1, 2, T.P. Gening1
1Ulyanovsk State University, 2Ulyanovsk Regional Clinical Cancer Center
Список литературы Редокс-зависимые процессы в неоплазме при прогрессировании рака шейки матки
- Андреева, Л.И. Модификация метода определения перекисей липидов в тесте с тиобарбитуровой кислотой/Л.И. Андреева, Л.А. Кожемякин, А.А. Кишкун//Лабораторное дело. -1988. -№11. -С. 41-43.
- Антонеева, И.И. Анализ заболеваемости раком шейки матки в Ульяновской области/И.И. Антонеева, Е.Г. Сидоренко, Т.П. Генинг//Креативная хирургия и онкология. -2011. -№2. -С. 33-35.
- Горожанская, Э.Г. Роль глутатион-зави-симых пероксидаз в регуляции утилизации липопероксидов в злокачественных опухолях/Э.Г. Го-рожанская, В.Б. Ларионова, Г.Н. Зубрихина//Био-химия. -2001 -Т. 66, вып. 2. -С. 273-278.
- Горожанская, Э.Г. Содержание глутати-она и активность глутатиона-S-трансферазы как фактор прогноза эффективности лекарственной терапии больных раком яичников/Э.Г. Горожанская, В.Б. Ларионова, Г.Н. Зубрихина//Российский онкологический журн. -2002. -№5. -С. 29-32.
- Дубинина, Е.Е. Биологическая роль супероксидного анион-радикала и супероксиддисмутазы в тканях организма/Е.Е. Дубинина//Успехи современной биологии. -1989. -Т. 108, вып. 1 (4). -С. 3-18.
- Карпищенко, А.И. Медицинские лабораторные технологии и диагностика: справ.: в 2 т./А.И. Карпищенко. -СПб.: Интермедика, 1999. -564 с.
- Кезик, В. Скрининг рака шейки матки/В. Кезик//Практическая онкология. -2009. -Т. 30, №2. -С. 59-61.
- Козаченко, А.В. Новые направления в диагностике и лечении микрокарциномы шейки матки/А.В. Козаченко//Акушерство и гинекология. -2006. -Прил. 2. -С. 56-59.
- Крыжановский, Г.Н. Введение в общую патофизиологию/Г.Н. Крыжановский. -М.: РГМУ, 2000. -71 с.
- Лю, Б.Н. Физико-химические и биокибер-нетические аспекты онкогенеза/Б.Н. Лю, Е.М. Шай-хутдинов. -Алма-Ата: Гылым, 1991. -270 с.
- Лю, Б.Н. Старение, возрастные патологии и канцерогенез (кислородно-перекисная концепция)/Б.Н. Лю. -Алматы: КазНТУ, 2003. -706 с.
- Пожарисский, К.М. Значение иммуногистохимических методик для определения характера лечения и прогноза опухолевых заболеваний/К.М. Пожарисский, Е.А. Самсонова, В.П. Тен//Архив патологии. -2005. -№2. -С. 13-17.
- Ременник, Л.В. Злокачественные новообразования женских половых органов в России/Л.В. Ременник, Е.Г. Новикова, В.Д. Мокина//Российский онкологический журн. -1997. -№6. -С. 4-8.
- Чиссов, В.И. Злокачественные новообразования в России накануне XXI века как медицинская и социальная проблема/В.И. Чиссов, В.В. Старинский, Л.В. Ременник//Российский онкологический журн. -1998. -№3. -С. 8-20.
- Bradford, M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding//Anal. Biochem. -1976. -Vol. 72. -Р. 248-254.
- Habig, W.H. Glutathione-S-transferase: а novel kinetic mechanism in which the major reaction pathway depends on substrate concentration/W.H. Habig, M.J. Pabst, W.B. Jakoby//J. Biol. Chem. -1974. -Vol. 249 (22). -Р. 7140-7147.
- Harris, S.R. Oxidative stress contributes to the antiproliferative effects of flavone acetic acid on endothelial cells/S.R. Harris, N.J. Panaro, U.P. Thorgeirsson//Anticancer. Res. -2000. -Vol. 20, №4. -P. 2249-2254.
- Keating, J.T. Ki-67, ciclin E and pl6INK4 are complementary surrogate biomarkers for human pappilomavirus-related cervical neoplasia/J.T. Kea-ting, A. Cvico, S. Riethdorf//Am. J. Surg. Pathol. -2001. -Vol. 25. -P. 421-426.
- Liu, S.S. Anti-apoptotic proteins, apoptotic significance in cervical carcinoma/S.S. Liu, B.K. Tsang, A.N. Cheungetal//Europ. J. Cancer. -2001. -Vol. 37. -P. 1104-1110.
- Molecular detection of human papilloma-virus in women with minorgrade cervical cytology abnormalities/A. Vince et al.//J. Clin. Virol. -2001. -Vol. 20, №1-2. -P. 11-16.
- Nishikimi, M. The occurrence of superoxide anion in the reaction of reduced phenacine-methosulfate and molecular oxygen/M. Nishikimi, N. Appa, K. Yagi//Biochem. Biophys. Res. Com-mun. -1972. -Vol. 46. -P. 849-854.
- Superoxide radical production stimulates retroocular fibroblast proliferation in Graves oph-talmopathy/H.B. Burch et al.//Int. J. Biochem. -1998. -Vol. 20. -P. 569-580.
- Suzuki, Y. Rapid and specific reactive oxygen species generation via NADPH-oxidase activation during FAS-mediated apoptosis/Y. Su-zuki, Y. Ono, Y. Hirabayashi//FEBS Lett. -1998. -Vol. 425, №2. -P. 209-212.


