Редокс-зависимые процессы в опухолевой ткани рака шейки матки при воздействии фемтосекундного лазерного излучения
Автор: Генинг Татьяна Петровна, Воронова Ольга Сергеевна, Долгова Динара Ришатовна, Абакумова Татьяна Владимировна, Аляпышев Григорий Сергеевич
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 4-4 т.14, 2012 года.
Бесплатный доступ
Изучены показатели перекисного окисления липидов и ферментативного звена антиоксидантной системы, а также морфометрические показатели опухолевой ткани после воздействия различных доз фемтосекундного лазерного излучения на различных стадиях экспериментального рака шейки матки. Установлено, что данное излучение дозозависимо увеличивает в опухолевой ткани объем участков некроза и на 30-ые сутки после трансплантации стимулирует в неоплазме возникновение оксидативного стресса.
Перекисное окисление липидов, антиоксиданты, рак шейки матки, фемтосекундное лазерное излучение
Короткий адрес: https://sciup.org/148201340
IDR: 148201340 | УДК: 616-006.699-57.084.1:577.29
Текст научной статьи Редокс-зависимые процессы в опухолевой ткани рака шейки матки при воздействии фемтосекундного лазерного излучения
Аляпышев Григорий Сергеевич, студент.
ствие данных об изменении биологического портрета опухолей различной тканевой организации при воздействии ЛИ с различными параметрами. Основными преимуществами фемтосекундных (ФС) лазеров является малая длительность импульса, высокая пиковая (кВт) и малая средняя (мВт) мощности, что позволяет предполагать отсутствие выраженных термических эффектов. В медицине сегодня эти лазеры используются в качестве голографического пинцета и оптического скальпеля. Использование фемтосекундного лазерного излучения (ФСЛИ) в терапии поверхностно локализованных опухолей позволило бы существенно снизить лучевую нагрузку на пациента.
В соответствии свышеизложенным, целью исследования было изучение влияния ФСЛИ на показатели оксидативного стресса в опухолевой ткани при экспериментальном раке шейки матки (РШМ).
Материалы и методы исследования. Модель РШМ была воспроизведена на белых инбредных мышах массой не менее 20 г путем перевивки опухолевого штамма РШМ-5 (НИИ Экспериментальной диагностики и терапии опухолей РОНЦ им. Н.Н. Блохина РАМН, г. Москва).
Использовали фемтосекундный волоконный эрбиевый лазер, который является совместной разработкой Научного центра волоконной оптики Российской Академии наук и Ульяновского государственного университета, со следующими характеристиками: длительность импульса 100*10-15с, пиковая мощность 6 кВт, средняя мощность 1,26 мВт ±2%, X =1,55 мкм. При облучении ФС лазером средняя плотность энергии на ткань (энергетическая доза) за одну процедуру составляла 0,24 Дж/см2 за 10 минут и 0,36 Дж/см2 за 15 минут, но при этом облучение проходило в импульсном ре- жиме при огромной пиковой интенсивности, равной 1910,8 Вт/см2. При 10-ти процедурах 10-ти минутного лазерного облучения суммарная энергетическая доза ЛИ за курс составила 2,4 Дж/см2. При 10-кратном облучении в режиме 15-ти минут на расстоянии 10 см суммарная плотность энергии на ткань составила 3,6 Дж/см2.
Биохимические методы исследования. Интенсивность перекисного окисления липидов (ПОЛ) оценивали по уровню вторичного продукта – малонового диальдегида (МДА) в тесте с тиобарбитуровой кислотой [3]. Активность су-пероксид-дисмутазы (СОД) определяли по методу Nishikimi M. в модификации Дубининой Е.Е. [4, 5], каталазы и глутатион-редуктазы (ГР) по Карпищенко А.И. [6], глутатион-S-трансфе-разы (ГТ) по Habig W.H.[7]. Активность антиоксидантных ферментов и уровень МДА пересчитывались на 1 мг белка, который определяли по методу Брэдфорда [8].
Морфологические методы исследования. Опухолевый материал фиксировали в 10% нейтральном формалине, обезвоживали в спиртах, заключали в парафин. Из парафиновых блоков изготавливали срезы толщиной 5-7 мкм, которые окрашивали гематоксилин-эозиноном. Для морфометрического исследования применялась компьютерная видео-тест-система с программой денситофотометрии «Mecos C1». При анализе гистологических срезов производился расчет удельного объема опухолевой паренхимы, удельного объема опухолевой стромы, удельного объема участков некроза, митотического и апоптоти-ческого индексов. Апоптотические клетки определяли по уровню маргинации хроматина, неровным контурам ядра, наличию кариопикно-за и кариорексиса, а также по некоторым изменениям в цитоплазме (изменение окрашивания цитоплазмы, вакуолизация цитоплазмы, изменение контуров и фрагментация клеток) [9].
Статистическая значимость полученных результатов оценивалась с помощью непараметрического критерия Манна-Уитни и корреляционного критерия значимости (Т) по Стьюденту. Различия между группами считали достоверными при р<0,05.
Результаты исследования. Опухолевая трансформация сопровождается изменением внутриклеточного метаболизма, в частности, изменением образования и утилизации различных форм активного кислорода.
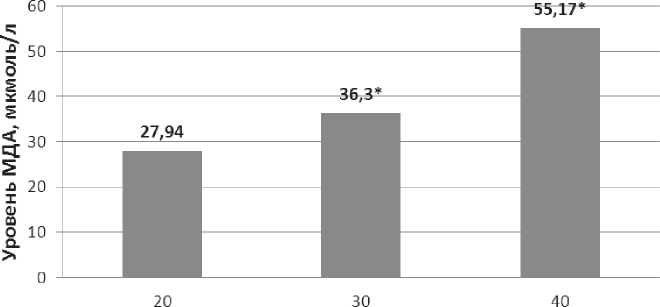
Наши исследования показали достоверное увеличение показателей уровня МДА с ростом опухоли (27,94±1,60; 36,3±1,22; 58,55±6,51 мкмоль/мг белка на 20-ые, 30-ые, 40-ые сутки после трансплантации, соответственно) (рис. 1), что не противоречит данным литературы об усилении ПОЛ при прогрессировании неоплазмы, хотя существует мнение, согласно которому активность процессов ПОЛ в опухолевых клетках может быть снижена [10].
Активность антиоксидантных ферментов (АОФ) в неоплазме в процессе развития РШМ-5 (табл. 1) зависела от стадии развития опухоли.
Как следует из представленных данных, при прогрессировании РШМ-5 в неоплазме достоверно возрастает активность СОД и ГТ (табл. 1). Уровень каталазы, напротив, снижается с увеличением сроков роста опухоли, количество ГР значимо не изменяется . Таким образом, в динамике прогрессирования РШМ-5 имеет место возрастание уровня МДА в неоплазме при разнонаправленном изменении активности ферментов антиоксидантной защиты (АОЗ), что позволяет предполагать возникновение в опухолевой ткани оксидативного стресса.
Установлено, что молекулы кислорода, находящегося в межлипидном пространстве мембран клеток, являются основным акцептором ЛИ. Возникающие при этом гидроперекиси липидов в при-
Сутки после перевивки
Рис. 1. Уровень МДА в неоплазме мышей на разных сроках после трансплантации РШМ-5
Примечание: * - данные, статистически значимо отличающиеся от данных контроля, р < 0,05
Таблица 1. Показатели ферментов АОЗ в неоплазме мышей в динамике прогрессирования РШМ-5
|
Антиоксидант, ед. изм. Сроки после перевивки опухоли |
СОД, у.е./мг белка (n=18) |
Каталаза, ммоль/с/мг белка (n=18) |
ГР, ммоль/мин/м г белка (n=18) |
ГТ, ммоль/мин/м г белка (n=18) |
|
20 сутки |
9,23±0,93 |
0,747±0,345 |
0,235±0,008 |
0,465±0,076 |
|
30 сутки |
26,57±6,00* |
0,537±0,100* |
0,212±0,016 |
1,502±0,292* |
|
40 сутки |
27,10±4,70* |
0,592±0,160* |
0,218±0,018 |
1,603±0,152* |
Примечание: * – данные, достоверно отличающиеся от данных на 20-ые сутки после трансплантации опухоли, р < 0,05
сутствии восстановленных форм железа инициируют цепную реакцию окисления полиненасы-щенных жирных кислот клеточных мембран и плазмы крови. Синглетный кислород, образующийся в результате фотохимических реакций, в частности, может повреждать цитоплазматические мембраны, что сопровождается соответствующими физиологическими реакциями на уровне целостного организма . Корси Л.В. с соавт. (2009) показали, что облучение клеток опухоли на длине волны 1268 нм приводит к образованию синглетного кислорода и индуцируемых им реакций окисления, так как ближний инфракрасный диапазон является спектром поглощения кислорода [11].
Изменение уровня МДА в неоплазме под влиянием ФСЛИ представлено в табл. 2
Воздействие ФСЛИ в дозах 2,4 Дж/см2и 3,6 Дж/см2 статистически значимо увеличивает количество МДА в неоплазме на 20-ые и снижает на 30-ые сутки после трансплантации опухоли.
Результаты изучения активности ферментов АОЗ в неоплазме после ФСЛИ представлены в табл. 3.
ФСЛИ на 20-ые сутки после трансплантации РШМ-5 не влияет на активность ГР и каталазы, одновременно увеличивая активность СОД. Уровень ГТ изменяется волнообразно в зависимости от дозы облучения (табл. 3). На 30ые сутки после перевивки опухоли активность ГР и СОД снижается при возрастании активности каталазы (табл. 3).
Морфологическая характеристика опухолевой ткани при прогрессировании РШМ-5
При оценке морфометрических показателей опухолевой ткани в динамике прогрессирования РШМ-5 установлено, что имеет место достоверное снижение удельного объема опухолевой паренхимы с 76,81±2,01% на 20-ые сутки, до 65,34±2,78% на 30-ые и 43,09±7,58% на 40-ые сутки после трансплантации опухоли. Одновременно снижается и удельный объем опухолевой стромы с 1,207±0,158% на 20-ые сутки после перевивки до 0,200±0,036% на 30-ые и 0,070±0,025% на 40-ые сутки. Уменьшение площади паренхимы, вероятно, обусловлено увеличением зон некроза (21,99±2,05%; 34,64±2,76%; 53,35±11,06% на 20-ые, 30-ые и 40-ые сутки, соответственно). С ростом опухоли возрастает число и размеры участков некроза, выявляемых как в центральных, так и в периферических отделах опухолевой ткани. Апоптотический и митотический индексы достоверно не изменяются в динамике прогрессирования опухоли. При этом апоптотический индекс составляет на 30-ые сутки 67,00±4,25‰, на 40-ые сутки 82,25±9,74‰ относительно 20-х суток (87,00±3,76‰). Митотический индекс значимо не изменяется на всех сутках после трансплантации опухоли (87,00±3,76; 67,00±4,25; 82,25±9,74% на 20-ые, 30-ые, 40-ые сутки после трансплантации опухоли, соответственно).
Таблица 2. Уровень МДА (мкмоль/мг белка) в неоплазме РШМ-5 при воздействии разных доз ФСЛИ
|
Доза ФСЛИ Эксперимент. группа |
Без облучения n=18 |
Э сред .=2,4 Дж/см2 n=18 |
Э сред .=3,6 Дж/см2 n=18 |
|
20 сутки РШМ -5 |
27,94±1,600 |
32,17±1,150* |
33,92±2,780* |
|
30 сутки РШМ -5 |
36,30±1,220 |
32,44±0,960* |
33,81±1,490 |
Примечание: * - данные статистически значимо отличающиеся от данных без облучения, p<0,05
Таблица 3. Активность ферментов АОЗ в опухолевой ткани РШМ-5 в разные сроки после трансплантации опухоли при воздействии ФСЛИ
|
Группы Показатели |
20-е сутки роста РШМ |
30-е сутки роста РШМ |
||||
|
Без облучения n= 20 |
Э =2 4 сред. , Дж/см2 n= 12 |
Э сред .=3,6 Дж/см2 n= 12 |
Без облучения n= 20 |
Э =2 4 ср ед. , Дж/см2 n= 12 |
Э сред .=3,6 Дж/см2 n= 12 |
|
|
ГР,ммоль/ми н/мг |
0,24±0,008 |
0,240±0,009 |
0,250±0,006 |
0,210±0,016 |
0,170±0,004* |
0,140±0,005* |
|
ГТ,ммоль/ми н/мг |
0,470±0,076 |
0,750±0,070* |
0,560±0,077 |
1,50±0,292 |
1,74±0,120 |
0,64±0,065* |
|
СОД, у.е./мг |
9,23±0,93 |
12,92±1,92* |
17,10±1,40* |
26,57±2,00 |
8,15±0,20* |
14,86±3,41* |
|
Каталаза, ммоль/с/мг |
0,750±0,345 |
0,530±0,110 |
1,050±0,169 |
0,540±0,100 |
0,450±0,073 |
0,810±0,019* |
Примечание: * - данные статистически значимо отличающиеся от данных без облучения, p<0,05
Воздействие ФСЛИ в обеих использованных дозах на разные сутки после трансплантации опухоли вызывает достоверные изменения в морфометрических показателях опухолевой ткани (табл. 4).
На 20-е сутки после трансплантации опухоли ФСЛИ приводит к уменьшению удельного объема опухолевой паренхимы (рис.2), стромы, митотического и апоптотического индексов (‰). Однако, при облучении мышей ФС лазером вдвое возрастает удельный объем участков некроза, что позволяет предполагать о том, что ФСЛИ является активатором некротических процессов в опухолевой ткани экспериментального РШМ (рис.34). На 30-е сутки после трансплантации опухоли воздействие ФС лазером вызывает те же изменения, что и на 20-е сутки после перевивки, за исключением изменений в удельном объеме опухолевой стромы: на 30-е сутки облучение ФС-лазе-ром дозозависимо увеличивает объем опухолевой стромы (рис.2).
Результаты данного исследования позволяют предполагать, что ФСЛИ в исследуемых дозах стимулирует некроз опухолей.
ВЫВОДЫ
-
1. ФСЛИ в неоплазме на 20-е сутки после трансплантации РШМ-5 повышает уровень функциональной активности системы «перекисное окисление липидов - антиоксиданты». На 30-е сутки после трансплантации РШМ-5 опухоли ФСЛИ стимулирует в неоплазме оксидативный стресс.
-
2. Под влиянием ФСЛИ в опухолевой ткани РШМ-5 возрастает объем участков некроза при одновременном снижении удельного объема паренхимы, митотического и апоптотического индексов.
Работа выполнена при поддержке грантов гос-задания Минобрнауки РФ и гранта Президента РФ.
Таблица 4. Морфологические показатели опухолевой ткани при РШМ-5 мышей
|
Группа Показатели |
20-е сутки роста РШМ |
30-е сутки роста РШМ |
||||
|
Без облучения |
Э сред .=2,4 Дж/см2 |
Э сред .=3,6 Дж/см2 |
Без облучения |
Э =2 4 сред. , Дж/см2 |
Э сред .=3,6 Дж/см2 |
|
|
Удельный объем опухолевой паренхимы (%) |
76,81±2,01 |
57,39±0,41* |
53,59±3,73* |
65,34±2,78 |
41,22±3,22* |
56,02±5,34* |
|
Удельный объем опухолевой стромы (%) |
1,21±0,16 |
0,49±0,04* |
0,25±0,01* |
0,2±0,036 |
0,38±0,01* |
0,50±0,21* |
|
Удельный объем участков некроза (%) |
21,99±2,05 |
42,12±0,37* |
46,17±3,73* |
34,64±2,76 |
58,41±3,22* |
43,50±5,14* |
|
Митотический индекс, (‰) |
18,00±1,40 |
15,63±5,63 |
9,38±3,13* |
18,00±3,18 |
6,25±2,50* |
5,00±0,01* |
|
Апоптотический индекс, (‰) |
87,00±3,76 |
33,75±6,25* |
23,13±1,88* |
67,00±4,25 |
26,25±10,00* |
23,13±1,88* |
Примечание: * - данные, значимо отличающиеся от показателей без облучения
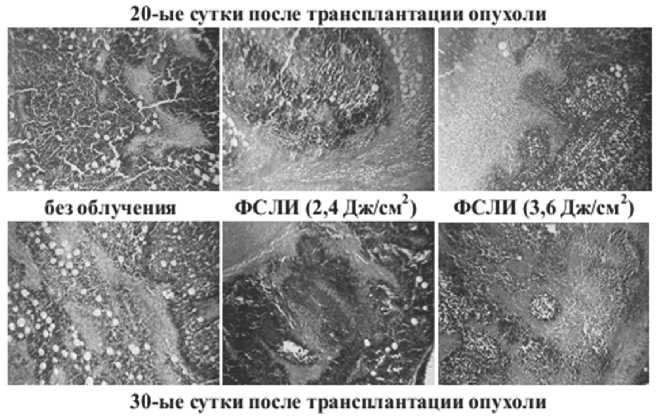
Рис. 2. Опухоль РШМ-5 до и после воздействия ФСЛИ на разные сутки после трансплантации опухоли. Окраска гематоксилин-эозином. Микрофото х100
Список литературы Редокс-зависимые процессы в опухолевой ткани рака шейки матки при воздействии фемтосекундного лазерного излучения
- Kamata T. Roles of Nox1 and other Nox-isoforms in cancer development//Cancer Sci. 2009. Vol.100(8). P.1382-1388.
- Закономерности паранеопластических расстройств при отечно-инфильтративной форме рака молочной железы/В.Ю.Барсуков, В.Н.Плохов, Н.П.Чеснокова//Современные проблемы науки и образования. 2008. №1. С. 13-19.
- Модификация метода определения перекисей липидов в тесте с тиобарбитуровой кислотой/Л.И.Андреева, А.А.Кишкун, Л.А.Кожемякин//Лаб.дело. 1988. №11. С.41-43.
- Дубинина Е.Е. Биологическая роль супероксидного анион-радикала и супероксиддисмутазы в тканях организма//Успехи соврем.биол. 1989. Т.108. №1(4). С.3-18.
- The occurrence of superoxide anion inthereaction of reduced phenacinemethosulfateand molecular oxygen/M.Nishikimi, N.Appa, K.Yagi//Biochem. Biophys. Res. Commun. 1972. Vol.46. P.849-854.
- Карпищенко А.И. Медицинские лабораторные технологии и диагностика: Справочник: в 2 т. СПб.: Интермедика 1999. 656 с.
- Glutathione S-transferase novel kinetic mechanism in which the major reaction pathway depends on substrate concentration/W.H.Habig, M.J.Pabst, W.B.Jakoby//J.Biol.Chem. 1974. Vol.249 (22). Р.7140-7147.
- Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding//Anal. Biochem. 1976. Vol.72. P.248-54.
- Манских В.Н. Морфологические методы верификации и количественной оценки апоптоза//Бюллетень сибирской медицины. 2004. №1. C.63-70.
- Oxy-radical sources, scavender systems and membrane damage in cancer cells/T.Galeotti, S.Borello, L.Masotti//In: Oxygen Radicals: Systemic Events and Disease Processes. Basel: Karger, 2004. Р.129-148.
- Корси Л.В., Соколов В.Г. Лазерный способ фотохимической деструкции опухолей без экзогенных сенсибилизаторов//Сборник «Лазерно-оптические системы и технологии». М.: ФГУП «НПО Астрофизика», 2009. С.101-106.


