Регенеративная активность кожного покрова и заживление ожоговой раны у взрослых и детей при ожогах второй степени
Автор: Абдуллаева Ж.Д., Абдуллаев Д.К., Калматов Р.К.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 2 т.10, 2024 года.
Бесплатный доступ
Улучшение регенеративной активности кожного покрова необходимо для своевременного заживления ожоговых ран. Регенеративная активность кожного эпителия варьирует у пациентов разного возраста.
Регенеративная активность, заживление ожоговой раны, ожоги второй степени, возрастные особенности, наночастицы серебра
Короткий адрес: https://sciup.org/14129850
IDR: 14129850 | УДК: 616.-001.17 | DOI: 10.33619/2414-2948/99/27
Текст научной статьи Регенеративная активность кожного покрова и заживление ожоговой раны у взрослых и детей при ожогах второй степени
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.-001.17
Кожа является важнейшим компонентом иммунной системы и закрепляет различные иммунные клетки, такие как фибробласты, тучные клетки, макрофаги и антигенпрезентирующие клетки (тучные клетки и дендритные клетки кожи — клетки Лангерганса), которые влияют на заживление ран. Эти клетки представляют собой клеточный компонент дермы, и их количество уменьшается с возрастом [1].
В настоящее время в нашей стране используется классификация ожоговых ран, принятая на XXVII Всесоюзном съезде хирургов согласно которой выделяют следующие степени поражения: 1 степень — поверхностный эпидермальный ожог; 2 степень — ожог верхнего слоя кожи (Рисунок 1); 3 степень — коагуляция и некроз всего сосочкового слоя или более глубоких слоев кожи; 3А степень — некроз эпителия распространяется на глубину эпителиального слоя до герминативного, но захватывает последний не полностью, а лишь на верхушках сосочков, сохраняются придатки кожи; 3Б степень — некроз распространяется на глубину всего эпителиального слоя и дермы; 4 степень — поражение глубжележащих тканей подкожной клетчатки, фасций, мышц, сухожилий и костей .
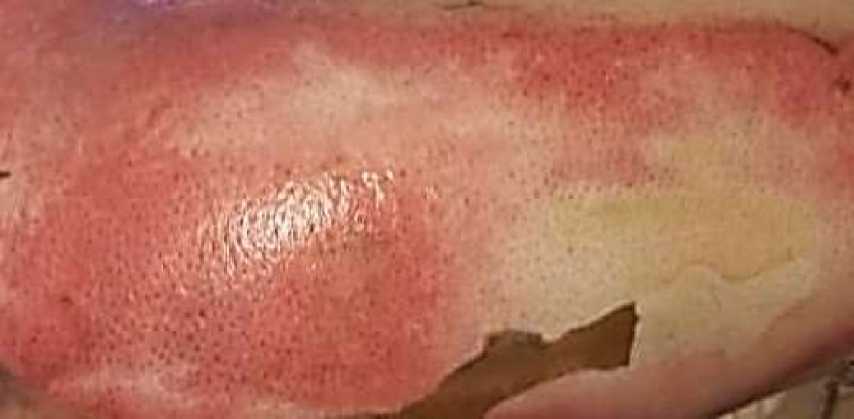
Рисунок 1. Ожоговая рана второй степени
Лечение ран и ожогов проводят дифференцированно в зависимости от стадии и фазы течения раневого процесса, при этом последовательно используются разнообразные лекарственные формы препаратов с различным механизмом действия [2].
В клинической картине при ожоге 2 степени на различной глубине в толще эпидермального слоя образуются пузыри, наполненные прозрачной серозной жидкостью. Содержимым таких пузырей является бесклеточная серозная жидкость с высоким содержанием в ней белков. Заживление происходит за счет регенерации эпителия .
Материалы и методы исследования
Произведен литературный обзор результатов современной научной, отечественной и зарубежной литературы и клинических рекомендаций регенерации ожоговой раны.
Исследованы пациенты Ошской межобластной объединенной клинической больницы возраста от 0 до 90 лет с ожоговой раной второй степени. Выполнен синтез наночастиц серебра при помощи экстрактов растений для изготовления повязочных матералов с целью улучшения регенеративной активности кожного покрова и заживления ожоговых ран.
Результаты и обсуждение
Для лечения ожоговых ран в амбулаторных и стационарных условиях методом выбора является повязочный метод. При этом повязка в известной мере предохраняет ожоговую раневую поверхность от инфицирования, удерживает на ране лекарственные препараты, способна всасывать раневое отделяемое. Выбор лекарственных средств определяется глубиной ожога, стадией течения раневого процесса, характером инфицированности раны. Каждая лекарственная форма (мази, растворы) имеет свои показания к применению. По воздействию на раневой процесс при ожогах монокомпонентные препараты можно разделить на следующие группы:
-
1. противомикробного действия, содержащие антибиотики, антисептики, сульфаниламиды (мази линкомициновая, тетрациклиновая, синтомициновая, фурацилиновая, диоксидиновая, дермазин и т. д.; растворы хлоргексидина, фурацилина, йодопирона, борной кислоты, калия перманганата, натрия гипохлорита);
-
2. противовоспалительного действия, содержащие гормональные препараты (мази фторокорт, локакортен, преднизолон и др.);
-
3. протеолитического и кератолитического действия (салициловая мазь, профезим, ируксол и др.);
-
4. стимулирующие регенерацию (мази метилурациловая, солкосерил);
-
5. местные обезболивающие средства (тримекаин, лидокаин) [3].
Длительное существование ожоговых ран, обусловливая увеличение частоты гнойносептических осложнений ожоговой болезни, ухудшают результаты лечения. Проблемой остается выбор оптимальных местных раневых покрытий или их эффективных комбинаций с физиотерапевтическими методами лечения локальных поверхностных и глубоких ожоговых, донорских ран и профилактики раневой инфекции [4–6].
Как известно, ожоговая рана в зависимости от морфологических и функциональных изменений условно разделяется на зоны коагуляции, стаза (паранекроза) и гиперемии. Зона коагуляции — эта зона необратимого некроза. В зоне гиперемии повреждение тканей выражено в минимальном объеме, микроциркуляция практически не изменена. Располагающаяся в середине повреждения зона стаза в последующем подвержена гибели вследствие нарушения микроциркуляции, воздействия цитокинов и свободных радикалов [7].
В соответствии с изменениями в тканях выделять четыре стадии в раневом процессе, которые более полно, чем в существующих классификациях, отражают динамику морфологических и метаболических превращений, происходящих в ране и хорошо определяемых по клиническим признакам: 1) стадию метаболических и сосудистых расстройств с реактивной транссудацией; 2) стадию клеточной инфильтрации и воспалительной серозной экссудации; 3) стадию воспалительной гнойной экссудации; 4) стадию регенерации и эпителизации [8].
Начиная с 60-х годов XX века, в клинической практике для местного применения стали использовать препараты серебра Нитрат серебра, повязки с чистым или ионизированным серебром, крем с сульфадиазином серебра позволили получить благоприятные результаты при инфицированных ранах и ожогах [9, 10].
Наночастицы и ионы серебра проникают внутрь бактериальных клеток, связываясь с биомолекулами и клеточными структурами (липиды, белки, ДНК), это приводит к остановке или замедлению процессов транскрипции, трансляции, синтеза белка, денатурации рибосом, что ведет к нарушению жизнедеятельности клетки. Серебро снижает синтез и нарушает работу антиоксидантных ферментов, что приводит к накоплению в клетке активных форм кислорода [11, 12].
Наиболее широкий круг исследований посвящен применению серебра в наноформе для заживления ран. Применение серебра в наноформе в составе мазей, повязок именно для целей профилактики контаминации раны, либо для лечения инфицированной раны описано в большом числе работ. Авторы отмечают высокую эффективность наночастиц серебра как антибактериальных агентов, а также нанокомпозитов, в состав которых входит серебро в наноразмерной форме и нановолокон [13]. Механизм действия наночастиц серебра показан на Рисунке 2 [14].
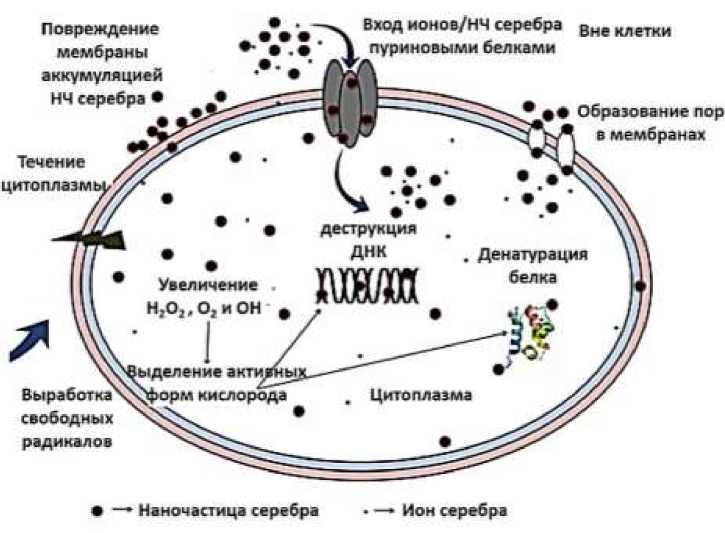
Рисунок 2. Механизм взаимодействия наночастиц серебра с бактериальными клетками [14]
В результате проведенных исследований было установлено, что новая мазь на основе микрочастиц серебра обладает выраженными ранозаживляющими свойствами по сравнению с известными монопрепаратами [15].
Наночастицы серебра обладают антибактериальным, ранозаживляющим и выраженной антимикробной активностью. Получены наночастицы серебра из экстрактов растений для приготовления повязочных материалов пациентам с ожоговой раной второй степени. Получение и применение наночастиц позволяют решать многие проблемы в медицине, в ускорении процесса заживления ран, в снижении времени и затрат на лечение пациентов с различными раневыми процессами.
Список литературы Регенеративная активность кожного покрова и заживление ожоговой раны у взрослых и детей при ожогах второй степени
- Кузьмин Ю. А., Испаева Ж. Б., Маемгенова Г. Н., Сарсенбаева А. М., Шоканова Э. Т. Кожа и иммунная система (обзор литературы) // Вестник Казахского Национального медицинского университета. 2019. №2. С. 296-300.
- Емельянова А. М., Стяжкина С. Н., Федоров В. Г., Субботин А. В. Современные методы лечения гнойных и ожоговых ран // Вестник медицинского института «Реавиз»: реабилитация, врач и здоровье. 2020. №1 (43). С. 27-34. EDN: SPAQLD
- Спиридонова Т. Г. Консервативное лечение ожоговых ран // Русский медицинский журнал. 2001. Т. 9. №13-14. С. 560-561.
- Крайнюков П. Е., Зиновьев Е. В., Османов К. Ф. Особенности клинической картины и результаты лечения донорских ран после аутодермопластики у пострадавших от ожогов // Вестник Национального медико-хирургического центра им. НИ Пирогова. 2018. Т. 13. №2. С. 113-119.
- Мордяков А. Е., Чарышкин А. Л., Слесарева Е. В. Оценка результатов лечения ран донорских мест у пациентов с глубокими ожогами // Казанский медицинский журнал. 2018. Т. 99. №1. С. 17-23. EDN: YMRWAP. https://doi.org/10.17816/KMJ2018-017
- Bailey J. K., Blackstone B. N., DeBruler D. M., Kim J. Y., Baumann M. E., McFarland K. L., Powell H. M. Effects of early combinatorial treatment of autologous split‐thickness skin grafts in red duroc pig model using pulsed dye laser and fractional CO2 laser // Lasers in surgery and medicine. 2018. V. 50. №1. P. 78-87. https://doi.org/10.1002/lsm.22702
- Рузимуратов Д. А., Фаязов А. Д., Камилов У. Р., Магдиев Ш. А., Набиев А. А. Современные взгляды на проблему местного лечения ожоговых ран // Вестник экстренной медицины. 2022. Т. 15. №5. С. 90-98.
- Торгунаков А. П. Нерешенные вопросы хирургической обработки ран. Требует ли ожоговая рана обособленной терминологии? // Политравма. 2015. №1. С. 63-68. EDN: TMOHHF
- Савадян Э. Ш. Использование препаратов серебра в хирургии и травматологии (Обзор зарубежной литературы) // Хирургия. 1989. Т. 8. С. 135-139.
- Russell A. D., Hugo W. B. 7 antimicrobial activity and action of silver // Progress in medicinal chemistry. 1994. Т. 31. С. 351-370. https://doi.org/10.1016/S0079-6468(08)70024-9
- Ржеусский С. Э. Наночастицы серебра в медицине // Вестник Витебского государственного медицинского университета. 2022. Т. 21. №2. С. 15-24. EDN: GYXFVT. https://doi.org/10.22263/2312-4156.2022.2.15
- Panáček A., Kvítek L., Smékalová M., Večeřová R., Kolář M., Röderová M., Zbořil R. Bacterial resistance to silver nanoparticles and how to overcome it // Nature nanotechnology. 2018. V. 13. №1. P. 65-71. https://doi.org/10.1038/s41565-017-0013-y
- Шурыгина И. А., Шурыгин М. Г. Перспективы применения наночастиц металлов для целей регенеративной медицины // Сибирское медицинское обозрение. 2018. №4 (112). P. 31-37. EDN: XWPTNZ. https://doi.org/10.20333/2500136-2018-4-31-37
- Parikh R. Y., Singh S., Prasad B. L. V., Patole M. S., Sastry M., Shouche Y. S. Extracellular synthesis of crystalline silver nanoparticles and molecular evidence of silver resistance from Morganella sp.: towards understanding biochemical synthesis mechanism // ChemBioChem. 2008. V. 9. №9. P. 1415-1422. https://doi.org/10.1002/cbic.200700592
- Федота Н. В., Лукьянова Д. А. Влияние мазей на основе серебра и цинка на регенерацию кожи при моделировании термических ожогов // Известия Оренбургского государственного аграрного университета. 2014. №6 (50). С. 77-78. EDN: TGNLHN


