Регионарная перфузия и консервация таза и нижних конечностей с последующим их включением в системный кровоток. результаты пилотного эксперимента на животных
Автор: Бабич А.И., Гургенидзе В.В., Хубезов Л.Д., Осипов А.В., Завражнов А.А., Демко А.Е.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.20, 2025 года.
Бесплатный доступ
Обоснование: сосудистые травмы являются основной причиной летальности и инвалидизации при военных и гражданских травмах. При массовом поступлении пострадавших во время осложненных ЧС, как правило, отсутствует время на высокотехнологичные и длительные операции. Поиск новых эффективных способов, позволяющих увеличить жизнеспособность поврежденного сегмента конечности для обеспечения возможности транспортировки на следующий этап оказания медицинской помощи, представляется крайне актуальным. Ввиду этого, было спланировано и проведено экспериментальное исследование.
Изолированная перфузия, консервация конечностей
Короткий адрес: https://sciup.org/140310010
IDR: 140310010 | DOI: 10.25881/20728255_2025_20_2_41
Текст научной статьи Регионарная перфузия и консервация таза и нижних конечностей с последующим их включением в системный кровоток. результаты пилотного эксперимента на животных
Актуальность
Сосудистые травмы являются основной причиной летальности и инвалидизации при военных и гражданских травмах. Частота ранений и закрытых травм кровеносных сосудов в современных военных конфликтах значительно выросла, составляя порядка 10–18% [1]. Частота повреждений магистральных артерий и вен конечностей на войне достигает 60% от всех сосудистых повреждений, не имеет тенденции к снижению и является определяющим фактором ампутаций по первичным и вторичным показаниям [1].
В современных военных конфликтах превалирует массовый характер поступления раненых вследствие того, что эвакуация с поля боя осуществляется после завершения активной фазы боевых действий, которая может занимать длительное время, а использование противником беспилотных летательных аппаратов делает невозможной тактическую авиомедицинскую эвакуацию и значительно удлиняет догоспитальный этап. При массовом поступлении раненых отсутствует время на высокотехнологичные и длительные операции, кроме того, хирурги, оказывающие раннюю специализированную помощь в прифронтовых медицинских пунктах, зачастую не имеют достаточного опыта артериальных реконструкций и приемлемых условий (время, оборудование, расходные материалы,) для их выполнения.
Основным способом временного обеспечения кровотока при повреждениях магистральных артерий, применяемым более 100 лет, является временное протезирование поврежденной артерии, которое сопряжено с большим количеством осложнений. В этой связи поиск новых эффективных способов, позволяющих увеличить жизнеспособность поврежденного с артерией сегмента конечности для транспортировки раненого на следующий этап оказания медицинской помощи, в рамках которого имеются время, необходимые ресурсы и опыт врачей, представляется крайне актуальным [2].
Цель исследования : разработать методику регионарной перфузии и консервации таза и нижних конечностей с последующим их включением в системный кровоток, а также провести доклинические испытания разработанного метода на лабораторных животных (самках минипигов).
Материалы и методы
Исследование проводилось на четырех минипигах, самках массой 40±5 кг каждая и возрастом 4–8 месяцев, в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментальных и других научных целей от 18 марта 1986 г. За сутки перед операцией животных не кормили, доступ к воде оставляя свободным. С целью премедикации вводили 2 мл препарата «Золетил 100». После доставки животного в операционную его размещали на спине, выполняли трахеостомию, трахеостомическую трубку подключали к аппарату ИВЛ, поддержание анестезии осуществляли
Севофлюраном, при необходимости дополнительно вводили Золетил.
Перфузию и консервацию таза и нижних конечностей с последующим их включением в системный кровоток у экспериментальных животных проводили по следующей оригинальной, самостоятельно разработанной методике: под общим обезболиванием с интубацией трахеи и ИВЛ, после 3-х кратной обработки операционного поля растворами антисептиков и отграничением стерильным операционным материалом выполняли поперечный, циркулярный разрез кожи и подкожной жировой клетчатки на уровне пупка. Пересекали все мышцы, мягкие ткани, брыжейку толстой кишки и толстую кишку, а также гонадные сосуды, после чего таз с нижними конечностями оставался фиксирован только позвоночным столбом. Все возможные коллатерали между верхней и нижней половиной тела лабораторного животного пересекались. Выполнялась мобилизация аорты и нижней полой вены ниже почечных сосудов. После завершения мобилизации аорта и нижняя полая вена пережимались сосудистыми зажимами ниже почечных сосудов и пересекались – имитировалось артериальное и венозное повреждение, анатомический сегмент (таз и нижние конечности) полностью отключался от системного кровообращения.
Далее имитировался первичный этап эвакуации экспериментального животного (этап эвакуации пострадавшего) – в течение 90 минут дистальная часть аорты и нижней полой вены оставались открытыми. По завершении данного этапа из аорты выполнялась тромбэктомия зондом фогарти (6 Fr), в дистальные отделы аорты и нижней полой вены устанавливались артериальная (10 Fr) и венозная канюли (14 Fr), осуществлялась изолированная нормотермическая гипероксическая перфузия таза и конечностей в течение 30 мин. Скорость перфузии составляла 800 мл в мин.
После завершения перфузии проводилась консервация отключенного анатомического сегмента раствором НТК Кустодиол путем его введения в аорту через установленную ранее артериальную канюлю. Консервация осуществлялась до поступления из НПВ прозрачного раствора (1–1,5 л раствора).
После завершения консервации таз и нижние конечности обкладывались льдом. Имитировался повторный этап транспортировки (этап эвакуации пострадавшего после оказания квалифицированной помощи) – в течение 6 часов лабораторные животные находились под наркозом без выполнения каких-либо манипуляций. Далее, через ранее установленную артериальную канюлю таз и нижние конечности «отмывались» 1000 мл 0,9% изотонического раствора хлорида натрия и включались в системный кровоток путем сшивания проксимального и дистальных концов аорты (пролен 4/0, непрерывный обвивной шов) и проксимального и дистального концов нижней полой вены (пролен 4/0, непрерывный обвивной шов). Через 1 час после восстановления кровотока в отключенном ранее анатомическом сегменте замерялись

Бабич А.И., Гургенидзе В.В., Хубезов Л.Д. и др.
РЕГИОНАРНАЯ ПЕРФУЗИЯ И КОНСЕРВАЦИЯ ТАЗА И НИЖНИХ КОНЕЧНОСТЕЙ С ПОСЛЕДУЮЩИМ ИХ ВКЛЮЧЕНИЕМ В СИСТЕМНЫЙ КРОВОТОК. РЕЗУЛЬТАТЫ ПИЛОТНОГО ЭКСПЕРИМЕНТА НА ЖИВОТНЫХ
Табл. 1. Параметры, оцениваемые во время проведения эксперимента
|
Измеряемый параметр |
После индукции наркоза |
90 мин.* |
150 мин. |
210 мин. |
270 мин. |
330 мин. |
360 мин. |
390 мин.** |
420 мин.*** |
|
Контроль АД, ЧСС |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Темп диуреза |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Газы крови (ph, pCO2, paO2, HCO3, BE) |
+ |
+ |
+ |
||||||
|
Газы крови (ph, pCO2, paO2, HCO3, BE) проксимальнее наложенных зажимов на аорту и НПВ |
+ |
+ |
+ |
+ |
+ |
+ |
|||
|
Газы крови (ph, pCO2, paO2, HCO3, BE) дистальнее наложенных зажимов на аорту и НПВ |
+ |
+ |
+ |
+ |
+ |
+ |
|||
|
Гемоглобин крови |
+ |
+ |
+ |
||||||
|
Креатинин крови |
+ |
+ |
+ |
||||||
|
Допплерография бедренных артерий |
+ |
+ |
+ |
+ |
|||||
|
Нейромиография мышц нижних конечностей |
+ |
+ |
+ |
+ |
|||||
|
Гистологическое исследование мышц проксимальнее наложенных зажимов |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
Гистологическое исследование мышц дистальнее наложенных зажимов |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
Гистологическое исследование ткани печени |
+ |
+ |
+ |
||||||
|
Гистологическое исследование ткани легкого |
+ |
+ |
+ |
||||||
|
Гистологическое исследование ткани почек |
+ |
+ |
+ |
Примечание : * – после пережатия и пересечения аорты и нижней полой вены и индукции кровопотери. **– через 30 минут после запуска кровотока по отключенному ранее анатомическому сегменту. *** – через 60 минут после запуска кровотока по отключенному ранее сегменту тела.
контрольные параметры, и животное выводилось из эксперимента во время выполнения ИВЛ с максимально высокой концентрацией Севофлюрана и системного введения препарата «Золетил» [5].
По аналогии с исследованием Rohde E. et al. (2021) [6] во время процедуры осуществлялся инвазивный мониторинг артериального давления, частоты сердечных сокращений, контроль диуреза, кислотно-основного состояния в артериальной крови (i-STAT, Abbot, США), выполнялись нейромиография мышц нижних конечностей, допплеросонография (Mindray M6, Китай) и патологоанатомическое исследование образцов тканей лабораторного животного (мышцы, почки, печень, легки) по временным точкам, представленным в таблице 1.
Образцы тканей (почки, печень, мышцы) фиксировали в 10% растворе нейтрального формалина. Ткань обрабатывали обычным способом, после чего заливали в парафин. Микротомия образцов с толщиной срезов 4–5 мкм выполнена на санном микротоме фирмы «Leica». Все полученные срезы окрашивали гематоксилином и эозином. При гистологическом исследовании полуколичественно оценивали выраженность степени изменений в исследуемых органах [4; 7].
Функцию периферической нервной системы оценивали при помощи нейромиоанализатора НМА4-01 НЕЙРОМИАН. Выполняли электромиографию (ЭМГ) и электонейромиографию (ЭНМГ). Исследовали и анализировали амплитуду ЭМГ-кривой, порог возбудимости, амплитуду М-ответа.
При проведении допплеросогнографии оценивали пиковую линейную скорость кровотока на бедренной артерии справа и слева, так же определяли тип кровотока.
При гистологическом исследовании скелетных мышц по 3-балльной шкале оценивали следующие показатели:
– потерю поперечной исчерченности, лизис ядер и наличие некрозов, кровоизлияния, нейтрофильную инфильтрацию, наличие фрагментации мышц и фибрина;
– при оценке эндомизия определяли наличие кровоизлияний, отек и разоволокнение фиброзных волокон, нейтрофильную инфильтрацию;
– при анализе перимизия определяли наличие кровоизлияний, отека и разволокнения фиброзных волокон, нейтрофильную инфильтрацию;
– при оценке состояния сосудов оценивали наличие стаза, сладжей, тромбов, разволокнения стенки, наличие острого васкулита, пролиферацию эндотелиоцитов и периваскулярную нейтрофильную инфильтрацию;
– в жировой клетчатке определяли наличие отека, кровоизлияний и нейтрофильной инфильтрации;
– в фасциях определяли отек и разволокнение волокон, наличие кровоизлияний и нейтрофильной инфильтрации, а также фрагментацию и деформацию коллагеновых волокон; в нервных волокнах определяли наличие некрозов и отека [3].
Результаты
Во всех четырех случаях эксперимента удалось успешно провести и завершить запланированное хирургическое вмешательство.
Во время пережатия аорты и нижней полой вены, моделирования ранения сосудов и кровопотери отмечалось умеренное падение среднего системного артериального давления с 60–80 мм рт. ст. до 35–40 мм рт. ст., что

потребовало введения вазопрессоров – норадреналин в дозировке 0,1–0,3 мкг/кг/мин. массы тела в час. После проведения инфузионной терапии кристаллоидными растворами и стабилизации гемодинамики постепенно снижали дозу вазопрессоров до нуля.
Значения показателей центрального венозного давления, EtCO2, газов крови и кислотно-основного состояния оставались в пределах референтных значений на протяжении всего эксперимента. При анализе показателей газов крови в отключенном анатомическом сегменте, перед началом изолированной перфузии отмечался выраженный ацидоз (pH менее 6,0) гипоксемия (PаO2 менее 10), что соответствовало данным аналогичного исследования Rohde E. et al. (2021) [6]. Темп диуреза оставался нормальным и не снижался как во время
Табл. 2. Частота встречаемости морфологических признаков в образцах исследуемых тканей, %
|
Признак |
1 группа n = 4 |
2 группа n = 14 |
3 группа n = 11 |
Скелетная мышца
|
потеря поперечной исчерченности |
75 |
95 |
68,2 |
|
лизис ядер и наличие некрозов |
100 |
35,7 |
50,0 |
|
Кровоизлияния |
25 |
0 |
18,2 |
|
нейтрофильная инфильтрация |
25 |
0 |
0 |
|
Фрагментация |
25 |
25,0 |
36,4 |
|
наличие фибрина |
25 |
0 |
0 |
Эндомизий
|
Кровоизлияния |
25 |
14,3 |
22,7 |
|
отек и разволокнение фиброзных волокон |
50 |
100 |
63,6 |
|
нейтрофильная инфильтрация |
0 |
0 |
18,2 |
Перимизий
|
Кровоизлияния |
0 |
21,4 |
36,3 |
|
отек и разволокнение фиброзных волокон |
50 |
100 |
81,8 |
|
нейтрофильная инфильтрация |
0 |
28,6 |
45,5 |
Сосуды
|
Стазы |
25 |
85,7 |
9,1 |
|
Сладжи |
0 |
14,2 |
0 |
|
тромбы |
50 |
7,1 |
9,1 |
|
разволокнение стенки |
50 |
35,7 |
18,2 |
|
острый васкулит |
50 |
28,6 |
45,5 |
|
краевое стояние нейтрофильных лейкоцитов |
100 |
64,3 |
63,6 |
|
пролиферация эндотелиоцитов |
100 |
100 |
90,9 |
|
периваскулярная нейтрофильная инфильтрация |
100 |
21,4 |
63,6 |
Жировая клетчатка
|
отек |
100 |
92,8 |
90,9 |
|
кровоизлияния |
50 |
0 |
36,4 |
|
нейтрофильная инфильтрация |
75 |
10,7 |
36,4 |
Фасции
При допплеросонографии во всех исследуемых точках на бедренных сосудах определялся магистральный тип кровотока, характеризовавшийся ламинарным кровотоком и наличием на допплерограмме трехфазной кривой (2 антеградных пика и один ретроградный). Каких-либо изменений, определяемых при помощи до-плеросонграфии, после запуска кровотока в отключенном ранее анатомическом сегменте выявлено не было.
При исследовании функции мышц таза и конечностей была зарегистрирована интерференционная активность 1-го типа без нарушения структуры электромиографии. Амплитуда биоэлектрической активности мышц до выключения из системного кровотока, а также через 30 и 60 мин. после включения изолированного ранее анатомического сегмента не отличалась.
Для оценки морфологических изменений в скелетной мышце было выделено 3 группы (Табл. 2):
-
1) ткань скелетные мышцы, взятые через 90 мин. после пережатия сосудов;
-
2) скелетные мышцы, взятые из дистального отдела через 270 мин. после изолированной перфузии и консервации отключенного анатомического сегмента;
-
3) скелетные мышцы, взятые из проксимального отдела после включения изолированного анатомического сегмента в кровоток, контролем послужили образцы ткани скелетной мышцы, взятые до начала проведения эксперимента.
Данные, представленные в таблице 2, позволяют видеть, что во всех группах выявлена очаговая потеря почеречной исчерченности скелетных мышц (Рис. 1), часть мышечных волокон – с лизисом ядер.
В исследуемых тканях определялись небольшие группы мышечных волокон (преимущественно рядом с фасцией) с увеличением количества ядер, гиперхромны-ми ядрами, местами с их центральным расположением. Наиболее часто изучаемые морфологические признаки
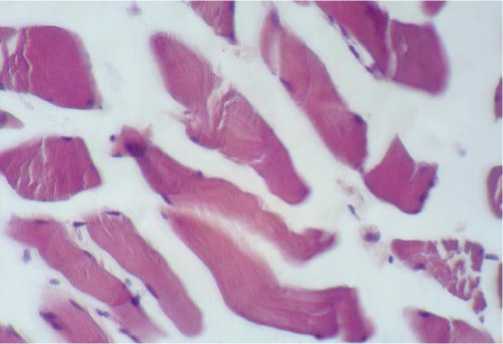
Рис. 1. Скелетная мышца. Потеря поперечной исчерченности. Окраска гематоксилином и эозином, ув. 400.

Бабич А.И., Гургенидзе В.В., Хубезов Л.Д. и др.
РЕГИОНАРНАЯ ПЕРФУЗИЯ И КОНСЕРВАЦИЯ ТАЗА И НИЖНИХ КОНЕЧНОСТЕЙ С ПОСЛЕДУЮЩИМ ИХ ВКЛЮЧЕНИЕМ В СИСТЕМНЫЙ КРОВОТОК. РЕЗУЛЬТАТЫ ПИЛОТНОГО ЭКСПЕРИМЕНТА НА ЖИВОТНЫХ
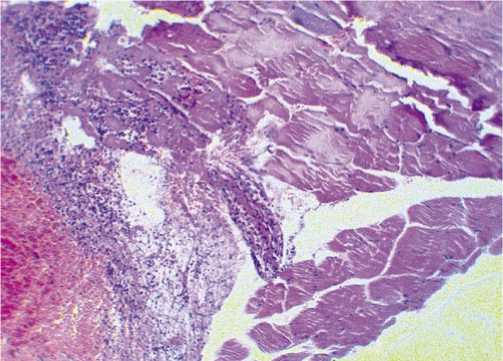
Рис. 2. Скелетная мышца. Некроз, кровизлияние с перифокальной нейтрофильной инфильтрацией. Окраска гематоксилином и эозином, ув. 200.
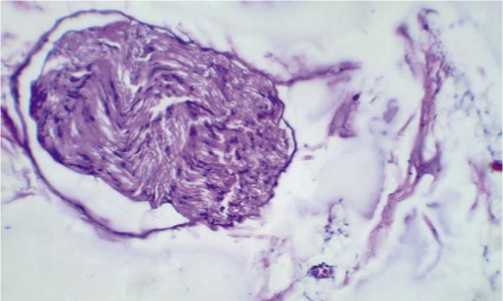
Рис. 3. Периферический нерв. Отек. Окраска гематоксилином и эозином, ув. 400.
были выявлены в 1-й группе (состояние в которой имитировало ранение). Полуколичественный анализ показал, что в этой же группе наблюдались и самые выраженные изменения. При гистологическом исследовании в данной группе выявлены крупноочаговые некрозы, кровоизлиния с перифокальной нейтрофильной реакцией (Рис. 2).
В эндомизии и перимизии во всех исследуемых группах отмечались отек и разволокнение фиброзных волокон, малочисленные мелкоочаговые кровоизлияния. Единичные тромбы в просвете сосудов выявлены только в первой группе.
Кроме этого, во всех исследуемых группах при исследовании периферических нервов выявлены минимальные изменения в виде отека разной степени выраженности (Рис. 3).
При исследовании печени определяли наличие или отсутствие следующих морфологических признаков: нарушения микроциркуляции (полнокровие, лейкостаз, тромбы), дистрофические изменения гепатоцитов, некроз гепатоцитов, отек стромы, периваскулярный отек, клеточная инфильтрация стромы, дискомплексация печеночных балок.
В срезах ткани печени были выявлены микроцир-куляторные изменения в клубочках и перитубулярных капиллярах, отек стромы, дистрофические изменения, кариолизис ядер и некроз эпителиоцитов проксимальных и дистальных канальцев, слущивание эпителиоцитов и обнажение базальных мембран канальцев. Кроме того, отмечено неравномерное кровенаполнение синусоидов и признаки повышения проницаемости сосудистой стенки с отеком стенок внутрипеченочных сосудов и стромы. В части случаев наблюдалось нарушение архитектоники ткани в виде дискомплексации печеночных балок (Рис. 4).
При морфологическом исследовании ткани почек выявлена мозаичность кровенаполнения перитубулярных капилляров в виде чередования малокровных и полнокровных сосудов. Капиллярные петли клубочков были преимущественно малокровны. Со стороны ка-
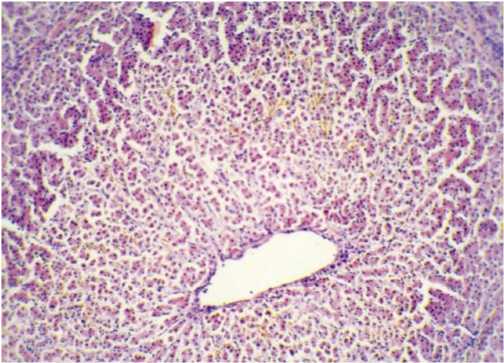
Рис. 4. Печень. Дискомплексация печеночных балок за счет отека, очаговое полнокровие синусоидов. Окраска гематоксилином и эозином, ув. 200.
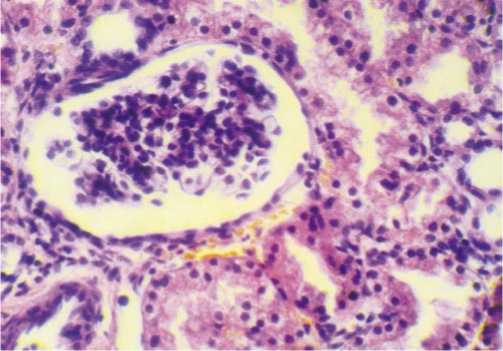
Рис. 5. Почка. Зернистая дистрофия и некроз отдельных эпителиоцитов с потерей щеточной каемки. Окраска гематоксилином и эозином, ув. 400.
нальцев выявлены изменения в виде дистрофических изменений эпителия канальцев разной степени выраженности с потерей щеточной каемки (Рис. 5).
Табл. 3. Преимущества и недостатки различных методов временного сохранения конечностей при повреждении магистральных артерий и вен
|
Показатель |
Временный протез |
Селективная изолированная перфузия |
Вено-артериальная изолированная перфузия |
|
Техническая простота |
Относительно просто |
Средне сложно (требуется навык сосудистой хирургии) |
Сложно (требуется навык эндоваскулярной хирургии) |
|
Время выполнения |
30–60 мин. |
30–60 мин. |
60–70 мин. |
|
Удобство эвакуации |
Удобно |
Неудобно (требуется эвакуация вместе с АИКом) |
Неудобно (требуется эвакуация вместе с АИКом) |
|
Применение при повреждении артерии и вены |
Неэффективно |
Неэффективно |
Неэффективно |
|
Применение при повреждении артерии в нескольких местах |
Неэффективно |
Неэффективно |
Неэффективно |
|
Повреждение вены на протяжении |
Неэффективно |
Неэффективно |
Неэффективно |
|
Реперфузионные повреждения |
Выражены максимально |
В случае отмывания контура не выражены |
Выражены максимально |
Вместе с тем, стоит отметить, что при гистологическом исследовании мышц таза и конечностей ни в одном из образцов нервных волокон не определялись некрозы.
Оценка гистологических изменений в поперечнополосатых мышцах изолированного анатомического сегмента, а также ткани печени, легких и почек после включения отключенного сегмента в системный кровоток показала отсутствие некробиотических изменений в тканях и отсутствие признаков реперфузионного повреждения в почках, печени и легких.
Обсуждение
В настоящее время в литературе описано три способа сохранения жизнеспособности конечностей при повреждении магистральных артерий: использование временного протезирования артерии (временного шунта), селективная изолированная перфузия конечности, вено-артериальная изолированная перфузия конечности. В таблице 3 указаны преимущества и недостатки каждого метода.
Таким образом, анализ существующих в настоящее время методов сохранения жизнеспособности конечностей при повреждении магистральных сосудов показал, что все предложенные способы не эффективны и сопровождаются развитием тяжелого реперфузионного синдрома. Временное протезирование (шунтирование) артерии и вено-артериальная перфузия мышц конечности не эффективны при одномоментном повреждении магистральной артерии и вены. Кроме того, выполнение вено-артериальной перфузии требует навыков эндоваскулярной хирургии, которые, зачастую, отсутствуют у хирургов, работающих на передовых этапах медицинской эвакуации. Также следует отметить, что транспортировка пострадавшего с работающим аппаратом искусственного кровообращения и набором магистралей в условиях длительной эвакуации является сложно выполнимой задачей.
Отсутствие структурных изменений в нервных волокнах, а также восстановление нормального кровотока, нейромышечной передачи и нормальных показателей определяемых при доплерографии и электромиографии свидетельствуют об эффективности и безопасности разработанного способа временного сохранения жизнеспособности тканей изолированного таза и конечностей.
Применение изолированной перфузии перед консервацией и последующее отмывание контура изолированной перфузии перед включением анатомического сегмента в системный кровоток позволяет избежать или существенно снизить вероятность развития реперфузионных повреждений.
Заключение
Разработанный в эксперименте способ сохранения жизнеспособности конечностей обладает следующими особенностями:
-
1) может быть применен при многососудистых повреждениях;
-
2) не требует навыков эндоваскулярной хирургии;
-
3) существенно увеличивает срок жизнеспособностей тканей поврежденной конечности.
Рассматриваемая методика – изолированная перфузия и консервация анатомического сегмента представляется безопасной и эффективной, позволяет сохранить жизнеспособность мышц таза и конечностей в течение 5 часов (в эксперименте) и может быть использована в клинической практике наряду с методами реперфузии конечностей в условиях дефицита ресурсов и необходимости длительной эвакуации пострадавших.
Список литературы Регионарная перфузия и консервация таза и нижних конечностей с последующим их включением в системный кровоток. результаты пилотного эксперимента на животных
- Дубров В.Э., Герейханов Ф.Г., Колтович А.П. Ранения магистральных сосудов при боевых термомеханических повреждениях // Политравма. - 2020. - №4. - С.23-29. DOI: 10.24411/1819-1495-2020-10042 EDN: CTSYKN
- Рева В.А., Потёмкин В.Д., Баранов М.И., Ершов Е.Н., Татаринцев С.А., Селезнёв А.Б. Временная экстракорпоральная перфузия - альтернативная техника поддержания жизнеспособности конечности при повреждении магистральных артерий (экспериментальное исследование) // Ангиология и сосудистая хирургия. Журнал имени академика А.В. Покровского. - 2023. - №29(4). - С.108-119. DOI: 10.33029/1027-6661-2023-29-4-108-119 EDN: LGCBBL
- Kruit AS, Smits L, Pouwels A, et al. Ex-vivo perfusion as a successful strategy for reduction of ischemia-reperfusion in-jury in prolonged muscle flap preservation - a gene expres-sion study. Gene. 2019; 701: 89-97. DOI: 10.1016/j.gene.2019.03.021
- Ng ZY, Lellouch AG, Drijkoningen T, Chang IA, et al. Vascularized composite allotransplantation - an emerging concept for burn reconstruction. Journal of Burn Care & Research. 2017; 38(6): 371-378. DOI: 10.1097/BCR.0000000000000532
- Müller S, Constantinescu M, Kiermeir D. Ischemia/reperfusion injury of porcine limbs after extracorporeal perfusion. J Surg Res. 2013; 181: 170-182. DOI: 10.1016/j.jss.2012.05.088
- Rohde E, Goudarzi M, Madajka M. Metabolic profiling of skeletal muscle during ex-vivo normothermic limb perfusion. Mil Med. 2021; 186: 358-363. DOI: 10.1093/milmed/usaa268
- Kueckelhaus M, Fischer S, Sisk G. A mobile extracorporeal extremity salvage system for replantation and transplantation. Ann Plast Surg. 2016; 76: 355-360. DOI: 10.1097/SAP.0000000000000681


