Регорафениб: новый препарат для лечения метастатического колоректального рака
Автор: Секачева М.И.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 2 (18), 2016 года.
Бесплатный доступ
Метастатический колоректальный рак - огромная, социально значимая проблема здравоохранения. Разработка новых подходов к лечению, внедрение новейших препаратов, особенно таргетного действия позволяет увеличить продолжительность жизни таких пациентов. Недавно появившийся в арсенале онкологов препарат регорафениб достоверно улучшает результаты лечения в этой сложной группе больных, обладая приемлемым профилем токсичности. В статье представлены данные крупных исследований, проведенных для изучения свойств и эффектов регорафениба. Всесторонне рассмотрены полученные результаты по изменению показателей общей выживаемости, выживаемости без прогрессирования, объективного ответа, спектр нежелательных явлений.
Метастатический колоректальный рак, регорафениб, противоопухолевый препарат, таргетная терапия
Короткий адрес: https://sciup.org/140222652
IDR: 140222652 | DOI: 10.18027/2224-5057-2016-2-Х-Х
Текст научной статьи Регорафениб: новый препарат для лечения метастатического колоректального рака
Колоректальный рак (КРР) – одна из важнейших проблем здравоохранения сегодняшнего дня. По данным регистра GLOBOCAN за 2012 год в Российской федерации коло- ректальный рак занял первое место по заболеваемости и второе место по смертности среди онкологических заболеваний [1]. Приблизительно у 50% пациентов либо в момент диагностики заболевания, либо в ходе наблюдения после удаления первичной опухоли возникают метастазы.
У ограниченной части пациентов с метастазами удается выполнить резекционное вмешательство на пораженном органе, что дает таким пациентам надежду на полное выздоровление. Однако у подавляющей доли больных при метастатическом поражении ситуация расценивается как нерезектабельная, и их дальнейшая жизнь становится целиком и полностью зависимой от проведения лекарственной терапии. Основу лечения метастатической фазы колоректального рака составляют цитотоксические препараты (5-фторурацил и его производные, оксалиплатин и иринотекан). В последние десятилетия возможности расширились за счет внедрения таргетных биологических препаратов, таких как бевацизумаб, цетуксимаб, паниту-мумаб, афлиберцепт. Тем не менее результаты терапии все еще оставляют желать лучшего, что способствует дальнейшему увеличению числа исследований, направленных на поиск новых препаратов для лечения КРР. Одним из последних открытий в этой области стал новый препарат регорафениб (производитель Байер, Германия).
СТРОЕНИЕ И БИОХИМИЧЕСКАЯ АКТИВНОСТЬ РЕГОРАФЕНИБА
Регорафениб представляет собой противоопухолевый препарат, относящийся к классу ингибиторов протеинки-наз. По своему строению он очень похож на другой противоопухолевый препарат сорафениб, успешно используемый для лечения рака почки, гепатоцеллюлярного рака и рака щитовидной железы. В отличие от сорафениба ре-горафениб имеет в центре фенилового кольца атом фтора, что, как предполагается, увеличивает его потенциал (Рис. 1). Сказать определенно, как это небольшое изменение в строении молекулы вызывает значимое изменение в биохимических свойствах молекулы, пока сложно. При изучении in vitro регорафениб продемонстрировал мощное ингибирующее действие в отношении ангиогенных
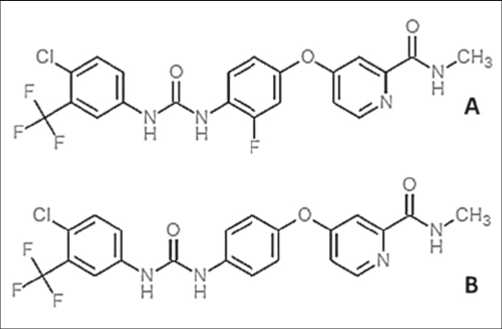
Рис. 1. Строение молекулы регорафениба (А) и сорафениба (В)
и стромальных тирозинкиназ 1–3 типов, рецепторов фибробластного фактора роста 1 типа, рецептора тромбоцитарного фактора роста – бета, онкогенных тирозинкиназ RET и KIT, а также внутриклеточных сигнальных киназ c-RAF/RAF1 и BRAF. Некоторые из этих молекул играют ключевую роль в создании и стабилизации новых сосудов в опухоли, а также в формировании лимфатических сосудов, регуляции опухолевого микроокружения, что крайне важно для роста и метастазирования опухоли [2]. В моделях КРР регорафениб подавлял рост имеющихся метастаз и предотвращал возникновение новых очагов в других органах [3], что создало предпосылки для его изучения в клинических условиях.
ФАРМАКОДИНАМИКА И ФАРМАКОКИНЕТИКА РЕГОРАФЕНИБА
В соответствии со своей биохимической структурой рего-рафениб в дозозависимой манере приводит к снижению концентрации в плазме свободного рецептора фактора роста эндотелия сосудов-2 [4]. Подобное изменение концентрации плазменного маркера находит свое отражение в снижении опухолевой перфузии по данным динамической МРТ с контрастированием на 40% через 21 день при применении в дозе 120 мг и выше [5].
В таблетированной форме биодоступность регорафениба составляет 69%, при использовании раствора биодоступность повышается до 83%. Концентрация регорафени-ба и его метаболитов в плазме достигает своего первого максимума через 1–6 часов после приема, второго максимума – через 6–8 часов и третьего – через 24 часа. Метаболизм препарата происходит в печени системами ферментов CYP3A4 и UGT1A9 с формированием двух метаболитов, показавших в доклинических условиях сходную с регорафенибом фармакологическую активность. В связи с этим механизмом метаболизма следует избегать сочетанного приема регорафениба с препаратами, индуцирующими или ингибирующими CYP3A4. Время полувыведения составляет около 28 часов. Выведение осуществляется преимущественно с калом, приблизительно 50% экскретируется в виде неизмененной молекулы, 19% выделяется почками [6].
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ РЕГОРАФЕНИБА В КЛИНИКЕ
В исследовании I фазы с повышением дозы, проведенном для оценки безопасности, переносимости и изучения фармакокинетики регорафениба в монотерапии у пациентов с солидными опухолями, был продемонстрирован
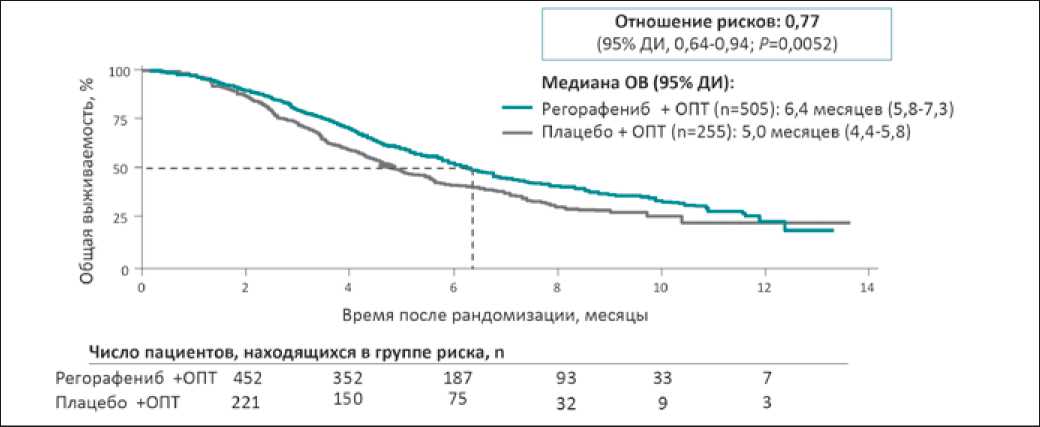
Рис. 2. Результаты исследования CORRECT: общая выживаемость
приемлемый уровень токсичности препарата, сходный с другими препаратами этого класса [4]. На основании результатов этого исследования была отобрана доза регора-фениба 160 мг в течение 21 дня с последующим перерывом в 7 дней (цикл 28 дней). Кроме того, это исследование дало предварительные результаты по противоопухолевой активности регорафениба, что позволило выделить больных с метастатическим КРР. Например, в этом исследовании у 70% пациентов с метастатическим КРР была достигнута стабилизация заболевания на фоне приема регорафениба, а у 4% получен частичный ответ в соответствии с RECIST1.1 (частичный ответ – уменьшение минимум на 30% суммы диаметров таргетных очагов).
Исследование CORRECT [7] стало рандомизированным, двойным-слепым, плацебо-контролированным исследованием регорафениба III фазы, в котором оценивались его эффективность и безопасность у пациентов с метастатическим КРР, резистентным ко всем вариантам стандартного лечения (то есть после прогрессирования на фоне использования фторпиримидинов, оксалиплатина, иринотекана, бевацизумаба и цетуксимаба или панитумумаба при диком типе KRAS). Первичной конечной точкой был показатель общей выживаемости. Вторичными конечными точками были выживаемость без прогрессирования, частота объективного ответа (оценка через каждые 8 недель), частота контроля над заболеванием, безопасность и анализ качества жизни. Важно подчеркнуть, что пациенты, принимавшие участие в исследовании CORRECT, получили все варианты лечения, почти половина получили более 3 линий терапии.
В исследовании участвовали 760 пациентов, которые были разделены на две группы в соотношении 2 (регорафениб)
к 1. Пациенты принимали препарат по схеме 160 мг в начальной дозе 3 недели, затем 1 неделя перерыв. Прием продолжался до регистрации прогрессирования заболевания или развития неприемлемой токсичности. Пациенты были стратифицированы по предшествующему приему бевациз-умаба, времени от момента постановки диагноза (≥ или <18 месяцев) и географическому региону. Переход из группы в группу не допускался. Исследование имело 90% мощность для определения 33,3% повышения медианы общей выживаемости (первичная конечная точка), исходя из медианы общей выживаемости 4,5 месяца в группе плацебо. Исходно запланированные критерии прекращения исследования были достигнуты при проведении второго запланированного промежуточного анализа общей выживаемости (432 события). Применение регорафениба повысило медиану общей выживаемости до 6,4 месяцев по сравнению с 5 месяцами в группе плацебо (рис. 2). Эффективность регорафениба была подтверждена и при окончательном анализе данных по общей выживаемости. По результатам окончательного анализа регорафе-ниб снижал риск смерти на 21% по сравнению с плацебо (95% ДИ: 0,66–0,94; P=0,0038). В группе регорафениба через 6 месяцев были живы 52,5% пациентов по сравнению с 43,5 в группе плацебо. При подгрупповом анализе общей выживаемости эффективность регорафениба была подтверждена во всех подгруппах, за исключением подгруппы с первичным поражением и ободочной, и прямой кишки (рис. 3). Однако необходимо отметить, что эта подгруппа была очень мала для определения статистической значимости. Кроме того, риск смерти больше снижался на фоне регорафениба в группе с первичной локализацией опухоли в ободочной кишке (HR=0,70) по сравнению
Преимущество в выживаемости в разных подгруппах в исследовании CORRECT
|
Подгруппы |
п |
ОР (95% ДИ) |
|
Все пациенты |
760 —е- |
0,77 (0.64-0,94) |
|
Предшествующая терапия F, Ox, Iri, Bev |
375 —•- |
0,83 (0,63-1,09) |
|
F, Ox, Iri, Bev, анш-EGFR |
385 —•— |
0,71 (0,54-0,94) |
|
Число предшествующих линий терапии мКРР 53 |
395 —•- |
0,79 (0,60-1,04) |
|
Число предшествующих линий терапии мКРР >3 |
365 —е— |
0,75 (0,56-0,99) |
|
На момент включения в исследование: KRAS дикий тип* |
299 -♦— |
0,65 (0.48-0,90) |
|
KRAS мутации' |
430 —► |
0,87 (0,67-1.12) |
|
0,0 0,5 1,0 1,5 2,0 2,5 3,0 |
||
|
В пользу |
В пользу |
|
|
регорефениб + ОПТ |
плацебо ♦ ОПТ |
|
Bev-бевацнзумаб, EGFR-рецептор эпидермального фактора роста; F-Фторпирнмидин; Ох-оксалиплатин; ki- иринотекан;
* За исключением пациентов с первичной опухолью толстой и прямой киижи (на основании незначительного числа случаев) 'На основании данных историй болезни.
Примечание Настоящий предустановленный анализ не обладал достаточной мощностью для оценки статистической значимости. Данные носят лишь описательный характер.
ОПТ - оптимальная поддерживающая терапия
Рис. 3. Результаты исследования CORRECT: анализ подгрупп по общей выживаемости
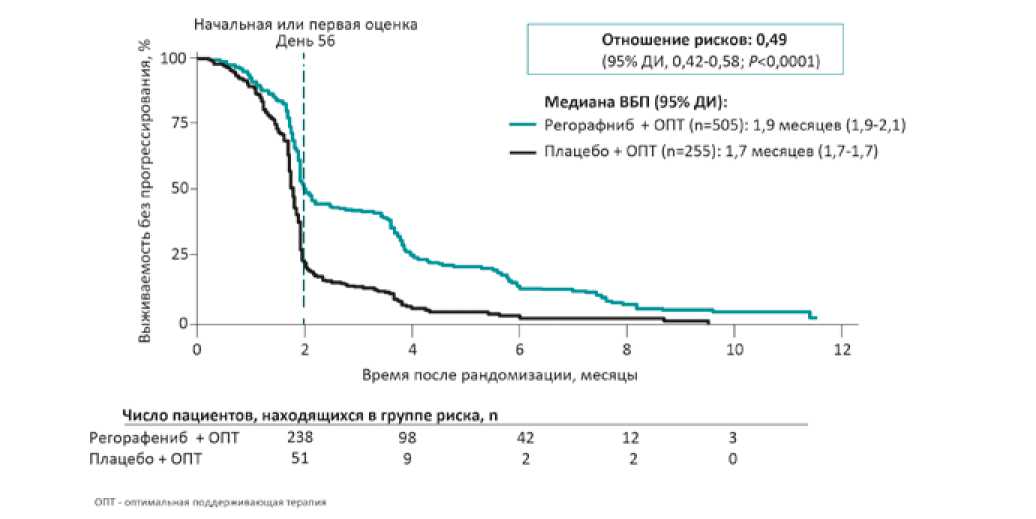
Рис. 4. Результаты исследования CORRECT: выживаемость без прогрессирования заболевания
с подгруппой прямой кишки (HR=0,95). Но нужно заметить, что пациенты с первичным раком прямой кишки, получившие плацебо, после прогрессирования чаще получали какой-либо другой вариант лечения по сравнению с общей популяцией; а пациенты с этой же первичной локализацией, но попавшие в группу регорафениба, реже после прогрессирования получали какое-либо лечение. В целом регорафениб продемонстрировал преимущество по сравнению с плацебо вне зависимости от времени с момента диагностики первичной опухоли, предшествующего противоопухолевого лечения и количества линий терапии. Также не было существенного различия в зависимости от генетического статуса KRAS. Регорафениб статистически значимо увеличивал и выживаемость без прогрессирования, эффект сохранялся на протяжении всего периода наблюдения (рис. 4).
Табл.1. Нежелательные явления, связанные с приемом препарата и зарегистрированные у ≥10% пациентов в исследовании CORRECT
|
Нежелательное явление (НЯ) |
Регорафениб (160 мг) + ОПТ (n=500) |
Плацебо + ОПТ (n=253) |
||||
|
Все степени тяжести |
3 степень |
4 степень |
Все степени тяжести |
3 степень |
4 степень |
|
|
Слабость |
47% |
9% |
<1% |
28% |
5% |
<1% |
|
Ладонно-подошвенный синдром |
47% |
17% |
0 |
8% |
<1% |
0 |
|
Диарея |
34% |
7% |
<1% |
8% |
1% |
0 |
|
Aнорексия |
30% |
3% |
0 |
15% |
3% |
0 |
|
Изменения голоса |
29% |
<1% |
0 |
6% |
0 |
0 |
|
Повышение артериального давления |
28% |
7% |
0 |
6% |
1% |
0 |
|
Воспаление слизистых полости рта |
27% |
3% |
0 |
4% |
0 |
0 |
|
Сыпь или шелушение |
26% |
6% |
0 |
4% |
0 |
0 |
|
Тошнота |
14% |
<1% |
0 |
11% |
0% |
0 |
|
Снижение веса |
14% |
0 |
0 |
2% |
0 |
0 |
|
Лихорадка |
10% |
1% |
0 |
3% |
0 |
0 |
ОБЪЕКТИВНЫЙ ОТВЕТ
БЕЗОПАСНОСТЬ
В исследовании CORRECT производилась оценка ответа опухоли в соответствии с критериями RECIST. Не было зафиксировано ни одного случая полного ответа, однако частичный ответ наблюдался у 1% больных в группе регорафениба и 0,4% в группе плацебо. Самым важным достижением в группе регорафениба явилось повышение частоты контроля над заболеванием (частичный ответ+ста-билизация через минимум 6 недель после рандомизации) до 41% по сравнению с 15% в группе плацебо (р<0,0001). Эти результаты сходны с полученными при использовании бевацизумаба и еще раз подчеркивают тот факт, что стандартные ориентированные на изменение размера критерии оценки эффективности по данным визуализационных методик (RECIST) недостаточны для оценки ответа на биологические препараты. Критерии RECIST, разработанные для оценки уменьшения размеров опухоли на фоне цитотоксической химиотерапии, не вполне отвечают на запросы при применении новых препаратов, как правило, демонстрирующих цитостатический механизм действия.
При ретроспективном анализе группы пациентов, включенных в исследование в одном из центров, отмечалось снижение рентгенологической плотности опухоли и образование полостей в метастазах в легких на фоне приема регорафе-ниба [8]. И хотя в данный анализ были включены только 22 пациента, исследователи обнаружили значимую связь между уменьшением размера опухоли, образованием полости в метастазах и изначальной низкой плотностью опухоли и лучшими результатами лечения (повышение общей выживаемости и выживаемости без прогрессирования).
В целом регорафениб имеет предсказуемый и благоприятный профиль безопасности. К наиболее частым побочным эффектам любой степени выраженности относятся утомляемость, снижение аппетита, ладонно-подошвенный синдром, диарея, мукозит, потеря веса, артериальная гипертензия, инфекционные процессы (табл. 1). Кроме того, у некоторых больных фиксировалось повышение АЛТ, АСТ и билирубина (табл. 2). В большинстве случаев подъем АСТ, АЛТ и билирубина были 1 и 2 степени и клинически незначимыми. Крайне важно, что частота прекращения лечения из-за нежелательных явлений, связанных с препаратом, была достаточно низкой при использовании регорафениба (8,2% по сравнению с 1,2% на фоне плацебо), что говорит об управляемости побочных эффектов в ходе терапии [7].
Обращает на себя внимание, что большинство нежелательных явлений развивалось на ранних этапах лечения, преимущественно в течение первых двух месяцев, и их частота снижалась при продолжении терапии (рис. 5). Средняя доза регорафениба оставалась относительно постоянной в течение первых трех циклов и отсутствовала кумулятивная токсичность. Данные этого исследования показали, что частота вызванных регорафенибом нежелательных явлений снижается с течением времени, и раннее их выявление позволяет уменьшить их степень выраженности.
Результаты исследования CORRECT позднее были подтверждены в сходном по дизайну, но меньшим по числу участников исследовании CONCUR, выполненном в Азии
Табл. 2. Частота повышения трансаминаз и билирубина в исследовании CORRECT
Регорафениб (160 мг) + ОПТ Плацебо + ОПТ
|
Нежелательное явление (НЯ) |
(n=500) |
(n=253) |
||||
|
Все степени тяжести (%) |
3 степень (%) |
4 степень (%) |
||||
|
Все степени тяжести (%) |
3 степень (%) |
4 степень (%) |
||||
|
Повышение уровня билирубина |
45 |
10 |
3 |
17 |
5 |
3 |
|
Повышение уровня аспартатаминотрансферазы (АСТ) |
65 |
5 |
1 |
46 |
4 |
3 |
|
Повышение уровня аланинаминотрансферазы (АЛТ) |
45 |
5 |
1 |
30 |
3 |
<1 |
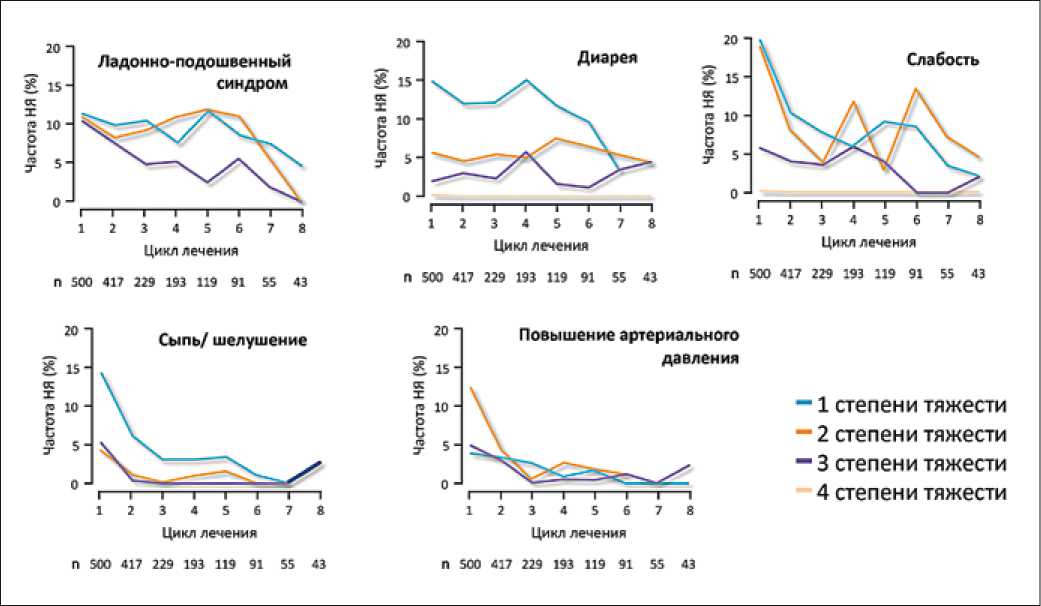
Рис. 5. Результаты исследования CORRECT: зависимость нежелательных явлений от времени с момента начала терапии
[9]. В исследовании участвовало 204 пациента с метастатическим КРР, у которых прогрессирование было зарегистрировано минимум на двух линиях терапии. Важным отличием была возможность включения пациентов, которые не получали в анамнезе антиангиоген-ную терапию. Медиана общей выживаемости в группе регорафениба составила 8,8 месяцев по сравнению с 6,3 месяцами в группе плацебо (HR0,55; 95% ДИ 0,40– 0,77; p = 0,00016), также было отмечено улучшение выживаемости без прогрессирования и частоты контроля над заболеванием. При подгрупповом анализе у пациентов, не получавших ранее таргетную терапию, риск смерти, благодаря применению регорафениба, уменьшался более чем в два раза по сравнению с подгруппой, получавшей ранее биологические препараты. Причина этого феномена не совсем понятна. Предполагается, что предшествующее воздействие таргетных препаратов, ингибирующих аналогичные пути, может способствовать отбору резистентных клеток, делая менее эффективным последующее лечение регорафенибом.
Эффективность и безопасность регорафениба были подтверждены и в открытых крупномасштабных исследованиях, охватывавших больных с метастатическим колоректальным раком в условиях реальной клиниче-
Табл. 3. Обзор данных по эффективности регорафениба
Последние данные на большой группе пациентов были получены в ходе открытого исследования IIIb фазы CONSIGN [11], целью которого было изучение профиля безопасности регорафениба. В исследовании приняли участие почти 3000 пациентов, в том числе 45 пациентов из России. При средней продолжительности терапии 2,5 месяца у 80% пациентов были зарегистрированы нежелательные явления 3 и более степени токсичности по CTCAE4.0, из них 57% рассматривались исследователями как требующие лечения и связанные с регорафенибом. Самыми частыми нежелательными явлениями были артериальная гипертензия (15%), ладонно-подошвенный синдром (14%) и утомляемость (13%). Только в 9% случаев нежелательные явления привели к прекращению терапии. Самыми частыми отклонениями в лабораторных показателях были повышение печеночных ферментов и реже цитопении. В целом профиль безопасности не отличался существенно от результатов предшествующих исследований. Показатель медианы выживаемости без прогрессирования составил 2,7 месяцев, что также совпадало с предыдущими данными (табл. 3).
ЗАКЛЮЧЕНИЕ
Изучение регорафениба в клинических условиях перевернуло подход к планированию исследований для такого рода препаратов. Предшествующие исследования ингибиторов киназ были построены на оценке данных препаратов в сочетании с цитотоксической терапией, преимущественно в первых линиях терапии. Исследование CORRECT включало пациентов с резистентным ко всем вариантам химиотерапии метастатическим колоректальным раком, и препарат назначался в качестве монотерапии. Подобный дизайн вызывал много вопросов, однако очень быстрый набор в исследование продемонстрировал потребность в новых препаратах для поздних этапов терапии.
Крупные исследования регорафениба, выполненные в соответствии с требованиями медицины, основанной на доказательствах, расширили возможности лекарственного лечения при метастатическом колоректальном раке. Эффективность и приемлемый профиль токсичности регорафениба позволяет использовать его у длительно получавших терапию пациентов с метастатическим колоректальным раком, давая шанс на продолжение активной жизни.


ПОЧКИ ПЕЧЕНЬ щитовидная
У X X X ЖЕЛЕЗА У
Нексавар: эффективность и надежность в трех показаниях14
Нексавар одобрен для лечения трех видов
- местно-распространенный или к радиоактивному иоду
- метастатический почечно клеточный рак
- печеночно-клеточный рак солидных опухолей1:

Нексавар
метастатический дифференцированный рак щитовидной железы, резистентный
Нексавар применяется в клинической практике в России более 8 лет
АЦ.МК T.SH «,№>№27 1\м ним л
Нг кглмр (Ыгхпта) Международное и ел а тантр ля иное каман^с: Спрафгижб (wrgfpnlbfr Леч арсгпсшия форма: таблетки. ппкрытаг ллемтхниЗ абрломсой 1 таблетка содержит: сорафениба ппилзг -2 74 мг (эмдивалгчпнО Ж1 мг сорафениба опадания}, Лрыы^на: ^тэстятачмкий печгчнр-клеточный рун. пгчемгянр-жлетачкый' рай, *ггтна -расщюгфвмгимнй или мгчастртмче:кий дмффгрентадг плмиый рак щнадндиюй железа. ргхнстсмтмый к радию» кти иному йоду. Проти полой »з а мня- повышенная ^«тамтельмост^ к спрафтнибу или к любому другому гомгюигнту препарат, бфГ мгнностъ и п<\ри<ЪЧ еюрмлгмнЯ грудью.ЛПТхий Я03р*П (эффективность и безСЮЗСНОСГЬ прннемгмна нс уп#НПВлемы)Х остррржмСЮЪЮ: при кржны* нбопсюмнях.лрн артгрня.адой гнпгртлнн. при лряышениой кровоточивости иди кровотечении* в аидмигтс. при и«табмп1.нюй стенокардии, перенес емком инфэрялт миокарда. при тгралин спв**гст110 с ирмиептклмом и доцетакселом, Способ применение и дозы: рскоме-нд^ная суточная доза сорафеямфа состидист 800 мг (4 т»бптдн по 200 мг) Суточная доза чазнаммтгя в два приема (2 таблетки 2 раза • сутки), либо в промежуток между пригмами пнц^ы, либо вместе с пищей, содержащий низкое или умеренное количество жире Тэбпсткн проглапыввюх запивая сгаедчои воды.Лечение продолжают до тех лор, пока сохраняется клиническая эффекту ноль препарата или до появления его непрмеммного wi«ki№ действия. ПсСнууюо действие очень нагло (ИДО); лнм&злечн?. вродотичеяня [включая кровотечения нз мелудочню-кншечмого тракт», дыхательных путей ы кровомэлняни» в головной нозО, повышение артериального давления, сухость кожи, кожная сыпь, алопеийа, надданоподошвенкаа эрнтроднзестоэнта.эрятан», кожный зуд. йнарся, тошнота, рвота, запор, анорексия, артралгия, гипй&хфвтемия. увеличение активности липазы и амктазы,повышенная утомляемость, болевой си ядром различной локалязадин. (в том числе бопь в ротавоЯ полости, боль а .животе, боль в мостах, боль в области опухоли, головная 0о-*Х сннжеиис массы тела, инфекции, повышение температуры тел» Часта (от *1/100 до < 1/1Щ. «йкопення. нейтропения, аненна. тромбоимтопения, xpohhwc*.»h сердечная яежктаточностъ, ншрння мнохараа н/нли инфаркт мнокэрда, приливы, рмнорея, днейония, керзтоакантона/нпоскоклеточный ₽а« кожи, мсфалиативный дерматит, ашне, шелушение ■о*и, гиперкераюз, фоллнхуднт, лопатит (включая сухость слизистой ротавон пртостн к гпоссоднншс), диспепсия дисфагия, гастроээсфагеа,^-ный рефлорх, пгериферинеская сенсорная нейропатия, дчетевэня, депрессия, звон в ушах, миалгия, мы^янные спазмы, почечная недостаточность, лрогеинурня, эректильная дисфунчимя; гипотноеоз, транзитарное повышение активности трансаминаз [ACT, АЛУ], гитчкагьегнемня, енпонатрнемня, астечия. гриппоподобный синдром, воспаление слизистых. РегнстрациоыныЯ напер: № /КР-1Ю0095, актуальная версия инст^дции от 01.Dfr.2615. Произваджтель: байер Фарма АГ. Германия. Отпускается по рецепту врача. Подробная информация содержится в инструкции по гфииеменмю препарата. З.Инптухцм по применений лекарственного препарата для меднинмского применения НЕКСАВАР NF ЛФ-ООСОТЗ от 01.062015.2. ЕкшЗгег В. er al Soratenlb In advanced cLear-celi гега4ч^1 carcinoma, n Enqt J Med.200?: 356:! 25-1 И. 3. Йпйк J., RacHJ J.L, ЗЛептзао M. etaL Efficacy and ta^ety of loraten^ in pauencs v*ith advanced hepatocellular carcinoma: tubanalyses ol a phase Nl ufatJ HepaioL 2012 (Xt; 57(4). 821 -?. 4. Brose 4 ei al Sorafenib In radioactive iodine-refractory, locally advanced or metasasic tfiffierendared Ttryroid cancer: a randomised, double-Blind, phase 3 trial Lancet Oncol 2 014; 384(9940): З!?- 2 8.
Аля специалистов здравоохранения
АО «БАЙЕР*. 10 7Ш Москва, 5-я Рыбинская ул., д, 18, стр. 2. Тел,: +7 (495) 2 51 1200, факс: +7 (49 5) 2 31 1202.
Список литературы Регорафениб: новый препарат для лечения метастатического колоректального рака
- http://globocan.iarc.fr/old/bar_pop.asp?selection=163643&title =Russian+Federation&sex=0&statistic=0&window=1&grid=1&color1=5&color1e=&color2=4&color2e=&orientation=1&submit=%C2%A0Execute
- Wilhelm S. M., Dumas J., Adnane L., et al. Regorafenib (BAY73-4506): a new oral multikinase inhibitor of angiogenic, stromal and oncogenic receptor tyrosine kinases with potent preclinical antitumor activity. Int J Cancer. 2011; 129: 245-255.
- Schmieder R., Hoffmann J., Becker M., et al. Regorafenib (BAY73-4506): antitumor and antimetastatic activities in preclinical models of colorectal cancer. Int J Cancer. 2014; 135: 1487-1496.
- Strumberg D., Scheulen M. E., Schultheis B., et al. Regorafenib (BAY73-4506) in advanced colorectal cancer: a phase I study. Br J Cancer. 2012; 106: 1722-1727).
- Solimando Jr. D.A., Waddell J. A. Drug monographs: bosutinib and regorafenib. Hosp Pharm. 2013; 48: 190-194.
- Zopf D., Heinig R., Thierauch K-H., et al. Abstract 1666: Regorafenib (BAY73-4506): preclinical pharmacology and clinical identification and quantification of its major metabolites. Cancer Res. 2010; 70 (8 Supplement): 1666.
- Grothey A., Van Cutsem E., Sobrero A., et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013; 38: 303-312.
- Ricotta R., Sartore-Bianchi A., Verrioli A., Vanzulli A., Siena S. Regorafenib for metastatic colorectal cancer. Lancet. 2013; 381(9877): 1537.
- Li J., Qin S., Xu R. et al. Regorafenib plus best supportive care versus placebo plus best supportive care in Asian patients with previously treated metastatic colorectal cancer (CONCUR): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2015; 16: 619-629.
- Tougeron D., Desseigne F., Etienne P. L., Dourthe L. M., Mineur L., Paule B. et al. REBECCA: a large cohort study of regorafenib (REG) in the real-life setting in patients (pts) previously treated for metastatic colorectal cancer (mCRC). Ann Oncol. 2014; 25(4): iv167-209.
- Van Cutsem E., Ciardiello F., Seitz J-F. et al. Results from the large, open-label phase 3b CONSIGN study of regorafenib in patients with previously treated metastatic colorectal cancer. Ann Oncol. 2015; 26(4 Supplement): iv118.


