Регулирование активности аконата гидратазы в листьях кукурузы с красным и синим светом
Автор: Федорин Д.Н., Эпринцев А.Т.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 3 т.13, 2017 года.
Бесплатный доступ
Изучена динамика активности аконатгидратазы (AH, EC 4.2.1.3) в листьях кукурузы при различных режимах света, и было установлено, что красный и синий свет оказывает тормозящее влияние на функционирование исследуемого фермента. Повышенная активность АГ в темных условиях связана с активизацией дыхательного обмена как основного источника энергетических эквивалентов в отсутствие света. Показана зависимость скорости экспрессии генов aco1 и aco2 в листьях кукурузы при облучении светом разных длин волн. Изменение скорости экспрессии гена aco1 в зависимости от состояния фитохрома и криптохромных систем коррелирует с активностью кодируемого фермента, что указывает на механизм опосредованного генами фитохром- и криптохром. Для гена aco2 показана обратная зависимость в регуляции фитохромной системы.
Короткий адрес: https://sciup.org/14324015
IDR: 14324015
Текст научной статьи Регулирование активности аконата гидратазы в листьях кукурузы с красным и синим светом
В метаболизме митохондрий растений, как и у всех эукариот, преобладает синтез АТФ, фундаментальный вклад в который вносит цикл Кребса, связывая путь гликолиза с цепью переноса электронов. Несмотря на тот факт, что работа и расположение полного цикла Кребса были продемонстрированы в клетках растений несколько десятилетий назад, функциями этого важного пути в растениях еще далека от полной ясности. Даже фундаментальные вопросы, такие как, работает ли цикл Кребса в освещаемой фотосинтетической ткани, и вносит ли он вклад в энергетические потребности фотосинтеза, остаются противоречивыми (Regev-Rudzki et al. , 2008).
Учитывая его центральную и многогранную роль в метаболизме, неудивительно, что цикл ЦТК представляет сложный процесс. Фактически, ключевые ферменты в пути подвержены многим перекрывающимся формам контроля, которые, в конечном счете, диктуют поток через цикл в соответствии с энергетическими требованиями (Carrari et al. , 2003).
Свет - один из главных регуляторов жизни растения, оказывающий влияние на все стороны его жизнедеятельности, в частности такие физиологические процессы, как рост, формообразование, адаптивные реакции. Он способен осуществлять регулирующую роль ключевых метаболических путей посредством фитохромной системы (Carrari et al., 2003). Было выяснено, что фитохромная система может осуществлять регуляцию активности некоторых дыхательных ферментов на уровне экспрессии их генов (Escobar et al., 2004). Поэтому актуальной проблемой представляется исследование роли фитохромной системы растений в работе ферментов цикла трикарбоновых кислот, одним из которых является аконитаза – фермент, осуществляющий первую реакцию цикла по преобразованию цитрата в изоцитрат через промежуточное соединение – цисаконитат. Данные об активности этого фермента позволят судить о скорости функционирования цикла Кребса. О работе фермента можно судить не только по его каталитической активности, но и по экспрессии гена, кодирующего белковую молекулу фермента. Наличие активно транскрибируемого гена может указывать на наличие функционально активного белка.
В настоящее время открываются и другие важные функции аконитазы в клетке. Все осуществляемые ими функции в растительных объектах, несмотря на всю их важность, изучены не в полной мере, что в особенности касается цитозольной формы АГ. Все это, в совокупности, делает аконитатгидратазу весьма интересным объектом для изучения, и обуславливает актуальность нашей работы. В связи с этим, целью являлось изучение регуляции функционирования изоформ АГ в листьях кукурузы под действием красного и синего света.
MATERIALS AND METHODS
В качестве объекта исследования были выбраны 14-дневные растения кукурузы ( Zea mays L.) сорта Воронежская 76, выращенные гидропонным методом при температуре 25оС и 12-часовом световом дне.
Опыты по изучению светового режима проводили по разработанному ранее методу (Popov et al. , 2010). В качестве источников белого света использовали лампы дневного света в климатической камере LabTech LCC-2-MP. Источниками красного и дальнего красного света служили светодиоды с областью испускания 640-680 нм (ОАО «Протон», Россия) и 710-750нм (ОАО «Протон», Россия). Синий свет получали с помощью светодиодов с областью испускания 465-470 нм (ОАО «Протон», Россия). Интенсивность света составляла 0,044 Ватт/м2. Интенсивности света такого уровня хватает для индукции сигнальных реакций, с участием фитохромной системы, но при этом реакция протекания фотосинтеза не запускается (Popov et al. , 2010).
Для определения активности АГ использовали спектрофотометрический метод на Т70+ UV-VIS Spectrophotometer (PG Instruments Limited, Англия). Увеличение оптической плотности показывало образование цис-аконитовой кислоты, при 240 нм в течение 3 мин.
При выделении РНК из листьев кукурузы использовали метод гуанидин-тиоционат-фенол-хлороформной экстракции (Chomczynski and Sacchi, 1987).
Обратная транскрипция осуществлялась при помощи набора AmpliSence (Хеликон, Россия) согласно инструкции производителя.
Количественную ПЦР в реальном времени проводили на приборе LightCycler96 (Roche, Швейцария), краситель, применяемый в работе -SYBR Green I. В качестве праймеров, подобранных с помощью программного обеспечения Primer3, использовали нуклеотидные последовательности: к гену к гену aco 1 : прямой – 5’-tggaaggagatgctgtcagt-3’; обратный – 5’-cgtatagcgccatccacatg-3’; к гену aco 2 : прямой – 5’-caagttcttcagccttccgg-3’; обратный – 5’-gcaaggtctacaactgctgg-3’. Параметры проводимой амплификации: денатурация 95оС – 5 мин., после чего цикл: 95оС – 30 сек., 60оС – 30 сек., 72оС – 30 сек. (детекция), финальная элонгация - 72оС – 10 мин.
Определение относительного уровня экспрессии анализируемых генов проводили с применением 2-ΔΔCt-метода с использованием программного обеспечения LightCycler 96 Software Version 1.1 (Roshe, Швейцария).
Полученные данные обрабатывали с использованием статистических критериев. Обсуждали статистически достоверные различия при р < 0,05 (Лакин, 1990).
RESULTS
Проведенные исследования влияния светового режима на активность аконитазы в листьях кукурузы показали, что функционирование фермент проявляет светозависимость. При помещении растений в условия темноты наблюдали увеличение данного показателя в 2 раза, относительно варианта «свет» (рис. 1).
Выявлено, что под влиянием красного света (660 нм) происходило снижение активности фермента в 3,25 раз относительно контрольного уровня (24 часа в темноте). Воздействие на растения дальнего красного света имело противоположный красному свету эффект. Воздействие дальним красным светом на скорость функционирования АГ не вызывало изменений данного показателя относительно контрольного уровня и соответствовало 10,18 Е/г.с.м. Последовательное действие на растения красного и дальнего красного света вызывало аналогичный эффект с дальним красным светом, т.е. ферментативная активность аконитатгидратазы в зеленых листьях кукурузы не изменялась.
Через 3 часа после импульсного облучения растений синим светом наблюдали значительные изменении в активности исследуемого фермента по сравнению с темнотой, что проявлялось в ее ингибировании в 2,5 раза (рис. 2). Данное отличие величин активностей фермента при различных условиях облучения связано с тем, что при освещении светом с длиной волны 465нм происходит косвенное влияние на функционирование аконитазы через систему криптохромов.
При исследовании влияния светового режима на уровень транскриптов гена aco1 аконитатгидратазы, было показано, что данный показатель проявляет определенную зависимость (рис. 3). При обучении растений красным светом происходит значительное снижение величины данного показателя с 12,8 ед. до 0,52 ед. относительно контрольного варианта, в качестве которого выступал вариант «темнота». При этом, облучение листьев кукурузы дальним красным светом и последовательное облучение красным и дальним красным светом не приводило к существенному изменению содержания транскриптов гена митохондриальной формы аконитазы относительно варианта «темнота».
Иная картина наблюдалась при исследовании действия красной части спектра на содержание транскриптов гена цитозольной формы аконитазы. В условия света и при облучении растений кукурузы красным светом наблюдалось большее содержания его мРНК, по сравнению с условиями темноты (рис. 4). В данном случае снижение концентрации транскриптов в темноте составило 1,15 раза. Сходная картина наблюдалась при освещении листьев кукурузы красным светом, уровень транскриптов был равен таковому показателю в условиях света.
Количественный ПЦР анализ кДНК с генспецифичными праймерами к аконитазе, показал, что при импульсном облучении зеленых листьев кукурузы наблюдали изменения уровня транскриптов гена aco1 при инкубации растений в условиях темноты. Однако, после облучения растений синим светом содержание транскриптов исследуемого гена уменьшилось более чем в 5 раза по сравнению с темновым вариантом (рис. 5).
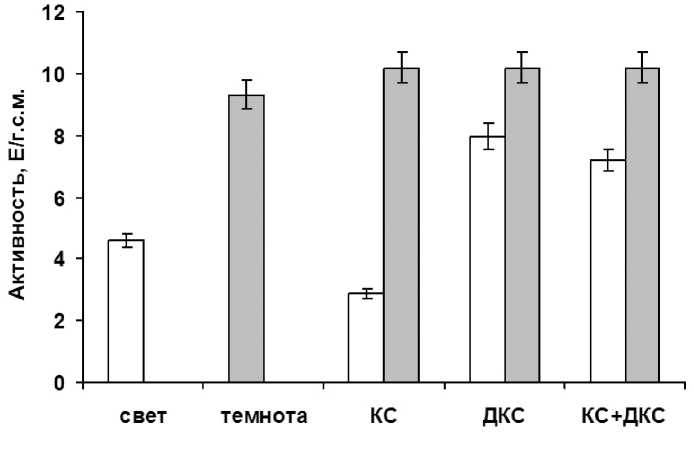
Figure 1. Активность аконитатгидратазы в листьях кукурузы при их облучении светом разной длины волны. Свет – растения, освещенные белым светом; Темнота – растения, выдержанные в темноте; КС – растения, освещенные светом с длиной волны 660 нм; КС+ДКС – растения, последовательно освещенные светом с длиной волны 660 нм и 730 нм. Серые столбцы – темновой контроль.
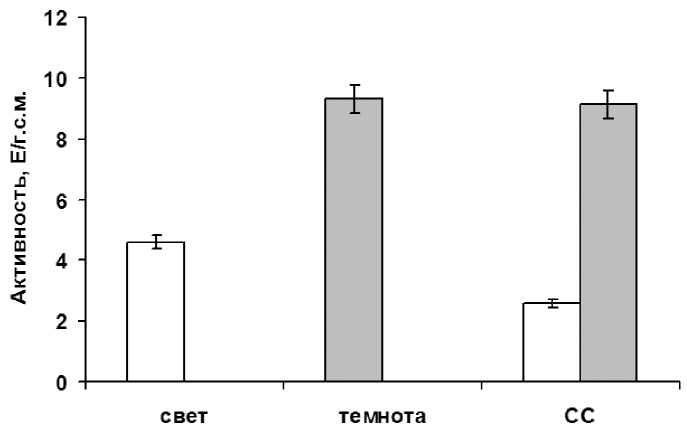
Figure 2. Активность аконитатгидратазы в зеленых листьях кукурузы в условиях различного светового режима. Свет – растения, экспонируемые на свету с интенсивностью 25 Дж/м2с. Темнота – растения выдержанные 24 часа в темноте. СС – растения после импульсного облучения синим светом в течение 15 минут, час. Серые столбцы – темновой контроль. Серые столбцы – темновой контроль.
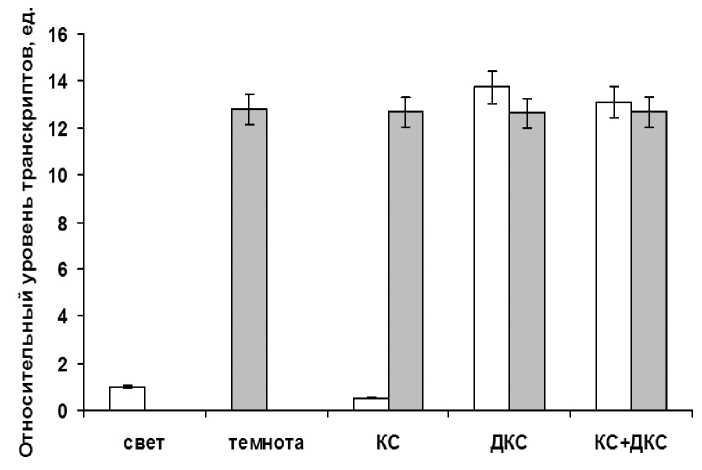
Figure 3. Уровень транскриптов гена aco1 в листьях кукурузы при их облучении светом разной длины волны. Свет – растения, освещенные белым светом; Темнота – растения, выдержанные в темноте; КС – растения, освещенные светом с длиной волны 660 нм; КС+ДКС – растения, последовательно освещенные светом с длиной волны 660 нм и 730 нм. Серые столбцы – темновой контроль.
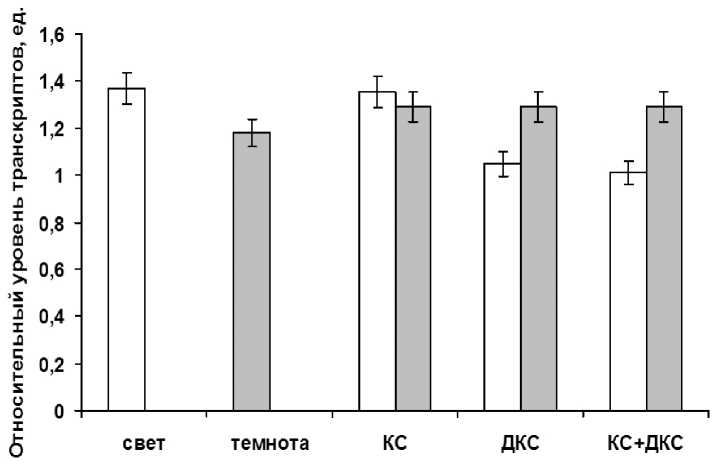
Figure 4. Уровень транскриптов гена aco2 в листьях кукурузы при их облучении светом разной длины волны. Свет – растения, освещенные белым светом; Темнота – растения, выдержанные в темноте; КС – растения, освещенные светом с длиной волны 660 нм; КС+ДКС – растения, последовательно освещенные светом с длиной волны 660 нм и 730 нм. Серые столбцы – темновой контроль.
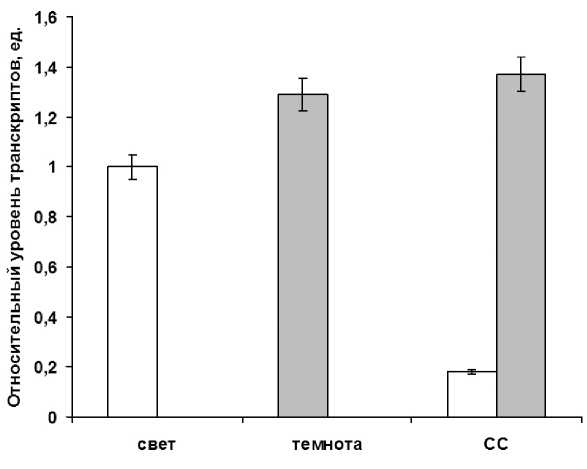
Figure 5. Относительный уровень транскриптов гена aco1 в листьях кукурузы в условиях различного светового режима. Свет – растения, экспонируемые на свету с интенсивностью 25 Дж/м2с. Темнота – растения выдержанные в 24 часа темноте. СС –растения после импульсного облучения синим светом в течение 15 минут. Серые столбцы – темновой контроль.
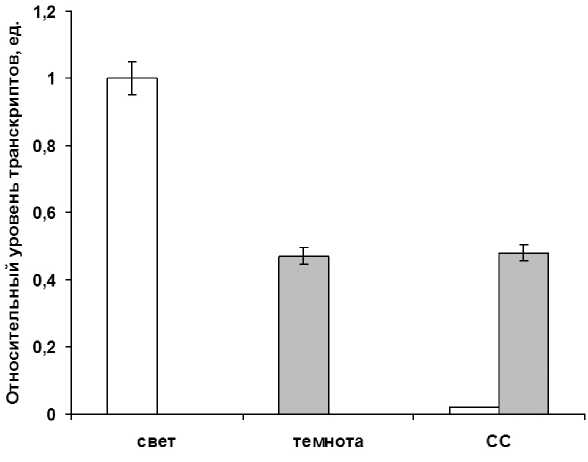
Figure 6. Относительный уровень транскриптов гена aco2 в листьях кукурузы в условиях различного светового режима. Свет – растения, экспонируемые на свету с интенсивностью 25 Дж/м2с. Темнота – растения выдержанные в 24 часа темноте. СС –растения после импульсного облучения синим светом в течение 15 минут. Серые столбцы – темновой контроль.
При этом наблюдалась иная картина содержания транскриптов гена aco2 в листьях кукурузы в ответ на воздействие синего света (рис. 6). Высокий уровень транскриптов исследуемого гена на свету связан с метаболизацией митохондриального цитрата, что ранее было показано для растений арабидопсиса.
Уменьшение содержания транскриптов гена aco2 после инкубации растений в условии темноты составляло 43,7% относительно такового показателя на свету. Следовательно, ген aco2 , ответственный за синтез цитозольной формы аконитатгидратазы, ингибируется по мере активации цикла Кребса, обеспечивающего его протекание и быструю метаболизацию цитрата в условия темнового дыхания. В данных условиях фотосинтез не функционирует, и основным источником энергетических эквивалентов выступает цикл трикарбоновых кислот.
DISCUSSION
Полученные данные о влиянии низкоэнергетического красного и дальнего красного света на активность аконитазы, свидетельствуют об участии фитохромной системы в регуляции ее активности. Экспозиция растений в красном свете вызывает конформационные перестройки в структуре фитохрома, переводя его из неактивной формы в активную, которая вызывает ингибирующий эффект функционирование АГ.
Рядом исследователей была показана фитохром-зависимомая регуляция некоторых ферментов дыхательного метаболизма. Анализ ДНК-чипов выявил репрессию E1-альфа субъединицы митохондриального комплекса пируватдегидрогеназы, репрессию одного и индукцию другого гена для митохондриальной цитратсинтазы, некоторую репрессию аконитазы и индукцию митохондриальной малатдегидрогеназы. В целом эти результаты согласуются с метаболическими данными, указывающими на повышенную челночную активность малата и отток цитрата из митохондрий, активированных фитохромом (Tepperman et al , 2006). Обсуждение роли фитохрома в регуляции экспрессии этих ферментов представлено в обзоре Rasmusson & Escobar Rasmusson and Escobar, 2007).
В ходе наших исследований было показано, что активность АГ в контрольных растениях на свету составила 4,58 Е/г.с.м., а в темноте в 9,31, что в 2,03 раза выше. Это обусловлено активацией работы цикла Кребса в отсутствие фотосинтеза (Eprintsev et al., 2013).
Такое падение активности аконитатгидратазы можно объяснить работой фоторецепторных систем, максимум поглощения которых лежит в области 400700 нм.
Следовательно, полученные результаты могут свидетельствовать о зависимости скорости работы гена aco1 от состояния фитохромной системы. Активная форма фитохрома проявляет ингибирующее действие на данный ген, вызывая снижение концентрации его транскриптов. Такой эффект красного света согласуется с данными, полученными для генов каталитического димера сукцинатдегидрогеназы при исследовании действия на них красного и дальнего красного света (Епринцев и др. , 2016). В этом случае, снижение содержания транскриптов генов цикла Кребса обусловлено торможением скорости работы всего цикла в условиях активно функционирующего фотосинтеза.
Результаты исследований показывают, что уровень мРНК гена aco2 в листьях кукурузы при облучении красным светом незначительно возрастает, что, вероятно, связано активацией цитозольной формы данного фермента, необходимой для осуществления биосинтетических процессов. Ранее было показано, что в условиях активно функционирующего фотосинтеза работа цикла трикарбоновых кислот претерпевает изменения и наблюдается отток цитрата из митохондрии в цитоплазму Thum et al 2004).
Подавление экспрессии генов aco1 и aco2 при воздействии синего света с длиной волны 465нм через 3 часа после облучения может свидетельствовать об опосредованном действии на них криптохромной системы. Ранее подобный механизм регуляции экспрессии был показан для гена sdh1-2 в листьях арабидопсиса при облучении растения синим светом (Епринцев и др. , 2015).
Механизм трансдукции криптохромного сигнала еще недостаточно изучен, однако, установлено, что свет активирует С-концевой домен криптохрома путем фотовосстановления ФАД, который затем проявляет светозависимые эффекты путем фосфорилирования мишеней (Casal and Yanovsky,
2005). Это проявляется во взаимодействии между С-концевым доменом криптохрома и белком COP1 (Yang et al. , 2001), что может являться криптохром-опосредованным механизмом регуляции экспрессии генов в ядре клетки (Zuo et al. , 2011).
Таким образом, выявлено ингибирующее действие красного и синего света на содержание транскриптов генов митохондриальной и цитоплазматической форм аконитазы. Исследование уровня транскрипции генов aco1 в зеленых листьях кукурузы показало уменьшение концентрации их мРНК под действием данного фактора, что четко коррелирует с изменением скорости функционирования АГ в данных условиях. Полученные результаты свидетельствуют об участии фитохромной и криптохромной систем в регуляции функционирования аконитатгидратазы. Вероятно, в механизме реализации криптохромного сигнала могут принимать участие транскрипционные факторы COP1 и HY5 (Zuo et al. , 2011).
ACKNOWLEDGEMENTS
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (РФФИ), грант № 14-04-01039.
Список литературы Регулирование активности аконата гидратазы в листьях кукурузы с красным и синим светом
- Епринцев А.Т., Селиванова Н.В., Федорин Д.Н. (2015) Регуляция активности сукцинатдегидрогеназного комплекса Arabidopsis thaliana L. синим светом. Биологические мембраны, 32(4), 287-292
- Епринцев А.Т., Федорин Д.Н., Карабутова Л.А., Покусина Т.А. (2016) Световая регуляция экспрессии гена sdh2-3 субъединицы в сукцинатдегидрогеназы в листьях кукурузы. Физиология растений, 63(4), 1-7
- Лакин Г.Ф. (1990) Биометрия. М.: Высш. шк., 351
- Carrari F., Nunes-Nesi A., Gibon Y., Lytovchenko A., Loureiro M.E., Fernie A.R. (2003) Reduced expression of aconitase results in an enhanced rate of photosynthesis and marked shifts in carbon partitioning in illuminated leaves of wild species tomato. Plant Physiol, 133, 1322-1335
- Casal J.J., Yanovsky M.J. (2005) Regulation of gene expression by light. Int. J. Dev. Biol., 49, 501-511
- Chomczynski P., Sacchi N. (1987) Singlestep-method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal. Biochem, 162, 156-159
- Eprintsev A.T., Fedorin D.N., Igamberdiev A.U. (2013) Ca2+ is involved in phytochrome A-dependent regulation of the succinate dehydrogenase gene sdh1-2 in Arabidopsis. J Plant Physiol, 170(15), 1349-1352
- Escobar M.A., Franklin K.A., Svensson A.S., Salter M.G., Whitelam G.C., Rasmusson A.G. (2004) Light Regulation of the Arabidopsis Respiratory Chain. Multiple Discrete Photoreceptor Responses Contribute to Induction of Type II NAD(P)H Dehydrogenase Genes. Plant Physiol, 136, 2710-2721
- Popov V.N., Eprintsev A.T., Fedorin D.N., Igamberdiev A.U. (2010) Succinate dehydrogenase in Arabidopsis thaliana is regulated by light via phytochrome A. FEBS Letters, 584(1), 199-202
- Rasmusson A.G., Escobar M. (2007) Light and diurnal regulation of plant respiratory gene expression. Physiologia Plantarum, 129, 57-67
- Regev-Rudzki N., Yogev O., Pines O. (2008) The mitochondrial targeting sequence tilts the balance between mitochondrial and cytosolic dual localization. Journal of Cell Science, 121, 2423-2431
- Tepperman J.M., Hwang Y.S., Quail P.H. (2006) PhyA dominates in transduction of red-light signals to rapidly responding genes at the initiation of Arabidopsis seedling de-etiolation. Plant Journal, 48, 728-742
- Thum K.E., Shin M.J., Palenchar P.M., Kouranov A., Coruzzi G.M. (2004) Genome-wide investigation of light and carbon signaling interactions in Arabidopsis. Genome Biology, 5, 10
- Yang H.Q., Tang R.H., Cashmore A.R. (2001) The signaling mechanism of Arabidopsis CRY1 involves direct interaction with COP1. Plant Cell, 13, 2573-2587
- Zuo Z., Liu H., Liu B., Liu X., Lin C. (2011) Arabidopsis cryptochrome 2 undergoes blue light-dependent interaction with the SPA1-COP1 complex to regulate floral initiation in plants. Curr Biol., 21(10), 841-847


