Регулярные мультимолекулярные сорбенты (РММС). Получение, изучение поверхностных и сорбционных свойств
Автор: Кельциева Ольга Александровна, Гладилович В.Д., Прусаков А.Н., Колоницкий П.Д., Суходолов Н.Г., Селютин А.А., Краснов Н.В., Бонитенко Е.Ю., Подольская Е.П.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Поверхность
Статья в выпуске: 4 т.22, 2012 года.
Бесплатный доступ
Работа посвящена синтезу регулярных мультимолекулярных структур на основе стеаратов железа и определению их сорбционной емкости по отношению к пептиду SSNGHVY рGKLSSI методом высокоэффективной жидкостной хроматографии. Было показано, что полученные структуры обладают высокой сорбционной емкостью и могут быть использованы как сорбенты для металл-аффинной хроматографии применительно к биологическим объектам.
Регулярные мультимолекулярные структуры, стеарат железа, удельная поверхность, металл-аффинные сорбенты, аффинная хроматография
Короткий адрес: https://sciup.org/14264827
IDR: 14264827 | УДК: 543.544.414,
Текст научной статьи Регулярные мультимолекулярные сорбенты (РММС). Получение, изучение поверхностных и сорбционных свойств
В связи с появлением новых высокочувствительных методов анализа белковых соединений в последние годы особое внимание уделяется разработке методик специфичного выделения из сложных образцов фосфорилированных пептидов с помощью металл-аффинных сорбентов. Стоит отметить, что фосфорилирование белков является одним из ключевых регуляторных процессов в организме. Нарушение процесса фосфорилирования через ингибирование или активацию ферментов протеинкиназ может вызывать такие последствия, как злокачественная трансформация, приводящая к онкологическим или метаболическим заболеваниям, таким как диабет. В настоящее время поиск мишеней активации / ингибирования протеинкиназ активно востребован в современной фармакологии при разработке новых лекарственных средств для терапии онкологических и метаболических заболеваний. Было показано, что металл-аффинные сорбенты могут быть использованы при поиске аддуктов белков крови с отравляющими веществами (параоксон, иприт) [1, 2]. Таким образом, металл-аффинная хроматография является высокоспецифичным методом пробоподготовки, который успешно применяется при решении многих протеомных задач для снижения числа маскирующих пептидов в образце.
Однако существующие металл-аффинные сорбенты являются продуктами зарубежного производства, что, во-первых, ставит аналитиков в зависимость от импортной поставки, во-вторых, при- водит к значительному увеличению стоимости процесса анализа в силу высокой закупочной цены. В последние годы появились работы, посвященные синтезу и исследованию новых металл-аффинных сорбентов в лабораторных условиях [3–8], но процессы, описываемые в данных работах, достаточно трудновыполнимы и также требуют значительных финансовых затрат.
В связи с этим становится очевидной необходимость разработки и получения новых материалов, которые по своим структурным особенностям могли бы эффективно выполнять функции металл-аффинных сорбентов.
Пленки Лэнгмюра—Блоджетт [9, 10] или системы, полученные путем диспергирования монослоев жирной кислоты, снятых с поверхности водной субфазы, содержащей соли металлов, представляют собой регулярные мультимолекулярные структуры, в которых поверхность состоит преимущественно из ионов металлов, надежно связанных с поверхностью твердого тела.
Ранее был разработан метод синтеза регулярных мономолекулярных наноструктур на основе стеарата железа (III), и масс-спектрометрически определено, что для них основным структурным звеном является дистеарат железа (III) [11], при образовании которого задействованы только две валентные возможности металла. При этом третий заместитель может быть различным и связь металла с ним слабее, чем с остатками стеариновой кислоты, что позволяет, согласно теории Пирсона, предположить возможность взаимодействия иона железа с фосфорилированными пептидами и соот- ветственно использование данной структуры в качестве металл-аффинного сорбента.
Стоит отметить, что получение регулярных структур по методу Лэнгмюра—Блоджетт обладает рядом преимуществ. Во-первых, он позволяет без значительных экономических затрат воспроизводимо получать молекулярные моно- и мультислои на основе солей стеариновой кислоты. Во-вторых, при его реализации не возникает необходимости использования вакуума, высоких температур и давлений. Кроме того, уникальность метода заключается в возможности послойно увеличивать толщину пленки, формирующейся на твердой поверхности (причем толщина каждого слоя определяется размерами молекулы используемого органического вещества), и строго контролировать структурное совершенство получаемых пленок.
Таким образом, целью данной работы был синтез и охарактеризация в качестве металл-аффин-ных сорбентов регулярных мультимолекулярных структур на основе стеаратов железа (РММС Fe(III)).
МЕТОДИКИ ПОЛУЧЕНИЯ СОРБЕНТА И ИССЛЕДОВАНИЯ
Получение РММС Fe(III)
В специальной ванне на поверхность водной субфазы был нанесен по каплям раствор поверхностно-активного вещества (ПАВ) в подходящем неполярном легколетучем органическом растворителе. Раствор ПАВ растекался по поверхности водной субфазы, образуя монослой, ограниченный бортами ванны и подвижными

А
Б
В
Г
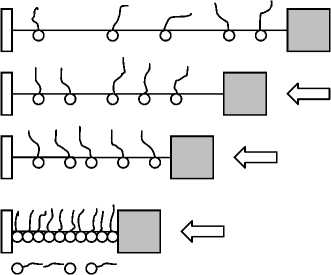
Рис. 1. Фазовые состояния монослоя жирной кислоты при различной степени его сжатия.
А — двумерный газ, Б — изотропная жидкость, В — жидкий кристалл, Г — твердый кристалл, Д — коллапсированная структура барьерами, которые могут регулировать поверхностное давление в образовавшемся монослое. В качестве субфазы использовали 10–4 М водного раствора хлорида железа (III) объемом 1.5 л (для ванны размером 500 × 150 × 20 мм). В качестве ПАВ на субфазу наносили 30 мкл насыщенного раствора стеариновой кислоты (HSt) в гексане. После испарения гексана с поверхности водной субфазы на поверхности образовывался монослой стеариновой кислоты, который после прохождения реакции с ионами субфазы медленно сжимали с помощью подвижных барьеров. При достижении определенного давления монослой коллапсировал (ломался), и отдельные части монослоя наползали друг на друга (рис. 1). Таким образом, были получены многослойные регулярные структуры, состоящие из продуктов взаимодействия стеариновой кислоты с ионами металла субфазы. Полученные частицы собирали с поверхности раствора в микропробирку и в дальнейшем использовали в качестве сорбента.
Определение удельной поверхности сорбента
Удельную поверхность определяли по методу тепловой десорбции аргона (газохроматографическим методом) по стандартной методике [12]. В качестве образцов для проведения эксперимента были выбраны вещества, близкие по строению к структуре сорбента — стеариновая кислота (HSt) и пальмитат алюминия.
Определение сорбционной емкости сорбента
Предварительно взвешенную спиновую колонку (размер пор — 0.45 мкм) заполняли сорбентом, колонку помещали в микропробирку на 1.5 мл и с помощью центрифуги (15 с, 3000 об./мин) отделяли консервирующий раствор (TFA 0.1 %). Далее колонку с сорбентом взвешивали и по разности масс устанавливали массу сорбента. Были приготовлены две порции раствора, содержащего пептид SSNGHVYрGKLSSI в концентрации 20 мг / мл. Одну порцию наносили на сорбент (таким образом, чтобы количество пептида составило 20 % от массы сорбента), вторую часть сохраняли для хроматографического анализа. Колонку инкубировали на качающейся платформе в течение 15 мин. Затем жидкую фазу отделяли с помощью центрифугирования (30 с, 3000 об. / мин). Проскок сохраняли для дальнейшего анализа. Далее наносили на сорбент 100 мкл 5 % раствора аммиака, после чего центрифугировали 30 с при 3000 об./мин. Элюат сохраняли для анализа. Определение количества пептида в образцах проводили с помощью жидкостного хроматографа "Милихром А-02" с исполь- зованием метода внешнего стандарта при следующих характеристиках: колонка Prontosil C18; размер колонки 2 × 120 мм; зерно 5.0 мкм; скорость подачи элюентов 200 мкл / мин; градиент элюции 10–90 % элюента В; длина волны на спектрофотометрическом детекторе 280 нм; объем контрольного образца, взятый на анализ — 3 мкл; объем образца проскока, взятый на анализ — 10 мкл.
В качестве элюентов использовались растворы объемом 200 мл:
-
• А — 0.25 % раствор уксусной кислоты в дистиллированной воде;
-
• В — 0.25 % раствор уксусной кислоты в ацетонитриле.
Приготовленные элюенты фильтровали через фильтр с размером пор 11 мкм во избежание попадания частичек пыли в прибор и выдерживали 20 мин в ультразвуковой ванне для дегазации.
Определение влажности сорбента
В предварительно взвешенную спиновую колонку помещали 30 монослоев сорбента, и с помощью центрифуги (15 с, 3000 об. / мин) отделяли лишнюю жидкость. Затем колонку взвешивали и по разности масс устанавливали массу влажного сорбента. Далее на колонку наносили ацетон в таком количестве, чтобы сорбент был погружен в слой ацетона полностью. С помощью центрифуги (15 с, 5000 об. / мин) ацетон отделяли и колонку с сорбентом выдерживали в вакуумном эксикаторе в течение 30 мин до полного высыхания сорбента. Затем колонку взвешивали и устанавливали массу сухого сорбента.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА
В связи со спецификой металл-аффинного анализа биологических образцов, сорбенты должны соответствовать следующим требованиям:
-
1. ионы металла должны быть доступны для исследуемых молекул;
-
2. ионы металла должны находиться в активной форме;
-
3. ионы металла не должны переходить в раствор вместе с исследуемым веществом.
Эти требования трудно удовлетворимы из-за того, что на поверхности твердого тела металл находится чаще всего в форме оксидов. Однако пленки Лэнгмюра—Блоджетт или системы, полученные путем диспергирования коллапсированных монослоев стеариновой кислоты, снятых с поверхности водной субфазы, содержащей ионы Fe(III), имеют поверхность, которая состоит преимущественно из ионов железа, надежно связанных с поверхностью твердого тела. Ранее было проведено масс-спектрометрическое исследование состава таких пленок и было показано, что основным структурным звеном монослоя является St2Fe+ [11], что позволило сделать предположение о том, что описанные структуры могут являться металл-аффинными сорбентами, а содержание в них железа (III) обусловливает их специфичность к фосфорсодержащим пептидам.
Пептиды можно отнести к макромолекулам. Молекулярные массы пептидов, успешно анализируемых методом MALDI-масс-спектрометрии, варьируются в диапазоне 1000–3000 Да. Можно ожидать, что адсорбция больших органических молекул должна эффективно проходить на поверхности коллапсированных монослоев. Таким образом, регулярные мультимолекулярные структуры (пленки Лэнгмюра—Блоджетт), содержащие железо (III) (РММС Fe(III)), могут соответствовать требованиям, предъявляемым металл-аффинным сорбентам.
ОХАРАКТЕРИЗАЦИЯ СОРБЕНТА
Получение РММС Fe(III)
При образовании монослоя стеариновой кислоты на субфазе происходит гетерофазная реакция взаимодействия ионов Fe3+ со стеарат-ионами. При этом образуются стеараты железа, которые нерастворимы в воде и плохо растворяются в большинстве органических растворителей,
2C 17 H 35 COO-+ FeOH2+ → FeOH(C 17 H 35 COO) 2 .
Таким образом, при взаимодействии монослоев стеариновой кислоты с ионами Fe3+ водной субфазы образуется мономолекулярный слой, который при коллапсировании легко переносится в устройство, используемое как хроматографическая колонка, и применяется в качестве сорбента.
Определение удельной поверхности РММС Fe(III)
В качестве образцов для проведения эксперимента были выбраны вещества, близкие по строению к исследуемому РММС Fe(III) — стеариновая кислота и пальмитат алюминия, т. к. получить значения удельной поверхности для наших структур не представилось возможным из-за необходимости синтеза больших количеств образца на анализ (более 1000 монослоев).
Удельную поверхность исследуемых образцов находили по формуле (1)
S уд = A ⋅ x , (1)
g
Данные хроматографического исследования
|
Образец |
Объем образца, взятого на анализ (мкл) |
Высота хроматографического пика (отн. ед.) |
Полуширина хроматографического пика (мкл) |
Площадь хро-матографиче-ского пика (отн. ед. × мкл) |
Приведенная площадь |
|
Исходный раствор (SSNGHVY р GKLS SI) |
3 |
0.88 |
44.18 |
40 |
133.2 |
|
Проскок с РММС Fe(III) |
10 |
1.29 |
44.91 |
60 |
60 |
где S — удельная поверхность исследуемого образца, м2 / г; А — коэффициент интегратора, равный 0.000085 м2 / ед.; x — величина сигнала десорбции, ед.; g — навеска исследуемого образца:
а также площадь поверхности одной частицы
S 1 = 4 п г 2 . (4)
Удельная поверхность была определена по
HSt
S уд
0.000085 • 2502
0.0871
= 2.44м2/г ,
формуле (5):
0choai 0.000085 • 15422 „ м
S аддя =-------------= 4.02м 2 / г .
уд
S yd =
S 1 m
4 • nr1
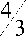
• n r 3 р
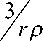
/0.2
= 15м2/г .
Столь малые значения удельной поверхности свидетельствуют об отсутствии пористости. Близкие значения удельной поверхности для различных жирных кислот и солей на их основе позволяют оценить удельную поверхность и для сорбентов на основе стеариновой кислоты, содержащих ионы железа (III).
Рассчитанное значение удельной поверхности имеет немного большее значение, чем найденное экспериментально, что можно объяснить дополнительным ультразвуковым диспергированием монослоя сорбента при подготовке к микроэлек-трофоретическим исследованиям.
Расчет удельной поверхности РММ-сорбента
Размеры частиц сорбента были измерены с помощью анализатора Zetaciser NANO ZC, их радиус составил 200 нм. Это позволяет рассчитать значение удельной поверхности. Предположив, что полученные структуры имеют низкую пористость и форму, близкую к сферической, была рассчитана масса одной частицы:
43 m = π r 3 ρ ,
где ρ — плотность стеарата; r — радиус частицы, мм. Для большинства стеаратов плотность лежит в интервале 1.01–1.08 г / мл.
Было рассчитано число частиц в 1 г
3 3 n= π r 3 ρ , 4
Определение емкости РММС Fe(III)
Сорбционная емкость РММС Fe(III) была определена по разнице концентраций пептида SSNGHVY р GKLSSI в образцах до и после проведения сорбции методом ВЭЖХ (С-18) с помощью хроматографа "Милихром А-02". Данные хроматографического исследования приведены в таблице.
Для подтверждения соответствия пика хроматограммы анализируемому пептиду были получены MALDI-масс-спектры как исходного раствора пептида SSNGHVY р GKLSSI с концентрацией 20 мг/мл, так и образца, содержащего проскок с сорбента (рис. 2).
Как видно из рисунка, с сорбента действительно элюируется пептид SSNGHVY р GKLSSI. Кроме того, стоит отметить, что в обоих масс-спектрах имеется сигнал, соответствующий нефосфорили-рованной форме пептида, причем в масс-спектре проскока его интенсивность значительно выше. Это позволяет сделать выводы, что соотношение

Рис. 2. MALDI-масс-спектры исходного образца (а), содержащего пептид SSNGHVY р GKLSSI и проскока с сорбента РММС Fe(III) (б)
фосфорилированной формы и нефосфолирирован-ной меняется в сторону уменьшения количества фосфорилированного пептида, который задерживается на РММС Fe(III).
По концентрации исходного раствора было определено количество пептида. Величина составила 1.08 мг. На хроматограмме такому количеству пептида соответствует пик с площадью 133.2 отн.ед. × мкл. Площадь пика, соответствующего пептиду в проскоке, равна 60 отн.ед. × мкл. Составив пропорцию, вычислили количество сорбированного образца пептида, равное 0.52 мг, что составило 1.1 масс. % от массы влажного сорбента (54 мг). Влажность сорбента составила 65 масс. %. В пересчете на сухой сорбент (18.9 мг) сорбционная емкость составила 2.75 масс. %. Полученная сорбционная емкость РММС Fe(III) более чем на порядок превышает технические характеристики коммерческого сорбента PHOS-Select Iron Affinity Gel (Sigma) [13].
ЗАКЛЮЧЕНИЕ
Таким образом, в результате работы показано, что созданные РММС Fe(III) обладают высокой сорбционной емкостью. Кроме того, применение методики Лэнгмюра—Блоджетт позволяет с небольшими затратами получать регулярные муль-тимолекулярные структуры, содержащие различные ионы металлов, которые, как и было показано на примере РММС Fe(III), могут быть использованы для металл-аффинной хроматографии применительно к биологическим объектам.


