Регуляторная роль фотооксидазной реакции в работе циклической редокс-цепи интактных хроматофоров пурпурной бактерии Rhodospirillum rubrum
Автор: Гирва М.В., Белевич И.О., Ременников В.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2004 года.
Бесплатный доступ
Установлено, что в аэробных условиях в результате оттока электронов на кислород и в анаэробных условиях в присутствии донора электронов наблюдается ингибирование генерации мембранного потенциала, которое устраняется в первом случае при создании анаэробных условий вследствие добавления субстратов окисления фотооксидазной реакции (сукцината), а во втором ~ при возникновении акцепторов электронов, устраняющих чрезмерное восстановление компонентов циклической редокс-цепи (фумарат, О2, ТеОз^")- Полученные данные иллюстрируют регуляторную роль фотооксидазной реакции в генерации мембранного потенциала, обусловленной работой циклической редокс-цепи клеточных хроматофоров К rubrum.
Короткий адрес: https://sciup.org/147204312
IDR: 147204312 | УДК: 579.222.121
Текст научной статьи Регуляторная роль фотооксидазной реакции в работе циклической редокс-цепи интактных хроматофоров пурпурной бактерии Rhodospirillum rubrum
М. В. Гирева, И. О. Белевич, В. Г. Ременников
Пермский государственный университет, 614990, Пермь, ул. Букирева, 15
Установлено, что в аэробных условиях в результате оттока электронов на кислород и в анаэробных условиях в присутствии донора электронов наблюдается ингибирование генерации мембранного потенциала, которое устраняется в первом случае при создании анаэробных условий вследствие добавления субстратов окисления фотооксидазной реакции (сукцината), а во втором - при возникновении акцепторов электронов, устраняющих чрезмерное восстановление компонентов циклической редокс-цепи (фумарат, О2, ТеО32"). Полученные данные иллюстрируют регуляторную роль фотооксидазной реакции в генерации мембранного потенциала, обусловленной работой циклической редокс-цепи клеточных хроматофоров R rubrum.
Ранее нами было показано (Ежова, Мартыненко, Ременников, 2000; Белевич и др., 2001), что при выращивании R. rubrum на среде с ингибирующими концентрациями яблочной и янтарной кислот энергетический кризис проявляется в подавлении роста культуры. Окисление этих сильно восстановленных соединений происходит в результате фотоиндуцированного переноса электронов на различные акцепторы, например, на исследуемые нами О2, Н2О2, (Белевич и др., 2001), ТеО32" (Белевич и др., 2002).
В качестве акцептора электронов при изучении регуляторной роли фотооксидазной реакции интактных хроматофоров пурпурной бактерии R. rubrum использовали оксианионы теллурита.
Объекты и методы исследований
Объектом исследования служила пурпурная несерная бактерия R. rubrum, чистая культура которой была получена из коллекции кафедры микробиологии МГУ. Культивирование бактерий производили в пробирках с притертой пробкой в анаэробных условиях на свету при 35°С, pH = 6,9 на среде с малатом (Bose et al, 1969) в присутствии дрожжевого экстракта.
Поглощение проникающих анионов тетрафенил-бората (ТБ") измеряли с помощью фосфолипидной (азолектиновой) мембраны, разделяющей два отсека тефлоновой кюветы с раствором. Содержание бактериохлорофилла в клетках определяли спектрофотометрически, используя коэффициент экстинкции in vitro, равный 75 мМ"' см"1 при 770 нм.
Среда инкубации содержала 250 мМ сахарозы, 50 мМ трис-НС1-буфер pH 7,6, 1 мкМ тетрафенил-борат натрия и клетки R. rubrum с бактериохлорофиллом - 14 мкг/мл. Некоторые опыты проводили в анаэробных условиях. Для этого в оба отсека кюветы с раствором, дополненным 30 мМ глюкозой (концентрация сахарозы в этих опытах была снижена до 220 мМ), добавляли каталазу и глюкозо-оксидазу по 0,17 мг/мл, 0,1 мМ ТМФД, 5 мМ трис-аскорбат и заливали вазелиновым маслом (толщина слоя 6-8 мм). Раствор в измерительной кювете перемешивали магнитной мешалкой. Добавки: в аэробных условиях - 5 мМ трис-сукцинат; в анаэробных условиях - 5 мМ трис-фумарат, 1 мМ трис-оксалацетат. Аэрацию производили путем удаления слоя вазелинового масла или добавления 0,1 мМ ТеО32".
Для освещения суспензии хроматофоров обычно использовали свет насыщающей интенсивности с длиной волны больше 660 нм.
Результаты и обсуждение
Для изучения регуляторной функции фотооксидазной реакции использовали клетки R. rubrum, инкубируемые в аэробных и анаэробных условиях с различными донорами и акцепторами электронов. Клетки R. rubrum, инкубируемые аэробно, поглощают анионы тетрафенилбората (ТБ"). Этот процесс, протекающий в темноте, обусловлен поглощением данных анионов по градиенту концентрации и их распределением (коэффициент распределения высокий) между клеткой в гидрофоб-
Анаэробиоз Фумарат О2. ТеСК 2"
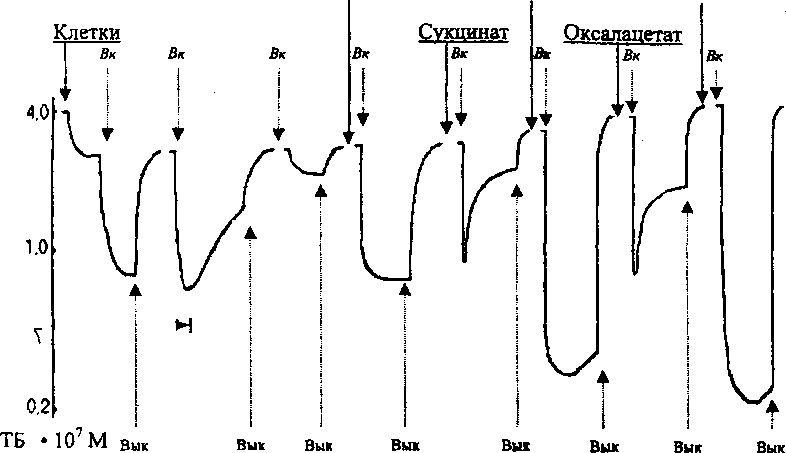
Рис. 1. Фотоиндуцированное поглощение анионов ТБ интактными хроматофорами R. rubrum в аэробных и анаэробных условиях
ной фазе и водной средой. Последующее включение света вызывает дополнительное поглощение анионов клетками против градиента концентрации, что свидетельствует об их переносе из цитоплазмы во внутриклеточные хроматофоры (Ременников, Самуилов, 1979). Снижение концентрации ТБ" в цитоплазме в свою очередь вызывает перенос этих анионов по градиенту концентрации из среды в цитоплазму клетки. Выключение света приводит к восстановлению исходной концентрации ТБ" в среде инкубации.
При длительном освещении клеток, инкубируемых аэробно в отсутствие доноров электронов, наблюдается значительное снижение светового ответа поглощения анионов ТБ". Повторное включение света вызывает дополнительное снижение величины мембранного потенциала, что обусловлено фотооксидазной реакцией, окисляющей компоненты циклической редокс-цепи. Создание анаэробных условий предотвращает спад уровня поглощения ТБ" и восстанавливает его до исходной величины. Данный эффект может быть объяснен восстановлением в анаэробных условиях компонентов циклической цепи за счет эндогенных субстратов. Однако чрезмерное восстановление компонентов циклической редокс-цепи при последующем добавлении в среду инкубации сукцината также вызывает подавление генерации мембранного потенциала (рис. 1). Этот ингибирующий эффект устраняется при добавлении фумарата - акцептора электронов на уровне убихинона. Действие фумарата снимается оксалацетатом - конкурентным ингибитором сукцинатдегидрогеназы. Таким образом, происходит очередное падение уровня поглощения
ТБ", индуцируемое светом.
При добавлении в среду инкубирования другого акцептора электронов - О2 или теллурит-аниона - вызывает максимальное фотоиндуцированное поглощение ионов ТБ".
Полученные данные иллюстрируют регуляторную роль фотооксидазной реакции в генерации мембранного потенциала, обусловленной работой циклической редокс-цепи клеточных хроматофо-ров R rubrum. В аэробных условиях вследствие оттока электронов на кислород и в анаэробных условиях в присутствии донора электронов наблюдается ингибирование генерации мембранного потенциала, которое устраняется в первом случае при создании анаэробных условий в результате добавления субстратов окисления фотооксидазной реакции (сукцината), а во втором - при возникновении акцепторов электронов, которые устраняют чрезмерное восстановление компонентов циклической редокс-цепи (фумарат, О2, ТеО32").
Согласно представлениям Мура и Каплан, при росте пурпурных бактерий в анаэробных условиях на свету и на среде, содержащей сильно восстановленные углеродные соединения, в клетках синтезируется избыточное количество восстановленного НАДН, хинонов и цитохромов, принимающих участие в функционировании циклической цепи. В результате их накопления в клетке нарушается ре-докс-баланс (Moore, Kaplan, 1994), что подавляет работу циклической редокс-цепи как генератора электрохимического протонного градиента. В клетке наступает энергетический кризис, для удаления которого используются механизмы восстановления различных акцепторов электронов (Мо-
Регуляторная роль фотооксидазной реакции в работе циклической редокс-цепи... 109
ore, Kaplan, 1994), среди которых наиболее подходящим по своим физико-химическим характеристикам может быть теллурит. Мнение Мура и Каплан согласуется с результатами наших опытов (рис. 2). Ингибирующее действие на рост культуры R. rubrum оказывает повышение концентрации малата, а также внесение сукцината в среду культивирования в концентрации 15 мМ на фоне 60 мМ малата. Снятие ингибирования происходит при последующем добавлении фумарата - акцептора электронов на уровне убихинонов, но только при повышении концентрации фумарата в среде до 110 мМ. Дальнейшее его увеличение также подавляет рост пурпурных бактерий.
ОП, % Сукцинат

30 60 90 120 150
[Малат], мМ
Рис. 2. Влияние малата, сукцината и фумарата на рост несерной пурпурной бактерии R. rubrum в анаэробных условиях на свету
(100% соответствует 9,3 ед. ОП)
Из этого следует, что вторая фаза ингибирования роста R. rubrum, проявляющаяся при концентрации более 110 мМ малата в среде, обусловлена, вероятно, осмотическим шоком, возникающим при увеличении в среде кислот.
Дальнейшие исследования показали, что ингибирующее действие яблочной кислоты и сукцината снимается при добавлении в среду инкубации теллурита в концентрации от 0,1 мкМ до 100 мкМ (рис. 2). Таким образом, теллурит, выполняя роль акцептора электронов, подобно кислороду, осуществляет регуляцию работы циклической редокс-цепи пурпурных бактерий и тем самым регулирует редокс-баланс клетки.
Следовательно, в меняющихся условиях окружающей среды, фотоиндуцированный нециклический перенос электронов на Ог и Те2О32' является адаптивным механизмом регуляции работы циклической редокс-цепи. Данный процесс можно считать и экологически важным, поскольку идет восстановление теллурита до теллура и осаждение последнего. В этой связи он может быть успешно использован для очистки водоемов от токсичных форм теллура.
Список литературы Регуляторная роль фотооксидазной реакции в работе циклической редокс-цепи интактных хроматофоров пурпурной бактерии Rhodospirillum rubrum
- Белевич И.О., Гирёва М.В., Ременников В.Г., Суворов В.И., Чудинова Л.А. Влияние Ог и Н2О2 на рост пурпурных бактерий на среде с малатом.//Вестник Перм. ун-та. 2001. Вып. 4.Биология. С. 107-120.
- Ежова Л.Е., Мартыненко И.О., Ременников В.Г. Влияние малата на рост пурпурной бактерии Rhodospirillum rubrum. II Вестник Перм. ун-та. 2000. Вып. 2. Биология. С. 143-147.
- Ременников В.Г. Роль кислорода и фотооксидазной реакции в эволюции фотосинтетического аппарата.//Вестник Перм. ун-та. 1997. Вып. 2. Биология. С. 106-110.
- Ременников В.Г, Самуилов В.Д. Нециклический перенос электронов и генерация мембранного потенциала в хроматофррах Rhodospirillum rubrum.//Биол. науки. 1979. № 5. С. 45-52.
- Ременников В.Г., Самуилов В.Д. Генерация мембранного потенциала при функционировании полной и сокращенной систем циклического переноса электронов в хроматофорах Rhodospirillum rubrum. II Биол. науки. 1979. № 10. С. 24-29.
- Moore M.D., Kaplan S. Members of the family Rhodospirillaceae reduce heavy-metal oxyanions to maintain redox poise during photosynthetic growth//ASM News. 1994. Vol. 60, № 1. P. 17-23.


