Регуляторные Т-лимфоциты у больных с новообразованиями желудочно-кишечного тракта
Автор: Курганова Е.В., Тихонова М.А., Егоров Д.Н., Шорохов Р.В., Перфильева И.М., Останин А.А., Черных Е.Р.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (38), 2010 года.
Бесплатный доступ
Проведена оценка субпопуляций регуляторных Т-клеток (Трег) в периферической крови и лимфатических узлах больных раком желудка (РЖ, n=13) и колоректальным раком (КРР, n=10) на различных стадиях заболевания. Установлено, что при РЖ увеличение CD4+CD25+ и CD4+CD25high клеток наблюдалось только в периферической крови. Напротив, пациенты с КРР характеризовались увеличением CD4+CD25+/CD4+CD25high клеток в лимфатических узлах и снижением их в кровотоке. Выявленные изменения были наиболее выражены при поздних стадиях заболевания. Как у больных РЖ, так и у пациентов с КРР наблюдалось увеличение CD4+FOXP3+ клеток в периферической крови и еще в большей степени - в региональных лимфоузлах. Количество CD4+FOXP3+ клеток обратно коррелировало с функциональной (пролиферативной) активностью Т-клеток. Таким образом, при раке желудка и колоректальном раке наблюдаются разнонаправленные изменения субпо- пуляций Трег на системном и локорегиональном уровне, при этом угнетение функциональной активности Т-лимфоцитов ассоциировано только с CD4+FOXP3+ субпопуляцией клеток
Регуляторные т-клетки, рак желудка, колоректальный рак, периферическая кровь, лимфатические узлы
Короткий адрес: https://sciup.org/14055610
IDR: 14055610 | УДК: 616.33/35-006:612.112.94
Текст научной статьи Регуляторные Т-лимфоциты у больных с новообразованиями желудочно-кишечного тракта
Наличие Т-клеточноопосредованной иммуносупрессии при опухолевом росте является хорошо известным фактом, однако четко идентифицировать источник супрессорной активности долгое время не удавалось. Открытие CD4+CD25+ регуляторных Т-клеток (Трег) явилось переломным моментом в истории супрессорных Т-клеток и позволило существенно продвинуться в понимании механизмов Т-клеточной иммуносупрессии при онкопатологии. И хотя впервые Трег были описаны как клетки, способные поддерживать перифериче- скую толерантность к аутоантигенам, впоследствии выяснилось, что эти клетки подавляют также противоопухолевый иммунный ответ, способствуя опухолевой прогрессии [10, 14, 17, 23]. Так, у мышей-опухоленосителей было обнаружено повышенное содержание CD4+CD25+ клеток, а удаление этих лимфоцитов приводило к отторжению опухолевого субстрата [16, 20].
На сегодняшний день выделяют, по меньшей мере, два типа Трег – естественные и индуцированные регуляторные Т-клетки. Первые представлены CD4+ Т-клетками с высокой экс- прессией рецептора к интерлейкину-2 (CD25), имеют тимическое происхождение, анергичны и в культуре in vitro обладают контактзависимым супрессорным эффектом. Вторые – могут быть представлены как CD4+, так и CD8+ Т-клетками, генерируются на периферии при «особых» условиях активации Т-лимфоцитов и реализуют супрессорный эффект через продукцию растворимых факторов. Специфичным маркером Трег является внутриклеточный транскрипционный фактор FOXP3. Экспрессия данного белка определяет способность регуляторных Т-клеток ингибировать промоторную часть генов провос-палительных цитокинов [7, 15].
Увеличение регуляторных Т-лимфоцитов у человека выявлено при многих формах солидных опухолей (рак легкого, яичников, поджелудочной железы и др.) и гемобластозах. Более того, в ряде исследований (при раке яичников, груди и поджелудочной железы) продемонстрирована обратная взаимосвязь количества Трег с выживаемостью пациентов [ 3, 8, 22 ] .
Поэтому целью работы явилась оценка количественного содержания различных субпопуляций Трег в периферической крови и лимфатических узлах больных РЖ и КРР на различных стадиях заболевания.
Материал и методы
В обследование было включено 13 больных
РЖ (включая 1 пациента с I, 3 – со II, 5 – с III и 4 – с IV стадией заболевания) и 10 больных с КРР (2 пациента с I, 1 – со II, 2 – с III и 5 – с IV стадией заболевания). Возраст обследуемых варьировал от 45 до 72 лет (в среднем 59,7 ± 1,6 года). Для иммунологического исследования у больных перед оперативным вмешательством забирали 20 мл периферической крови, во время операции – регионарные лимфатические узлы. Обследование всех пациентов проводилось после получения информированного согласия. Контрольную группу составили 30 здоровых доноров, сопоставимых по возрасту.
Мононуклеарные клетки периферической крови (МНК-ПК) выделяли стандартно путем центрифугирования гепаринизированной венозной крови в градиенте плотности фиколла-верографина. МНК лимфоузлов получали аналогичным способом, наслаивая на градиент плотности клеточную суспензию, полученную путем мягкого механического выдавливания лимфоцитов из фрагментированной ткани лимфоузлов. МНК в концентрации 0,1х106/лунку культивировали в 96-луночных круглодонных планшетах в среде RPMI-1640 (Sigma-Aldrich), дополненной 0,3 мг/мл L-глютамина, 5мМ HEPES-буфера, 100 мкг/мл гентамицина и 10 % инактивированной сыворотки доноров АВ(IY) группы крови при 37ºС в СО2-инкубаторе. Для стимуляции клеток использовали моноклональные анти-CD3 антитела ICO-90 (анти-CD3, «Медбиоспектр», Москва) в концентрации 1 мкг/мл. Интенсивность пролиферации оценивали через 72 ч по включению 3H-тимидина (1 мкКю/лунку), вносимого за 18 ч до окончания культивирования.
Относительное содержание CD4+CD25+ и CD4+CD25high Т-клеток определяли методом проточной цитофлюориметрии на лазерном клеточном сортере-анализаторе FACSCalibur (Becton Dickinson, США) с использованием фикоэретрин (РЕ)-меченных анти-CD4 («Сорбент», Москва) и FITC-меченных анти-CD25 моноклональных антител (BD PharMingen, США). Для оценки экспрессии внутриклеточного транскрипционного белка FOXP3 в CD4+- и в CD8+-Т-лимфоцитах МНК обрабатывали FITC-меченными анти-CD4 или анти-CD8 антителами («Сорбент», Москва). Пермеабилизацию клеток проводили с использованием 0,2 % раствора Твин-20, после чего клетки культивировали 30 мин с PE-меченными анти-FOXP3-антителами (eBioscience, San Diego, США). Образцы анализировали на проточном цитофлюориметре с использованием программы Cellquest. Математическую обработку полученных результатов проводили с использованием программы «Statistica 6.0».
Результаты и обсуждение
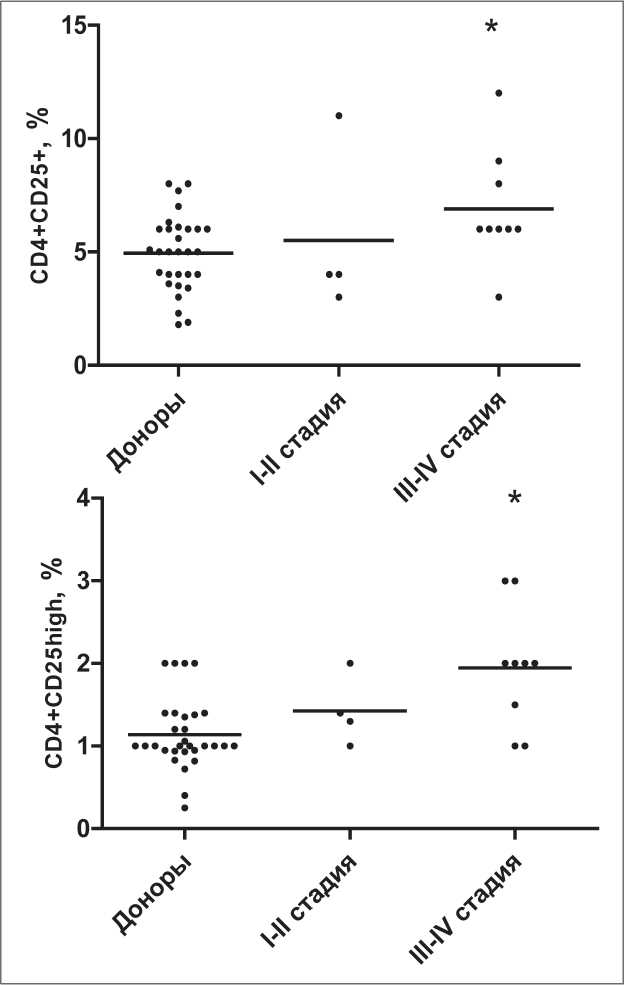
Оценка относительного количества CD4+CD25+ клеток в периферической крови больных РЖ выявила их достоверное увеличение (табл. 1). Учитывая, что у человека супрессорной активностью обладают преимущественно CD4+Т-клетки с высокой экспрессией CD25 молекулы [2], было также проанализировано содержание CD4+CD25high клеток. Доля этих клеток практически в 2 раза превышала донорские значения. Возрастание CD4+CD25+ и CD4+CD25high Т-клеток было обусловлено, главным образом, за счет пациентов с III–IV стадией заболевания (рис. 1), составляющих большую часть исследуемой группы (9 из 13 больных РЖ). В то же время у больных с I–II стадиями (n=4) увеличение Трег было менее выраженным и проявлялось в виде тенденции. Содержание CD4+CD25+ и CD4+CD25high Т-клеток в регионарных лимфоузлах больных РЖ находилось на уровне периферического кровотока здоровых доноров и не различалось в подгруппах пациентов с I–II и III–IV стадиями заболевания (CD4+CD25+ Т-клеток – 5,0 ± 1,7 % и 5,3 ± 0,9 % соответственно; CD4+CD25high Т-клеток – 1,3 ± 0,3 % в обеих подгруппах).
Анализ CD4+FOXP3+ и CD8+FOXP3+ клеток показал (табл. 1), что в целом по группе больные РЖ характеризовались отчетливой тенденцией к увеличению их количества в системном кровотоке. При этом более выраженный прирост CD4+FOXP3+Т-клеток регистрировался у больных с III–IV стадиями (до 4,8 ± 0,9 %, n=9; PU=0,08), тогда как у пациентов c I–II стадиями количество CD4+FOXP3+ клеток находилось на нормальном уровне (3,5 ± 1,0 %, n=4). Содержание CD4+FOXP3+ клеток в региональных лимфоузлах больных РЖ было достоверно выше, чем в периферической крови. Локорегионарное увеличение количества CD4+FOXP3+ Т-клеток выявлялось уже на ранних стадиях РЖ (8,0 ± 2,3 %, n=3), а в подгруппе больных с III–IV стадиями достигало уровня 11,7 ± 2,8 % (n=5). Относительное число CD8+FOXP3+ клеток в периферической крови и лимфоузлах больных РЖ также было повышенным и прямо коррелировало с количеством CD4+FOXP3+ Т-клеток (rS=0,57, p=0,03; n=14 и rS=0,62, p=0,01; n=8 соответственно). В этом случае локорегиональ- ное увеличение CD8+FOXP3+ Т-лимфоцитов отмечалось также у больных с III–IV стадиями РЖ (17,8 ± 7,9 %, n=5) и не выявлялось у пациентов на начальных стадиях заболевания (6,8 ± 4,3 %, n=3).
В группе больных КРР увеличение относительного количества CD4+CD25+ и CD4+CD25high клеток регистрировалось только в регионарных лимфоузлах, тогда как в крови их содержание было достоверно снижено по сравнению с уровнем здоровых доноров (табл. 1). Локорегио-
Вилкоксона–Манна–Уитни, PU<0,05) СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2010. №2 (38)
Таблица 1
Содержание различных субпопуляций Трег в крови и лимфоузлах больных РЖ и КРР
Примечание: ПК – периферическая кровь, ЛУ – лимфатические узлы. * – различия статистически значимы по сравнению с группой здоровых доноров (рU<0,05), # – различия статистически значимы между ПК и ЛУ (рU <0,05, U – критерий Вилкоксона–Манна–Уитни).
Таблица 2
Пролиферативная активность Т-клеток здоровых доноров и больных РЖ и КРР
Примечание: ПК – периферическая кровь, ЛУ – лимфатические узлы. * – различия статистически значимы по сравнению с группой здоровых доноров (рU<0,05), # – различия статистически значимы между ПК и ЛУ (рU <0,05, U – критерий Вилкоксона–Манна–Уитни).
нальное увеличение CD4+CD25+и CD4+CD25high клеток было характерным для больных с III–IV стадиями (7,0 ± 0,9 % и 2,5 ± 0,5 % соответственно; n=5) и не выявлялось у пациентов с начальными стадиями (4,6 ± 1,2 % и 0,8 ± 0,4 % соответственно; n=3). В целом по группе больных КРР относительное количество циркулирующих CD4+FOXP3+ было достоверно повышенным, причем у больных с III–IV стадией (рис. 2) изменение было статистически значимым (5,2 ± 1,0 %; n=6; PU=0,04), а у больных с I–II стадиями проявлялось в виде тенденции (4,3 ± 0,9 %, n=3; PU=0,07). Содержание CD4+FOXP3+Т-клеток в лимфоузлах было еще выше и в 2 раза превышало их уровень в кровотоке. Повышенное количество CD4+FOXP3+ клеток выявлялось как в региональных лимфоузлах больных с I–II, так и с III–IV стадиями (10,0 ± 3,1 %, n=4 и 9,0 ± 2,9 %, n=5). Статистически значимых изменений в популяции CD8+FOXP3+ Трег в группе больных КРР выявлено не было.
Учитывая, что Трег характеризуются супрессорной активностью, на заключитель- ном этапе было проведено сравнительное исследование пролиферативного потенциала Т-лимфоцитов больных РЖ и КРР. Уровень анти-CD3-стимулированного пролиферативного ответа Т-клеток в культурах МНК периферической крови больных был достоверно снижен (табл. 2). При этом интенсивность пролиферации у больных РЖ была наиболее низкой в подгруппе пациентов с III–IV стадиями, характеризующимися наибольшим увеличением CD4+CD25+ и CD4+CD25high Т-клеток (данные не представлены). Кроме того, у больных КРР интенсивность пролиферации МНК обратно коррелировала с количеством CD4+FOXP3+ клеток (rS=-0,58, p=0,03; n=10). Наиболее глубокое угнетение пролиферативного ответа Т-клеток отмечалось в популяции МНК лимфоузлов. Как было показано ранее, лимфоузлы больных РЖ и КРР характеризовались наиболее высоким содержанием CD4+FOXP3+ Т-клеток. Более того, важная роль этих клеток в угнетении пролиферации лимфоцитов подтверждалась наличием достоверной обратной корреляци- онной связи между относительным содержанием CD4+FOXP3+ клеток и интенсивностью пролиферации в общей группе обследованных пациентов (rS = -0,69, p=0,005; n=15).
Полученные нами данные, с одной стороны, однозначно свидетельствуют о возрастании количества регуляторных Т-клеток при онкопатологии желудочно-кишечного тракта, с другой – позволяют сделать заключение о некоторых различиях в характере изменений Трег у больных РЖ и КРР. Так, у больных РЖ значимое возрастание CD4+CD25+ и CD4+CD25high Т-клеток выявлялось только в периферической крови. В то же время у больных КРР увеличение CD4+CD25+ и CD4+CD25high отмечалось в региональных лимфоузлах, а доля этих клеток на периферии была, напротив, снижена. Полученные данные позволяют предполагать, что при КРР естественные Трег мигрируют из периферической крови в лимфатические узлы и что важную роль в этом процессе играет вовлечение лимфоузлов в опухолевый процесс, поскольку наиболее выраженное перераспределение клеток наблюдается у больных c III–IV стадиями заболевания. Миграция Трег в зону опухолевого микроокружения продемонстрирована при раке яичников и поджелудочной железы и обусловлена экспрессией/продукцией опухолевыми клетками молекул, являющихся хемоаттрактантами для Трег. Например, опухолевые клетки при раке яичников экспрессируют CCL22, а при раке поджелудочной железы – ССL5, взаимодействие которых, соответственно, с CCR4 и CCR5 на Трег определяет миграцию последних в опухолевое микроокружение [6, 21]. Другим механизмом накопления Трег в метастатических лимфоузлах при КРР может быть экспансия и генерация этих клеток de novo. Так, известно, что опухолевые клетки при КРР продуцируют простагландин E2, способный индуцировать экспрессию FOXP3 и активировать регуляторные Т-клетки [19, 24]. При РЖ избирательного накопления Трег в дренирующих опухоль лимфоузлах, похоже, не происходит, что может быть связано с особенностями экспрессии хемокинов или других гуморальных факторов опухолевыми клетками. При этом увеличение CD4+CD25+ и CD4+CD25high Т-клеток на периферии сопряжено, по-видимому, с размером опухолевой массы, поскольку отмечается у больных с более распространенными стадиями заболевания.
Изменения CD4+FOXP3+ клеток при РЖ и КРР схожи и проявляются увеличением количества этих клеток в периферической крови и еще в большей степени – в региональных лимфоузлах. Возрастание CD4+FOXP3+ клеток в крови при обеих формах рака выявляется при III–IV стадиях, тогда как высокое содержание в региональных лимфоузлах регистрируется, начиная с I–II стадии, и сравнимо с таковым у пациентов с более распространенным процессом.
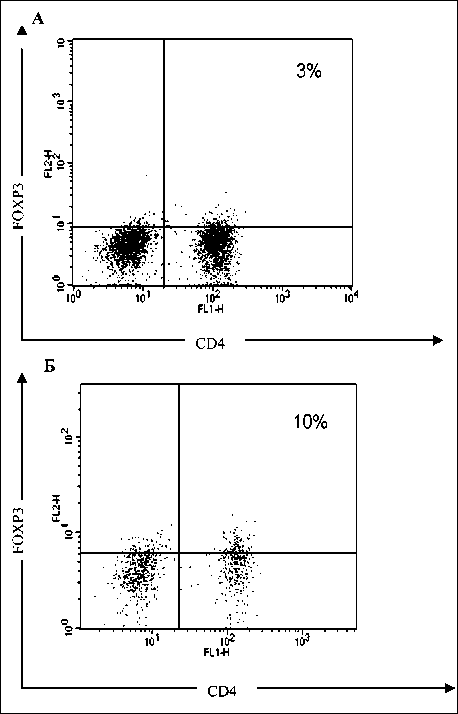
Рис. 2. Содержание CD4+FOXP3+ клеток в периферической крови больных КРР при различных стадиях заболевания. Представлены индивидуальные значения относительного количества CD4+FOXP3+ клеток в периферической крови больных КРР. А – пациент с I стадией, Б – пациент с III стадией КРР. CD4+FOXP3+ определяли методом двуцветной проточной цитометрии, используя FITC-меченные анти-CD4- (FL1-канал) и PE-меченные анти-FOXP3-антитела (FL2-H-канал)
Учитывая, что численность этой субпопуляции находится в обратной корреляционной связи с интенсивностью пролиферации лимфоцитов, можно полагать, что CD4+FOXP3+ клетки играют важную роль в подавлении иммунных реакций в дренирующих опухоль лимфоузлах с самых начальных этапов опухолевого роста, еще до момента метастатического вовлечения региональных лимфоузлов. Следует отметить, что возрастание CD4+FOXP3+ клеток в лимфоузлах при РЖ не сопровождалось увеличением численности CD4+CD25+/CD4+CD25high клеток, а увеличение CD4+FOXP3+ клеток в крови больных КРР ассоциировалось даже с уменьшением доли циркулирующих CD4+CD25+/CD4+CD25high Т-лимфоцитов. В этих случаях количество CD4+FOXP3+ клеток существенно превышало содержание CD4+CD25+ Т-лимфоцитов. Можно полагать, что популяция CD4+FOXP3+ клеток является гетерогенной и включает не только CD4+FOXP3+CD25+ (естественные Трег), но и CD4+FOXP3+CD25- клетки, представляющие, по-видимому, индуцированные Трег. Существование подобной субпопуляции было описано нами в периферической крови больных раком яичников [1]. При таком допущении можно полагать, что при РЖ естественные Трег в большей степени накапливаются в периферической крови, а при КРР – в регионарных лимфоузлах. В свою очередь, возрастание индуцированных Трег при РЖ происходит преимущественно в регионарных лимфоузлах, а при КРР эти клетки накапливаются как в периферической крови, так и лимфоузлах.
Достоверных изменений в субпопуляции CD8+FOXP3+ не было выявлено ни при РЖ, ни при КРР. Тем не менее у больных РЖ отмечалась выраженная тенденция к увеличению данной субпопуляции в периферической крови и лимфоузлах, а у пациентов с КРР – в периферической крови. Численность CD8+FOXP3+ лимфоцитов у больных РЖ достоверно коррелировала с количеством CD4+FOXP3+ клеток в периферической крови. Кроме того, отмечалась довольно выраженная тенденция, указывающая на взаимосвязь между содержанием CD8+FOXP3+ клеток и стадией заболевания (rS=0,53, p=0,1; n=10), что также указывает на возможное вовлечение данной субпопуляции в патогенез опухолевого роста, однако это предположение требует дальнейших исследований.
Полученные нами результаты в целом согласуются с данными большинства авторов о возрастании в периферической крови больных РЖ субпопуляций CD4+CD25+ и CD4+CD25high клеток по мере прогрессии заболевания [ 9, 11, 18 ] . В то же время мы не выявили увеличения данных субпопуляций в периферической крови больных КРР, количество которых, по данным некоторых авторов, также возрастало [12]. Вместе с тем нами впервые исследовано содержание CD4+CD25+ и CD4+CD25high клеток в регионарных лимфоузлах больных КРР и показано их существенное возрастание.
Что касается исследований FOXP3-экспрес-сирующих клеток, выявленные нами факты согласуются с данными других авторов об увеличении CD4+CD25+FOXP3+, CD8+CD25+FOXP3+ клеток в периферической крови [ 4, 5, 24 ] и возрастании FOXP3-экспрессирующих клеток в дренирующих опухоль лимфоузлах при КРР [24]. Более того, нами было показано, что достоверное возрастание FOXP3+-клеток в регионарных лимфоузлах происходит в субпопуляции СD4+ лимфоцитов. Кроме того, нами впервые охарактеризовано содержание CD4+FOXP3+ и CD8+FOXP3+ клеток у больных РЖ. Ранее Y. Mizukami et al. продемонстрировали увеличение общей популяции FOXP3-экспрессирующих клеток в лимфатических узлах и среди опухоль-инфильтрирующих лимфоцитов [ 13 ] . Однако эти данные не позволяли сделать заключение, за счет какой субпопуляции Т-клеток (CD4+ или CD8+) происходило увеличение численности FOXP3+ и каково содержание этих клеток в периферической крови. Полученные нами результаты свидетельствуют, что значимое возрастание FOXP3-экспрессирующих клеток происходит в субпопуляции CD4+ лимфоцитов и увеличение данной субпопуляции наблюдается не только в региональных лимфоузлах, но и в периферической крови больных РЖ.
Наконец, при ответе на вопрос, какая из анализируемых субпопуляций Трег наиболее тесно связана с угнетением функциональной активности Т-клеток, нами впервые показано, что наиболее выраженное угнетение пролиферативного ответа лимфоцитов коррелирует с численностью CD4+FOXP3+ клеток и наблюдается в популяции МНК региональных лимфоузлов.


