Реконструкция дефектов покровных тканей методом транспозиции локо-регионарных перфорантных островковых лоскутов
Автор: Воротников Александр Анатольевич, Румянцев Дмитрий Олегович, Айрапетов Георгий Александрович, Душин Руслан Владимирович, Шиндин Анатолий Николаевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.28, 2022 года.
Бесплатный доступ
Введение. Лечение длительно незаживающих ран с наличием глубоких посттравматических дефектов покровных тканей является актуальной проблемой на стыке травматологии и реконструктивной хирургии. Цель. Повышение качества лечения больных с хроническими дефектами мягких тканей конечностей. Анализ эффективности реконструкции дефектов нижних конечностей методом транспозиции локальных перфорантных лоскутов, а также обоснование предпочтительного применения keystone-лоскута послужили задачами для реализации указанной цели. Материалы и методы. В исследование включено 48 пациентов с посттравматическими и остеомиелитическими дефектами мягких тканей нижних конечностей. Пациенты разделены на 2 группы. В исследуемой группе применен метод лечения с использованием регионарных перфорантных кожно-фасциальных лоскутов, как одномоментно с остеонекрэктомией, так и в качестве последовательного этапа. (22 пациента). В группе сравнения (26 пациентов) применена традиционная тактика лечения посттравматических и остеомиелитических дефектов, заключающаяся в местном лечении раны, этапных остеонекрэктомиях с последующей аутодермопластикой. Результаты. Применение метода транспозиции локо-регионарных перфорантных лоскутов снизило частоту развития вторичного некроза на 33,7 %, среднее количество этапных операций - в 2 раза. В 72,7 % случаев реконструктивная задача в исследуемой группе была осуществлена в один этап. Также отмечено уменьшение длительности стационарного лечения в среднем на 30 койко-дней. Обсуждение. Уменьшение сроков лечения в исследуемой группе объясняется исключением либо значительным сокращением этапа местного лечения раны; кроме того, снижается частота осложнений в виде вторичного некроза глубоко лежащих тканей, требующих дополнительных этапов и сроков лечения. Выводы. Реконструкция остеомиелитических дефектов методом транспозиции локо-регионарных перфорантных лоскутов позволяет уменьшить частоту осложнений и улучшить функциональные результаты лечения пациентов с посттравматическими и остеомиелитическими дефектами мягких тканей нижних конечностей.
Мягкие ткани конечностей, дефекты, посттравматические, остеомиелитические, перфорантные лоскуты, хронический остеомиелит, длительно незаживающие раны
Короткий адрес: https://sciup.org/142235732
IDR: 142235732 | УДК: 616-001.4-039.22-089.844 | DOI: 10.18019/1028-4427-2022-28-4-538-545
Текст научной статьи Реконструкция дефектов покровных тканей методом транспозиции локо-регионарных перфорантных островковых лоскутов
В настоящее время ортопедическая хирургия достигла значительных высот своего развития. Тем не менее, в этой области медицинских знаний сохраняются проблемы, не теряющие своей актуальности. Одним из комплексных вопросов является раздел осложненной травмы и, в частности, лечение длительно незаживающих ран с наличием глубоких посттравматических дефектов покровных тканей.
Весомым фактором формирования посттравматических дефектов кожи является хронический остеомиелит. Лечение его представляет не только медицинскую, но и социально-экономическую проблему, поскольку до 78 % больных составляют лица трудоспособного возраста (от 20 до 50 лет), именно среди них отмечается наиболее высокий процент выхода на инвалидность (более 70 %) [1–4].
Актуальность проблемы закрытия мягкотканных дефектов при хроническом остеомиелите конечностей имеет высокую степень [5–10]. При хроническом остеомиелите на фоне трофических расстройств нередко образуются и длительно существуют глубокие дефекты покровных тканей. Дефект кожи как при первоначальной травме, так и при замедленном заживлении послеоперационной раны неизбежно приводит к высыханию подлежащей кости (либо сухожилия), а в дальнейшем – к некрозу, а значит, и к вторичным дефектам [11].
Традиционным подходом в лечении подобных дефектов является открытое ведение раны с последующим вторичным заживлением. Результатом нередко бывает формирование грубых рубцов, персистирование хронической раневой инфекции с последующим обострением, значительное ограничение возможности повторных операций в зоне замещенного дефекта, приводящих к ещё большему усугублению рубцового процесса.
Замещение посттравматических дефектов мягких тканей с помощью традиционных методов не всегда даёт желаемые результаты. Особую значимость представляет локализация их в анатомо-функциональных нагружаемых и иных проблемных зонах. Для закрытия подобных дефектов необходимо использовать хорошо васкуляризированные ткани [12–19]. Свободно пересаженные тканевые комплексы с наложением микроанастомозов закономерно обладают лучшим кровоснабжением [7, 10, 20–22]. Однако при их использовании имеется определенный риск – тромбоз анастомозов, и требуется наличие специально организованной микрохирургической службы.
В то же время, микрохирургическая техника позволяет формировать комплексы тканей на перфорантных сосудах и путём транспозиции замещать остеомиелитические дефекты, не прибегая к наложению микроанастомозов [13, 14, 16–18, 23]. Данный способ позволяет закрывать дефекты покровных тканей с меньшими затратами и меньшими рисками, что увеличивает эффективность лечения. При такой тактике местное лечение раны рассматривается как подготовительный этап перед транспозицией лоскута [24].
Для реализации задач по замещению дефектов мягких тканей требуется использование комплексов тканей, максимально соответствующих анатомически и функционально утраченным вследствие повреждения. Достижение максимальной клинической результативности обеспечивает использование ткани из соседних с дефектом участков, которые обладают сходными свойствами с окружающими дефект покровными структурами.
Этому в большей степени соответствует способ транспозиции локальных перфорантных лоскутов. Данный метод основан на принципе использования хорошо васкуляризированных тканевых комплексов с первичным заживлением послеоперационной раны.
Однако при несомненных преимуществах имеется ряд вопросов теоретического и практического характера, решение которых будет способствовать улучшению анатомо-функциональных исходов лечения этого сложного контингента больных.
Мы провели анализ эффективности реконструкции посттравматических и остеомиелитических дефектов методом транспозиции локальных перфорантных лоскутов для определения преимуществ данного метода перед традиционным местным лечением ран с применением этапных некрэктомий и аутодермопластики, а также обоснования предпочтительного применения кейстон-лоскута.
Целью работы является определение оптимального способа формирования локо-регионарных лоскутов для пластической реконструкции хронических посттравматических дефектов мягких тканей нижних конечностей, что позволит улучшить результаты лечения больных.
Благодаря современным исследованиям и развитию практики, в настоящее время перфорантные лоскуты нижней конечности условно можно разделить в соответствии с бассейном кровоснабжения на исходящие из перфорантов передней и задней большеберцовых артерий, малоберцовой артерии, а также на исходящие из медиальной суральной артерии и модифицированный перфорантный латеральный лоскут бедра на реверсированном кровотоке. [26]. Суральный лоскут с дистальным основанием является кожно-фасциальным лоскутом с ретроградным кровотоком, основанным на артериальной сети, окружающей суральный нерв и исходящей из поверхностной суральной артерии и малоберцовой артерии. Поверхностная суральная артерия происходит из подколенной или из общей суральной артерии. Артерия анастомозирует с постоянной сетью мышечно-кожных перфорантных ветвей малоберцовой артерии [28].
Использование лоскутов на перфорантных сосудах не компрометирует основные сосудистые магистрали нижней конечности, так как не изменяет кровоснабжение ее дистальных зон. Хирургическая техника при их использовании требует меньше операционного времени, технического дорогостоящего обеспечения в сравнении со свободной пересадкой комплексов тканей с формированием микроанастомозов. При этом очевидна меньшая хирургическая агрессия в зоне донорских участков [26].
Выделяют 5 основных видов дизайна перфорантных лоскутов: лоскуты-пропеллеры, полуостровковые лоскуты (peninsular), скользящие лоскуты, лоскуты, имеющие проксимальное и дистальное основание [27].
Среди локальных перфорантных лоскутов представляют интерес методики, которые достаточно эффективно можно применять для закрытия мягкотканных дефектов с минимальным риском осложнений. Одна из таких методик была предложена в 1995 г. и названа автором «keystone island flap». Данная концепция была разработана F. Behan et al. [29], которые в процессе анатомических и клинических исследований до- казали, что аксиллярные перфорантные артерии имеют собственные микроскопические венозные, нейроваскулярные и артериальные сплетения, тесно связанные между собой. Использование этих данных в практике, в сочетании с ангиосомной теорией Taylor, позволяет значительно улучшить питание участков покровных тканей, окружающих дефект в реципиентной зоне, и, следовательно, существенно увеличить площадь формируемого регионального островкового лоскута для его транспозиции.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 48 пациентов с посттравматическими и остеомиелитическими дефектами мягких тканей, находившихся на лечении в отделении в период с 2015 по 2019 г., среди них 40 мужчин и 8 женщин. Средний возраст пациентов составил 49,9 года. Характер распределения пациентов по возрасту, социальному положению, срокам болезни и количеству этапных операций до поступления в клинику представлен в таблице 1.
Таблица 1
Распределение пациентов по клинико-анамнестическим параметрам
|
Клинико-анамнестические параметры |
Количество пациентов |
||
|
абс. |
% |
||
|
Возраст, лет |
18–35 |
9 |
18,8 |
|
36–60 |
27 |
56,3 |
|
|
61–80 |
12 |
25 |
|
|
> 80 |
– |
– |
|
|
Социальное положение |
рабочий |
20 |
41,6 |
|
учащийся |
1 |
2,1 |
|
|
с/х работник |
2 |
4,2 |
|
|
инвалид |
21 |
43,8 |
|
|
прочее |
4 |
8,3 |
|
|
Сроки болезни, мес. |
1–3 |
11 |
22,9 |
|
3–6 |
10 |
20,8 |
|
|
6–12 |
10 |
20,8 |
|
|
> 12 |
17 |
35,4 |
|
|
Количество предыдущих операций |
одна |
2 |
4,2 |
|
две |
19 |
39,6 |
|
|
три |
14 |
29,1 |
|
|
> трёх |
13 |
27,1 |
|
|
Всего: |
48 |
100 |
|
Дефекты покровных тканей нижних конечностей являлись как сопутствующими компонентами открытых переломов, осложненных глубокой раневой инфекцией в раннем посттравматическом периоде, так и длительно незаживающими язвами на фоне хронического остеомиелита. При этом у 22 пациентов открытые переломы костей голени сопровождались повреждением покровных тканей в зоне перелома, у 26 пациентов язвы голени были следствием неоднократного обострения хронического остеомиелитического процесса и многих хирургических реконструктивных вмешательств на предыдущих этапах (рис. 1).
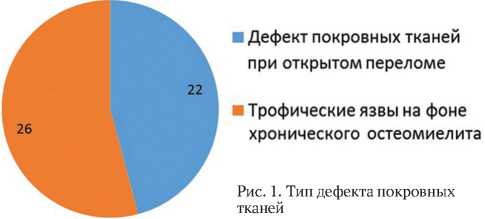
Рис. 1. Тип дефекта покровных тканей
■ Дефект покровных тканей при открытом переломе
■ Трофические язвы на фоне хронического остеомиелита
В исследовании пациенты были условно разделены на 2 группы. В первую (группа сравнения) вошли 26 пациентов, в лечении которых применена традиционная тактика, заключающаяся в этапных санационных остеонекрэктомиях, использовании мазевых повязок и вакуумной системы до созревания грануляций с последующей аутодермопластикой расщепленным кожным аутотрансплантатом. Костно-пластические операции в зоне дефекта выполняли после полной эпителизации в зоне аутодермопластики, предпочтительно вне пределов кожного трансплантата.
Во вторую, исследуемую группу включены 22 пациента, у которых для замещения дефектов кожи были применены регионарные перфорантные кожно-фасциальные лоскуты. Последние формировали как одномоментно с остеонекрэктомией, так и в качестве отдельного этапа. Из них 10 пациентам выполнена пластика дефекта кожи суральным лоскутом, 12 пациентам для замещения дефектов использован метод пространственного перераспределения тканей с формированием локального перфорантного кейстон-лоскута.
Для статистической обработки данных использовался лицензированный пакет анализа R (версия 3.2, R Foundation for Statistical Computing, Vienna, Austria).
Проверка данных на нормальность распределения была выполнена с помощью теста Колмогорова-Смирнова. В качестве описательных статистик для количественных показателей посчитаны средние ± средние квадратичные отклонения; медиана и квартили; минимальные и максимальные значения в выборке. Для качественных показателей посчитаны частоты встречаемости и построены их диаграммы.
Сравнение средних уровней в группах проводилось с помощью теста Манна-Уитни, частот – с помощью точного теста Фишера. Различия признавались статистически значимыми на уровне р < 0,05.
Показанием для указанных операций являлось наличие длительно незаживающих ран с наличием дефектов покровных тканей на фоне хронического остеомиелита и посттравматических дефектов.
Согласно исследованию Невёдрова А.В., небольшими раневыми дефектами в области голени, которые возможно заместить методом применения локо-реги-ональных лоскутов, являются раны, когда их протяженность меньше ширины кисти на уровне головок пястных костей, а площадь – менее половины площади ладонной поверхности кисти пациента. Обширные дефекты, протяженность которых больше ширины кисти и площадь более половины площади ладонной поверхности кисти пациента или 0,5 % площади поверхности тела, возможно закрыть только с помощью свободных реваскуляризированных лоскутов [31].
Помимо декомпенсированной соматической патологии и обширных размеров дефекта противопоказа- нием для данного способа замещения дефектов является резкое снижение периферического кровотока на фоне сосудистой патологии различного генеза, характеризующееся отсутствием эхо-сигнала магистральных артерий в зоне дефекта.
Предоперационная подготовка заключалась в стандартном общеклиническом обследовании и оценке локального сосудистого статуса с помощью портативного аудио-допплера с датчиком 8 МГц Минидоп-8 («Биосс»). Эхо-сигнал магистральных артерий определяли на уровне голеностопного сустава (для задней большеберцовой и малоберцовой артерий) и тыла стопы (тыльная артерия стопы). Все операции выполнялись под спинномозговой анестезией. Для разметки точек выхода перфорантных сосудов с целью планирования дизайна лоскута также использовался аудио-допплер. Форму и размеры лоскута выкраивали по размерам дефекта с запасом 0,5 см по каждому измерению с целью компенсации ретракции тканей после формирования лоскута.
Техника выкраивания кожно-фасциальных лоскутов основана на концепции включения в их состав перфорантных артерий, исходящих из магистральных сосудов. В частности, для сурального лоскута питающей артерией является суральная артерия, анастомозирующая с малоберцовой артерией через систему перфорантов, дистальный из которых расположен приблизительно на 6–8 см проксимальнее нижнего края наружной лодыжки. В состав кейстон-лоскута входит несколько перфорантов, расположенных вдоль оси магистрального сосуда. Поэтому способы выкраивания указанных лоскутов существенно различаются.
В первые 72 часа после операции с использованием сурального лоскута оперированной конечности придавали возвышенное положение на шине Белера для уменьшения риска развития декомпенсации венозного оттока из тканей лоскута. При расположении дефектов вблизи суставов использовалась гипсовая иммобилизация. Всем пациентам в послеоперационном периоде на фоне адекватного обезболивания назначалась вазоактивная терапия с использованием сулодексида 2,0 внутримышечно 1 раз в сутки на 10 дней, супрастина 2,0 внутримышечно 1 раз в сутки на 5 дней, пентоксифиллина 5,0 на 250,0 физиологического раствора на 10 дней, при отсутствии противопоказаний и аллергических реакций. Пациентам назначалось физиолечение (УВЧ, магнитотерапия), при необходимости – сеансы гипербарической оксигенации в первые 5 дней. Средний койко-день до операции составил 5, после операции – 14 суток. На амбулаторном этапе пациенты продолжали наблюдаться в течение 3-х месяцев, с регулярным осмотром каждые 3 недели.
РЕЗУЛЬТАТЫ
В раннем послеоперационном периоде (до снятия швов) результаты лечения оценивались по следующим показателям: характер и качество заживления раны, степень приживления лоскута (наличие и величина некроза). В исследуемой группе у 16 пациентов имело место полное приживление лоскутов с первичным заживлением послеоперационных ран. При транспозиции сурального лоскута у 1-го пациента имелись участки вторичного краевого некроза, у 3-х пациентов наблюдался тотальный некроз лоскута. В случае применения кейстон-лоскута у 2 пациентов наблюдался тотальный некроз перемещенных тканей (табл. 2).
В отдаленном периоде оценка проводилась по следующим критериям:
– жизнеспособность пересаженных трансплантатов;
– окончательный функциональный результат.
Жизнеспособность лоскутов субъективно оценивали клинически по цвету кожного покрова, температуре, капиллярной реакции и объективно - с помощью допплерографии.
У пациентов с прижившимися лоскутами их жизнеспособность полностью совпадала с соответствующими характеристиками окружающих тканей. По данным допплеровского исследования кровоток в лоскутах не отличался от кровотока в тканях здоровой конечности. Эластичность лоскута при пальпаторном исследовании, в сравнении с окружающей кожей, была незначительно снижена, а в нескольких случаях избыточна при использовании сурального лоскута и практически не была изменена при использовании кейстон-лоскута.
Окончательный функциональный результат (в период от 6 до 12 месяцев после оперативного лечения) оценивался по степени восстановления функции конечности и рассматривался как хороший, удовлетворительный и неудовлетворительный. Хороший функциональный результат заключался в полном восстановлении активной функции пораженной конечности. Если восстановление функции нельзя было рассматривать как полное, но удовлетворяло пациента, то результат расценивался как удовлетворительный. При отсутствии восстановления функции конечности результат считался неудовлетворительным.
В 89,5 % случаев наблюдался хороший результат, в 7,9 % – удовлетворительный, что свидетельствует о высокой эффективности указанных способов пластики остеомиелитических дефектов.
Таблица 2
Оценка результатов лечения в раннем послеоперационном периоде в исследуемой группе
|
Характер заживления раны |
Суральный лоскут |
Кейстон-лоскут |
Всего |
|||
|
абс. |
% |
абс. |
% |
абс. |
% |
|
|
Первичное заживление |
6 |
27,3 |
10 |
45,5 |
16 |
72,8 |
|
Формирование краевого некроза |
1 |
4,5 |
– |
1 |
4,5 |
|
|
Формирование тотального некроза лоскута (> ½ площади) |
3 |
13,6 |
2 |
9,1 |
5 |
22,7 |
Перемещенные кожно-фасциальные лоскуты являются источником кровоснабжения для подлежащих поврежденных структур, чем значительно снижают частоту развития вторичной раневой инфекции. Это объясняется тем, что восстановление покрова над поврежденной областью идет по типу первичного заживления, минуя фазу экссудации. Кроме того, такой лоскут защищает подлежащие структуры от повторной контаминации микроорганизмами. Отсутствие высыхания глубоких структур, как при местном лечении раны, снижает вероятность их некроза и развития гнойных осложнений.
Частота развития вторичного некроза в исследуемой группе составила 27,3 % (в группе сравнения – 61 %).
Среднее количество этапных операций в исследуемой группе сравнения составило 1,45, в группе сравнения – 3,1. В 72,7 % случаев реконструктивная задача в исследуемой группе была осуществлена в один этап. Длительность стационарного лечения составила в группе сравнения 59,1 койко-дня, в исследуемой группе – 29,1 койко-дня (табл. 3).
Для всех количественных показателей зафиксировано статистически значимое отличие от нормального закона распределения (тест Колмогорова-Смирнова, табл. 4).
Сравнение количественных показателей в группах позволило выявить значимые различия по двум из них: "Количество этапных операций" и "Длительность стационарного лечения" (табл. 6).
В группе сравнения наблюдались повышенные значения "Количество этапных операций" и "Длительность стационарного лечения" по сравнению с исследуемой группой.
Сравнение частот встречаемости признаков позволило выявить значимые различия по одному из них: "Развитие вторичного некроза" (табл. 7).
В группе сравнения наблюдались повышенные частоты обнаружения "Развитие вторичного некроза" по сравнению с исследуемой группой.
Таблица 3
Оценка результатов лечения в обеих группах
|
Параметры оценки результатов |
Группа сравнения |
Исследуемая группа |
|
Среднее количество этапных операций |
3,1 |
1,45 |
|
Частота развития вторичного некроза, % |
61 |
27,3 |
|
Длительность стационарного лечения, койко-дни |
59,1 |
29,1 |
Таблица 4
Описательные статистики количественных показателей
|
Показатель |
Среднее значение ± СКО |
Медиана |
Квартили |
min |
max |
p (тест Колмогорова-Смирнова) |
|
Группа сравнения |
||||||
|
Количество этапных операций |
3,12 ± 2,1 |
2 |
[2; 3] |
1 |
9 |
< 0,001 |
|
Длительность стационарного лечения, койко-дни |
59,1 ± 40,9 |
44 |
[30; 68] |
12 |
153 |
< 0,001 |
|
Исследуемая группа |
||||||
|
Количество этапных операций |
1,45 ± 0,96 |
1 |
[1; 2] |
1 |
5 |
< 0,001 |
|
Длительность стационарного лечения, койко-дни |
29,3 ± 19,7 |
20,5 |
[20; 30] |
16 |
98 |
< 0,001 |
Таблица 5
Описательные статистики качественных показателей
|
Развитие вторичного некроза |
Число наблюдений, n |
Частота, % |
Всего наблюдений, n |
|
|
Группа сравнения |
– |
10 |
38,5 |
26 |
|
+ |
16 |
61,5 |
||
|
Исследуемая группа |
– |
16 |
72,7 |
22 |
|
+ |
6 |
27,3 |
||
Таблица 6
Сравнение средних уровней количественных показателей в группах с помощью теста Манна-Уитни
|
Группа сравнения, n = 26 |
Исследуемая группа, n = 22 |
p |
|
|
Количество этапных операций |
3,12 ± 2,1 |
1,45 ± 0,96 |
< 0,001 |
|
Длительность стационарного лечения, койко-дни |
59,1 ± 40,9 |
29,3 ± 19,7 |
< 0,001 |
Примечание: в таблице средние значения представлены в виде среднее ± стандартное отклонение.
Сравнение частот качественных показателей в группах с помощью точного теста Фишера
Таблица 7
|
Развитие вторичного некроза |
Группа сравнения, n = 26 |
Исследуемая группа, n = 22 |
p |
|
– |
10 (38 %) |
16 (73 %) |
0,023 |
|
+ |
16 (62 %) |
6 (27 %) |
Примечание: в таблице встречаемость представлена в виде частот.
Клинические наблюдения
Пациент Р., 39 лет, поступил на лечение с диагнозом: трофическая язва нижней трети правой голени с дефектом кожи; выраженная рубцовая посттравматическая контрактура правого голеностопного сустава и суставов предплюсны правой стопы. В 2012 г. пациент получил открытый перелом костей среднего отдела правой стопы и нижней трети правой голени, обширное размозжение мягких тканей в нижней трети правой голени. После трёх этапных операций в нижней трети голени по передней поверхности сформировалась трофическая язва с дефектом кожи, которая длительно не заживала. В один этап была выполнена некрэктомия с иссечением рубцово-измененного участка сухожилия передней большеберцовой мышцы (рис. 2), пластика дефекта кожи передней поверхности нижней трети правой голени островковым кожно-фасциальным суральным лоскутом на дистальной сосудистой ножке (рис. 3, 4). Предварительно выполнена разметка выхода перфорантов малоберцовой артерии с помощью портативного аудио-допплера с датчиком 8 МГц, что позволило определить уровень точки ротации лоскута и прецизионно выделить питающую ножку. Послеоперационная рана зажила первично, пациент был выписан на амбу- латорное наблюдение через 13 дней после операции. В позднем послеоперационном периоде приживление лоскута полное, дефект замещен, что позволило добиться стойкого выздоровления (рис. 5.)
Пациентка С., 45 лет, поступила на лечение с диагнозом: инфицированная рана н/3 правой голени с дефектом кожи. За 3 месяца до поступления была укушена собакой, после чего сформировалась длительно незаживающая рана в проекции ахиллова сухожилия (рис. 6). В один этап, под спинномозговой анестезией, пациентке была выполнена некрэктомия кожи и мягких тканей с поверхностным иссечением нежизнеспособных участков ахиллова сухожилия, сформирован кожно-фасциальный кейстон-лоскут на перфорантах по типу островкового, перемещён в зону дефекта и подшит к краям раны. Дефект кожи был замещён полностью (рис. 7). Послеоперационная рана зажила первично, пациентка выписана из стационара через 14 дней после операции. Через 3 месяца после операции такие характеристики кожного покрова перемещенного лоскута как цвет, температура и чувствительность были идентичны аналогичным характеристикам окружающих дефект тканей (рис. 8). Продолжительность пребывания в стационаре составила 21 день.
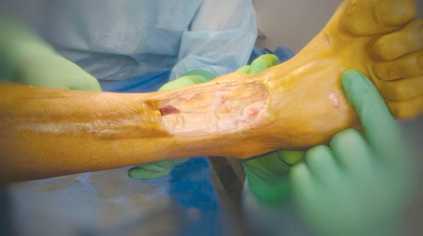
Рис. 2. Дефект кожи и мягких тканей по передней поверхности н/3 правой голени после некрэктомии
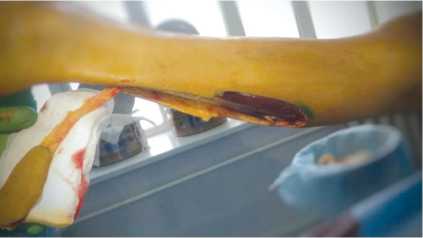
Рис. 3. Сформирован кожно-фасциальный островковый суральный лоскут на дистальном основании
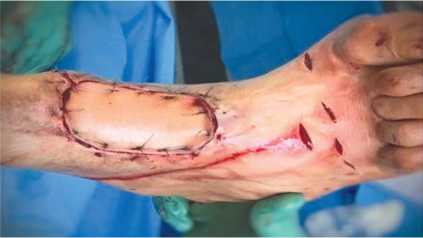
Рис. 4. Дефект кожи по передней поверхности н/3 голени полностью замещен суральным лоскутом
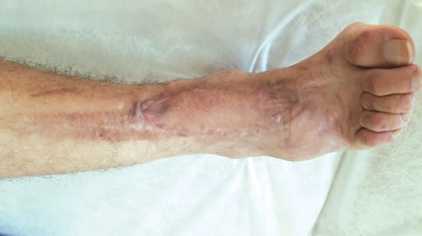
Рис. 5. Результат хирургического лечения через 3 месяца
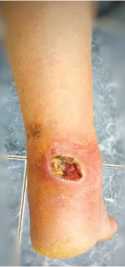
Рис. 6. Длительно незаживающая инфицированная рана в проекции ахиллова сухожилия с его поражением
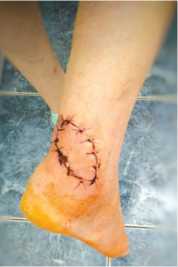
Рис. 7. Замещение дефекта кожи в проекции ахиллова сухожилия keystone-лоскутом
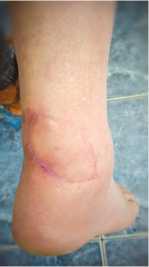
Рис. 8. Результат хирургического лечения через 3 месяца
ОБСУЖДЕНИЕ
На наш взгляд, полный некроз сурального лоскута у 3-х пациентов исследуемой группы был вызван венозной недостаточностью лоскута, так как отток венозной крови происходит против венозных клапанов. Риск развития подобных осложнений связан с патологией венозной системы (варикозное расширение вен, тромбофлебиты в анамнезе). Поэтому для уменьшения вероятности подобных осложнений следует более тщательно проводить предоперационное обследование, особенно у лиц старше 50 лет. Также для профилактики некроза мы предлагаем включать в состав ножки лоскута, по крайней мере, одну подкожную вену.
Уменьшение сроков лечения в исследуемой группе объясняется исключением либо значительным сокращением этапа местного лечения раны; кроме того, снижается частота осложнений в виде вторичного некроза глубоко лежащих тканей, требующих дополнительных этапов и сроков лечения.
Восстановление покровных структур – неотъемлемый компонент стойкого купирования гнойного процесса. Если этап восстановления покровных тканей не завершён или решён не полностью, то это заведомо приводит к усугублению хронической раневой инфекции, развитию стойкой резистентной микрофлоры, гибели участков кости и нарушению консолидации переломов в случае свежей травмы [4].
Для лечения пациентов с хроническим остеомиелитом и наличием дефекта кожи и мягких тканей традиционно используется многоэтапная тактика местного лечения раны с последующим выполнением аутодермопластики после заполнения дефекта грануляционной тканью [32]. К преимуществам данного подхода следует отнести:
-
1) безопасность для пациента за счет меньшей травматичности, несложных реконструктивных вмешательств;
-
2) техническая простота для врача, так как не требуется специальных навыков по транспозиции кровоснабжаемых комплексов тканей;
-
3) не требуется специального инструментария и оборудования.
Среди существенных недостатков традиционной тактики местного лечения ран можно выделить следующие:
-
1) длительность восстановления покровных тканей. При обнажении кости либо сухожилия срок заполнения раневой полости грануляциями, достаточный для последующего этапа, может достигать нескольких месяцев;
-
2) при использовании способа местного лечения раны восстановленный кожный покров неполноценен. В частности, он не может выдерживать адекватную нагрузку на опорной поверхности стопы или культи нижней конечности независимо от уровня;
-
3) повторные реконструктивные операции значительно ограничены ввиду неполноценного заживления разрезов и формирования ещё более грубых вторичных рубцов;
-
4) при неизбежных повторных некрэктомиях удаляются дополнительные участки обнаженных костей и сухожилий, дефект этих тканей значительно превышает первоначальный, полученный при травме.
Особенности закрытия дефектов мягких тканей путём транспозиции локо-регионарных перфорантных островковых лоскутов следующие:
-
1) технология позволяет восстановить в максимально короткий срок полноценный покров в зоне дефекта;
-
2) требует наличия специальных навыков у хирурга и микрохирургического инструментария (исключая формирование микроанастомозов);
-
3) оперативные вмешательства такого рода сопровождаются большей кровопотерей и могут быть длительными. Тем не менее, предотвращение развития вторичных некрозов и, соответственно, устранение рисков сохранения очагов глубокой раневой инфекции в зоне дефекта существенно сокращает общий срок лечения, что имеет экономическую выгоду для ЛПУ;
-
4) в большинстве случаев требуется индивидуальный подход в выборе способа решения реконструктивной задачи, алгоритмизация данного процесса затруднена;
-
5) перемещение кожно-фасциальных лоскутов восстанавливает полноценный покров в зоне раневого или язвенного дефекта, включающий фасцию, подкожножировую клетчатку и кожу;
-
6) требуется точная разметка лоскутов перед транспозицией.
ЗАКЛЮЧЕНИЕ
Для закрытия дефекта в функционально важных зонах были применены два способа формирования локальных перфорантных лоскутов: методом транспозиции по типу кейстон-лоскута и формирование сурального лоскута на дистальном основании.
Использование кейстон-лоскута и сурального лоскута соответствует задаче замещения дефектов покровных структур тканями, анатомически максимально соответствующими утраченным в результате травматического повреждения или гнойного процесса.
В результате проведенного исследования проанализирована эффективность реконструкции остеомиелитических и посттравматических дефектов покровных тканей методом транспозиции локальных перфорантных лоскутов, определены преимущества данного метода перед традиционным местным лечением ран с применением этапных некрэктомий и аутодермопластики, а также обосновано предпочтительное применение кейстон-лоскута при наличии прилежащих к дефекту неповрежденных и пригодных к использованию донорских тканевых ресурсов.
Данный метод позволяет восстановить в максимально короткий срок полноценный покров в зоне дефекта, уменьшить общий срок лечения пациентов с указанной патологией, обеспечивает полноценную функциональную и косметическую реабилитацию.
Учитывая перечисленные преимущества, метод транспозиции локальных перфорантных лоскутов можно считать оптимальным для пластической реконструкции хронических посттравматических дефектов мягких тканей нижних конечностей, что позволяет улучшить результаты лечения больных.
Список литературы Реконструкция дефектов покровных тканей методом транспозиции локо-регионарных перфорантных островковых лоскутов
- The Functional outcome of severe, open tibia fractures managed with early fixation and flap coverage / S. Gopal, P.V. Giannoudis, A. Murray, S.I. Matthews, R.M. Smith // J. Bone Joint Surg. Br. 2004. Vol. 86, No 6. P. 861-867. DOI: 10.1302/0301-620x.86b6.13400.
- Lerner A., Reis D., Soudry M. Severe Injuries to the Limbs: Staged Treatment. Berlin, Heidelberg, New York: Springer; 2007. 231 p.
- Иванов П.А. Лечение открытых переломов длинных костей конечностей у пострадавших с множественной и сочетанной травмой : дис. ... д-ра мед. наук. М., 2009. 234 с.
- Infectious complications and soft tissue injury contribute to late amputation after severe lower extremity trauma / J. Huh, D.J. Stinner, T.C. Burns, J.R. Hsu; Late Amputation Study Team // J. Trauma. 2011. Vol. 71, No 1 Suppl. P. S47-S51. DOI: 10.1097/TA.0b013e318221181d.
- Устранение рубцовых деформаций лица с применением пластики местными тканями на основе анатомических представлений о кровоснабжении и лимфооттоке. Клиническое наблюдение / Р.Т. Адамян, Н.О. Миланов., Э.Н. Юршевич, А.Л. Истранов, Д.М. Бжассо // Анналы пластической, реконструктивной и эстетической хирургии. 2008. № 2. С. 39-45.
- Гришкевич В.М., Мороз В.Ю., Мадазимов М.М. Устранения обширных дефектов мягких тканей // Хирургия. 1989. № 12. С. 91-93.
- Шибаев Е.Ю., Скольщик М.М., Оганесян А.Р. Пластика комбинированных дефектов пястных костей свободными васкуляризированными аутотрансплантатами // Проблемы микрохирургии. М., 1991. С. 132-133.
- Юденич В.В., Гришкевич В.М. Коррекция послеожоговых рубцовых деформаций с помощью трапециевидного костно-жирового лоскута // Ортопедия, травматология и протезирование. 1981. № 7. С. 56-58.
- Blair J.W., Bainbridge L.C., Knight S.L. Double V-Y advancement flaps in the reconstruction of skin defects of the anterior lower limb // Br. J. Plast. Surg. 1993. Vol. 46, No 8. P. 644-646. DOI: 10.1016/0007-1226(93)90193-f.
- Hing D.N., Bancke N.J., Alpert B.S. Use of the temporoparietal free fascial flap in the upper extremity // Plast. Reconstr. Surg. 1988. Vol. 81, No 4. P. 534-544. DOI: 10.1097/00006534-198804000-00008.
- Соколов В.А. Множественные и сочетанные травмы. Практическое руководство для врачей-травматологов. М.: ГЭОТАР-Медиа, 2006.
- Минасов Б.Ш. Функциональные и эстетические результаты замещения дефектов мягких тканей кровоснабжаемыми лоскутами // Травматология и ортопедия России. 2006. № 1. С. 30-35.
- Hyakusoku H., Yamamoto T., Fumiiri М. The propeller flap method // Br. J. Plast. Surg. 1991. Vol. 44, No 1. P. 53-54. DOI: 10.1016/0007-1226(91)90179-n.
- Hyakusoku H., Gao J.H. The «super-thin» flap // Br. J. Plast. Surg. 1994. Vol. 47, No 7. P. 457-464. DOI: 10.1016/0007-1226(94)90027-2.
- Lyons A.J. Perforator flaps in head and neck surgery // Int. J. Oral Maxillofac. Surg. 2006. Vol. 35, No 3. P. 199-207. DOI: 10.1016/j.ijom.2005.07.015.
- Shape-modified method using the radial forearm perforator flap for reconstruction of soft-tissue defects of the scalp / M.A. Mateev, K.A. Beermanov, L.K. Subanova, T.V. Novikova, G. Shaltakova // J. Reconstr. Microsurg. 2005. Vol. 21, No 1. P. 21-24. DOI: 10.1055/s-2005-862775.
- Shape-modified radial artery perforator flap method: analysis of 112 cases / M.A. Mateev, R. Ogawa, L. Trunov, N. Moldobaeva, H. Hyakusoku // Plast. Reconstr. Surg. 2009. Vol. 123, No 5. P. 1533-1543. DOI: 10.1097/PRS.0b013e3181a07655.
- The "Tokyo" consensus on propeller flaps / M. Pignatti, R. Ogawa, G.G. Hallock, M. Mateev, A.V. Georgescu, G. Balakrishnan, S. Ono, T.C.S. Cubison, S. D'Arpa, I. Koshima, H. Hyakusoku // Plast. Reconstr. Surg. 2011. Vol. 127, No 2. P. 716-722. DOI: 10.1097/PRS.0b013e3181fed6b2.
- Quaba O., Quaba A. Pedicled perforator flaps for the lower limb // Semin. Plast. Surg. 2006. Vol. 20, No 2. Р. 103-111. DOI: 10.1055/s-2006-941717.
- Галич С.П., Дрюк Н.Ф., Повстяной Н.Е. Замещение сложными комплексами тканей послеожоговых и посттравматических дефектов области головы и шеи // Анналы пластической, реконструктивной и эстетической хирургии. 2002. № 4. С. 37-38.
- Миланов Н.О., Трофимов Е.И., Пинский Г.С. Микрохирургическая аутотрансплантация в пластике дефектов головы и шеи // Тезисы IV Всесоюзного симпозиума. М., 1991. С. 31-34.
- Пшениснов К.П. Аутотрансплантация васкуляризованных комплексов тканей в пластической и реконструктивной хирургии дефектов стопы // Проблемы микрохирургии: тез. IV Всесоюзного симпозиума по микрохирургии. М., 1991. С. 166- 169.
- Taylor G.I. The angiosomes of the body and their supply to perforator flaps // Clin. Plast. Surg. 2003. Vol. 30, ^ 3. P. 331-342. DOI: 10.1016/ s0094-1298(03)00034-8.
- Delayed flap reconstruction with vacuum-assisted closure management of the open IIIB tibial fracture / Z. Hou, K. Irgit, K.A. Strohecker, M.E. Matzko, N.C. Wingert, J.G. DeSantis, W.R. Smith // J. Trauma. 2011. Vol. 71, No 6. P. 1705-1708. DOI: 10.1097/TA.0b013e31822e2823.
- Taylor G.I., Palmer J.H. The vascular territories (angiosomes) of the body: experimental study and clinical applications // Br. J. Plast. Surg. 1987. Vol. 40, No 2. P. 113-141. DOI: 10.1016/0007-1226(87)90185-8.
- Азимова Р.Б. Варианты мягкотканных лоскутов для восстановления дефектов нижней конечности как одного из самых сложных разделов реконструктивной онкохирургии. Анализ литературы // Саркомы костей, мягких тканей и опухоли кожи. 2018. Т. 10, № 4. С. 40-50.
- Surgical management of soft tissue sarcomas of the hand and foot / P.P. Lin, V.B. Guzel, P.W. Pisters, G.K. Zagars, K.L. Weber, B.W. Feig, R.E Pollock, A.W. Yasko // Cancer. 2002. Vol. 95, No 4. P. 852-861. DOI: 10.1002/cncr.10750.
- Родоманова Л.А., Кочиш А.Ю. Реконструктивные микрохирургические операции при травмах конечностей: руководство для врачей / Российский науч.-исслед. ин-т травматологии и ортопедии им. Р. Р. Вредена. СПб.: РНИИТО, 2012. 115 с.
- Behan F., Findlay M., Lo C.H., editors. The keystone perforator island flap concept. Elsevier Australia; 2012.
- Слесаренко С.В., Бадюл П.А. Методика пространственного перераспределения покровных тканей при пластическом закрытии глубоких и обширных раневых дефектов // Вопросы реконструктивной и пластической хирургии. 2013. Т. 16, № 4. С. 17-25.
- Невёдров А.В. Пластика покровных тканей при оказании неотложной помощи пострадавшим с открытыми переломами костей голени: дис. канд. мед. наук. М., 2015. 169 с.
- The efficacy of negative pressure wound therapy in the management of lower extremity trauma: review of clinical evidence / N.K. Kanakaris, C. Thanasas, N. Keramaris, G. Kontakis, M.S. Granick, P.V. Giannoudis // Injury. 2007. Vol. 38, No Suppl. 5. P. S9-S18. DOI: 10.1016/j. injury.2007.10.029.


