Реконструктивно-восстановительные операции в комплексном лечении рака молочной железы (10-летний опыт)
Автор: Ходырев С.А., Самойленко В.М., Шабаев Р.М.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 4 (52), 2021 года.
Бесплатный доступ
Целью исследования является улучшение качества жизни женщин с раком молочной железы (РМЖ) и высоким риском его развития путем выполнения одномоментной или отсроченной реконструкции утраченных молочных желез (МЖ).Задачами исследования явились уточнение критериев отбора пациенток на проведение профилактической мастэктомии; выработка хирургической тактики при лечении РМЖ и высоком риске его развития; оценка онкологической безопасности кожесохранной мастэктомии (КМЭ); уточнение способов реконструкции МЖ; анализ послеоперационных осложнений, в том числе влияния неоадъювантной полихимиотерапии (ПХТ) при одномоментной реконструкции МЖ на их частоту и определение возможных путей их предотвращения.Материал и методы. В проспективное контролируемое исследование включено 258 пациенток, перенесших хирургическое лечение в нашем отделении в период с 2007 года по 2016 год. Критериями включения пациенток в исследование явились: проведение радикального хирургического лечения по поводу РМЖ как изолированно, так и в сочетании с реконструкцией утраченной МЖ; носительство герминальных мутаций в генах-супрессорах опухолевой пролиферации BRCA1 и BRCA2, наличие родственниц I степени родства, страдающих РМЖ, перенесенный ранее BRCA-ассоциированный РМЖ; желание пациенток с многократно рецидивирующими пролиферативными доброкачественными заболеваниями МЖ, не поддающимися консервативному и оперативному лечению, воспользоваться хирургическим методом профилактики РМЖ с одномоментным восстановлением МЖ.Результаты. Согласно опроснику депрессивности Бека, в первой группе пациенток у 72 % наблюдался критический и высокий уровень депрессивности, в то время как у пациенток, перенесших радикальную мастэктомию (РМЭ) с одномоментной реконструкцией, подобных уровней депрессивности не наблюдалось. При этом относительно благополучное психологическое состояние пациенток с низким уровнем депрессивности наблюдали у 17 из 21 пациентки группы РМЭ + отсроченная реконструкция (что составило 81 % группы), у 21 из 22 пациенток группы РМЭ + одномоментная реконструкция (95 % группы), и лишь у 5 из 43 пациенток группы РМЭ (12 % группы) (χ2 = 51,6; критическое значение 9,2 при p ≤ 0,01).Выводы. При анализе полученных результатов мы еще раз убедились в онкологической безопасности КМЭ с одномоментной реконструкцией МЖ при соблюдении определенных требований. При наличии соответствующих условий возможно сохранение САК в ходе КМЭ. Профилактическая КМЭ с одномоментной реконструкцией МЖ является способом выбора у пациенток с высоким риском развития РМЖ при соблюдении соответствующих критериев отбора и желании пациентки.
Качество жизни, рак молочной железы, радикальная мастэктомия, кожесохранная мастэктомия
Короткий адрес: https://sciup.org/143177457
IDR: 143177457 | УДК: 618.19-006.6-089.844 | DOI: 10.20340/vmi-rvz.2021.4.CLIN.6
Текст научной статьи Реконструктивно-восстановительные операции в комплексном лечении рака молочной железы (10-летний опыт)
УДК 618.19-006.6-089.844
Рак молочной железы (РМЖ) является ведущей онкологической патологией среди женского населения и по данным Каприна А.Д. и соавт. [1] в 2015 году составил 20,9 % в общей структуре заболеваемости злокачественными новообразованиями. В 2015 году в России впервые выявлен 66621 новый случай заболевания РМЖ. Лечение РМЖ должно быть мультидисциплинарным, направленным не только на первичный очаг, но и на организм пациентки в целом, и включать в себя хирургический этап, по- лихимиотерапию (ПХТ) и лучевую терапию и их комбинацию.
К факторам, способствующим развитию РМЖ, относятся: генетическая предрасположенность (наличие мутаций в генах-супрессорах опухолевой пролиферации BRCA1 и BRCA2); особенности репродуктивной системы (начало менструации в возрасте до 12 лет, наступление менопаузы после 55 лет, отсутствие беременностей, либо поздние роды, отсутствие лактации, заболевания яичников и матки и т.д.); образ жизни (ожирение, отсутствие регулярных физических упражнений, употребление в пищу высококалорийной пищи с высоким содержанием жиров и алкоголя); эндокринно-метаболические, дисгормональные доброкачественные заболевания молочных желез (МЖ) – пролиферативные формы мастопатии, не поддающиеся консервативному и оперативному лечению; экзогенные факторы.
Основной целью хирургического лечения РМЖ является избавление пациентки от рака с сохранением оптимальных эстетических результатов, а также определение тактики адъювантного лечения. Реконструкция молочной железы (МЖ), выполненная пациентке, перенесшей радикальную мастэктомию (РМЭ) по поводу рака, позволяет исключить эстетические дефекты со стороны МЖ и минимизировать психологические последствия в связи с утратой МЖ. Однако остаются спорными сроки выполнения реконструкции (одномоментная или отсроченная) МЖ после радикального лечения.
Одномоментная реконструкция МЖ конечно же считается наиболее оптимальной, позволяющей восстановить МЖ максимально идентичной утраченной с минимальным количеством хирургических вмешательств. Сама по себе отсроченная реконструкция МЖ любым способом подразумевает проведение пациентке повторного хирургического вмешательства разной степени сложности с сопровождающими его процедурами, а именно адекватное анестезиологическое пособие, послеоперационная терапия сопровождения и т.д. К тому же отсроченная реконструкция МЖ сопровождается особенностями как в выборе способа реконструкции (собственные ткани и их комбинация с эндопротезом, одноэтапная или двухэтапная), так и окончательным эстетическим результатом [6].
Общеизвестно, что на выживаемость пациенток, страдающих РМЖ, влияет множество прогностических факторов, одним из которых являются молекулярнобиологические характеристики опухоли. В частности, наиболее агрессивно протекают случаи заболевания Базальноподобного РМЖ и HER2-зависимого РМЖ, при которых прогрессирование онкопроцесса возникает зачастую на первом году после проведенного всего комплекса лечебных мероприятий (ПХТ + РМЭ) несмотря на стадию онкопроцесса. Бурно развивающаяся таргетная терапия моноклональными антителами (трастузумаб, пертузумаб и др.) улучшает показатели выживаемости этих пациенток, но полностью не снимает эту проблему.
Радикальная резекция МЖ с адъювантной лучевой терапией является безопасной альтернативой РМЭ для пациенток с ранним РМЖ [5]. Однако одной трети пациенток с большими размерами опухоли (от 5 см и более), а также мультифокальной формой заболевания показано выполнение РМЭ в связи с неудовлетворительными эстетическими результатами после органосохранной операции, высоким риском локального рецидива [3].
Впервые кожесохранная мастэктомия (КМЭ) с максимальным сохранением кожных лоскутов с целью последующей реконструкции МЖ описана Toth B.A. и Lappert P. в 1991 году [11]. В ходе КМЭ единым блоком должна удаляться вся железистая ткань МЖ с сосково-ареолярным комплексом (САК), а также фрагмент кожи в месте ранее выполненной биопсии опухоли. При этом кожный чехол и субмаммарная складка сохраняются [7]. Благодаря сохранению исходного кожного чехла получается оптимальный эстетический результат, исключающий в большинстве случаев необходимость проведения корригирующих операций на контрлатеральной МЖ для достижения симметрии. Кроме того, уменьшается количество послеоперационных рубцов и объем перемещаемых покровных тканей (кожи), не соответствующих по структуре, цвету, наличию волосяного покрова [8]. Комбинация онкологического и реконструктивного этапов лечения является также экономически целесообразной в связи с уменьшением количества госпитализаций пациенток, уменьшением сроков нетрудоспособности [9]. Такой подход является эффективным в лечении пациенток с ранним РМЖ и протоковой карциномой in situ (DCIS) при наличии противопоказаний для органосохранного лечения. КМЭ с одномоментной реконструкцией также может быть эффективна у пациенток, страдающих РМЖ на фоне ранее перенесенной аугмен-тационной маммопластики, и является альтернативой органосохранному лечению, подразумевающему адъювантную лучевую терапию [4].
Признание и популярность КМЭ с одномоментной реконструкцией растет как среди пациенток, так и среди практикующих хирургов. Опрос хирургов, оперирующих пациенток по поводу РМЖ, в 2008 году (США, штат Калифорния) показал, что 90 % врачей довольны онкологическим радикализмом при раннем РМЖ, 70 % врачей согласны с тем, что эстетический внешний вид при КМЭ с одномоментной реконструкцией превосходит результаты после стандартной РМЭ [10].
В последнее время проводятся исследования о влиянии лучевой терапии на результаты одномоментной реконструкции МЖ, изучаются вопросы онкологического радикализма при сохранении САК, целесообразность использования эндоскопической мастэктомии, биологических материалов для дополнительного укрытия эндопротеза, установленного под большую грудную мышцу.
Начиная наше исследование, мы предположили, что выполнение реконструкции МЖ позволит нам сохранить пациенток, перенесших лечение по поводу РМЖ, в окружающем их социуме, снизить частоту и тяжесть психосоциальной дезадаптации. При наличии высокого риска развития РМЖ выполнение профилактических операций с одномоментной реконструкцией, по нашему мнению, позволит женщине избавиться от ежедневного стресса из-за боязни возникновения онкозаболевания.
Целью исследования: улучшение качества жизни женщин с РМЖ и высоким риском его развития путем выполнения одномоментной или отсроченной реконструкции утраченных МЖ.
Задачами исследования: уточнение критериев отбора пациенток на проведение профилактической мастэктомии; выработка хирургической тактики при лечении РМЖ и высоком риске его развития; оценка онкологической безопасности КМЭ; уточнение способов реконструкции МЖ; анализ послеоперационных осложнений, в том числе влияния неоадъювантной ПХТ при одномоментной реконструкции МЖ на их частоту, и определение возможных путей их предотвращения.
Материал и методы
В проспективное контролируемое исследование включено 258 пациенток, перенесших хирургическое лечение в нашем отделении в период с 2007 года по 2016 год.
Критериями включения пациенток в наше исследование явились: проведение радикального хирургического лечения по поводу РМЖ как изолированно, так и в сочетании с реконструкцией утраченной МЖ; носительство герминальных мутаций в генах-супрессорах опухолевой пролиферации BRCA1 и BRCA2, наличие родственниц I степени родства, страдающих РМЖ, перенесенный ранее BRCA-ассоциированный РМЖ; желание пациенток с многократно рецидивирующими пролиферативными доброкачественными заболеваниями МЖ, не поддающимися консервативному и оперативному лечению, воспользоваться хирургическим методом профилактики РМЖ с одномоментным восстановлением МЖ. Конечно же спорным является выполнение профилактической мастэктомии пациенткам с многократно рецидивирующими пролиферативными доброкачественными заболеваниями МЖ, не поддающиеся консервативному и оперативному лечению. Помимо того, что наличие доброкачествен- ных пролиферативных заболеваний МЖ с различной степенью выраженности атипии протокового эпителия уже несёт в себе риск возникновения РМЖ, неоднократные секторальные резекции, в связи с постоянным рецидивированием доброкачественных новообразований МЖ, приводят к появлению у пациентки страха перед очередным рецидивом, «психической зависимости» от очередного посещения врача-онколога, страха возникновения РМЖ, боязни послеоперационной боли, и, что не маловажно, нарушению эстетического внешнего вида МЖ в связи с их деформацией, формированием гипертрофических послеоперационных рубцов, асимметрией сосковоареолярных комплексов (САК). Стремление достичь полного здоровья у наших пациенток, их психосоциальной адаптации в семье, обществе позволило нам рассматривать наличие рецидивирующих пролиферативных доброкачественных заболеваний МЖ как один из критериев отбора пациенток для проведения им ПМ с одномоментной реконструкцией МЖ.
Все пациентки разделены по объему выполненного хирургического пособия на три группы: I группа – 170 пациенток (65,9 %), которым выполнена РМЭ по поводу РМЖ, но не производилось одномоментное или отсроченное восстановление МЖ; II группа – 80 пациенток (31,0 %), которым после радикального резекционного этапа лечения РМЖ выполнено восстановление МЖ как одномоментное, так и отсроченное, III группа – 8 пациенток (3,1 %) с высоким риском развития РМЖ, которым выполнено подкожное удаление МЖ с сохранением САК с одномоментным их восстановлением.
Возраст пациенток колебался от 15 до 70 лет и старше, в основном это были пациентки трудоспособного и репродуктивного возраста (табл. 1).
При анализе стадии РМЖ установлено, что преобладали I и II стадии заболевания (табл. 2).
Таблица 1. Распределение пациенток по возрасту
Table 1. Distribution of patients by age
|
Группа |
Возраст пациенток |
|||||
|
15–29 лет |
30–39 лет |
40–49 лет |
50–59 лет |
60–69 лет |
70 лет и старше |
|
|
I группа (n = 170) |
1 |
17 |
48 |
53 |
36 |
15 |
|
II группа (n = 80) |
1 |
20 |
38 |
18 |
3 |
– |
|
III группа (n = 8) |
2 |
1 |
5 |
– |
– |
– |
Таблица 2. Распределение пациенток в I и II группах по стадиям заболевания и статистическая значимость различий между группами по этому признаку
Table 2. Distribution of patients in groups I and II according to the stages of the disease and the statistical significance of differences between groups for this feature
|
Группа |
Стадия заболевания |
||||||
|
I стадия |
IIa стадия |
IIb стадия |
IIIa стадия |
IIIb стадия |
IIIc стадия |
IV стадия |
|
|
I группа (n =170) |
45 |
51 |
20 |
22 |
14 |
4 |
14 |
|
II группа (n = 80) |
29 |
36 |
8 |
5 |
1 |
1 |
– |
|
Точный критерий Фишера |
0,138 |
0,023* |
0,830 |
0,129 |
0,042* |
1,000 |
– |
Статистически значимых различий между первой и второй группами по стадиям I, IIb, IIIa и IIIс не было, при этом IIa стадия РМЖ встречалась в группе II в 1,5 раза чаще, чем в группе I (р = 0,023), а IIIb стадия, напротив диагностирована во II группе в 6,3 раза реже, чем в I (1,3 % и 8,2 %, соответственно; р = 0,042). Таким образом, значимые отличия в качественном составе по стадиям заболевания в совокупности с возрастом пациенток обусловлены выбранными нами критериями отбора в группы.
Пациенткам I группы (65,9 %) была выполнена традиционная радикальная мастэктомия по Мадену. Радикальный резекционный этап пациенткам II группы выполнялся по общепринятой методике, при этом 43-м пациенткам (16,7 %) была выполнена традиционная радикальная мастэктомия по Мадену, 36-ти пациенткам (13,9 %) – КМЭ, радикальная резекция МЖ была выполнена одной пациентке (0,4 %) с раком Педжета (без признаков инвазивного компонента по результатам планового гистологического исследования операционного материала). В III группе всем пациенткам была выполнена простая билатеральная подкожная мастэктомия с сохранением САК без ак-силлярной лимфаденэктомии (рис. 1).
В двух случаях пациенткам с BRCA-ассоциированным РМЖ с профилактической целью выполнена контрлатеральная профилактическая подкожная мастэктомия. С целью достижения симметрии 21-й пациентке II группы выполнена коррекция контрлатеральной МЖ (аугментаци-онная маммопластика, редукционная ма-стопексия). При выполнении КМЭ соблюдались все принципы онкорадикализма, а именно толщина сохраняемого кожножирового лоскута составляла не более 0,5 см, иссекался фрагмент кожи, где выполнялась первичная биопсия опухоли, проводился срочный цитологический контроль на наличие атипичных клеток с внутренней поверхности оставляемых тканей в проекции расположения опухоли, удаление восьми и более аксиллярных лимфоузлов в ходе аксиллярной лимфаденэктомии. Органосохранное лечение (радикальная секторальная резекция и т.д.) даже при ранних формах онкопроцесса, DCIS, биопсия сторожевого лимфоузла на диагностическом этапе нами не выполнялись в связи с ограниченными техническими возможностями (отсутствие необходимой аппаратуры).

Рис. 1. Распределение видов оперативных вмешательств в группах
Fig. 1. Distribution of types of surgical procedures in groups
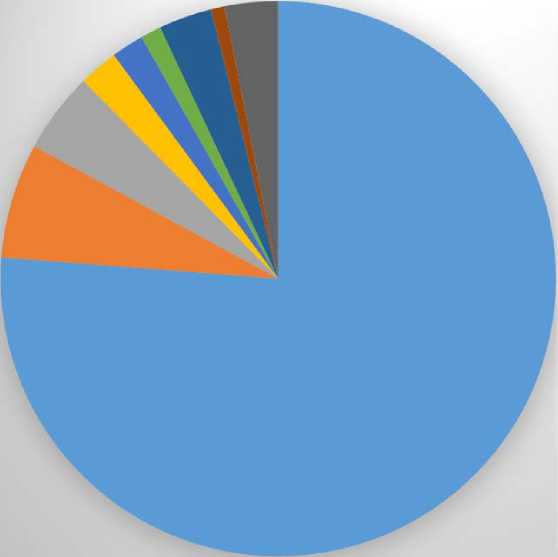
Из гистологических форм РМЖ (рис. 2) преобладал инфильтративный протоковый рак (197 случаев, 76,3 %), инфильтративный протоковый рак с преобладанием внутрипротокового компонента (12 случаев, 4,7 %), инфильтративный дольковый рак в 17-ти случаях (6,6 %), рак Педжета в трех случая (1,2 %), DCIS в шести случаях (2,3 %), LCIS в пяти случаях (1,9 %), единичные случаи редких форм рака (рак с метаплазией, медуллярный рак, секреторный рак, тубулярный рак, апокринный рак, саркома) в восьми случаях (3,1 %). В двух случаях (0,8 %) морфологическая верификация диагноза не выполнена по техническим причинам. В III группе по результатам планового гистологического исследования удаленного операционного материала во всех случаях получена морфологическая картина фиб- розно-кистозной мастопатии с очагами пролиферации и апокринизации эпителия протоков, склерозирующего аденоза, фиброаденом МЖ смешанного строения.
Среди молекулярно-биологических подтипов РМЖ (рис. 3) Люминальный А тип выявлен в 98-ми случаях (38 %), Люминальный В HER2-отрицательный в шести случаях (2,3 %), Люминальный В HER2-положительный в 65-ти случаях (25,2 %), HER2-положительный в 28-ми случаях (10,9 %), Базальноподобный в 32-х случаях (12,4 %), в 19-ти случаях (7,4 %) рецепторный статус не определен по различным причинам (полный лечебный патоморфоз опухоли на фоне неоадъювантного лечения, выполнение радикального хирургического лечения не в нашем стационаре, выписка пациенток из стационара без лечения и др.).
-
■ Инфильтративный протоковый рак, 76,3%
-
■ Инфильтративный дольковый рак, 6,7%
-
■ Инфильтративный протоковый рак с внутрипротоковым компонентом, 4.7%
DC IS, 2,3%
-
■ LCIS, 1,9%
-
■ Рак Педжета, 1,2%
-
■ Редкие формыРМЖ, 3,1%
-
■ ^верифицированный РМЖ, 0,8%
-
■ Фиброаденома, ФКМ 3,1%
Рис. 2. Распределение морфологических форм рака молочной железы
Fig. 2. Distribution of morphological forms of breast cancer
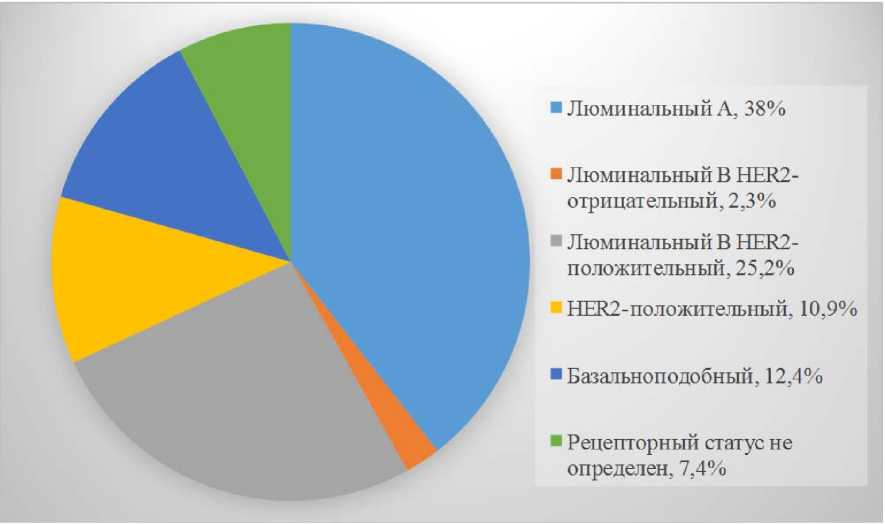
■ Люминальный A, 38%
HER2-пoлoжитeльный, 10,9%
■ Базальноподобный, 12,4%
Люминапьный В HER2-положительный, 25,2%
■ Люминапьный В HER2-отрицательный, 2,3%
■ Рецепторный статус не определен, 7,4%
Рис. 3. Молекулярно-биологические типы РМЖ Fig. 3. Molecular biological types of breast cancer
Билатеральный РМЖ выявлен у пяти пациенток (1,9 %) I группы (в одном случае синхронный РМЖ, в четырех случаях метахронный РМЖ), у восьми пациенток (2,8 %) II группы, из них у трех пациенток с носительством мутации генов BRCA1/2, диагностирован рак контрлатеральной МЖ (в двух случаях метахронный, в одном случае синхронный), в одном случае диагностирован синхронный РМЖ (HER2-положительный тип), у четырех пациенток метахронный рак диагностирован через 6 месяцев – 11 лет после лечения первичного онкопроцесса. У одной пациентки BRCA-ассоциированный метахронный РМЖ сочетался с раком яичников. У шести пациенток (2,3 %) I группы РМЖ сочетался с раком яичника, раком почки, меланомой кожи, раком ободочной кишки.
Одномоментная реконструкция МЖ выполнена 61-й пациентке II группы (23,6 %), всем пациенткам III группы (3,1 %), отсроченная реконструкция МЖ выполнена 19-ти пациенткам II группы (7,4 %) в среднем через 1–3 года после первичного лечения РМЖ. При этом собственные ткани использовались в 51-м случае (57,9 %), эндопро- тезы в 19-ти случаях (21,6 %) изолированно и 18-ти случаях (20,5 %) в комбинации с собственными тканями.Пациенткам I группы по показаниям проводилась неоадъювантная (при Т2N+), адъювантная ПХТ (стадия РМЖ IIa и выше, Базальноподобный РМЖ), антиэстрогенотерапия (Люминальный А, Люминальный В тип РМЖ), таргет-ная терапия (HER2-положительный тип РМЖ). Исключением являлись пациентки возрастной группы 60 лет и старше, в постменопаузе, которым назначалась анти-эстрогенотерапия в монорежиме. Из других видов лечения пациенток II группы при одномоментной реконструкции МЖ из 61-го случая в 25-ти нами проведена неоадъювантная ПХТ по схеме FAC (из них одной пациентке с I стадией РМЖ в дальнейшем мы не проводили адъювантную ПХТ, в 24-х случаях проведена адъювантная ПХТ, при чем в зависимости от молекулярнобиологического подтипа РМЖ, степени лечебного патоморфоза проводилась замена схемы FAC на DA, в одном случае пациентке в послеоперационном периоде проведена лучевая терапия в связи с выявлением опухолевых клеток по краю резекции желе- зистой ткани МЖ), в 27-ми случаях проведена адъювантная ПХТ (FAC или DA в зависимости от молекулярно-биологического подтипа РМЖ), в трех случаях была назначена адъювантная антиэстрогенотерапия, в шести случаях пациенткам с I стадией РМЖ проведено только хирургическое лечение. Проведение ПХТ в любом из режимов в ходе ранее перенесенного комбинированного лечения 19-ти пациенткам II группы с отсроченной реконструкцией нами не оценивалось в связи с отсутствием какого-либо влияния на частоту и характер развившихся послеоперационных осложнений. Пациенткам III группы по характеру патологии проведение какого-либо дополнительного лечения не планировалось. Двусторонняя овариэктомия проводилась пациенткам I и II групп с сохраненной функцией яичников при наличии гормонзависимого (Люминальный А, Люминальный В тип РМЖ) РМЖ как этап антиэстрогенотерапии с последующим назначением тамоксифена, ингибиторов ароматазы.
Течение послеоперационного периода у пациенток I группы было закономерным. Период лимфорреи из постмастэктомиче-ской области составлял в среднем от 7 до 21 дня, пункционное ведение позволило купировать лимфоррею без дополнительных хирургических вмешательств. Лимфос-таз верхней конечности IV типа (по Leis H.P. и соавт., 1966) на стороне РМЭ в отсроченном периоде (через 2–3 года) был отмечен у 22-х пациенток. В одном случае у пациентки через два года после проведенного лечения на фоне прогрессирования онкопроцесса в виде метастазов в над- и подключичные ипсилатеральные лимфоузлы развились лимфедема верхней конечности, тромбоз подключичной вены на стороне РМЭ.
Характер развившихся осложнений у пациенток II и III групп варьирует в зависимости от объема резекционного этапа и способа реконструкции. При изолированном использовании собственных тканей (TRAM-лоскут, TD-лоскут) со стороны донорской зоны зафиксировано 12 осложне- ний (в двух случаях (3,9 %) – серома, в двух случаях (3,9 %) – пролабирование и в одном случае (1,9 %) – грыжа передней брюшной стенки, в одном случае (1,9 %) – кровотечение в раннем послеоперационном периоде, в четырех случаях (7,8 %) – краевой некроз операционной раны передней брюшной стенки, в двух случаях (3,9 %) – частичный некроз САК после профилактической мастэктомии), со стороны перемещаемых тканей – частичный некроз перемещенного лоскута в трех случаях (5,8 %), формирование липогранулемы в двух случаях (3,9 %). При использовании эндопротезов и их комбинации с собственными тканями (TD-лоскут) осложнений со стороны донорской области не выявлено, отмечен в шести случаях (16,2 %) частичный некроз постмаст-эктомического лоскута, в одном случае (2,7 %) – частичный некроз САК, в одном случае – полный некроз САК (2,7 %), в пяти случаях (13,5 %) – частичный некроз перемещенного TD-лоскута (неоареола из кожного фрагмента перемещаемых тканей), в пяти случаях (13,5 %) сформировалось па-рапротезное лимфоцеле, в одном случае (2,7 %) – нагноение ложа эндопротеза, в двух (5,4 %) случаях произошла протрузия эндопротеза, в двух (5,4 %) случаях впоследствии развилась капсулярная контрактура 2 степени по Baker.
Несмотря на такое количество, большинство осложнений носили временный характер, купированы консервативными методами лечения, и только в пяти случаях (5,6 %) потребовалось использование альтернативного способа реконструкции МЖ.
Результаты
На начальных этапах нашего исследования мы оценили качество жизни пациенток, перенесших радикальное лечение по поводу РМЖ [2]. В него вошли 86 женщин, из них 43-м пациенткам выполнена РМЭ, 22-м пациенткам выполнена одномоментная реконструкция МЖ, 21-й пациентке отсроченная реконструкция МЖ.
Согласно опроснику депрессивности Бека, в первой группе пациенток у 72 % наблюдался критический и высокий уровень депрессивности, в то время как у пациенток, перенесших РМЭ с одномоментной реконструкцией, подобных уровней депрессивности не наблюдалось (рис. 4). При этом относительно благополучное психологическое состояние пациенток с низким уровнем депрессивности наблюдали у 17-ти из 21-й пациентки группы РМЭ + отсроченная реконструкция (что составило 81 % группы), у 21-й из 22-х пациенток группы РМЭ + одномоментная реконструкция (95 % группы), и лишь у 5-ти из 43-х пациенток группы РМЭ (12 % группы) ( χ 2 = 51,6; критическое значение 9,2 при p ≤ 0,01).
При оценке развившихся послеоперационных осложнений в призме проведения неоадъювантной ПХТ установлено, что среди 25-ти пациенток II группы с неоадъювантной ПХТ зафиксировано 10 случаев осложнений (из них три при изолированном использовании собственных тканей, семь при комбинированном использовании собственных тканей и эндопротеза), у 27-ми пациенток II группы без неоадъювантной ПХТ диагностировано 15 случаев осложнений (из них четыре при изолированном использовании собственных тканей, 11 при комбинированном использовании соб- ственных тканей и эндопротеза), а у 19-ти пациенток II группы с отсроченной реконструкцией развилось 10 случаев осложнений (из них восемь при изолированном использовании собственных тканей, два при комбинированном использовании собственных тканей и эндопротеза). Из пяти случаев осложнений, развившихся у пациенток III группы, четыре связаны с недостаточным кровоснабжением оставляемых тканей (частичный и полный некроз САК, некроз постмастэктомического лоскута), в одном случае развилось парапротезное лимфоцеле, купированное пункционным способом. Наличие ишемических нарушений со стороны постмастэктомических лоскутов обусловлено соблюдением максимального радикализма при кожесохранном удалении железистой ткани.
Прогрессирование онкопроцесса у пациенток I группы зафиксировано в 22-х случаях (8,1 %), из них на первом году наблюдения в 12 случаях (4,6 %), через два года у восьми пациенток (2,7 %), у двух пациенток (0,8 %) через пять лет. В двух случаях у пациенток с HER2-зависимым РМЖ первым проявлением прогрессирования онкопроцесса явились внутрикожные метастазы рака в зоне, ранее выполненной РМЭ (в одном случае через 12 месяцев, во втором случае через 24 месяца).
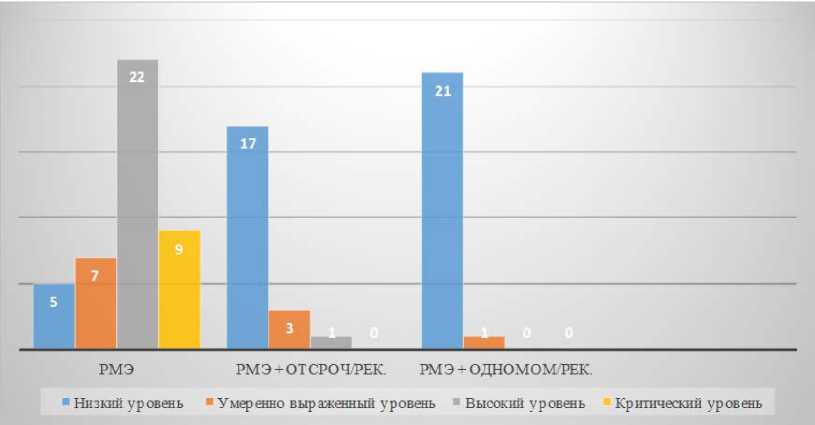
Рис. 4. Уровень депрессивности пациенток в группах сравнения, определённый по опроснику Бека
Fig. 4. The level of depression of patients in the comparison groups, determined by the Beck questionnaire
У пациенток II группы в ходе динамического наблюдения прогрессирование онкопроцесса выявлено в восьми случаях (3,1 %) в виде отдаленного метастазирования, из них через 1 год наблюдения у двух пациенток (0,8 %), через 2 года у трех пациенток (1,1 %), через 3 года у двух пациенток (0,8 %), через 5 лет у одной пациентки (0,4 %). При этом локальных рецидивов онкопроцесса после КМЭ не выявлено. По общему количеству случаев прогрессирования онкопроцесса статистически достоверной разницы между первой и второй группами не получено (OR = 1,27 [0,54 до 3], F = 0,676), что может свидетельствовать о сопоставимой радикальности и абластично-сти операций, примененных в этих группах.
За время наблюдения умерло 17 пациенток (10,1 %) I группы с прогрессированием онкопроцесса, из них пять пациенток со II стадией, пять пациенток с III стадией, шесть пациенток с IV стадией. В течение 1-го года наблюдения умерло четыре пациентки, в течение 2-го года наблюдения – девять пациенток, в течение 3-го года наблюдения – одна пациентка, через 4 года – две пациентки, через 7 лет – одна пациентка. Во II группе за время наблюдения умер- ло шесть пациенток (2,3 %), из них с I стадией РМЖ одна пациентка, с IIa стадией РМЖ три пациентки, с IIb стадией РМЖ две пациентки. На 2-м году наблюдения умерло две пациентки, на 4-м году – две пациентки, на 5-м году – две пациентки. Период наблюдения этих пациенток составил от 1-го года до 6-ти лет. Связь в процессе динамического наблюдения утеряна с 15-тью пациентками, из них 14 пациенток I группы, одна пациентка II группы.
Из молекулярно-биологических типов среди умерших пациенток I группы HER2-зависимый тип РМЖ диагностирован у семи пациенток, Базальноподобный тип у пяти пациенток, Люминальный А тип у трех пациенток, Люминальный В HER2-положительный тип у двух пациенток. Характерной особенностью этих пациенток II группы, умерших на фоне прогрессирования онкопроцесса, явились II стадия заболевания и Базальноподобный тип опухоли.
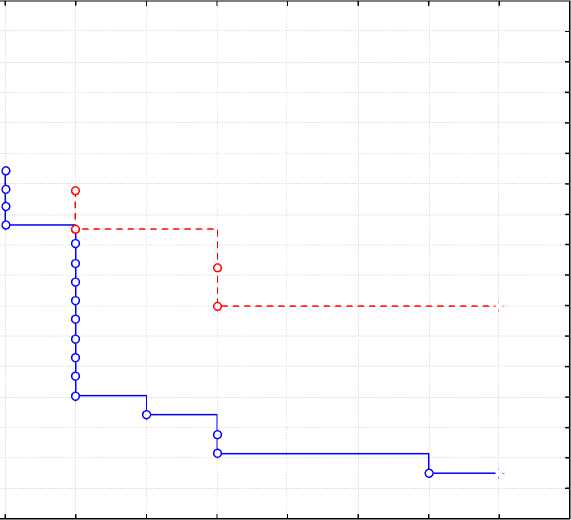
При сравнении кривых дожития по критерию Log-Rank Test различия между группами по времени до наступления изучаемого исхода нет (p = 0,141). По критерию Вил-коксона-Пето статистически значимых различий также не выявлено (p = 0,135).
Таблица 3. Выживаемость пациенток в группах сравнения
Table 3. Survival of patients in comparison groups
|
Время наблюдения |
I группа (170 чел.) |
II группа (80 чел.) |
||
|
Умерли |
Связь потеряна |
Умерли |
Связь потеряна |
|
|
1 год |
4 |
9 |
– |
– |
|
2 год |
9 |
2 |
2 |
– |
|
3 год |
1 |
2 |
– |
– |
|
4 год |
2 |
1 |
2 |
1 |
|
5 год |
– |
– |
2 |
– |
|
6 год |
– |
– |
– |
– |
|
7 год |
1 |
– |
– |
– |
|
8 год |
– |
– |
– |
– |
|
Итого |
17 |
14 |
6 |
1 |
£ Z3 C/)
Z3 E
Z3 О
1,05
1,04
1,03
1,02
1,01
1,00
0,99
0,98
0,97
0,96
0,95
0,94
0,93
0,92
0,91
0,90
0,89
0,88
Cumulative Proportion Surviving (Kaplan-Meier)
Complete
Censored
Time
Group 1,
9 Group 2,
Рис. 5. Кривые дожития в группах исследования: по оси ординат – кумулятивная доля выживших по группам, по оси абсцисс – время в годах
Fig. 5. Survival curves in study groups: the ordinate is the cumulative proportion of survivors by group, the abscissa is the time in years
Выводы
При анализе полученных результатов мы еще раз убедились в онкологической безопасности КМЭ с одномоментной реконструкцией МЖ при соблюдении определенных требований. При наличии соответствующих условий возможно сохранение САК в ходе КМЭ. Профилактическая КМЭ с одномоментной реконструкцией МЖ является способом выбора у пациенток с высоким риском развития РМЖ при соблюдении соответствующих критериев отбора и желании пациентки. Мультидисциплинар-ный подход к лечению РМЖ позволяет в большинстве случаев сохранить пациенток трудоспособными, социально адаптированными в семье, обществе.
Использование полихимиотерапии в неоадъювантном режиме не ухудшает результаты хирургического лечения, не увеличивает количество осложнений в после- операционном периоде. Задержка с началом проведения адъювантной полихимиотерапии не является критичной (1–2 недели) и может быть обусловлена боязнью возникновения осложнений в послеоперационном периоде со стороны оперирующего хирурга. Влияние лучевой терапии нами не оценено в связи с малым количеством пациенток, перенесших комплексное лечение, и малыми сроками наблюдения.
Наличие Базальноподобного и HER2-зависимого типа опухоли должно настораживать онколога и обязывать к максимально радикальному хирургическому лечению, исключающему сохранение САК, проведению всего объема необходимого лечения несмотря на стадию онкопроцесса (полихимиотерапия, таргетная терапия по показаниям, лучевая терапия), сокращению интервалов проведения динамического скрининга, увеличению периода наблюдения (3–
5 лет безрецидивной выживаемости) за пациенткой и выполнению отсроченных восстановительных операций.
Комбинированное использование собственных тканей (TD-лоскут) и эндопротеза позволяет уменьшить ущерб для эстетического внешнего вида и функциональной активности в донорских областях, добиться оптимального и желаемого пациенткой результата за меньшее количество оперативных вмешательств (первичная реконструкция и корригирующие операции) в отличие от использования только собственных тканей (перемещенный TRAM-лоскут). Применение АДМ на данный момент остается не- достаточно распространенным в связи с дороговизной подобных медицинских изделий и особенностями финансирования лечебных учреждений.
Характер большинства послеоперационных осложнений обусловлен техническими аспектами выполняемых операций, в первую очередь радикализмом резекционного этапа, и своевременное выявление и адекватное консервативное лечение позволяет в большинстве случаев купировать их, не прибегая к дополнительным или повторным реконструктивным альтернативным операциям.
Список литературы Реконструктивно-восстановительные операции в комплексном лечении рака молочной железы (10-летний опыт)
- Kaprin A.D., Starinskij V.V., Petrova G.V., Zlokachestvennye novoobrazovaniya v Rossii v 2015 godu. Moskva, 2017. (In Russ).
- Ragozina M.R., Timofeeva O.G. Rekonstruktivnaya, plasticheskaya i esteticheskaya hirurgiya molochnoj zhelezy: materialy IX Mezhdunarodnogo kongressa. Kazan', 2009. (In Russ).
- Carlson G.W. Skin Sparing Mastectomy: Anatomic and Technical Considerations. The American Surgeon. 1996;62:151-155.
- Carlson G.W., Losken A., Moore B. et al. Results of Immediate Breast Reconstruction after Skin-Sparing Mastectomy. Annals of Plastic Surgery. 2001;46:222-228.
- Fisher B., Anderson S., Bryant J. et al. Twenty-Year Follow-Up of a Randomized Trial Comparing Total Mastectomy, Lumpectomy, and Lumpectomy Plus Irradiation for the Treatment of Invasive Breast Cancer. The New England Journal of Medicine. 2002;347:1233-1241.
- Hidalgo D.A. Aesthetic Refinement in Breast Reconstruction: Complete Skin-Sparing Mastectomy with Autogenous Tissue Transfer. Plastic and Reconstructive Surgery. 1998; 102:63.
- NICE Guideline CG80. Early and Locally Advanced Breast Cancer: Diagnosis and Treatment. 2009.
- Simmons R.M. and Adamovich T.L. Skin-Sparing Mastectomy. Surgical Clinics of North America. 2003;83:885-899.
- Singletary S.E. Skin-Sparing Mastectomy with Immediate Breast Reconstruction: The M.D. Anderson Cancer Center Experience. Annals of Surgical Oncology. 1996;3:411-416.
- Shen J., Ellenhorn J., Qian D. et al. Skin-Sparing Mastectomy: A Survey Based Approach to Defining Standard of Care. The American Surgeon. 2008;74:902-905.
- Toth, B.A. and Lappert, P. Modified Skin Incisions for Mastectomy: The Need for Plastic Surgical Input in Pre-Operative Planning. Plastic and Reconstructive Surgery. 1991;87:1048-1053.


