Реконструктивные вмешательства на легочной артерии при органосохраняющих операциях в хирургии рака легкого
Автор: Киршин Александр Александрович, Бурмистров Михаил Владимирович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.19, 2020 года.
Бесплатный доступ
Целью исследования является изучение особенностей реконструктивных вмешательств на легочной артерии в органосохраняющей хирургии рака легкого в аспекте безопасности, функциональной целесообразности и качества жизни. материал и методы. С 2009 г. по декабрь 2016 г. в исследование были включены 183 больных с немелкоклеточным раком легкого (156 мужчин и 27 женщин, средний возраст - 58,4 ± 12,3 года). В 92 случаях выполнены ангиопластические лобэктомии, в 91 случае -пневмонэктомии. Результаты. Интраоперационных осложнений и летальных исходов не было. Послеоперационные осложнения после ангиопластической лобэктомии возникли в 23 (25 %), после пневмонэктомии - в 36 (39,6 %) случаях. Летальность после ангиопластической лобэктомии составила 3 (3,3 %), после пневмонэктомии - 7 (7,7 %) случаев. При анализе параметров функции внешнего дыхания установлено, что после ангиопластической лобэктомии ОФВ1 через 1 год после операции снизился на 0,69 (27 %) л, ЖЕЛ - на 1,17 (32,9 %) л, ФЖЕЛ - на 0,64 (20,5 %) л. После удаления легкого динамика снижения данных показателей составила 1,02 (42 %); 1,53 (43,8 %); 1,24 (40,3 %) л соответственно. При анализе 8 основных параметров опросника SF36 выявлено, что после ангиопластической лобэктомии средние значения данных показателей были выше, чем после пневмонэктомии. заключение. Реконструктивные вмешательства на легочной артерии при органосохраняющих операциях, выполненных по поводу рака легкого, позволяют получить приемлемый непосредственный результат, редуцировать негативные функциональные последствия по сравнению с полным удалением легкого и обеспечить максимальное сохранение качества жизни пациентов.
Рак легкого, резекция легочной артерии, ангиопластическая лобэктомия, органосберегающая хирургия, пневмонэктомия
Короткий адрес: https://sciup.org/140254318
IDR: 140254318 | УДК: 616.24-006.6-089.197.6 | DOI: 10.21294/1814-4861-2020-19-1-22-30
Текст научной статьи Реконструктивные вмешательства на легочной артерии при органосохраняющих операциях в хирургии рака легкого
Эра хирургии рака легкого началась с пневмонэктомии [1], и длительное время показанием к ее выполнению была прямая инвазия легочной артерии и/или вовлечение главного бронха, это было связано и с использованием турникетного способа обработки корня легкого без разделения его элементов [1]. Однако после пневмонэктомии по сравнению с лобэктомией наблюдается большее количество послеоперационных осложнений и случаев летальности [2–7].
Реконструктивные вмешательства на легочной артерии и бронхах выполняются последние 40 лет, после того как в 60-х годах прошлого столетия были сформулированы основные принципы и отработаны технические моменты торакальной хирургии. Впервые бронхиальную резекцию выполнил P.R. Alisson в 1952 г. [8]. Тогда же H. Metras во Франции (1952) [9], D.L. Paulson and R.R. Shaw в США (1955) [10] и С. Price Thomas в Англии (1956) [11] стали основоположниками бронхопластической хирургии. Уже в 1959 г. G.B. Johnston and P.H. Jones представили обзор 99 подобных операций [12]. Первая резекция и реконструкция легочной артерии были выполнены несколько позже, в 1967 г. A.E. Gundersen [13] выполнил 2
операции в объеме краевой резекции левой легочной артерии по поводу опухолевого поражения верхней доли с ее инфильтрацией. Приоритет выполнения реконструктивной операции на легочной артерии в СССР принадлежит М.И. Перельману (1968) [14].
Вмешательства на легочной артерии (правой и левой ветви) являются в настоящее время наиболее часто выполняемыми онковаскулярными операциями в хирургии рака легкого. Если целью резекций аорты, верхней полой вены и левого предсердия является повышение резектабельности при местнораспространенных новообразованиях, то реконструктивная хирургия легочной артерии направлена на сохранение легочной паренхимы [15, 16].
Целью исследования является изучение особенностей реконструктивных вмешательств на легочной артерии в органосохраняющей хирургии рака легкого в аспекте безопасности, функциональной целесообразности и качества жизни.
Материал и методы
Для решения поставленной цели с 2009 г. по декабрь 2016 г. в БУЗ «Республиканский клинический онкологический диспансер им. С.Г. Примуш- ко» Министерства здравоохранения Удмуртской Республики на базе хирургического отделения № 4 (торако-абдоминальное) были выполнены оперативные вмешательства 183 больным с немелкоклеточным раком легкого (156 мужчин и 27 женщин, средний возраст – 58,4 ± 12,3 года). В 92 случаях выполнены ангиопластические лобэктомии (основная группа), в 91 – пневмонэктомии (контрольная группа). Предоперационное обследование включало сбор анамнеза, рентгенографию и КТ органов грудной клетки, фибробронхоскопию с биопсией, морфологическое исследование био-птатов, МРТ головного мозга (по показаниям), УЗИ/КТ органов брюшной полости, остеосцинтиграфию костей скелета (по показаниям), спирографию, ЭКГ. В предоперационном периоде при наличии N2+ статуса проводилась неоадъювантная химиотерапия (НАХТ). В основной группе НАХТ получили 12 (13 %) пациентов (75 % от общего числа больных с pN2+), в группе сравнения – 10 (11 %) пациентов (62,5 % от общего числа больных с pN2+). Хирургическое лечение проводилось по унифицированной методике в различных вариантах ангиопластических лобэктомий и пневмонэктомий. Всем пациентам в ходе операции выполнялась системная ипсилатеральная лимфо-диссекция. При выявлении позитивного N-статуса по данным послеоперационного морфологического исследования пациентам, не получавшим НАХТ, назначалась адъювантная химиотерапия. Лучевая терапия проводилась больным с инвазией опухоли в грудную стенку.
Статистическая обработка полученных данных проводилась методами описательной, параметрической и непараметрической статистики.
Результаты
В объеме ангиопластической лобэктомии (АПЛ) прооперированы 92 пациента с диагнозом немелкоклеточный рак легкого, из них 69 (75 %) мужчин и 23 (25 %) женщины, средний возраст – 57,8 ± 6,7 года. Большую часть пациентов (2/3), перенесших операции с реконструктивным сосудистым компонентом, составили больные в возрасте 50–59 и 60–69 лет. Из 91 больного, которым выполнена пневмонэктомия (ПЭ), было 87 (95,6 %) мужчин и 4 (4,4 %) женщины, средний возраст – 59 ± 8,8 года.
В этой группе также преобладали пациенты трудоспособного возраста (50–59 лет) – 45,1 %.
Большая часть всех АПЛ была выполнена при локализации опухоли в верхних долях легких, в том числе в 60,9 % при поражении левого легкого и 19,6 % справа – при поражении правого, реже встретились опухоли в нижних долях (слева – в 9,8 %, справа – в 5,4 %) и в средней доле справа (4,3 %). В объеме пневмонэктомии также чаще оперировались больные с опухолями в верхних долях легких (справа – 28,5 %, слева – 30,8 %). В нижних долях легких опухоль встретилась в 18 (19,8 %) случаях справа и в 19 (20,9 %) случаях слева.
При правосторонней локализации опухоли выполнено 27 ангиопластических лобэктомий в 9 вариантах, при левосторонней локализации опухоли выполнено 65 ангиопластических лобэктомий в 6 вариантах. Из них 47 краевых резекций легочной артерии с ушиванием дефекта вдоль либо поперек оси сосуда, 11 окончатых резекций легочной артерии с пластикой заплатой (аутоперикард, легочная вена удаляемой доли), 29 циркулярных резекций легочной артерии с формированием прямого анастомоза и 5 циркулярных резекций легочной артерии с использованием сосудистой вставки. Комбинированные АПЛ выполнены в 77,2 % случаев, преобладали бронхопластические вмешательства – 45 (48,9 %). В контрольной группе выполнено 44 пневмонэктомии справа и 47 – слева, при этом 46 (50,5 %) операций носили комбинированный характер. Наиболее часто ПЭ сочеталась с резекцией трахеи – в 15 (16,5 %) случаях, перикарда – в 8 (8,8 %) и левого предсердия – в 6 (6,6 %) наблюдениях. Послеоперационная лучевая терапия была проведена 6 (6,5 %) пациентам в основной группе и 18 (19,8 %) – в контрольной, адъювантная химиотерапия – 31 (33,7 %) и 28 (30,8 %) больным соответственно.
Интраоперационных осложнений и летальных исходов не было. Частота и характер послеоперационных осложнений представлены в табл. 1. Осложнения, связанные с сосудистым компонентом оперативного вмешательства, встретились в 2 (2,2 %) случаях: кровотечение из зоны сосудистого анастомоза и послеоперационная пневмония.
Зарегистрировано 3 (3,3 %) летальных исхода после ангиопластической лобэктомии (30-суточная летальность), причинами которых явились: острый инфаркт миокарда, ТЭЛА, микронесостоятельность бронхиального анастомоза с последующим аррозионным кровотечением из легочной артерии. После пневмонэктомии умерло 7 (7,7 %) больных, причинами летальных исходов были ТЭЛА – в 3 (3,3 %) наблюдениях, по 2 (2,2 %) случая острого инфаркта миокарда на фоне некупируемой фибрилляции предсердий и несостоятельности швов культи главного бронха. Таким образом, в сравниваемых группах не выявлено значимых различий в показателях послеоперационной летальности (p=0,16).
При сравнении основной и контрольной групп по критериям pT, pN, с учетом послеоперационного морфологического исследования, распределение пациентов оказалось довольно схожим (табл. 2). Первичная опухоль, характеризующаяся как pT1a выявлена в 3 (3,3 %) случаях после выполнения АПЛ и в 2 (2,2 %) случаях при ПЭ, pT1b – в 5 (5,4 %) и 6 (6,6 %), pT2a – в 18 (19,6 %) и 21 (23 %), рТ2b – в 32 (34,8 %) и 28 (30,7 %), рТ3 – в 28 (30,4 %) и 26 (28,6 %), рТ4 – в 6 (6,5 %) и 8
|
Таблица 1/table 1 Частота и характер послеоперационных осложнений в сравниваемых группах/ the frequency and type of postoperative complications in the study and control groups |
|||
|
Осложнение/Complication |
Основная группа/ Study group (n=92) |
Контрольная группа/ Control group (n=91) |
р |
|
Внутриплевральное кровотечение/Intrapleural bleeding |
2 (2,2 %) |
2 (2,2 %) |
0,69 |
|
Свернувшийся гемоторакс/Coagulated hemothorax |
2 (2,2 %) |
0 |
0,25 |
|
Хилоторакс/Chylothorax |
1 (1,1 %) |
2 (2,2 %) |
0,5 |
|
Несостоятельность швов анастомоза/культи бронха/ Anastomosis/stump of bronchus suture failure |
3 (3,2 %) |
6 (6,6 %) |
0,24 |
|
Эмпиема плевры без свища/Pleural empyema without fistula |
1 (1,1 %) |
3 (3,3 %) |
0,3 |
|
Остаточная плевральная полость/Residual pleural cavity |
2 (2,2 %) |
- |
0,25 |
|
Длительное воздухотечение/Prolonged pulmonary air leak |
3 (3,2 %) |
- |
0,13 |
|
Ателектаз/Atelectasis |
1 (1,1 %) |
- |
0,5 |
|
Пневмония/Pneumonia |
2 (2,2 %) |
2 (2,2 %) |
0,69 |
|
Нарушение ритма/Rhythm disturbance |
2 (2,2 %) |
12 (13,2 %) |
0,005 |
|
Острое нарушение мозгового кровообращения/ Acute cerebrovascular accident |
1 (1,1 %) |
1 (1,1 %) |
0,75 |
|
Острый инфаркт миокарда/Acute myocardial infarction |
1 (1,1 %) |
2 (2,2 %) |
0,5 |
|
ТЭЛА/Pulmonary embolism |
1 (1,1 %) |
3 (3,3 %) |
0,3 |
|
Парез возвратного нерва/Recurrent nerve paresis |
1 (1,1 %) |
3 (3,3 %) |
0,3 |
|
Всего/Total |
23 (25 %) |
36 (39,6 %) |
0,026 |
Примечание: расчет уровня достоверности выполнен по точному методу Фишера.
Notes: the calculation of the confidence level was performed using the exact Fisher method.
Таблица 2/table 2
Распределение больных в сравниваемых группах в зависимости от стадии опухолевого процесса/ Distribution of patients to the study and control groups according to stage of disease
|
Критерий/ |
Основная группа/ |
Контрольная группа/ |
|
Ctiterion |
Study group (n=92) |
Control group (n=91) |
|
1a |
3 (3,3 %) |
2 (2,2 %) |
|
1b |
5 (5,4 %) |
6 (6,6 %) |
|
2а pT 2b |
18 (19,6 %) |
21 (23,1 %) |
|
32 (34,8 %) |
28 (30,7 %) |
|
|
3 |
28 (30,4 %) |
26 (28,6 %) |
|
4 |
6 (6,5 %) |
8 (8,8 %) |
|
0 |
44 (47,8 %) |
42 (46,2 %) |
|
pN 1 |
32 (34,8 %) |
33 (36,3 %) |
|
2 |
16 (17,4 %) |
16 (17,5 %) |
|
Ia |
4 (4,3 %) |
4 (4,4 %) |
|
Ib |
6 (6,5 %) |
8 (8,8 %) |
|
Стадия/Stage IIa |
26 (28,3 %) |
24 (26,4 %) |
|
IIb |
34 (37 %) |
31 (34 %) |
|
IIIa |
22 (23,9 %) |
24 (26,4 %) |
(8,8 %) наблюдениях соответственно. В каждом случае было исследовано не менее 6 удаленных лимфоузлов средостения. Распределение по статусу N: в основной группе рN0 выявлено в 44 (47,8 %), в контрольной группе – в 42 (46,2 %) случаях, рN1 – в 32 (34,8 %) и 33 (36,3 %), рN2 – в 16 (17,4 %) и 16 (17,5 %) соответственно. Данные результаты свидетельствуют о сопоставимости и достаточно однородном распределении больных в сравниваемых группах по стадии опухолевого процесса: Ia стадия была у 4 (4,3 %) пациентов в группе перенесших АПЛ и у 4 (4,4 %) человек в группе пациентов, оперированных в объеме ПЭ, Ib стадия – у 6 (6,5 %) и 8 (8,8 %), IIa стадия – у 26 (28,3 %) и 24 (26,4 %), IIb стадия – у 34 (37 %) и 31 (34 %), IIIа стадия – у 22 (23,9) и 24 (26,4 %) больных соответственно.
Подавляющее большинство в обеих группах составили пациенты с плоскоклеточным раком легких: в основной – у 63 (68,5 %), в контрольной группе – у 74 (81,3 %), аденокарцинома легких – у 21 (22,8 %) и 12 (13,2 %) больных соответственно (табл. 3). Прочие морфологические формы (базалоидный, крупноклеточный, аденокистозный и железисто-плоскоклеточный рак) являются относительно редкими и были представлены единичными случаями в обеих группах.
При анализе общей выживаемости без учета стадии рака легкого установлено, что в группе больных, перенесших АПЛ, 1-годичная наблюдаемая выживаемость составила 96,7 %, 3-летняя – 65,1 %, 5-летняя – 36,6 %, медиана выживаемости – 53,1 мес; аналогичные показатели у больных после пневмонэктомии составили: 92,3; 62,5; 27,6 и 39 мес (p=0,85) соответственно (рис. 1). Показатели безрецидивной выживаемости также без учета стадии опухоли после ангиопластических лобэктомий составили: одногодичная выживаемость – 89,9 %, 3-летняя – 65,3 %, 5-летняя – 48,8 %; после пневмонэктомий – 88,1; 53,8 и 39,1 % соответственно (рис. 2). Медиана безрецидивной выживаемости в основной группе равнялась 49,8 мес, в контрольной группе – 36,1 мес (р=0,18).
Основной целью применения ангиопластиче-ских лобэктомий как метода органосберегающего лечения является сохранение легочной паренхимы для обеспечения лучшего функционального результата и качества жизни после хирургического лечения рака легкого. В связи с этим нами был выполнен сравнительный анализ основных показателей спирограммы (ОФВ1, ЖЕЛ, ФЖЕЛ) до операции и через 1 год после ангиопластической лобэктомии (n=43) и пневмонэктомии (n=37). При анализе динамики параметров функции внешнего дыхания после АПЛ и ПЭ установлено, что после ангиопластической лобэктомии ОФВ1 через 1 год после операции снизился на 0,69 (27 %) л, ЖЕЛ – на 1,17 (32,9 %) л, ФЖЕЛ – на 0,64 (20,5 %) л (табл. 4). После удаления легкого динамика снижения
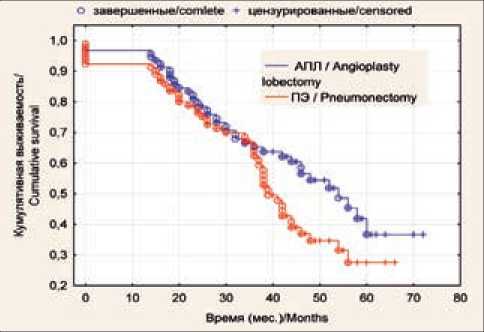
Рис. 1. Общая выживаемость больных раком легкого I–III стадии в зависимости от методики хирургического вмешательства
Fig. 1. Overall survival of patients with stage I–III lung cancer according to surgical technique
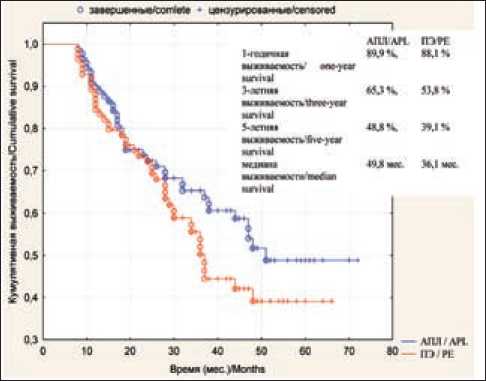
Рис. 2. Безрецидивная выживаемость больных раком легкого I–III стадии в зависимости от методики хирургического вмешательства
Fig. 2. Disease-free survival of patients with stage I–III lung cancer according to surgical technique данных показателей составила 1,02 (42 %); 1,53 (43,8 %); 1,24 (40,3 %) л соответственно. Различия в сравниваемых группах статистических значимы (р<0,05).
Для послеоперационной оценки качества жизни (КЖ) использовался опросник Short Form Medical Outcomes Study (SF36). Анкетирование в основной (n=40) и контрольной (n=40) группах проводилось через 12 мес после операции. При анализе 8 основных показателей опросника SF36 выявлено, что после ангиопластической лобэктомии средние показатели КЖ были значимо выше, чем после пневмонэктомии (табл. 5).
Обсуждение
Выполнение пневмонэктомии сопряжено с ухудшением качества жизни, особенно при ее правостороннем варианте и/или после неоадъю-
Таблица 3/table 3
Распределение больных в сравниваемых группах в зависимости от гистотипа опухолей/ Distribution of patients to the study and control groups according to the histological type of the tumor
|
Гистотип/ Histological type |
Основная группа/ Study group (n=92) |
Контрольная группа/ Control group (n=91) |
|
Плоскоклеточный рак/ Squamous cell carcinoma |
63 (68,5 %) |
74 (81,3 %) |
|
Аденокарцинома/ Adenocarcinoma |
21 (22,8 %) |
12 (13,2 %) |
|
Базалоидный рак/ Basaloid carcinoma |
3 (3,3 %) |
2 (2,2 %) |
|
Крупноклеточный рак/ Large-cell carcinoma |
2 (2,2 %) |
1 (1,1 %) |
|
Железисто-плоскоклеточный рак/ Glandular squamous cell carcinoma |
2 (2,2 %) |
1 (1,1 %) |
|
Аденокистозный рак/ Adenocystic cancer |
1 (1,1 %) |
1 (1,1 %) |
Таблица 4/table 4
Динамика показателей ФВД в сравниваемых группах до и после операции/Changes in pulmonary function parameters (PFP) in the study and control groups before and after surgery
|
Параметр ФВД/ PFP parameters |
Основная группа/Study group (n=43) |
Контрольная группа/Control group (n=37) |
||
|
До операции/ Before surgery |
После операции/ After surgery |
До операции/ Before surgery |
После операции/ After surgery |
|
|
ОВФ 1/FEV1 |
2,56 ± 0,59 |
1,87 ± 0,68** |
2,43 ± 0,62 |
1,41 ± 0,39* ## |
|
ЖЕЛ/LC |
3,56 ± 0,46 |
2,39 ± 0,52* |
3,49 ± 0,48 |
1,96 ± 0,42** ## |
|
ФЖЕЛ/FLC |
3,12 ± 0,39 |
2,48 ± 0,43** |
3,08 ± 0,54 |
1,84 ± 0,46** ## |
Примечание: значимость различий между показателями внутри каждой из сравниваемых групп до и после операции: * – р<0,05, ** – р<0,01, *** – р<0,001; значимость различий между показателями основной и контрольной групп после операции: # – р<0,05, ## – р<0,01, ### – р<0,001.
Notes: statistically significant difference in the parameters in each of the group before and after surgery: * – р<0.05, ** – р<0.01, *** – р<0.001; statistically significant difference in the parameters between the study and control groups after surgery: # – р<0.05, ## – р<0.01, ### – р<0.001.
tаблица 5/table 5
Показатели шкал опросника sF36 в сравниваемых группах через 12 мес после хирургического лечения the sF36 questionnaire parameters in the study and control groups 12 months after surgery
|
Показатель/ Parameters |
Основная группа/ Study group (n=40) |
Контрольная группа/ Control group (n=40) |
|
PF |
52,85 ± 5,65* |
49,42 ± 6,89 |
|
RF |
52,66 ± 6,75* |
49,49 ± 5,67 |
|
BP |
52,68 ± 4,53* |
49,56 ± 4,56 |
|
GH |
52,57 ± 5,84** |
49,82 ± 7,29 |
|
VT |
53,48 ± 7,22** |
49,23 ± 4,83 |
|
SF |
52,9 ± 6,34** |
49,37 ± 5,45 |
|
RE |
52,81 ± 5,82** |
49,59 ± 3,84 |
|
MH |
53,86 ± 7,21** |
48,12 ± 4,56 |
Примечание: PF – физическое функционирование, RF – ролевое функционирование, BP – шкала боли, GH – общее состояние здоровья, VT – шкала жизнеспособности, SF – социальное функционирование, RE – ролевое эмоциональное функционирование, MH – психологическое здоровье; значимость различий между показателями основной и контрольной групп: * – р<0,05, ** – р<0,01, *** – р<0,001.
Notes: PF – physical functioning, RF – role functioning, BP – bodily pain, GH – general health, VT – vitality, SF – social functioning, RE – role emotional, MH – mental health; statistically significant difference in the parameters between the study and control groups: * – р<0.05, ** – р<0.01, *** – р<0.001.
вантной химиотерапии [17–19]. Эти аспекты привели к развитию хирургической методики ан-гиопластических лобэктомий. Реконструктивные операции на легочной артерии позволяют достичь как R0-резекции, так и сохранения функционирующей легочной паренхимы [20, 21]. Данные метаанализа [4] указывают, что этап сосудистой реконструкции при радикальных операциях по поводу рака легкого приводит к увеличению уровня послеоперационных осложнений и летальности. Частота послеоперационных осложнений при васкулярных/бронховаскулярных лобэктомиях составляет 32,4 %, летальность – 3,3 %. Аналогичные показатели при бронхопластических лобэктомиях равняются 30,8 % и 3,0 %, при пневмонэктомиях – 33,6 % и 5,7 % соответственно. Очевидно, что по данным показателям ангиопластическая лобэктомия уступает бронхопластической лобэктомии, но превосходит пневмонэктомию. В нашем исследовании соответствующие показатели при выполнении ангиопластической лобэктомии составили 25 % и 3,3 %, при пневмонэктомии – 39,6 % и 7,7 %, при этом различия в частоте осложнений были статистически значимыми (p<0,05).
Авторы того же метаанализа [4] приводят данные, что сосудистая реконструкция снижает результаты общей выживаемости. Так, при выполнении васкулярных/бронховаскулярных лобэктомий 5-летняя выживаемость составила 38,7 %, при бронхопластических лобэктомиях – 50,3 %, при пневмонэктомиях – 30,7 %.
Местные рецидивы следует рассматривать в качестве основного послеоперационного осложнения после ангио- и/или бронхопластики. Локальные рецидивы опухоли, частота которых потенциально увеличивается при органосберегающих операциях, являются одним из сдерживающих факторов для широкого внедрения данной методики. В зависимости от определения понятия «локорегионарный рецидив» коллективом авторов данные о его частоте в различных публикациях колеблются от 4,5 % до 32,6 %, составляя в среднем 16,1 % [4]. Истинные рецидивы в зоне резекции бронха – редки, и при правильно организованном динамическом наблюдении могут быть своевременно выявлены и излечены выполнением пневмонэктомии [22]. Этот факт подкрепляет идею, что ангиопластика с возможной бронхопластикой позволяет радикально контролировать болезнь. Большинство локоре-гионарных рецидивов возникает в средостении и часто ассоциируется с системными проявлениями болезни. Это свидетельствует о том, что первичное выполнение пневмонэктомии не может повлиять на этот вид прогрессирования опухолевого процесса.
При анализе отдаленных результатов нашего исследования выявлена тенденция к увеличению общей выживаемости в группе больных, перенесших ангиопластическую лобэктомию, – 36,6 % против 27,6 % после пневмонэктомии. При анализе показателей безрецидивной выживаемости в сравниваемых группах (5-летняя безрецидивная выживаемость в основной группе – 48,8 %, в контрольной – 39,1 %) подтверждается non-inferiority гипотеза о целесообразности органосберегающего лечения. Несмотря на отсутствие статистически значимых различий (p>0,05), обе методики имеют сопоставимые результаты в отношении отдаленного результата.
Конечной целью хирургии рака легкого на современном этапе являются не только непосредственные и отдаленные результаты, но и такая важная составляющая, как качество жизни [23–25], которое является прогностическим фактором общей выживаемости. Качество жизни, особенно связанное с состоянием физической функции, в результате обширных легочных резекций подвержено негативному изменению и зависит от параметров ОФВ1 и DLCO [24, 26, 27]. Это интуитивно понятно, так как чем больше функционирующей паренхимы легкого в ходе операции будет удалено, тем большее физиологическое повреждение возникает в организме пациента [28]. С. Pompili et al. [24] приводят данные, что показатели общей выживаемости находятся под значимым влиянием такого субъективного фактора, как количество баллов опросника SF36. Кроме того, установлено, что оценка качества жизни ниже 50 баллов связана с плохим прогнозом [29].
При анализе наших данных установлено, что снижение основных показателей спирограммы после АПЛ выражено в меньшей степени, чем после ПЭ, что также коррелирует с более высоким количеством баллов опросника SF36 у пациентов после ангиопластической лобэктомии по сравнению с больными, перенесшими пневмонэктомию (в обоих случаях показатели достигли статистически значимых различий).
Заключение
Таким образом, реконструктивные вмешательства на легочной артерии при органосохраняющих операциях, выполненных по поводу рака легкого, позволяют получить приемлемый непосредственный результат, редуцировать негативные функциональные последствия для организма по сравнению с полным удалением легкого, и обеспечить сохранение качества жизни данной сложной категории пациентов. Исследования в области органосохраняющего хирургического лечения в онкологии должны получить дальнейшее развитие и критическую оценку.
Список литературы Реконструктивные вмешательства на легочной артерии при органосохраняющих операциях в хирургии рака легкого
- Graham E.A., Singer J.J. Succcessful removal of entire lung for carcinoma ofthe bronchus. JAMA. 1933; 101(18): 1371-74. 10.1001/ JAMA.1933.02740430017005. DOI: 10.1001/jama.1933.02740430017005
- Haithcock B.E., Stinchcombe T.E., Socinski M.A. Treatment of surgically resectable non-small-cell lung cancer in elderly patients. Clin Lung Cancer. 2009 Nov; 10(6): 405-9. DOI: 10.3816/CLC.2009.n.076
- Kalathiya R.J., Saha S.P. Pneumonectomy for non-small cell lung cancer: outcomes analysis. South Med J. 2012 Jul; 105(7): 350-4. DOI: 10.1097/SMJ.0b013e31825bc299
- Ma Z., Dong A., Fan J., Cheng H. Does sleeve lobectomy concomitant with or without pulmonary artery reconstruction (double sleeve) have favorable results for non-small cell lung cancer compared with pneumonec-tomy? A meta-analysis. Eur J Cardiothorac Surg. 2007 Jul; 32(1): 20-8.
- Mansour Z., Kochetkova E.A., Santelmo N., Meyer P., Wihlm J.M., Quoix E., Massard G. Risk factors for early mortality and morbidity after pneumonectomy: a reappraisal. Ann Thorac Surg. 2009 Dec; 88(6): 1737-43. DOI: 10.1016/j.athoracsur.2009.07.016


