Ремоделирование компонентов аэрогематического барьера легких в условиях высокогорья
Автор: Матвиенко Виктор Васильевич, Абдумаликова Инобат Абдусаттаровна, Шидаков Юсуф Хаджи-Махмудович, Маргарян Артур Ванушович, Захарчук Ольга Викторовна, Истомина Ольга Фридриховна, Шидин Владимир Александрович, Тулекеев Тохтогазы Иманалиевич
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 1, 2023 года.
Бесплатный доступ
Цель. Изучить структурные и ультраструктурные изменения на уровне аэрогематического барьера (АГБ) у крыс в разные сроки адаптации к высокогорной гипоксии. Материалы и методы. Эксперименты проведены на 60 половозрелых беспородных лабораторных крысах-самцах массой 140-160 г в условиях высокогорья (3200 м над ур. м.). Использованы гистологический метод окраски гематоксилин-эозином по Майеру, трансмиссионная и растровая электронная микроскопия на 7, 15 и 30-е сут пребывания животных в горах. Статистическая обработка материала проведена с помощью прикладных программ Statistica 6.0 (США) и StatTech v. 2.8.4 (Россия) с использованием критерия достоверности Стьюдента. Различия считали статистически значимыми при p
Высокогорная гипоксия, сурфактант, аэрогематический барьер, межальвеолярная перегородка, базальная мембрана
Короткий адрес: https://sciup.org/14127216
IDR: 14127216 | УДК: 611.24-911.7 | DOI: 10.34014/2227-1848-2023-1-114-124
Текст научной статьи Ремоделирование компонентов аэрогематического барьера легких в условиях высокогорья
Введение. Ключевым фактором, оказывающим влияние на организм в течение всего периода пребывания человека и животных в высокогорье, является гипоксия, действующая на организм в комплексе с другими составляющими высокогорной среды обитания [1–3]. В процессе адаптации к условиям высокогорья на фоне гипоксии важную роль играет респираторный отдел легких [4, 5]. Вследствие это- го вполне обоснован интерес к морфологическому и морфометрическому изучению органов дыхания на горных высотах, особенно роли аэрогематического барьера (АГБ) легких и неразрывному единству дыхания, кровообращения и нейрогуморального регулирования обеспечения организма кислородом [6, 7].
Результаты исследования АГБ в условиях экспериментальных моделей гипоксии далеки от оригинальных данных, полученных в высокогорье. Экспериментальные данные порой несопоставимы с методами исследования, что не дает возможности составить единое представление о механизмах реакции АГБ на отдельные виды гипоксии [8–10]. При этом особого внимания заслуживает исследование характера этих реакций и структурных изменений АГБ в зависимости от длительности гипоксического воздействия [11, 12].
Цель исследования. Изучить структурные и ультраструктурные изменения в легких на уровне аэрогематического барьера у крыс в разные сроки адаптации к высокогорью.
Материалы и методы. Эксперименты проведены на половозрелых беспородных лабораторных крысах-самцах массой 140–160 г. Первая группа животных (20 крыс) – контрольная, вторая (60 крыс) – опытная. Вторая группа животных была транспортирована на высокогорную базу пер. Туя-Ашу (3200 м над ур. м.). Животные содержались в клетках по 20 крыс в условиях вивария при температуре 21–22 °С. Содержание животных и эвтаназия были реализованы в соответствии с принципами биоэтики, изложенными в Международных рекомендациях по проведению медико-биологических исследований с использованием животных (Хельсинки, 1985). Эксперименты на животных проведены в соответствии с принципами, изложенными в Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других целей (Страсбург, 1986), и Приказе Минздрава России № 199 от 01.04.2016 «Об утверждении правил надлежащей лабораторной практики».
На 7, 15 и 30-е сут адаптации к условиям высокогорья под общим внутрибрюшинным наркозом Thiopentalum-natrium животных выводили из эксперимента, извлекали кусочки легких и фиксировали в 10 % растворе нейтрального формалина на фосфатном буфере (рН 7,2). Далее проводили по спиртам возрастающей концентрации (50, 70, 80, 90, 96, 100 %), заливали в парафин и приготовляли срезы толщиной 7–8 мкм на микротоме «Биолам». Срезы окрашивали по общепринятой методике гематоксилин-эозином по Майеру и по Ван-Гизону и заключали в канадский баль- зам под покровным стеклом. Для проведения обзорной световой микроскопии и морфометрического исследования производили микрофотосъемку случайных полей зрения гистологических препаратов цифровой камерой OLYMPUS XC30 на базе микроскопа OLYMPUS СX41 (Япония) при увеличении окуляра SWH ×10 и объектива UPLanFL ×40 (не менее 10 полей зрения в каждом гистологическом срезе). Для морфометрического анализа данных использовали компьютерные программы анализа изображений Image Scope Color и OLYMPUS Сell Sens (Япония). Статистическую обработку полученных данных проводили c использованием пакета прикладных программ Statistica 6.0 (США).
Для электронно-микроскопического изучения структуры клетки кусочки легочной ткани 1×1 мм фиксировали в 2,5 % растворе глутарового альдегида, дофиксировали в 1 % растворе четырехокиси осмия, контрастировали в 1 % растворе уранилацетата и цитрата свинца по Рейнолдсу, заливали в эпоновые смеси из аралдитов 964 и 812. Электронномикроскопические исследования биопрепаратов легочной ткани проводили в Тюменском научном центре Сибирского отделения Российской академии наук. Ультратонкие срезы толщиной 250 нм готовили на ультрамикротоме LEICA EM UC7 (США). Микрофотосъемку производили на трансмиссионном электронном микроскопе JEM-1011 (Япония). Для сканирующей электронной микроскопии готовили сколы легочной ткани в жидком азоте и напыляли коллоидным золотом в вакуумной установке HI CUDE (ФРГ). Объекты изучали под растровым микроскопом HITACI (Япония). Статистическую обработку осуществляли с помощью пакета МS Excel 2007 и пакета прикладных программ Statistica 6.0 с использованием критерия достоверности Стьюдента. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение. В табл. 1 отражены сведения о количественных изменениях толщины цитоплазматических отростков (ЦО) альвеолоцитов 1-го типа (А I типа), эн-дотелиоцитов, базальных мембран (БМ), суммарной толщины АГБ и межальвеолярных перегородок (МАП).
Таблица 1
Table 1
Морфометрия основных компонентов АГБ в процессе адаптации к условиям высокогорья, мкм, М±m
Morphometry of basic AHB components during high-altitude adaptation, mkm, М±m
|
Параметр Parameter |
Контроль Control |
Сроки эксперимента, сут Experiment duration, days |
||
|
7-е |
15-е |
30-е |
||
|
Толщина ЦО А I типа Thickness of A cytoplasmic processes, Type I |
0,16±0,04 |
0,17±0,006 |
0,26±0,007˟* |
0,18±0,003* |
|
Толщина ЦО эндотелиоцита Thickness of endotheliocyte cytoplasmic processes |
0,19±0,007 |
0,24±0,01˟ |
0,08±0,003˟* |
0,07±0,002˟* |
|
Базальные мембраны Basal membranes |
0,07±0,003 |
0,06±0,003 |
0,10±0,004˟* |
0,06±0,004˟* |
|
Суммарная толщина АГБ Total AHB thickness |
0,42±0,05 |
0,47±0,019 |
0,44±0,014 |
0,31±0,009˟* |
|
Толщина МАП IAS thickness |
3,74±0,06 |
4,30±0,07˟ |
4,28±0,03˟ |
4,76±0,09˟* |
Примечание. Различия достоверны (р<0,05) по сравнению с: ˟ – контролем, * – предыдущим сроком.
Note. AHB – aero-hematic barrier, IAS – interalveolar septum; ˟ – the differences are significant compared to the control (p<0.05); * – the differences are significant compared to the previous term (p<0.05).
Из табл. 1 видно, что толщина ЦО А I типа, эндотелиоцитов, БМ и АГБ достигает максимальных значений в аварийной стадии (7-е сут) адаптации животных в высокогорье. В стабильной фазе адаптации (30-е сут) показатели снижаются по сравнению не только с аварийной фазой, но и с данными контроля. Толщина МАП нарастает независимо от фазы адаптации животных в высокогорье. Следовательно, изменения компонентов АГБ и МАП в
процессе адаптации к высокогорью не совпадают по времени.
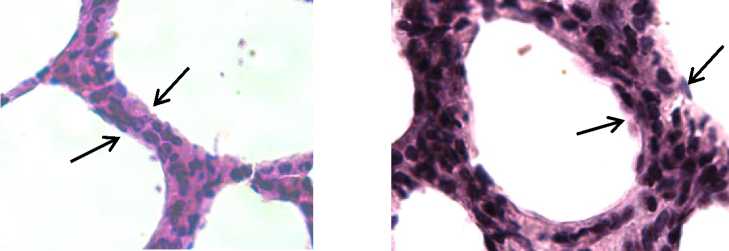
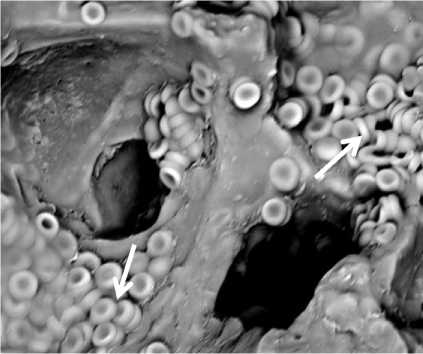
На 7-е сут адаптации за счет гипертрофии и гиперплазии пневмоцитов I–II типов происходит утолщение МАП. Одновременно в отдельных альвеолах отмечаются явления интерстициального отека стенок с поступлением транссудата в их просвет (рис. 1а, б) и образованием «кровяных рек» [13] (рис. 2а, б).
а б
Рис. 1. Межальвеолярная перегородка (черные стрелки): а) контроль, б) на 7-е сут пребывания животных в высокогорье. Утолщение МАП. Окраска гематоксилин-эозином по Майеру. Об. ×40, ок. ×10
Fig. 1. Interalveolar septum (black arrows). a – control, b – Day 7 of animals' life in the highlands. Thickening of the interalveolar septum. Mayer's hematoxylin and eosin staining protocol. Lens ×40, ocular ×10
а
Рис. 2. а) Транссудат в просвете альвеолы (черные стрелки). Окраска гематоксилин-эозином по Майеру. Об. ×40, ок. ×10; б) многорядное расположение эритроцитов в просвете сосуда (белые стрелки). Сканирующая электронная микроскопия на 7-е сут адаптации животных к условиям высокогорья.
СЭМ ×12 000
б
Fig. 2. a) Transudate in the alveoli lumen (black arrows). Mayer's hematoxylin and eosin staining protocol. Lens ×40, ocular ×10; b) multi-row red blood cell arrangement in the vessel lumen (white arrows). Scanning electron microscopy, Day 7 of animals’ adaptation to high-altitudes. SEM ×12 000
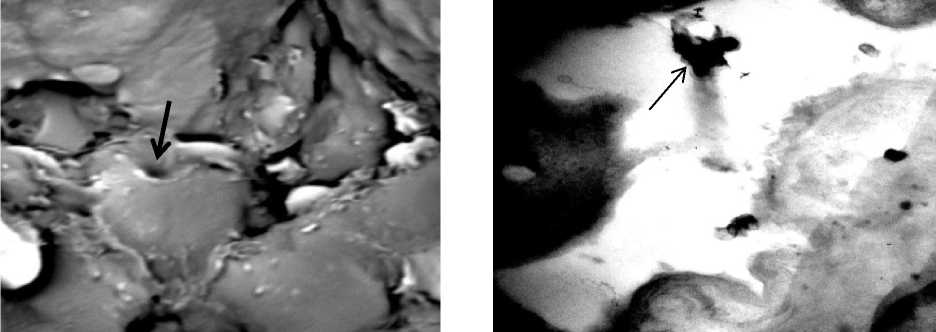
В аварийной фазе адаптации (7-е сут) на электроннограмме отражается разрушение аль-веолоцитов II типа по апокриновому способу
с выходом осмиофильных пластинчатых телец (ОПТ) в просвет альвеол (рис. 3а, б).
б
Рис. 3. а) Альвеолоцит II типа на 7-е сут адаптации к высокогорью. Разрушение клетки по апокриновому способу. СЭМ ×12 000;
б) выход осмиофильных пластинчатых телец в просвет альвеолы (черные стрелки). ТЭМ ×25 000
Fig. 3. a) Type II alveolocyte, Day 7 of adaptation to high-altitudes. Apocrine secretion. SEM ×12 000; b) output of osmiophilic lamellar bodies into alveoli lumen (black arrows). TEM ×25 000
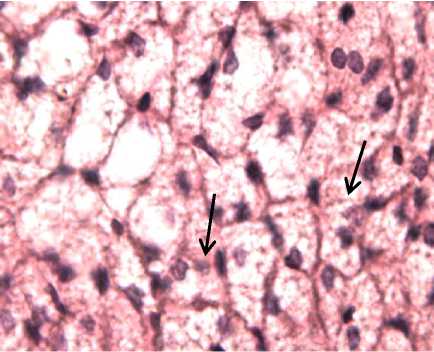
В цитоплазме альвеолоцитов II типа снижается количество молодых осмиофильных пластинчатых и ламеллярных телец с фосфолипидами, что свидетельствует о нарушении
(дистрофии) легочного эпителия [14]. Цистерны гранулярной эндоплазматической сети расширяются, лишаются части рибосом.
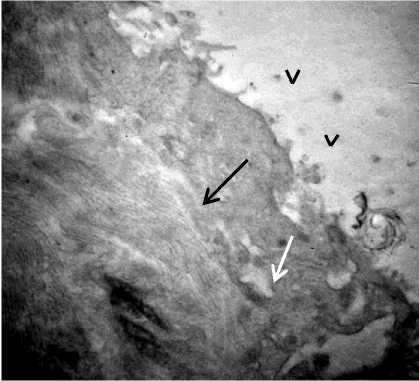
Рис. 4. а) Альвеолоцит II типа на 7-е сут адаптации к высокогорью.
В цитоплазме – расширенная зернистая эндоплазматическая сеть (черная стрелка), мультвезикулярные тельца (белая стрелка), комплекс Гольджи, в просвете альвеолы - микроворсинки ( V ). ТЭМ x25 000;
б) альвеола на 7-е сут адаптации. Видны нитевидные структуры сурфактанта (черная стрелка), макрофаги (белые стрелки) и эритроциты в просвете альвеол ( V ). СЭМ x20 000
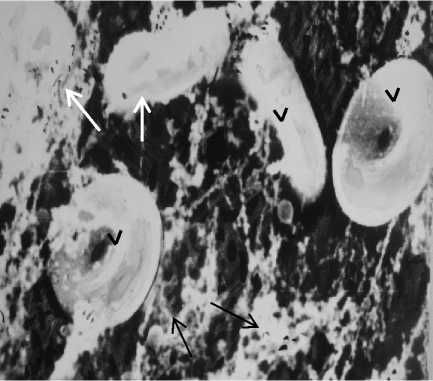
б
Fig. 4. a) Type 2 alveolocyte, Day 7 of adaptations to high-altitudes.
In the cytoplasm; expanded granular endoplasmic reticulum (black arrow), multvesicular corpuscles (white arrow), Golgi complex, in the alveoli lumen: microvilli ( V ). TEM x25 000; b) alveolus, Day 7 of adaptation. Surfactant threadlike structure (black arrow), macrophages (white arrows) and erythrocytes are visible in the alveoli lumen ( V ). SEM x20 000
Отдельные альвеолоциты II типа находятся в состоянии повышенной секреторной активности, другие теряют сурфактант за счет выхода ОПТ, встречаются одиночные эритроциты и макрофаги в просвете альвеол (рис. 4а, б).
В более поздние сроки пребывания животных в высокогорье в стенке МАП отмечается выбухание альвеолоцитов II типа с многочисленными «отверстиями» – порами Кона (рис. 5а). Апикальная поверхность пневмоци-тов I типа содержит многочисленные цитоплазматические отростки различной длины. В просвете альвеол – разрушенные остатки сурфактанта (рис. 5б).
В контексте проводимого исследования можно выделить факторы взаимодействия: вдыхаемый воздух – легкие – сердце и бронхиальное дерево – кровеносные сосуды – аэрогемати-ческий барьер. Развивается прекапиллярная легочная гипертензия, отражающаяся на функции АГБ, заключающейся в обеспечении нутриентами клеточной популяции МАП [15, 16].
Таким образом, в аварийной фазе (7-е сут) адаптации к высокогорью цитоплазматиче-
ские отростки эндотелиоцитов имеют тенденцию к утолщению, их нутритивная и газообменная функции нарушаются. В стабильной фазе адаптации формируются приспособительные структуры в виде артериол замыкающего типа, артериоло-венулярных анастомозов, регулирующих артериальное давление, наблюдаются дилатация микрососудов в МАП, истончение ЦО эндотелиоцитов по сравнению с контролем (табл. 1).
Мелкие ветви и артериолы легочной артерии в аварийной фазе адаптации к высокогорью повышают сопротивление току крови, при этом наполнение альвеол воздухом с низким парциальным давлением кислорода снижается. Так как строма с залегающими в ней терминальными бронхиолами представлена главным образом ретикулярными и частично коллагеновыми волокнами, менее влияющими на респираторный отдел легких, МАП и ЦО А I типа утолщаются. В этой ситуации нарастает гиперфункция и пролиферация аль-веолоцитов II типа, продуцирующих поверхностно-активные вещества. Структурным суб-
стратом гиперфункции альвеолоцитов II типа выступает снижение числа молодых ОПТ, расширение зернистой эндоплазматической сети, что отражает компенсаторно-приспособительные реакции в ответ на гипоксию. В от-
дельных альвеолах отмечаются зернистая дистрофия эпителия, нарушающая мукоцилиарный транспорт, активация сурфактантной системы легких с последующим развитием респираторного дистресс-синдрома.
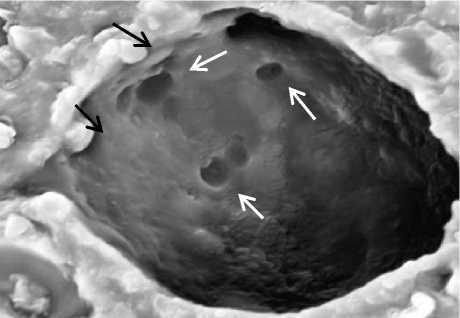
а
Рис. 5. а) Межальвеолярная перегородка на 15–30-е сут.
В стенке перегородки – выбухание альвеолоцитов II типа в просвет альвеолы (черные стрелки), многочисленные поры Кона (белые стрелки). СЭМ ×20 000; б) альвеолоцит I типа на 15–30-е сут. Цитоплазматические отростки различной длины с утолщением (белые стрелки).
В просвете альвеол – разрушенный сурфактант (черные стрелки). ТЭМ ×30 000
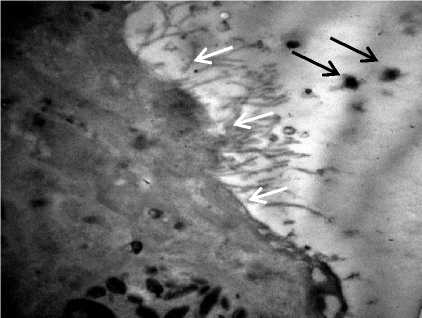
б
Fig. 5. а) Interalveolar septum, Day 15–30.
In the septum wall: bulging of type II alveolocytes into the alveoli lumen (black arrows), numerous pores of Kohn (white arrows). SEM ×20 000; b) type I alveolocyte, Day 15–30. Cytoplasmic processes of various lengths and thickness (white arrows).
In the alveoli lumen: destroyed surfactant (black arrows) TEM ×30 000
В последующие сроки адаптации к высокогорью толщина ЦО А I типа не отличается от толщины ЦО эндотелиоцитов, БМ и АГБ, при этом толщина МАП превышает контрольные данные. В стенке альвеол увеличивается количество фибробластов, что в условиях гипоксии приводит к расширению и увеличению количества пор Кона, обеспечивая коллатеральное дыхание [2].
Структурные основы адаптации и компенсации изменений функционирования легких в высокогорье охватывают богатый клеточный состав МАП. В альвеолоцитах I типа нарастает внутриклеточная регенерация, аль-веолоциты II типа не только активно секретируют, но и пролиферируют совместно с эндо-телиоцитами и альвеолярными макрофагами. В эти сроки активизируется сурфактантная система за счет клеточной популяции, продуцирующей поверхностно-активное вещество
альвеолоцитами II типа, клетками Клара и альвеолярными макрофагами [17, 18].
Заключение. В результате проведенных исследований установлено, что в ранние сроки адаптации животных к условиям высокогорья отмечается выраженное увеличение основных компонентов АГБ легких (толщины МАП, БМ, ЦО А I типа и эндотелиоцитов капилляров). В просвете альвеол наблюдаются явления транссудата, локальные разрушения альвеоло-цитов II типа в апикальной части по апокриновому способу, вымывание мембран сурфактанта, скопление эритроцитов в стенке альвеол. Активность сурфактантной системы в этот период заключается в гиперплазии и увеличении объема ОПТ, появлении мультвезикулярных пластинчатых телец в цитоплазме альвеолоци-тов II типа и альвеолярных макрофагов, участвующих в поглощении избыточного сурфактанта. В более поздние сроки пребывания жи-
вотных в высокогорье морфометрические показатели АГБ приближаются к конт-рольным величинам, кроме толщины МАП (табл. 1). Активность сурфактантной системы в эти сроки снижается за счет уменьшения выброса ОПТ структур сурфактанта. В стенке альвеол увеличивается количество фибробластов, что в условиях гипоксии приводит к расширению и увеличению количества пор Кона, обеспечивая коллатеральное дыхание [2].
Таким образом, изучение компонентов АГБ у экспериментальных животных (крыс) в разные сроки высокогорной адаптации выявило дистрофические процессы АГБ в МАП, компенсируемые за счет альвеолоцитов I типа, пролиферации альвеолоцитов II типа, что подтверждает адаптивные механизмы ультра-структурной перестройки всех звеньев эпителиального и эндотелиального компонентов легочных альвеол.
Список литературы Ремоделирование компонентов аэрогематического барьера легких в условиях высокогорья
- Айдаралиев A.A., Арабаева А.И., Шатманова Э.К. Устойчивое развитие горных регионов Кыргызстана. Здравоохранение Кыргызстана. 2021; 1: 3-12.
- Шидаков Ю.Х.-М., Балыкин М.В., Каркобатов Х.Д. Горная микроангиология. Бишкек; 2019. 172.
- Матвиенко В.В., Тулекеев Т.М., Матвиенко О.В., ШведскийМ.С. Морфофункциональные изменения сосудистого русла легких в условиях высокогорья. Вестник физической культуры и спорта. Бишкек. 2019; 2: 99-102.
- Иванов К.П. Современные медицинские проблемы микроциркуляции и гипоксического синдрома. Вестник РАМН. 2014; 1-2: 57-63.
- Белов Г.В. Сурфактантная система легких в условиях горного климата. Медицина Кыргызстана. 2014; 5: 19-23.
- Брилль Г.Е., Чеснокова Н.П., Понукалина Е.В. Механизмы компенсации и адаптации к гипоксии. Научное обозрение. Медицинские науки. 2017; 2: 55-57.
- Низамутдинова Р.Р. Влияние неблагоприятных факторов окружающей среды на сурфактантную систему легких и возможности ее спонтанного восстановления. Вестник новых медицинских технологий. 2008; 1: 133-136.
- Lopez-Rodriguez E. Structure-function rela-tionships in pulmonary surfactant membranes: from biophysics to therapy. Biochim. Biophys. Acta. 2014; 6 (6): 1568-1585.
- NematovaR.I. The Introduction of the Laryngeal Mask Airway for Surfactant Administration in Neonates with Respiratory Distress in Azerbaijan. Eurasian Journal of Clinical Sciences. 2019; 1 (1): 63-67.
- Шидаков Ю.Х.-М., Абдумаликова И.А., Матвиенко В.В. Ультраструктурные изменения микроцир-куляторного русла и паренхимы легких при физических нагрузках в условиях высокогорья. Вестник КРСУ. 2016; 7: 191-193.
- Шахбанов Р.К., Асадулаева М.Н., Алиева С.Н., Алимханова А.А. Развитие и функциональное значение системы легочного сурфактанта. Вестник Российского университета дружбы народов. Медицина. 2021; 4: 321-331.
- GhoshM.C. Insulin-like growth factor-I stimulates differentiation of ATII cells to ATI-like cells through activation of Wnta. Am J Physiol Lung Cell Mol. Physiol. 2013; 5 (5): 222-228.
- Gazdhar A. Targeted gene transfer of hepatocyte growth factor to alveolar type II epithelial cells reduces lung fibrosis in rats. Hum Gene Ther. 2013; 24 (24): 105-116.
- Полищук В.В. Функции и действие сурфактанта. Барнаул: Алтайский государственный университет; 2022: 665-666.
- Матвиенко В.В., Шведский М.С., Вагина Д.А. Влияние гипоксии на сурфактантную систему легких. Медико-физиологические проблемы экологии человека. Ульяновск: УлГУ; 2021: 224-226.
- Bouzas V., Haller T., Hobi N., Felder E., Pastoriza-Santos I., Pérez-Gil J. Nontoxic impact of PEG-coated gold nanospheres on functional pulmonary surfactant-secreting alveolar type II cells. Nanotoxicology. 2014: 813.
- CrystalR.G., RandellS. Y., Engelhardt J.F. Airway epithelial cells current concepts and challenges. Proc. Amer. Thorac. Soc. 2008; 5 (5): 772-776.
- Сапаров К.А., Нурмухан Г.С., Султанова А.Ж. Морфологические аспекты респираторного отдела легких при долговременной гипоксической гипоксии. Международный журнал прикладных и фундаментальных исследований. 2015; 12: 677-780


