Ремоделирование суставного хряща и субхондральной зоны большеберцовой кости при экзопротезировании конечности
Автор: Ступина Т.А., Еманов А.А., Кузнецов В.П., Овчинников Е.Н.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.31, 2025 года.
Бесплатный доступ
Введение. Экзопротезирование конечностей путем остеоинтеграции открывает новые возможности протезирования. Современные протезы становятся более высокотехнологичными, что требует глубокого понимания анатомо-функциональных особенностей костно-суставной системы. Цель работы — выявить особенности структурной реорганизации суставного хряща и субхондральной зоны большеберцовой кости при протезировании голени имплантатом с кальций-фосфатным покрытием и имплантатом без дополнительного покрытия. Материалы и методы. Исследование выполнено на пяти интактных (контроль) и шести опытных собаках мужского пола (возраст — (1,8 ± 0,5) г, масса — (19,0 ± 1,2) кг). Животным моделировали культю большеберцовой кости на границе средней и верхней трети диафиза, через 2,5 мес. устанавливали имплантат типа Press–Fit. В зависимости от материала имплантата животные разделены на группы: группа 1 — сплав Ti6Al4V (n = 3); группа 2 — сплав Ti6Al4V с кальций-фосфатным покрытием (n = 3). Срок эксперимента — 180 сут. после протезирования. Гистоморфометрическое исследование суставного хряща и субхондральной зоны выполнено по парафиновым срезам с помощью микроскопа AxioScope. A1 с камерой AxioCam и программного обеспечения Zenblue (CarlZeissMicroImagingGmbH, Германия). Результаты. Ремоделирование костной ткани выражалось истончением субхондральной костной пластинки, остеолизисом, изменением архитектоники костных трабекул в субхондральной трабекулярной кости, снижением минерализации костной ткани. Наблюдаемые признаки интенсивнее выражены в группе 1. Признаки репаративного остеогенеза, остеобласты на поверхности костных трабекул, отмечены в группе 2. Зарегистрировано снижение параметра «толщина субхондральной костной пластинки» в группе 1 в два раза, в группе 2 — в 1,5 раза относительно контроля. Значения параметра «площадь трабекул» снижены в группе 1 на 17 %, в группе 2 — на 10 %. Статистически значимое снижение значений толщины суставного хряща зарегистрировано в группе 1 и сопровождалось бóльшей (в 1,8 раза) частотой встречаемости сосудов в глубокой зоне хряща по сравнению с группой 2. Обсуждение. Выявленные изменения субхондральной зоны соответствовали стадии 0 (по классификации O-M. Aho et al., 2017), — очень ранние признаки остеоартроза, когда субхондральный склероз не выражен, субхондральная костная пластина — тонкая. Структурные изменения суставного хряща соответствовали степени 0–1 по гистологической классификации Международного общества изучения остеоартроза OARSI. Заключение. Гистоморфометрические изменения остеохондрального компонента большеберцового плато при протезировании голени (истончение субхондральной костной пластинки, рарефикация субхондральной трабекулярной кости, проникновение сосудов в некальцифицированный хрящ) являются предикторами артроза. Применение имплантатов группы 2 способствует снижению интенсивности процессов резорбции костной ткани и активации процессов репаративного остеогенеза.
Экзопротезирование, титановый имплантат, кальций-фосфатное покрытие, суставной хрящ, субхондральная кость, гистоморфометрия
Короткий адрес: https://sciup.org/142244811
IDR: 142244811 | УДК: 617.584-77:616.718.5-089.843:616.72-018.3]-092.9 | DOI: 10.18019/1028-4427-2025-31-3-341-349
Текст научной статьи Ремоделирование суставного хряща и субхондральной зоны большеберцовой кости при экзопротезировании конечности
Экзопротезирование конечностей путем остеоинтеграции обеспечивает физиологическую весовую нагрузку, остеоперцептивную сенсорную обратную связь, улучшенный диапазон движений в проксимальном суставе, что способствует созданию полнофункциональной искусственной конечности и открывает новые возможности протезирования [1–3]. Современные протезы становятся все более сложными и высокотехнологичными, требуя глубокого понимания анатомо-функциональных особенностей костно-суставной системы [4–6]. Изучение структурной реорганизации основных элементов смежного сустава при протезировании имеет большое значение для разработки реабилитационных программ, направленных на улучшение качества жизни пациентов.
В проведенных ранее исследованиях при одноэтапной технологии протезирования голени отмечена стабильность и приживаемость имплантата типа Press–Fit с костеобразованием по всей длине [7], при этом в смежном суставе выявлены структурные изменения мыщелков бедра в зоне контакта гиалинового хряща с субхондральной костью [8]. Многочисленные работы последних лет демонстрируют всё больше доказательств первостепенности патологических изменений в субхондральной кости при развитии артроза [9–11]. На сегодняшний день существует острая необходимость в разработке способов визуализации и гистологической количественной оценки процессов ремоделирования субхондральной зоны [12, 13].
Изучение процессов остеоинтеграции имплантатов направлено на улучшение контакта между костной тканью и имплантатом путем воздействия на состав имплантата и микроструктуру его поверхности [14, 15], на регенерирующую на поверхности имплантата костную ткань [16], а также нанесением лекарственных и биологически активных веществ на поверхность имплантата [17, 18].
Исследования структурной реорганизации суставного хряща смежного сустава при протезировании конечности малочисленны, не изучены особенности перестройки субхондральной зоны и гистологические предикторы артроза, что определило цель исследования.
Цель работы — выявить особенности структурной реорганизации суставного хряща и субхондральной зоны большеберцовой кости при протезировании голени имплантатом с кальций-фосфатным покрытием и имплантатом без дополнительного покрытия.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
Исследование проведено на шести беспородных собаках мужского пола (возраст — (1,8 ± 0,5) г, масса тела — (19,0 ± 1,2) кг), которым моделировали культю большеберцовой кости на границе средней и верхней трети диафиза.
Через 2,5 мес. животным устанавливали имплантат типа Press-Fit [19]. Затем имплантат фиксировали и выполняли компрессионную нагрузку на кость Fн = 20 Н с помощью специального устройства (рис. 1) [20] в течение 35 дн., после чего устанавливали экзопротез. Животных разделили на две равные группы в зависимости от материала имплантата: группа 1 — из сплава Ti6Al4V ( n = 3); группа 2 — из сплава Ti6Al4V с кальций-фосфатным покрытием ( n = 3). Срок эксперимента — 180 сут. после протезирования.
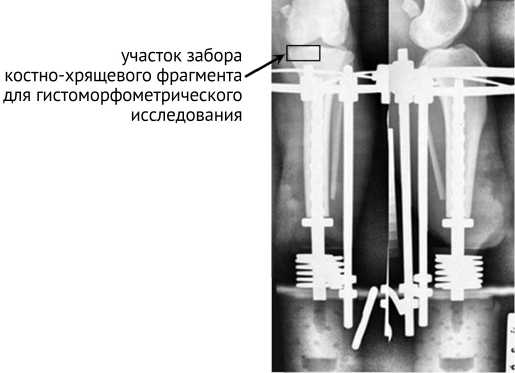
Рис. 1. Рентгенограммы большеберцовой кости при протезировании имплантатом типа Press-Fit с установкой компрессионного устройства
Объекты исследования — суставной хрящ и субхондральная зона большеберцовой кости.
В качестве контроля исследовали суставной хрящ и субхондральную зону большеберцовой кости трех интактных собак.
Этические принципы
Исследование проведено согласно принципам Европейской конвенции ETS № 123 о защите позвоночных животных, используемых для экспериментов или в иных научных целях (с приложением от 15.06.2006, Страсбург), и правилам надлежащей лабораторной практики (ГОСТ 33044-2014)». Протокол локального этического комитета от 29.11.2024 № 1(76).
Эвтаназия
Вывод животных из эксперимента проводили после миорелаксации раствором димедрола 1 % (0,02 мг/кг) и рометара 2 % (5 мг/кг), затем вводили летальную дозу барбитуратов.
Гистоморфометрическое исследование
Для гистоморфометрического исследования вычленяли суставной конец большеберцовой кости, удаляли мягкие ткани, костно-хрящевые блоки фиксировали в 10 % растворе нейтрального формалина (pH 7,4). Затем костно-хрящевые блоки помещали в декальцинирующий раствор, состоящий из смеси растворов муравьиной и соляной кислот. После этапа декальцинации материал промывали в проточной воде и подвергали гистологической проводке, включающей этапы обезвоживания, пропитки и заливки в парафин.
При заливке блоков кусочки ориентировали с учетом зонального строения суставного хряща, использовали перпендикулярные суставной поверхности парафиновые срезы адекватной толщины [21], которые изготавливали с помощью микротома НМ 450 Thermo Scientific (США). Применяли основной метод окрашивания гистологических препаратов, — окраску гематоксилином и эозином, и специальный метод трехцветной окраски по Массону с анилиновым синим.
Светооптическое исследование препаратов и оцифровку изображений проводили на микроскопе AxioScope.A1 с цифровой камерой AxioCam (CarlZeissMicroImagingGmbH, Германия). При описании субхондральной зоны опирались на определение двух структурных единиц: субхондральная костная пластинка и субхондральная трабекулярная кость [9].
Для количественного исследования использовали программное обеспечение Zenblue (CarlZeissMicroImagingGmbH, Германия). Измеряли параметры: толщина некальцифицированного (h uncal.cr , мм) хряща, толщина кальцифицированного (h cal.cr , мкм) хряща, толщина субхондральной костной пластики (h s.b.pl , мкм). В субхондральной трабекулярной кости рассчитывали площадь костных трабекул (S Tr , %,) и их толщину (h Tr , мкм). В глубокой зоне хряща определяли частоту встречаемости сосудов, данный параметр рассчитывали как сумму сосудов в полях зрения, разделенную на количество всех исследуемых полей зрения (от каждого животного анализировали в среднем 20 полей при 400-кратном увеличении).
Статистические методы
Обработку количественных данных осуществляли в электронных таблицах Microsoft Exсel. Оценку выборок на нормальность распределения проводили с помощью критерия Колмогорова. Мера центральной тенденции морфометрических параметров представлена в виде медианы и квартилей, минимальных и максимальных значений ( Me (р25–р75) [min–max]) и в виде средней и ошибки средней ( М ± m ). Для оценки различий сравниваемых групп применяли критерий Манна – Уитни, для частотного показателя — критерий Барнарда, значимыми считали различия при р < 0,05.
РЕЗУЛЬТАТЫ
Гистопатология суставного хряща
При светооптическом исследовании гистопрепаратов суставной хрящ латерального мыщелка большеберцовой кости в опытных и контрольной группах сохранял зональное строение (рис. 2).
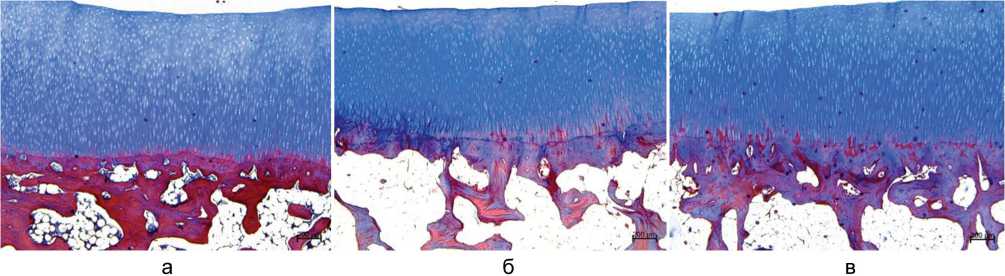
Рис. 2. Суставная выстилка латерального мыщелка большеберцовой кости: а — контроль (интактная норма), б — группа 1, в — группа 2. Парафиновые срезы, окраска трехцветным методом по Массону, ×40
В большей части опытных наблюдений в поверхностной зоне отсутствовало тангенциальное расположение клеток, отмечены пустые клеточные лакуны, бесклеточные поля, межклеточное вещество поверхностной зоны неравномерно окрашено (рис. 3, а), очаги разволокнения не выявлены, в группе 1 в одном наблюдении отмечен синовиальный паннус (рис. 3, в).
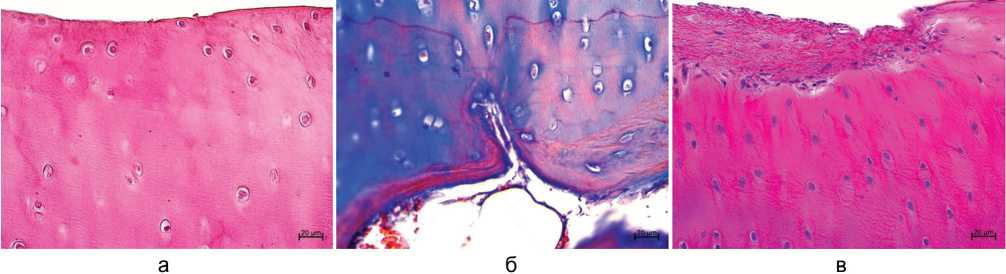
Рис. 3. Суставной хрящ: а — поверхностная зона (группа 2); б — проникновение сосудов в глубокую зону хряща (группа 2); в — синовиальный паннус на суставной поверхности (группа 1); г — проникновение сосудов в глубокую зону хряща (группа 1). Парафиновые срезы. Окраска гематоксилином и эозином (а, в), трехцветным методом по Массону (б, г), ×400
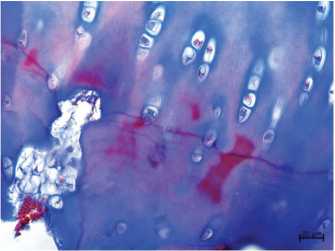
В промежуточной зоне хондроциты располагались чаще одиночно и в виде изогенных групп, состоящих из двух клеток. В глубокой зоне выражено колончатое расположение хрящевых клеток, преобладали гипертрофированные хондроциты, часть клеток — с признаками хондроптоза.
В обеих группах выявлены участки нарушения базофильной линии, проникновение сосудов и костномозгового паннуса в глубокую зону некальцифицированного хряща (рис. 3, б, г).
Частота встречаемости сосудов в глубокой зоне в группе 1 — (0,65 ± 0,06), что статистически значимо ( р = 0,0148) больше, чем в группе 2 (0,35 ± 0,02).
Толщина некальцифицированного хряща в группе 1 статистически значимо меньше контроля, в группе 2 сопоставима с контролем, различия между группами статистически значимы (табл. 1). Значения параметра «толщина кальцифицированного хряща» в группах 1 и 2 сопоставимы с контролем (табл. 1).
Таблица 1
Количественные характеристики суставного хряща и субхондральной зоны большеберцовой кости в опытных группах и в контроле
|
Группы |
Параметры |
|||||
|
h uncal.cr , (мм) |
h cal.cr. (мкм) |
h s.b.pl (мкм) |
h Tr (мкм) |
S Tr (%) |
||
|
Контроль |
Me |
1,28 |
125,93 |
144,11 |
156,47 |
45,21 |
|
(Q1; Q3) |
(1,21; 1,33) |
(104,68; 135,66) |
(87,55; 205,31) |
(81,95; 234,91) |
(24,73; 49,15) |
|
|
[min–max] |
[1,16–1,66] |
[95,98–173,84] |
[60,92–223,87] |
[28,23–281,94] |
[20,31–51,01] |
|
|
Группа 1 |
Me |
1,09 |
132,64 |
67,95 |
107,93 |
30,81 |
|
(Q1; Q3) |
(1,06; 1,13) |
(79,92; 154,41) |
(87,55; 205,31) |
(59,05; 124,93) |
(20,11; 35,49) |
|
|
[min–max] |
[1,01–1,15] |
[60,14–194,82] |
[40,02–203,86] |
[21,06–293,71] |
[11,79–38,51] |
|
|
p |
0,0001 |
0,3263 |
0,0218 |
0,0071 |
0,0102 |
|
|
Группа 2 |
Me |
1,24 |
120,34 |
97,44 |
112,91 |
37,04 |
|
(Q1; Q3) |
(1,18; 1,32) |
(105,43; 129,24) |
(87,97; 172,96) |
(70,35; 140,54) |
(28,72; 37,69) |
|
|
[min–max] |
[1,15–1,79] |
[75,36–189,76] |
[60,92–167,86] |
[56,82–195,12] |
[18,28–49,01] |
|
|
p |
0,5823 |
0,9081 |
0,0105 |
0,2801 |
0,0126 |
|
|
р1 |
0,0124 |
0,9528 |
0,001 |
0,0129 |
0,0268 |
|
Примечание : р — уровень значимости отличий при сравнении с контролем, р1 — уровень значимости отличий между группами по критерию Манна – Уитни, при р ≤ 0,05.
Гистопатология субхондральной зоны
Субхондральная костная пластинка в контроле неравномерной толщины, непрерывна на всем протяжении (рис. 4, а). В опытных группах субхондральная костная пластинка истончена, в группе 1 местами отсутствовала (рис. 4, б), в группе 2 регистрировали участки, выстланные остеобластами (рис. 4, в). Значения параметра «толщина субхондральной костной пластинки» в обеих группах статистически значимо меньше нормы, минимальные показатели зарегистрированы в группе 1 (табл. 1).
При окрашивании гистологических срезов трехцветным методом по Массону субхондральная костная пластинка в контроле окрашена преимущественно в красный цвет, в группе 2 отмечали снижение доли фуксинофильных структур, а в группе 1 преобладали анилинофильные структуры (рис. 4), что косвенно свидетельствовало о снижении минерализации костного матрикса.
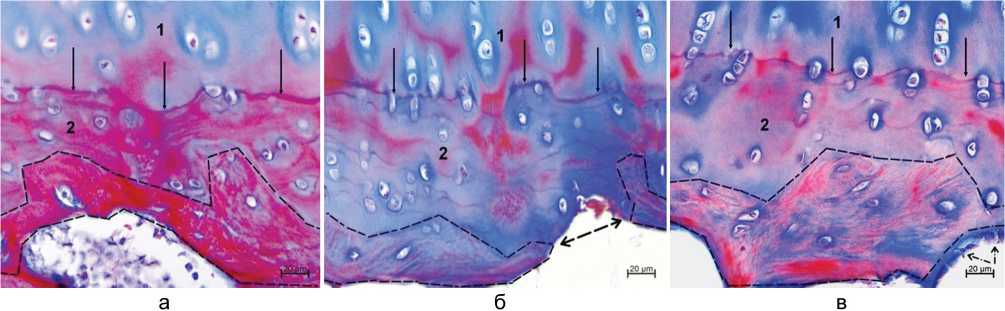
Рис. 4. Контакт суставного хряща и субхондральной кости: а — контроль; б — группа 1; в — группа 2. Обозначения: 1 — глубокая зона суставного хряща; 2 — зона обызвествленного хряща; сплошные стрелки — базофильная линия; пунктирная линия — границы субхондральной костной пластинки; обоюдоострая пунктирная стрелка — субхондральная костная пластинка отсутствует; пунктирные стрелки — остеобласты, выстилающие субхондральную костную пластинку. Парафиновые срезы. Окраска трехцветным методом по Массону, ×400
В опытных группах выявлено разряжение субхондральной трабекулярной кости, наиболее выраженные признаки резорбции отмечены в группе 1 (рис. 5, а, б). Гистоморфометрическое исследование выявило статистически значимое снижение значений параметров площади и толщины трабекул в группе 1 относительно контроля (табл. 1), в группе 2 параметр «толщина трабекул» не имел статистически значимых отличий с контролем, различия между группами статистически значимы (табл. 1).
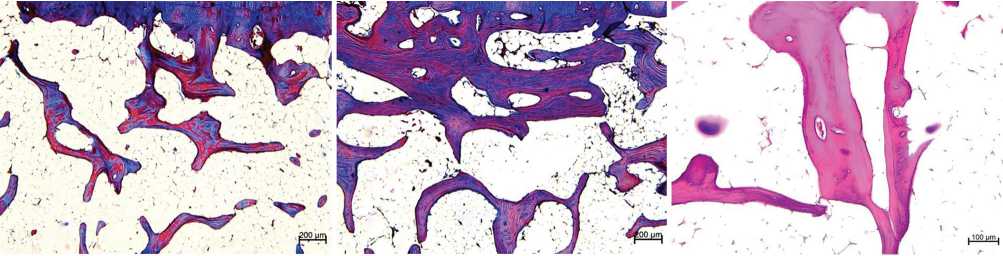
а б в
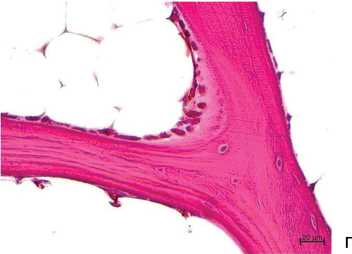
Рис. 5. Субхондральная трабекулярная кость: а — группа 1; б — группа 2; в — аутолиз костного матрикса (группа 1); г — остеобласты на поверхности трабекулы (группа 2). Парафиновые срезы, окраска трехцветным методом по Массону (а, б), гематоксилином и эозином (в, г). Увеличение: ×40 (а, б), ×100 (в), ×400 (г)
В группе 1 чаще отмечали явления остеолизиса, — аутолиз костного матрикса, расщепление основного вещества трабекул по линиям склеивания (рис. 5, в), поверхности костных трабекул не содержали клеток. В группе 2 регистрировали поверхности трабекул, выстланные активными остеобластами, продуцирующими основное вещество (рис. 5, г).
ОБСУЖДЕНИЕ
Для восстановления функции протезированной конечности большое значение имеет состояние смежного сустава. При протезировании нижних конечностей и у детей, и у взрослых пациентов отмечают контрактуры и формирование деформирующего артроза в вышерасположенных суставах [22]. Известно, что оперативное вмешательство на костных структурах сопровождается компенсаторными изменениями метаболизма костной ткани, — развитием стрессового ремоделирования, обеспечивающего адаптационную перестройку костной ткани после операции [23], при этом в смежном суставе отмечают деструктивные изменения суставного хряща, синовит [24, 25].
В данном исследовании впервые на экспериментальной модели методами гистоморфометрии изучены особенности ремоделирования субхондральной зоны большеберцовой кости при экзопротезировании конечности. К процессам ремоделирования костной ткани можно отнести истончение субхондральной костной пластинки, остеолизис и изменение архитектоники костных трабекул в субхондральной трабекулярной кости, снижение минерализации костной ткани, интенсивнее выраженные в группе 1, признаки репаративного остеогенеза, — активные остеобласты, выстилающие поверхности костных трабекул в группе 2. Гистоморфометрически зарегистрировано уменьшение значений параметра «толщина субхондральной костной пластинки» в группе 1 в два раза, в группе 2 — в 1,5 раза по сравнению с контролем. Значения параметра «площадь трабекул» снижены в среднем в группе 1 на 17 %, в группе 2 — на 10 %, минимальные значения параметра «толщина трабекул» зафиксированы в группе 1.
Согласно классификации O-M. Aho et al. [26], наблюдаемые в нашем исследовании изменения субхондральной зоны соответствовали стадии 0 (очень ранние признаки остеоартроза), когда субхондральный склероз не выражен, субхондральная костная пластина — тонкая.
Инициирующая роль субхондральной кости в деградации суставного хряща подтверждена многочисленными исследованиями [27–29]. Субхондральная кость вместе с суставным хрящом образуют «осте-охондральную» функциональную единицу и является механической основой для суставного хряща, поддерживая его структуру и трофику, защищая от чрезмерных нагрузок [30–32].
При патологических изменениях в зоне контакта между хрящом и субхондральной костью во всем суставе происходят значительные структурные изменения. Истончение субхондральной костной пластинки и разряжение субхондральной трабекулярной кости приводят к увеличению нагрузки на суставной хрящ и нарушению его структуры [29]. Ремоделирование субхондральной костной ткани сопровождается сосудистой инвазией в область кальцинированного хряща. Сочетание сосудистой инвазии в суставной хрящ и повышенного притока катаболических факторов без ингибирования металлопротеиназ обеспечивает прогрессирование деструкции хрящевой ткани [33, 34].
Наблюдаемые структурные изменения суставного хряща большеберцового плато при протезировании голени (истончение, гибель части хондроцитов поверхностной зоны, неравномерное окрашивание межклеточного матрикса) соответствовали степени 0–1 по гистологической классификации Международного общества изучения остеоартроза OARSI [35].
Статистически значимое снижение значений толщины суставного хряща зарегистрированы в группе 1 и сопровождались бóльшей (в 1,8 раза) частотой встречаемости сосудов в глубокой зоне некальцифи-цированного хряща по сравнению с группой 2. Применение имплантатов группы 2 способствовало менее выраженным изменениям в субходральной зоне.
Полученные знания об особенностях структурной реорганизации суставного хряща и субхондральной зоны смежного сустава при протезировании конечности имеют большое значение. Терапевтические стратегии, направленные на стимуляцию репаративного остеогенеза, могут предотвратить разрушение суставов.
ЗАКЛЮЧЕНИЕ
Гистоморфометрические изменения остеохондрального компонента большеберцового плато при протезировании голени (истончение субхондральной костной пластинки, рарефикация субхондральной трабекулярной кости, проникновение сосудов в некальцифицированный хрящ) являются предикторами артроза. Применение имплантатов из сплава Ti6Al4V с кальций-фосфатным покрытием способствует снижению интенсивности процессов резорбции костной ткани и активации процессов репаративного остеогенеза.


