Ремоделирующая лазерная терапия влагалища при генитоуринарном менопаузальном синдроме
Автор: Оразов М.Р., Демяшкин Г.А., Токтар Л.Р.
Журнал: Хирургическая практика @spractice
Статья в выпуске: 1, 2018 года.
Бесплатный доступ
Вагинальная атрофия - одно из наиболее частых патологических состояний женщин в пери- и постменопаузе и её проявления отри- цательно влияют на их качество жизни.Одной из самых актуальных проблем современной гинекологии являются изменения мочеполового тракта женщины, связанные с окончани- ем репродуктивного периода жизни и с её неизбежным старением. Для описания эстрогензависимых возрастных изменений, затрагивающих наружные половые органы, влагалище, уретру и мочевой пузырь, был принят новый термин - генитоуринарный менопаузальный синдромГУМС (IMS, 2014). Патогенетически оправданной терапией при любых расстройствах, связанных с климактерием, является применение эстрогенов (IMS, 2016), но в арсенале клинициста должны быть и немедикаментозные средства с сопоставимой эффективностью, в частности, гибридная двуволновая фракционная лазерная терапия.Цель исследования: расширение возможностей терапии генитоуринарного синдрома на основании клинико-морфологической оценки эффек- тивности ремоделирующей фракционной лазерной терапии.дизайн исследования: не сравнительное, независимое, проспективное, клинико-морфологическое исследование 26 пациенток (n=26) в возрасте 49.5±5 лет, обратившихся в период с октября 2017 по февраль 2018 года для консервативного лечения на клиническую базу кафедры акушер- ства и гинекологии с курсом перинатологии РУДН (НУЗ ЦКБ №6 ОАО «РЖД»)с диагнозом «Постменопаузный атрофический вагинит» (МКБ№95.2) и давших добровольное информированное согласие на включение их в исследование: получение биологического материала, изучение клинических, аппаратных и лабораторных показателей, проведение терапии, статистическую обработку и публикацию полученных результа- тов...
Генитоуринарный менопаузальный синдром, вульвовагинальная атрофия, лазерное ремоделирование
Короткий адрес: https://sciup.org/142221830
IDR: 142221830 | УДК: 618.15 | DOI: 10.17238/issn2223-2427.2018.1.22-37
Текст научной статьи Ремоделирующая лазерная терапия влагалища при генитоуринарном менопаузальном синдроме
Актуальность проблемы
Одной из самых актуальных проблем современной гинекологии являются изменения мочеполового тракта женщины, связанные с окончанием репродуктивного периода жизни и с её неизбежным старением. Широко распространенные для описания этих изменений термины «урогенитальный синдром», «атрофический вульвовагинит», в том числе и единственный связанный диагноз в МКБ-X (N95.2 – постменопаузный атрофический вагинит), и схожие термины не отражают весь объем современных представлений об
-
a E-mail: omekan@mail.ru
-
b E-mail: dr.dga@mail.ru
-
c E-mail: toktarly@yandex.ru
этиологии, патогенезе и клинической картине синдрома[1,2]. Международное общество специалистов по изучению сексуального здоровья женщин (ISSWSH, International Society for the Study of Women’s Sexual Health) и Североамериканское общество специалистов по менопаузе (NAMS, North American Menopause Society) инициировали коллегиальный пересмотр терминологии в формате согласительной конференции (Чикаго, 2013) [1,2]. Для описания эстрогензависимых возрастных изменений, затрагивающих наружные половые органы, влагалище, уретру и мочевой пузырь, был принят
новый термин – генитоуринарный менопаузальный синдром (Genitourinary Syndrome of Menopause; GSM/ ГУМС ) [2]. В 2013–2014 годах исполнительные комитеты профессиональных сообществ и Международного общества специалистов по менопаузе (IMS, International Menopause Society) вынесли окончательные одобрительные вердикты. Обоснование нового определения было опубликовано в 2014 году в нескольких авторитетных тематических журналах международного уровня под одним и тем же названием [1].
В период постменопаузы у большинства пациенток по мере снижения эстрогеновой депривации прогрессивно истончается слизистая оболочка влагалища: снижается митотическая активность базального и парабазального слоёв влагалищного эпителия, усугубляется атрофия, уменьшается карио-пикнотический индекс. В результате изменения клеточного состава – исчезновения поверхностных и промежуточных клеток многослойного плоского эпителия – нарушается поступление гликогена во влагалищный секрет в составе слущенных эпителиоцитов, снижается пул лактобактерий во влагалищном биотопе, повышается рН среды, создаются условия для активации условно-патогенной флоры и, как следствие, для воспалительных и дисбиотических процессов [3,4].
Вышесказанное иллюстрирует не новое, но весьма показательное исследование с участием 73 женщин в постменопаузе, не принимавших гормональную терапию. Детальный анализ микробиоты влагалища показал, что у 49% из них лактобациллы отсутствовали полностью, а у остальных пациенток количество лактофлоры было в 10–100 раз меньше, чем у женщин в пременопаузе [5].
Дистрофическим изменениям на фоне гипоэстрогенизма подвержены не только слизистая оболочка влагалища, но и практически все соединительнотканные и мышечные структуры его стенки. Рецепторы к эстрогенам обнаруживают и в строме вагинальной стенки, и в эндотелии сосудов – именно это объясняет снижение кровообращения вплоть до ишемии тканей. Не менее важно, что рецепторы к эстрогенам есть и у вегетативных, и у сенсорных нейронов влагалища и вульвы, что создаёт предпосылки к появлению жжения, зуда, спонтанной или спровоцированной боли, диспареунии. У 70% пациенток на фоне прогрессирующих изменений резко падает сексуальная активность, более 30% предъявляют жалобы на диспареунию, дискомфорт и жжение во влагалище [6].
И если вазомоторные проявления климактерического синдрома нивелируются с течением времени, то ГУМС неуклонно прогрессирует без лечения, значительно ухудшая здоровья и качество жизни женщин постменопаузального возраста.
Безусловно, все эти звенья патогенеза у значимой доли женщин накладываются на проблемы несостоятельности тазового дна («зияние половой щели»), пролапса тазовых органов [15,16] и недержания мочи, цисталгии, никтурии [13,14], без решения которых восстановление нормальной микроэкологии бывает чрезвычайно трудной задачей.
Нарушение микробиоты влагалища, предрасполагающие этому факторы и связанные состояния, формирующие ГУМС, неизбежно сопровождаются формированием и персистированием очагов хронического воспаления в коже вульвы, слизистой влагалища и подлежащих тканях. Известно, что воспаление сопровождается накоплением CD8+ Т-лимфоцитов, которые подвергают деградации клеточные элементы пораженной ткани путем лизиса или активации апоптоза. Таким образом, обнаружение в очаге воспаления цитотоксических Т-лимфоцитов путем определения их специфического маркера, трансмембранного гликопротеина CD8 , позволяет сделать вывод о наличии воспалительной реакции, а также оценить степень её выраженности в зоне инфильтрации по числу самих CD8+ Т-лимфоцитов[8].
Между тем, вклад в развитие воспалительной реакции вносят не только клетки лимфоцитарного, но и моноцитарного ряда – макрофаги. Анализ экспрессии генов, кодирующих синтез мембранных гликопротеинов макрофагов разных подтипов (M1 и M2), позволяет не только определить их присутствие и качественное соотношение, но и предположить относительный характер протекания воспалительных реакций на молекулярном уровне в очаге воспаления. Макрофаги, экспрессирующие на своей поверхности гликопротеин CD80 определяют, как условно относящиеся к подтипу провоспалительных (M1), т.е. синтезирующих и выделяющих специфических клеточные медиаторы, часть из которых обеспечивает активацию и миграцию клеточных элементов воспаления (лимфоцитов, самих макрофагов), другая часть оказывает непосредственно стимулирующее влияние на развитие и поддержание воспалительной реакции в пораженном участке[8].
Условно прорегенераторные (M2) макрофаги, характеризующиеся экспрессией мембранного гликопротеина CD163 , напротив, принимают участие в реакциях, направленных на снижение активности воспалительных реакций, угнетение миграции лимфоцитов и стимулирование пролиферации сосудов, т.е. ангиогенеза [8].
По современным представлениям, любое воспалительное изменение сопровождается оксидативным стрессом с выбросом большого числа активных форм кислорода, продуцируемых как мигрирующими лейкоцитами, так и резидентными клетками самой ткани, в том числе фибробластами [9]. Оксидативный стресс приводит к нарушению адекватной пролиферации большинства клеточных дифферонов ткани, индуцирует апоптоз и, предположительно, сохраняется длительное время ввиду нарушения ангиогенеза. Нарушению ангиогенеза при ГУМС способствует также и сниженный уровень эстрогенизации тканей, формируется замкнутый круг патогенеза: снижение эстрогенов нарушает пролиферацию и трофику – нарушается биоценоз влагалища с раз- витием воспалительного процесса – воспаление приводит к оксидативному стрессу – усиливается апоптоз и деградация клеток – усиливается коллагенизация – ухудшается трофика – нарушается пролиферация (рис.1).
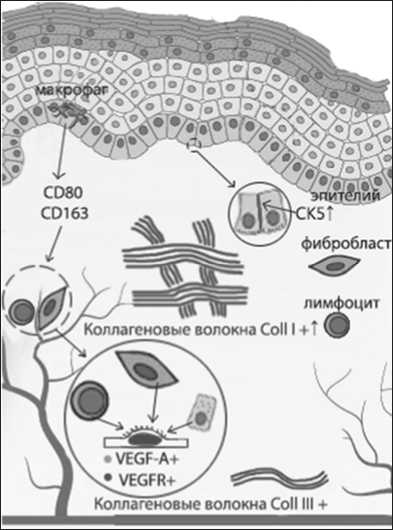
Рис. 1. Предполагаемые ультраструктурные механизмы ГУМС и его маркеры (схема)
Маркером изменения трофики влагалищной стенки может служить васкулярно-эндотелиальный фактор роста (VEGF-A), экспрессируемый фибробластами, макрофагами, кератиноцитами и, наконец, тромбоцитами. VEGF-A стимулирует пролиферацию эндотелия сосудов, активируя свой собственный сигнальный путь, что необходимо для снижения степени окислительного стресса, нормализации местного гомеостаза, уменьшения активности воспаления и активации регенерации тканей. В условиях снижения VEGF-A эти восстановительные процессы невозможны[12].
Закономерно, что присутствие очага воспаления в соединительнотканном слое неизбежно сказывается на состоянии покрывающего её эпителия, в первую очередь, клеток базального слоя. Базальная мембрана обеспечивает не только поддержание и обновление вышележащих слоев многослойного плоского эпителия, но и его прикрепление к базальной мембране и связь с подлежащей соединительной тканью. Ключевую роль в этих процессах играют элементы цитоскелета, в частности, промежуточные филаменты базальных эпителиоцитов. Эти волокна обеспечивают внутриклеточную архитектонику, связываются с десмосомами, формирующими межклеточные контакты кератиноцитов базального слоя эпителия, т.е. образуют единую поддерживающую структуру, обеспечивая механи- ческую прочность и упругость эпителия при воздействии стрессовых факторов. Образование этих волокон происходит в результате димерезации цитокератина 5 (CK5/K5) с цитокератином 14 (CK14/K14), Комплексы CK5/CK14 связываются с полудесмосомами, что обусловливает прикрепление эпителиоцитов базального слоя к подлежащей базальной мембране и сохранение связи с поверхностными слоями, что необходимо для адекватной трофики слизистой оболочки в целом [10].
Вместе с тем, при сохраняющемся очаге воспаления существенные изменения наблюдаются и глубже – в волокнистой соединительной ткани, где отмечаются качественные и количественные изменения эластических волокон , «нежного» коллагена III типа (Coll.III) и «грубого» коллагена I типа (Coll.I). Закономерно, что возможные изменения синтеза коллагена, сопровождающие воспалительную реакцию в условиях гипотрофии, не может не менять соотношение экспрессии фибробластами матриксных металлопротеиназ MMP-1, MMP-2, MMP-3, MMP-9, участвующих в реорганизации внеклеточного матрикса путем лизиса компонентов аморфного и волокнистого вещества[8].
Также сравнительно объективным маркером для оценки состояния волокнистого компонента соединительной ткани стенки влагалища выделяют экстрацеллюлярный матрикс-ный протеин 1 (ECM1), синтезируемый активными фибробластами. ECM1 участвует в дифференцировке кератиноци-тов, пространственной организации эпителия, регулирует сборку базальной мембраны и коллагеновых микрофибрилл интерстициального матрикса. Исходя из функциональной роли, возможное увеличение экспрессии ECM1 и его активация соответствует компенсаторным морфологическим изменениям при повреждениях ткани[10].
Ещё одним перспективным, но более общим маркером регенерации тканей предполагают другой протеин внеклеточного матрикса – периостин , способствующий пролиферации кератиноцитов и фибробластов. Сниженные уровни экспрессии гена, кодирующего периостин ( POSTN ), коррелируют с нарушением регенерации, задержкой в заживлении при различных видах повреждения тканей [11].
Наконец, важной составляющей стенки влагалища является ее гладко-мышечный компартмент. Гладко-мышечные клетки участвуют в формировании правильной архитектоники ткани путем организации волокнистых компонентов соединительной ткани. Более того, часть контрактильных гладких миоцитов способны к переходу в синтезирующий тип миоцитов, способных вырабатывать компоненты внеклеточного матрикса, в том числе и коллагены в условиях все того же дефицита трофики с формированием оксидативного стресса. Определение маркера актиновых миофиламентов α-SMA позволит понять глубину деградации влагалищной стенки при атрофии и деформации более поверхностных слоев[9].
Более четверти века в профессиональном сообществе идут обсуждения того, как именно лечить пациенток при выявлении у них симптомов урогенитальных расстройств — местно или локально, насколько длительно, только эстрогенами или в комплексе с применением дополнительных методов.
Понятно, что патогенетически оправданной терапией при любых расстройствах, связанных с климактерием, является применение эстрогенов. Подобные рекомендации имеет и Международное общество по менопаузе (International Menopause Society, IMS, 2014) [1,2,3,4], и множество других источников. Интересно, что при назначении эстрогенов внутрь у 30–45% пациенток эффект коррекции вагинальной атрофии развивается не сразу [2]. Кроме того, системное использование эстрогенов может иметь ограничения наличием противопоказаний. Получается, что вполне оправданной тактикой будет назначение местных форм эстриола. Оказывая значительно меньший системный эффект, чем препараты эстрадиола, эстриол при местном применении хорошо улучшает кровоснабжение влагалищной стенки, восстановлива-ет транссудативную функцию слизистой оболочки урогенитального тракта, поддерживает синтез, достаточную толщину и эластичность эпителия, поддерживает уровень гликогена во влагалищном содержимом, а также стимулирует секрецию иммуноглобулинов, т.е. препятствует развитию вагинита.
Такой вывод сделан специалистами Кокрейновского сотрудничества в результате выполненного анализа 15 рандомизированных плацебо-контролируемых исследований эффективности локальной терапии эстрогенами [7]. Аналогичные результаты были получены при анализе работы Общества эндокринологов, заключавшейся в систематическом обзоре опубликованной литературы по гормональной терапии в постменопаузе. Кроме того, сегодня с уверенностью можно утверждать, что локальное применение эстриола снижает риск рецидива мочевых инфекций, гиперактивного мочевого пузыря и синдрома недержания мочи у женщин в постменопаузе (уровень доказательности А) эффективнее, чем препараты для системного применения (ОР 1,65) [5,6]. И если системные эстрогены снижают частоту (p=0,0371) и императивность ночных мочеиспусканий (p=0,0425), то местное использование средств этой группы сокращает число эпизодов недержания мочи (p=0,0002) и повышает ёмкость мочевого пузыря (p = 0,0018) в сравнении с плацебо.
В РФ для вагинального применения зарегистрирован как монопрепарат эстриола, так и его комбинация с прогестероном и живыми лактобактериями L. casei rhamnosus в составе вагинальных капсул триожиналь. Прогестерон в составе комплексного препарата способствует формированию поверхностных и промежуточных слоёв эпителия и синтезу гликогена. Вместе с тем следует подчеркнуть о его не репродуктивных эффектах: анальгезирующий – за счет подавления синтеза простагландинов; нейропротективный и нейрорепа-ративный – за счет селективного воздействия на рецепторы нейромедиаторов; регуляторный – за счет усиления синтеза мышечного белка. [13]. А штамм лактобактерий L. Casei rhamnosus, хорошо продуцируя молочную кислоту и быстро восстанавливая оптимальный pH влагалищной среды, имеет дополнительное положительное свойство – ингибирует рост С. Albicans [13]. Но главным достоинством комплексного состава является наличие в нем прогестерона с его не связанными с его классической ролью воспроизводства эффектами, а также возможность снизить дозировку эстриола до минимально достаточных 0,2 мг, получив такой же эффект, как от больших доз местной монотерапии эстриолом [13].
Но и эти, казалось бы, оптимистичные данные не позволяют осуществлять помощь пациенткам с ГУМС, имеющим противопоказания для гормонотерапии, получившим осложнения от терапии или отказавшимся от нее вследствие гормонофобии. Значит, в арсенале клинициста должны быть и немедикаментозные средства с сопоставимой эффективно-стью[19,20]. Одним из таких направлений является применение местной лазеротерапии.
Развитие лазеротерапии, начавшееся с косметологических процедур постоянными СО2-лазерами, пройдя через этап импульсных СО2- и эрбиевых Er:YAG-лазеров, привело к возможности применять современные гибридные двуволновые (комбинированные) фракционные лазеры с yникальными возможностями и хорошим лечебным эффек-том[14]. Основным отличием последних является способность как одновременно, так и по отдельности доставлять лазерные волны двух длин: 1470 нм для коагуляции и 2940 нм для абляции. Вышеуказанный метод позволяет эпителию восстанавливаться быстрее, а сочетание абляционного и неабляционного воздействия за счет разной длины волны влияет на разные слои влагалищной стенки, нивелируя нежелательные эффекты каждого из них и достигая лечебного эффекта меньшим числом процедур, но и более быстрым восстановлением, что было показано в результатах пилотного исследования[14].
Цель исследования: расширение возможностей терапии генитоуринарного синдрома на основании клинико-морфологической оценки эффективности ремоделирующей фракционной лазерной терапии
Контингент, материалы и методы
Исследования проводились на клинической базе кафедры акушерства и гинекологии с курсом перинатологии МИ РУДН в период с октября 2017 по февраль 2018 года (НУЗ ЦКБ №6 ОАО «РЖД») и на кафедре патологической анатомии им. академика А.И. Струкова ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский Университет).
Дизайн исследования: не сравнительное, независимое, проспективное, клинико-морфологическое исследование.
Критериями включения в исследование явились: возраст менопаузального перехода или постменопаузальный; ГУМС, подтвержденный клинико-лабораторными методами, отри- цательный PAP-тест, отказ пациенток от локальной менопаузальной гормонотерапии (гормонофобия).
Критериями исключения служили: репродуктивный возраст, предварительная локальная или системная менопаузальная гормонотерапия; отсутствие признаков вагинальной атрофии; воспалительные заболевания органов малого таза в стадии обострения; злокачественные опухоли репродуктивной системы, а также болезни вульвы, шейки и влагалища, ассоциированных ВПЧ-инфекцией (ЦИН, ВИН, ВАИН).
Таким образом, в исследование были взяты 26 пациенток (n=26) в возрасте 49.5±5 лет, обратившихся для консервативного лечения на клиническую базу кафедры акушерства и гинекологии с курсом перинатологии РУДН с диагнозом «Постменопаузный атрофический вагинит» (МКБ №95.2) и давших добровольное информированное согласие на включение их в исследование: получение биологического материала, изучение клинических, аппаратных и лабораторных показателей, проведение терапии, статистическую обработку и публикацию полученных результатов. Диагнозы подтверждены клинически и на основании лабораторных и инструментальных исследований.
Клиническую оценку симптомов вагинальной атрофии проводили по шкале D. Barlow [17,18].
Эта шкала, выраженная в баллах, облегчает оценку интенсивности предъявляемых жалоб, позволяя перевести субъективные данные в параметрические значения: 1 балл соответствует минимальным нарушениям, не влияющим на повседневную жизнь; 2 балла характеризуют дискомфорт, периодически влияющий на повседневную жизнь; 3, 4 и 5 баллов – это, соответственно, умеренные, выраженные и крайне выраженные нарушения.
Гинекологическое обследование включало осмотр наружных и внутренних половых органов, при котором особое внимание уделялось состоянию вульвы, слизистой влагалища и шейки матки. Дополнительно определяли значение вагинального рН: индикатор вводился во влагалище с экспозицией 30 сек, результат оценивался по цветовой шкале в диапазоне рН 3,0 – 7,0. Проведение рутинного кольпоцитоло-гического исследования позволило рассчитывать карио-пик-нотический индекс вагинального эпителия, определяемый как процентное соотношение поверхностных клеток с ядер-ным пикнозом к общему числу клеток в кольпоцитограмме.
Кольпоскопия проводилась всем пациенткам с целью исключения патологических процессов шейки матки и верификации эпителиальной атрофии стенок влагалища. Степень эпителиальной атрофии определяли по 4-балльной шкале (0 – отсутствует, 1 – легкая, 2 – умеренная, 3 – тяжелая).
На основании осмотра, кольпоскопической картины и pH-метрии влагалища определяли индекс вагинального здоровья в баллах (табл. 1).
Таблица 1
Индекс вагинального здоровья (по Banhmann G., 1995)
|
Индекс |
Характеристики эпителия |
|||||
|
Баллы |
Изменения |
Эластичность |
Влажность |
Транссудат |
Целостность |
pH |
|
1 |
Высшая степень |
Нет |
Выраженная сухость, воспаление |
нет |
Петехии, кровоточивость |
>6.1 |
|
2 |
Выраженные |
Слабая |
Выраженная сухость, нет воспаления |
Скудный, поверхностный, желтый |
Кровоточивость при контакте |
5,6-6,0 |
|
3 |
Умеренные |
Средняя |
Минимальная |
Поверхностный, белый |
Кровоточивость при соскабливании |
5,1-5,5 |
|
4 |
Незначительные |
Хорошая |
Умеренная |
Умеренный, белый |
Нерыхлый, тонкий, целый |
4,7-5,0 |
|
5 |
Нет (норма) |
Отличная |
Нормальная |
Достаточный, белый |
Норма |
<4,6 |
Гиперпластические и опухолевые процессы шейки, тела и придатков матки были исключены при помощи сонографии, пайпель-биопсии и PAP-теста.
Всем пациенткам была проведена процедура лазерного ремоделирования на аппарате «Гибридный фракционный вагинальный лазер diVaTM с длиной волны 1470/2940 нм» в cистеме мультиплатформы JOULE. Уникальная платформа diVaTM – это единственная в мире система гибридного фракционного вагинального ремоделирования, способная как одновременно, так и по отдельности доставлять лазерные волны двух длин: 1470 нм для коагуляции и 2940 нм для абляции.
Лазерная волна длиной 1470 нм поглощается жидкостями и поэтому идеально подходит для прогрева мягких тканей с целью создания контролируемых зон коагуляции тканей на необходимой глубине эпителиального компартмента стенки влагалища, что создает только неабляционные каналы. Впоследствии эти каналы ремоделируются в ответ на термическое повреждение тканей. Главным плюсом фракционного неабляционного лазерного воздействия является короткий период реабилитации, но методика требует большого количества процедур для достижения желаемого эффекта.
Лазерная волна другой длины, 2940 нм, также хорошо поглощается жидкостью, но приводит к точечной, фракционной абляции столбиков эпителия слизистой оболочки и подслизистого компартмента влагалища. Эти участки в дальнейшем должны подвергаться интенсивной эпителизации. Абляционные процедуры позволяют достигать желаемого результата при значительно меньшем числе процедур, но обратной стороной этих возможностей является более длительный период реаблитации тканей.
Уникальная комбинация разных длин волн в гибридном фракционном лазере позволяет сочетать абляционную и неабляционную длины волн, по-разному воздействовать на гистоархитектонику мягких тканей влагалища, в результате получая хороший эффект абляционной методики при коротком восстановительном периоде, как у неабляционных лазеров.
Программа исследования эффективности метода лечения базировалась на биопсии стенок влагалища методом панч-биопсии до однократного применения процедуры лазерного ремоделирования, а также через один и три месяца после терапии (трехэтапный контроль).
Для подтверждения указанных эффектов гибридного фракционного лазерного воздействия на влагалищную стенку и обоснования расширения возможностей терапии ГУМС негормональными физическими методами мы провели морфологическое, иммуногистохимическое, морфометрическое исследования биоптатов влагалища пациенток, а для оценки экспрессии некоторых генов использовали методику полимеразной цепной реакции в режиме реального времени.
Несомненным достижением исследования стало изучение всеми заявленными методиками всех пациенток, вошедших в когорту (N=26). У каждой пациентки на каждом из трех этапов бралось два образца ткани влагалища – из передней и задней стенок. Таким образом, в общей сложности было проведено 156 исследований гистоструктуры стенки влагалища (26 пациенток * 2 биоптата * 3 этапа).
Материал признавался удовлетворительным для включения в исследование только тогда, когда проведением гистологических методов подтверждалось наличие в биоптате всех компартментов стенки влагалища – слизистого, мышечного и фасциального.
Морфологическое исследование проводили методом световой микроскопии после подготовки биоптатов согласно стандартной методике (фиксация в нейтральном формалине, гистологическая проводка, окрашивание гематоксилином и эозином, заключение).
Иммуногистохимическое исследование (ИГХ) выполняли после депарафинизации и регидратации парафиновых срезов по стандартному протоколу в автоматическом режиме в иммуногистостейнере Bond-Max («Leica», Германия). Мышиные антитела (Abcam, Великобритания) применялись как первичные – к коллагену I типа Col.I (Anti-Collagen I antibody, Clone abab138492, 1:500), коллагену III типа Col.III (Anti-
Collagen III antibody, Clone ab23445, 1:750), гладкомышечному альфа-актину α-SMA (Anti-alpha smooth muscle Actin antibody, Clone ab7817, 1:200), васкулярно-эндотелиальному фактору роста VEGF-A (Anti-VEGFA antibody, Clone ab46154, 1:400), цитокератину CK5 (Anti-Cytokeratin 5 antibody, Clone ab75869, 1:400), специфическому маркеру трансмембранного гликопротеина CD8 (Anti-CD8 antibody, Clone ab93278, 1:300). Вторичные антитела были универсальными «Cell Marque» (США). Для каждого маркёра выполнялись контрольные исследования с целью исключения псевдопозитивных и псевдонегативных результатов. Ядра клеток докрашивали гематоксилином Mayer; промывали под проточной водой; дегидратировали; заключали под покровные стёкла. Интенсивность ИГХ-окрашивания срезов оценивали при помощи трехбалльной шкалы: слабое (1 балл), умеренное (2 балла), выраженное окрашивание (3 балла). Учитывая биохимические особенности и характер расположения окрашиваемых структур (коллагены), определяли соотношение их распределения и суммарное содержание.
Визуализацию биопсийного материала выполняли на светооптическом микроскопе «Leica DM2500» (Leica Microsystems, Германия), совмещённом с видеокамерой «Pixelink Microscopy GmbH» (Канада) и программным обеспечением ZEN Lite.
Компьютерную морфометрию для оценки результатов иммуногистохимической реакции и определения площади позитивно окрашенных объектов в поле зрения осуществляли при помощи компьютерной системы анализа изображения с открытым кодом ImageJ 1.51. Для этого после выполненной ИГХ реакции с соответствующими первичными антителами проводили микрофотосъемку десяти случайно отобранных полей зрения при увеличении ×200. Далее полученное изображение автоматически подвергали нормализации и переводили из режима цветной 24-битной картинки (RGB) в режим 256 градаций серого (gray scale), выполняли бинаризацию объектов с заданным уровнем чувствительности. При обработке микрофотографий системой анализа изображений отсекались бинарные объекты с уровнем яркости >150 и выполнялось определение суммарной площади позитивно окрашенных объектов от общей площади микрофотографий, выраженное в процентах.
Полимеразная цепная реакция в режиме реального времени (ПЦР-РВ). Фрагменты биоптатов стенки влагалища помещались в стабилизирующий раствор RNAlater (QIAGEN, Нидерланды) и хранились при -70°C. Впоследствии образцы подвергли гомогенизации согласно стандартному протоколу. Экстракцию тотальной РНК производили с использованием набора готовых реактивов RNeasy Plus Mini Kit (QIAGEN, Нидерланды). Синтез комплементарной ДНК (кДНК) с матрицы полученной РНК осуществляли с помощью набора SuperScript™ VILO™ Master Mix (Invitrogen). Выделенные кДНК подверглись ПЦР-РВ с использованием готовой смеси реа- гентов ABsolute Blue QPCR Mix (Thermo Scientific, США) с ин-теркалирующим флуоресцентным красителем SYBR Green I. ПЦР-РВ проводилась с использованием StepOne System (Applied Biosystems, CША) и штатного программного обеспечения. Анализ экспрессии генов проведен с использованием метода определения порогового цикла (Ct) и вычисления относительной экспрессии генов согласно протоколу. Нормирование и внутренний контроль выполнены относительно референсного гена домашнего хозяйства GAPDH, уровень экспрессии которого по умолчанию считается постоянным. Подбор праймеров был осуществлён на основании общедоступных материалов о последовательностях ДНК и мРНК генов в базе данных NCBI с использованием программы Primer-BLAST. Таким образом была оценена экспрессия в полученных образцах ткани влагалища генов, кодирующих синтез: матриксных металлопротеиназ MMP-1, -2, -3, -9; мембранных гликопротеинов CD80 и CD163, экстрацеллюлярных матриксных протеинов ECM1 и POSTN.
Статистический анализ . Полученные в результате подсчёта данные обрабатывали с использованием компьютерной программы SPSS 7.5 for Windows statistical software package (IBM Analytics, США). Так рассчитывали средние арифметические величины с ее предельными отклонениями и среднеквадратичную ошибку. При статистической обработке для оценки достоверности различий средних значений между группами использовались следующие непараметрические критерии: U-критерий Манна–Уитни, Н-критерий Краскал-ла-Уоллеса. При отсутствии нормального распределения данных использовали непараметрический критерий F. Wilcoxon с уровнем значимости p<0.05, подходящим для сравнения малых групп. Количественные данные, полученные в ходе ПЦР-РВ, были проанализированы с использованием рангового дисперсионного анализа ANOVA. Для сравнения выборок использовали t-критерий с уровнем значимости p<0.05.
Результаты исследования
Пациентки, обратившиеся за медицинской помощью на клиническую базу кафедры акушерства и гинекологии с курсом перинатологии РУДН, предъявляли жалобы на жжение и зуд в области вульвы и влагалища (основная жалоба: n=26, 100%), сухость влагалища и диспареунию (n=11, 42,3%), редкие эпизоды подтекания мочи при напряжении, неудержания мочи при позывах к мочеиспусканию (n=6, 23,1%), жалоб на учащенное мочеиспускание и никтурию не предъявлял никто. Средний возраст обследованных пациенток 49,5±5 лет.
Анамнестическим, физикальными методами исследования (осмотр и бимануальная пальпация половых органов), аппаратной диагностикой (УЗИ, кольпоскопия) и цитологическим исследованием (ПАП-тест, пайпель-биопсия) были исключены гиперпластические и опухолевые процессы гениталий.
Проба с натуживанием и кашлевая проба были отрицательны у всех пациенток. Однако у 4 (15,4%) из них при осмотре была выявлена дилатация уретры.
Гинекологический осмотр показал атрофические изменения больших и малых половых губ и области промежности разной степени выраженности у всех пациенток. У 15 (57,7%) половая щель зияла. Пролапса тазовых органов не было выявлено ни у одной пациентки, но незначительное опущение стенок влагалища без формирования цистоцеле и/или рек-тоцеле обнаружено у 17 (65,4%) женщин изученной когорты.
Слизистая влагалища у всех пациенток была бледной, истонченной, сглаженной, малоэластичной, местами с петехиальными кровоизлияниями, лишенной естественной влажности; признаков воспаления, патологических белей выявлено не было.
При оценке выраженности симптомов вагинальной атрофии по 5-балльной шкале D. Barlow значения варьировали в интервале 3,2–4,15 баллов. Показатели pH влагалищной среды указывали на ощелачивание отделяемого влагалища – значения pH у всех женщин были выше 5,2, а у пациенток в постменопаузе достигали 7,2 (в среднем, 6,29±0,44). Подсчет карио-пикнотического индекса при кольпоцитоло-гическом исследовании показал низкую депривацию эстрогенами влагалищной стенки: от 28,2% до, максимум, 59,6%, а среднее значение КПИ в изученной когорте 38±3,44%. Индекс вагинального здоровья по Benhman составил, в среднем, 2,15±0,98 баллов. Важно отметить, что при взятии материала для цитологического исследования, слизистая влагалища легко травмировалась при дотрагивании инструментом.
С учетом указанных жалоб и характеристик «хрупкого» эпителия было важно, что проведение однократной процедуры лазеротерапии гибридным фракционным вагинальным лазером diVaTM с длиной волны 1470/2940 нм не вызывало чувства жжения и дискомфорта, было безболезненным. После проведенной терапии через 1 и 3 месяца соответственно – 18 (69,2%) и 20 (76,9%) пациенток отметили уменьшение сухости, 16 (61,5%) и 21 (80,7%) пациенток сообщили об уменьшении признаков раздражения, и у 19 (73%) и, в динамике, у 21 (80,7%) женщин изученной когорты регистрировали снижение признаков диспареунии.
При гинекологическом осмотре через 1 и 3 месяца после лазеротерапии почти у всех женщин (22, 84.6%) исследуемой когорты наблюдалось значительное улучшение состояния кожи и слизистой вульвы и влагалища, отмечалась их бледно-розовая окраска, достаточная увлажненность, исчезли петехиальные кровоизлияния. Результаты осмотра при помощи зеркал, в том числе с применением кольпоскопа, отражали и субъективное уменьшение жалоб на зуд, жжение, сухость и диспареунию у пациенток, повышение эластичности и формирование нерыхлого нормального эпителия, исчезли петехиальные кровоизлияния.
При оценке выраженности симптомов вагинальной атрофии по 5-балльной шкале D. Barlow через 1 и 3 месяца после терапии значения варьировали в интервале 1,8–2,78 и 1,76-2,41 баллов соответственно. Показатели pH через 1 месяца после терапии достигали, в среднем, 3,8±0,27, а через 3 мес – уже 4,1±0,28. Индекс вагинального здоровья по Benhman составил, в среднем, 4,15±0,46 и 4,65±0,59 баллов соответственно через 1 и 3 месяца после проведённой процедуры.
Следует отметить, что степень эпителиальной атрофии по результатам кольпоскопического исследования соответствовала 1,25±0,12 и 1,45±0,16 баллов и не выявила аномальных кольпоскопических симптомов (ацетобелый эпителий, пунктация, мозаика) после лечения. При неэффективности терапии, (4 пациентки из 26 15,4%) мы назначили «триожи-наль» инравагинально по схеме в режиме интенсивной и поддерживающей терапии.
Объективизацию эффекта от лазерной терапии проводили при помощи морфологического метода и связанных с ним – иммуногистохимической, морфометрической методик и изучения экспрессии некоторых генов методом ПЦР-РВ.
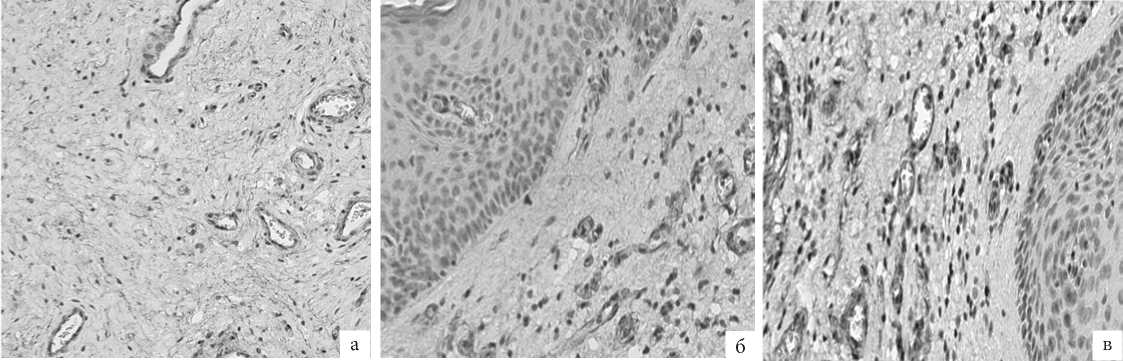
При микроскопии (гематоксилин-эозин) панч-биоптатов из передней и задней стенок влагалища, взятых до проведения лазеротерапии обнаружено, что многослойный плоский неороговевающий эпителий, покрывающий влагалище, у пациенток с ГУМС состоял из базального, промежуточного и поверхностного слоев без четкой демаркации. Характерно не только уменьшение числа слоев, но и значительное уменьшение толщины эпителиального компартмента, признаки выраженного ортокератоза и атрофии мальпигиева слоя с дезорганизацей архитектоники между шиповатыми клетками и явлениям в них кариопикноза и кариорексиса, обнаружены многочисленные вакуолизированные (гидропические) базальными кератиноциты.
Базальная мембрана эпителия во всех изученных образцах истончена, в некоторых фокусах подверглась деградации. Патогномоничной особенностью было слабое, фенестрированное эпителиально-базальное сочленение с редкими патологическими субэпителиальными пространствами.
Собственная пластинка слизистой оболочки гомогенная, фиброзно-утолщенная, отмечено разрастание и уплотнение коллагеновых волокон с явной дезорганизацией и нарушением нормальной архитектоники. Эластических волокон мало, они также дезорганизованы. Индекс местной васкуляризации низкий, сосуды полнокровны, в них обнаружены с явления стаза, периваскулярно и перибазально визуализировалась умеренная лимфоцитарная инфильтрация (рис. 2а).
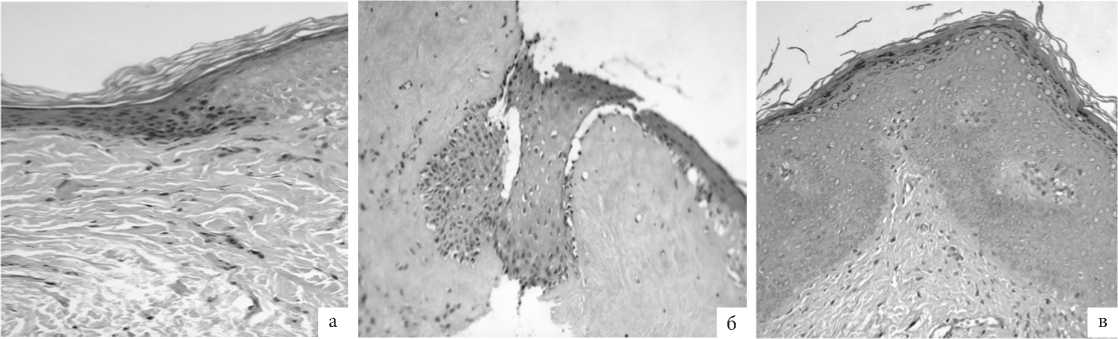
Рис. 2. ГУМС. Стенка влагалища (метод световой микроскопии, окраска гематоксилином и эозином, увелич. ×200): а – до лазерной терапии; б – 1 мес после лазерной терапии; в – 3 мес после лазерной терапии.
Мышечная оболочка представлена пучками гладких миоцитов, формирующих продольные и – реже – цилиндрические слои в глубоких отделах. В целом архитектоника гладко-мышечного компартмента стенки влагалища нарушена, но выражена коллагенизация рыхлой волокнистой соединительной ткани Выявлена существенная дезорганизация архитектоники с высокой степенью среди неравномерно расположенных, разобщенных гладких мышечных клеток
Адвентициальная оболочка также богата волокнистым компонентом, но, в отличие от собственной пластинки, с низким индексом васкуляризации (рис. 2а).
Биоптаты стенок влагалища после проведения фракционной лазерной терапии на светооптическом уровне характеризуются положительной динамикой у большинства пациенток.
Через 1 мес после лазерной терапии (рис. 2б) признаки гиперкератоза эпителия незначительно сохраняются, а через 3 мес практически совсем не визуализируются (рис. 2в). Уже через 1 месяц после терапии отмечено выраженное увеличение толщины эпителия, слои определяются более отчётливо, восстанавливается структурированность. Еще 2 мес спустя архитектоника эпителия восстановлена: кератиноциты мальпигиева слоя упорядоченно связаны между собой и образуют клеточные пласты на всём протяжении.
Единичные кератиноциты базального слоя с гидропическими изменениями цитоплазмы, еще выявляемые через 1 мес. после терапии, к следующему контрольному исследованию полностью заместились кератиноцитами со слабой или умеренной эозинофильной окраской – это пролиферирующие клетки на этапе дифференцировки (рис. 2 б, в).
Базальная мембрана во всех образцах, взятых после лечения, непрерывистая, сохранена на всём протяжении, образует отчетливую границу между эпителием и подлежащей рыхлой волокнистой соединительной тканью с формированием в отдельных участках характерных сосочков с мелкими гемокапиллярами, общее число которых значительно больше в более поздних, взятых через 3 мес, образцах. Кровеносные сосуды с признаками пролиферации эндотелия; вокруг них обнаружено небольшое количество активных и пролиферирующих фибробластов, окруженных малым количеством «молодого» коллагена, в некоторых зонах – единичные лимфоциты.
В контрольных исследованиях выявлены многочисленные крупные отростчатые фибробласты со светлыми овальными ядрами и слабо-базофильной цитоплазмой (признаки активного белкового синтеза). Коллагеновые волокна умеренной толщины, образуют равномерные тяжи, но присутствуют и тонкие волокна «молодого», нежного коллагена. Наряду с коллагеновыми фибриллами визуализируются множественные эластические волокна, совместно формирующие регулярные структуры рыхлой волокнистой соединительной ткани собственной пластинки слизистой оболочки стенки влагалища.
Основное вещество в образцах после лазерной терапии стало более компактным, а гладко-мышечные клетки лежат в виде упорядоченных пучков, вокруг которых также расположено умеренное количество эластических волокон.
Описанные явления становятся заметны спустя 1 мес после терапии, а через 3 мес уже очевидны (рис. 2б, в).
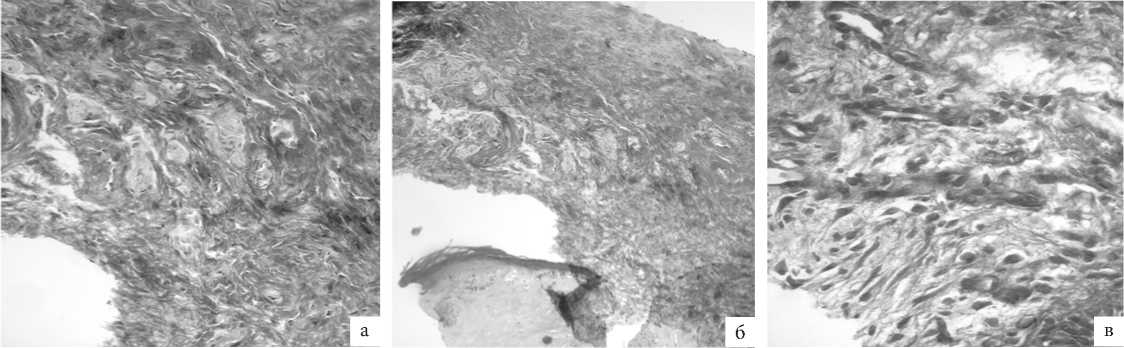
Рис. 3. ГУМС. Стенка влагалища (метод световой микроскопии, окраска: Masson’s trichrome, увелич. ×200): а – до лазерной терапии; б – 1 мес. после лазерной терапии; в – 3 мес. после лазерной терапии.
По результатам морфометрии при специфической гистохимической реакции на волокнистый и аморфный компоненты основного вещества (Masson’s trichrome) в биопта-тах, полученных через 1 месяц после проведения лазерной терапии, отмечено двукратное увеличение относительного количества эластических волокон (2.1%±0.2% vs 4.2%±0.1%, р<0.05), через 3 мес число эластических волокон увеличилось на фоне умеренного улучшения местной васкуляризации в 6 раз в сравнении с иходным значением (12.7%±0.8%, р<0.05) (рис. 3).
Нами осуществлена попытка доказать правомочность использования гибридного лазерного фракционного воздействия при ГУМС даже в отсутствие патогенетической местной гормональной терапии с помощью иммуногистохимического исследования шести маркеров ремоделирования влагалищной стенки. Результаты компьютерной морфометрии сведены в табл. 2.
При сравнении результатов компьютерной морфометрии до терапии и спустя 1 и 3 месяца после нее, изменения по всем выбранным маркерам имели достоверные статистиче- ские различия. Так, изучение распределения коллагеновых волокон I и III типов в тканях показало, что характер распределения и распространенность этих фибрилл в стенке влагалища не только изменяются с течением времени, прошедшим после терапии, но и различаются между собой в зависимости от типа коллагена.
Таблица 2
Компьютерная морфометрия стенки влагалища при ГУМС M±m % площади поля зрения
|
Маркеры ремоделирования |
До терапии |
После терапии |
p |
|
|
1 мес |
3 мес |
|||
|
Соll.I |
46.1±2.9 |
38.5±1.9 |
29.5±1.1 |
<0.05 |
|
Coll.III |
16.2±0.7 |
28.1±1.9 |
61.7±1.5 |
<0.05 |
|
α-SMA |
65.7±6.2 |
71.2±4.1 |
73.7±4.5 |
<0.05 |
|
CD8+ |
5.2±0.2 |
2.3±0.1 |
1.1±0.06 |
<0.05 |
|
CK5 |
27.3±1.1 |
41.7%±2.9 |
63.3±4.2 |
<0.05 |
|
VEGF-A |
17.4±1.7 |
21.7%±2.6 |
37.1±3.4 |
<0.05 |
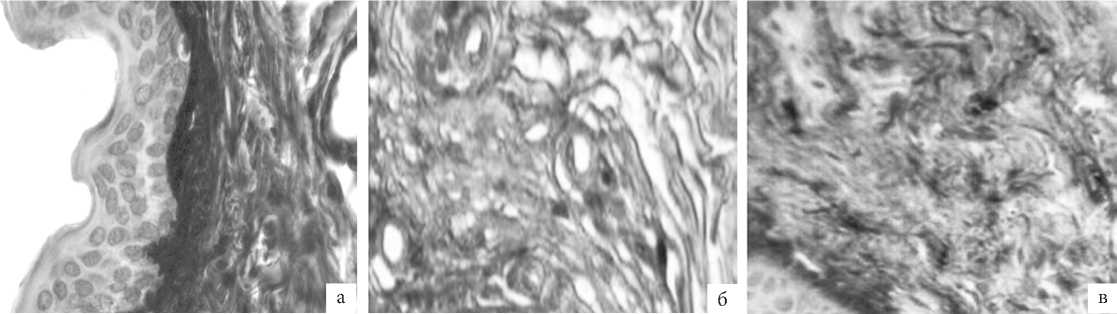
Рис. 4. ГУМС. Стенка влагалища (метод ИГХ; антитела к Coll.I, докрашивание – гематоксилином, увелич. ×400): а – до лазерной терапии; б – 1 мес. после лазерной терапии; в – 3 мес. после лазерной терапии.
И если число волокон коллагена I типа у пациенток с ГУМС занимало почти половину площади поля зрения, достоверно уменьшаясь после лазерной терапии, то коллаге-низация фибриллами III типа имела обратную тенденцию и увеличилась через 3 месяца после лечебной процедуры почти в 4 раза (рис. 4, 5).
Иммунопозитивные реакции отмечены в клетках фибробластического ряда и в основном веществе собственной пластинки. Выраженность свечения коллагена I типа уменьшилась с 3 баллов до терапии до устойчивых 2 баллов после нее (рис. 3). Реакция тканей на ремоделирующее лазерное воздействие имела обратные тенденции, когда мы обратили внимание на выработку и распределение «молодых» коллагеновых волокон III типа: от 2 баллов, характеризующих слабое свечение в образцах тканей пациенток с ГУМС на фоне характерных жалоб, до 3 баллов при практическом отсутствии жалоб в отдаленные сроки после лечения.
Показатель соотношения коллагенов I и III типов до проведения лазерной терапии составил 3,0, а после – 0,3 и 0,5, соответственно, через 1 и 3 месяца. Это указывает на общую активацию пластических процессов волокнистого компонента стенки влагалища и сохранение довольно длительного, не менее 3 месяцев, эффекта при однократном воздействии лазером.
Статистически значимые изменения коснулись и распределения гладкомышечных волокон в стенке влагалища (рис. 6).
Если до терапии наблюдалась выраженная дезорганизация гладко-мышечных клеток, обусловленная смещением их разрастающейся соединительной тканью, то после лазерного воздействия в обеих временных контрольных точках выявлена типичная, нормальная, локализация клеток мышечного компартмента с умеренным их распределением, компактной организацией и отчетливыми продольными и расположенными глубже редкими циркулярными слоями. Иммунопо-зитивная реакция гладких миоцитов была выраженной трех- балльной как до, так и после терапии. Несмотря на хорошее распределение гладкомышечных клеток влагалищной стенки, занимающих более 2/3 полей зрения, очевидной стала разная организация мышечных волокон в изученных препаратах. После терапии миоциты стали более упорядоченными, а уве- личение имунопозитивной реакции произошло за счет стенок вновь появившихся после терапии кровеносных сосудов.
Эту сосудистую реакцию демонстрирует распределение иммуногистохимического свечения васкулярно-эндотелиального фактора роста, VEGF-A (рис. 7).
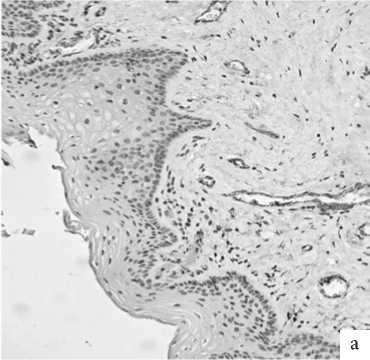
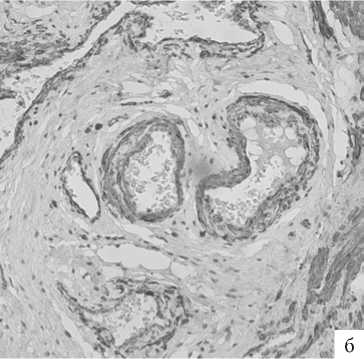
Рис. 6. ГУМС. Стенка влагалища (метод ИГХ; антитела к α-SMA, докрашивание – гематоксилином, увелич. ×200): а – до лазерной терапии; б – 1 мес. после лазерной терапии; в – 3 мес. после лазерной терапии.
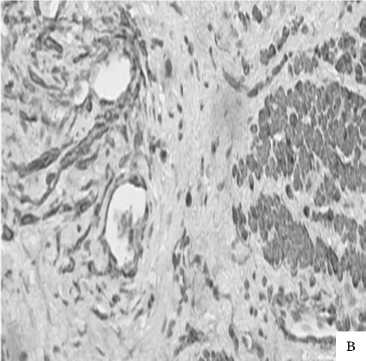
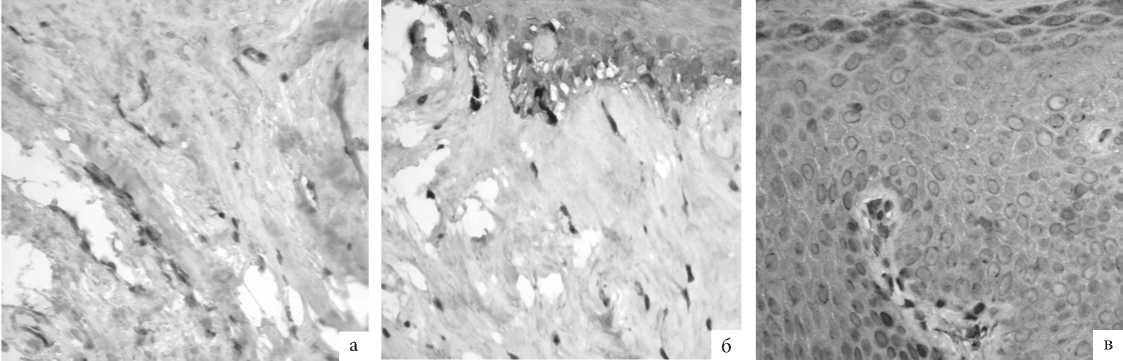
Рис. 7. ГУМС. Стенка влагалища (метод ИГХ; антитела к VEGF-A, докрашивание – гематоксилином, увелич. ×200): а – до лазерной терапии; б – 1 мес. после лазерной терапии; в – 3 мес. после лазерной терапии.
Положительная реакция VEGF-A в 3 балла отмечена в биоптатах, взятых как до, так и после проведения лазерной терапии – в цитоплазме фибробластов, кератиноцитов зернистого и базального слоя, а также в просвете кровеносных сосудов с признаками состоявшегося ангиогенеза. В ходе компьютерной морфометрии выявлено достоверное увеличение более, чем в 2 раза абсолютного числа иммунопозитивных клеток к антителам на VEGF-A в образцах, полученных через 1 и 3 мес после процедуры в сравнении с первичными данными. Активизация ангиогенеза в ответ на лазеротерапию, отмеченная нами еще при анализе результатов рутинного гистологического исследования (см. выше), иммуногистохимически подтвердилась как при исследовании неспецифических маркеров растущих сосудов (α-SMA), так и при изучении специфического маркера – VEGF-A.
Можно было бы предположить, что подобное усиление трофики тканей в ответ на лазерное воздействие должно быть следствием реактивного воспаления. Однако имуногистохи-мическое исследование специфического маркера цитотоксических Т-лимфоцитов гликопротеина CD8, свечение которого, по сути, является показателем интенсивности воспалительной реакции, показало противоположные результаты (рис. 8).
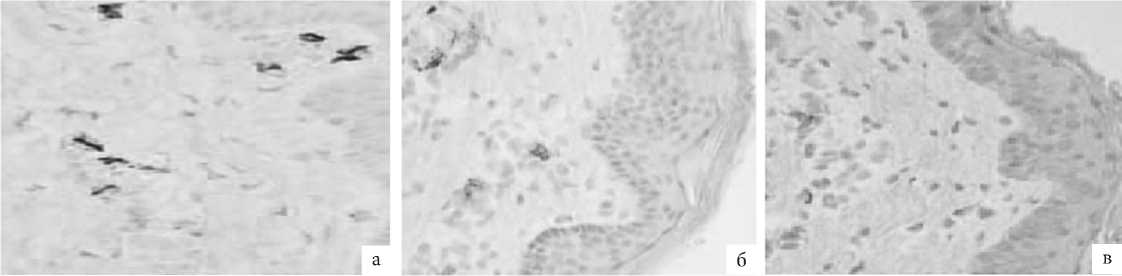
Рис. 8. ГУМС. Стенка влагалища (метод ИГХ: антитела к CD8+, докрашивание – гематоксилином, увелич. ×400): а – до лазерной терапии; б – 1 мес. после лазерной терапии; в – 3 мес. после лазерной терапии.
Выраженная имунопозитивная реакция в 3 балла к антителам CD8+ Т-лимфоцитов (Т-киллеров) была отмечена нами как раз при первичном изучении биоптатов, взятых до терапии. Через 1 мес после этой терапии положительная цитолеммальная реакция достоверно уменьшилась в 2 раза и практически отсутствовала спустя 3 мес от проведенной лечебной процедуры, несмотря на сопутствующие признаки ангиогенеза. Это говорит о практически полном отсутствии мононуклеарной инфильтрации провоспалительными цито- токсическими СD8+ лимфоцитами после проведения лазерной терапии, физиологическую репарацию тканей и восстановление функциональной активности тканей, несмотря на сниженную депривацию тканей эстрогенами в силу возраста пациенток и естественного угасания репродуктивной системы.
Наконец, нами было изучено иммуногистохимическое свечение в полученных образцах тканей белка промежуточных филаментов – цитокератина-5, CK5 (рис. 9)
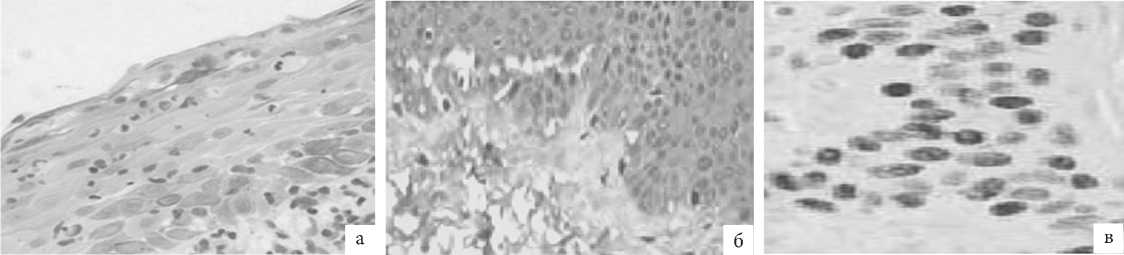
Рис. 9. ГУМС. Стенка влагалища (метод ИГХ; антитела к CK5, докрашивание – гематоксилином, увелич. ×400): а – до лазерной терапии; б – 1 мес. после лазерной терапии; в – 3 мес. после лазерной терапии.
Иммунопозитивные кератиноциты CK5 визуализированы во всех слоях эпителия слизистой оболочки стенки влагалища в биоптатах, полученных как до, так и после проведения лазерной терапии. При этом реакция в биоптатах стенки влагалища до терапии была слабой (1 балл) и выявлены лишь отдельные группы кератиноцитов CK5 базального слоя эпителия, занимающие суммарно менее трети площади полей зрения и совпадающих с местом наибольшей мононуклеар-ной инфильтрации. После лазерной терапии положительная умеренная ИГХ-реакция обнаружена в большем числе кера-тиноцитов базального слоя эпителия (2 балла), достигая 2/3 площади полей зрения в препаратах, полученных на третий месяц после лазерного воздействия. Повышение общего числа кератиноцитов как результат проведенного лечения свидетельствует о приобретении клетками правильной формы, формировании стабильных межклеточных связей и эпите-лио-базального сочленения, т.е. о восстановлении элементов цитоскелета.
Для уточнения функционального состояния тканей стенки влагалища нами была использована оценка уровня экспрессии некоторых генов путем измерения количества соответствующих мРНК методом ПЦР-РВ. Все полученные результаты имели достоверные различия в динамике через 1 и 3 месяца после лазерной процедуры в сравнении со значениями, полученными до нее (табл. 3).
При оценке уровня экспрессии генов матриксных металлопротеиназ и их ингибиторов, макрофагальных рецепторов и маркера дифференцировки кератиноцитов с помощью генов в образцах, полученных до и после терапии были выявлены достоверные статистические различия. Заслуживает внимания и тот факт, что все реактивные изменения тканей после лечения динамично развивались в течение не менее трех месяцев наблюдений, т.е. получен выраженный и длительный эффект последействия.
Таблица 3
Относительная экспрессия генов в биоптатах стенки влагалища при ГУМС до и после ремоделирующей фракционной лазерной терапии, у.е.±SEM
|
Ген |
До лазерной терапии |
1 мес. после лазерной терапии |
3 мес. после лазерной терапии |
|
MMP-1 |
1.77±0.34 |
1.96±0.41* |
2.71±0.67* |
|
MMP-2 |
1.85±0.41 |
2.56±0.59* |
3.15±1.11* |
|
MMP-3 |
1.81±0.38 |
2.17±0.36 |
2.89±0.21* |
|
MMP-9 |
1.12±0.23 |
1.66±0.33* |
1.96±0.37* |
|
ECM1 |
1.46±0.37 |
0.97±0.25* |
0.86±0.12* |
|
POSTN |
0.87±0.12 |
0.93±0.21 |
1.12±0.18* |
|
CD80 |
1.35±0.16 |
0.84±0.14* |
0.61±0.12* |
|
CD163 |
0.89±0.14 |
1.12±0.16* |
1.23±0.19* |
Примечание: * – p<0.05 при сравнении со значениями до терапии.
Экспрессия ECM1, CD80 до терапии значительно превышала пороговый уровень внутреннего контроля (GAPDH), что говорит об воспалительных изменениях ткани и, видимо, компенсаторном повышении синтеза экстрацеллюлярного матриксного протеина 1 в условиях структурных нарушений влагалищной стенки при ГУМС. Интересно, что значения экспрессии этих генов после проведенной терапии снизились до нормальных значений, особенно показательным оказалось достоверное уменьшение в 2,2 раза провоспали-тельного маркера CD80. Сопоставив эти изменения с увеличением в 1,4 раза экспрессии гена, отвечающего за выработку мембранного гликопротеина CD163 – маркера прорегенера-торных макрофагов, мы получили довольно ясную картину изменений в тканях при ГУМС (воспаление) и от лазерной терапии (разрешение воспаления, регенерация).
Исследование экспрессии матриксных металлопротеиназ, вопреки ожиданиям, показало и увеличение экспрессии кодирующих их генов после проведенного лазерного лечения в 1,5-1,75 раза, но полностью соответствовало результатам иммуногистохимического исследования (см. табл. 2), показавшего общее уменьшение распространенности коллагена I типа и коллагенизацией влагалищной стенки III типом этого белка. Видимо, деградация коллагенов является одним из обязательных этапов ремоделирования влагалищной стенки и может служить маркером эффективности методов лечения ГУМС.
Наконец, о повышении активности пролиферативных и, значит, репаративных процессов в тканях влагалища в ответ на лазерное воздействие даже в условиях гипоэстрогении, говорит увеличение в 1,3 раза по сравнению с исходными значениями уровня экспрессии гена POSTN, кодирующего белок внеклеточного матрикса периостин.
Заключение и выводы
Анализ и сопоставление 15 параметров морфологических показателей стенки влагалища при ГУМС раскрывают более-менее четкую патогенетическую картину. В условиях снижения эстрогенной депривации тканей, часто на фоне зияющей половой щели, нарушается биоценоз влагалища, приводящий в конечном счете к нарушению кислотности среды, развитию условно-патогенной флоры и воспалительным изменениям (СD80). Эти же воспалительные непролиферативные (гипоэ-строгения!) изменения отражаются и в крайне малой трофике, и в сниженной регенерации и, видимо, способствуют не просто истончению многослойного плоского эпителия, но и нарушению архитектоники, сглаживанию всей влагалищной стенки даже в отсутствии пролапса тазовых органов и предрасполагающих в нему факторов. В качестве компенсаторных звеньев патогенеза происходит увеличение коллагенизации основного вешества подслизистого и мышечного слоев (прочные, компактно расположенные волокна коллагена I типа) и уменьшение эластичности влагалищной стенки (резкое снижение эластиновых фибрилл). Таким образом, влагалище становится плохо растяжимым, легко травмируемым, трудно восстанавливающимся при воздействии любыми факторами – физическими, микробными, физиологическими.
Несомненно, терапией первой линии при ГУМС является местное применение эстриола, однако его использование может быть ограничено противопоказаниями, болевыми ощущениями в начале терапии, наконец, гормонофобией. Именно поэтому поиск методов лечения альтернативных, а иногда подготавливающих к последующей гормональной терапии крайне важен для расширения арсенала медицинской помощи при ГУМС.
Ремоделирование под воздействием лазеротерапии, по нашим данным, затронуло морфофункциональные свойства всех компартментов стенки влагалища, а не только слизистой оболочки. Даже без эстрогенного воздействия усилилась трофика тканей, деградировали компактно расположенные коллагеновые волокна I типа, им на смену стали активно синтезироваться новые коллагеновые волокна III типа, увеличилось общее количество миофиламентов, восстановилась их ориентация в пространстве, уменьшилась провоспалитель-ная и усилилась прорегенераторная активность фибробластов, стабилизировался прежде истонченный базальный слой эпителия. Наше исследование, пусть и на малой выборке, показало достоверные и разносторонние положительные, что немало важно – длительные эффекты даже от однократного применения гибридного фракционного лазера с возможностью одновременного использования аблационной и неаблационной длины волны и быстрым восстановлением после процедуры.
Список литературы Ремоделирующая лазерная терапия влагалища при генитоуринарном менопаузальном синдроме
- Генитоуринарный менопаузальный синдром. Новые возможности патогенетически оправданной местной терапии. Информационное письмо. - М.: Редакция журнала StatusPraesens, 2015. - C.4-6
- Portman D.J., Gass M.L.S. Vulvovaginal Atrophy Terminology Consensus Conference Panel. Genitourinary syndrome of menopause: new terminology for vulvovaginal atrophy from the International Society for the Study of Women's Sexual Health and the North American Menopause Society // Maturitas. 2014. Vol. 79. №3. P. 349-354. [PMID: 25179577.]
- Calleja-Agius J., Brincat M.P. The urogenital system and the menopause // Climacteric J. Int. Menopause Soc. 2015. Vol. 18. №1. P. 18-22. [PMID: 26366796.]
- Савичева А.М., Рыбина Е.В. Исследование in vitro роста, размножения, антибиотикорезистентности, конкурентных взаимоотношений штамма Lactobacillus casei rhamnosus // Акушерство и гинекология. 2014. №7. C. 79-83.
- Santen R.J., Allred D.C., Ardoin S.P. et al. Postmenopausal hormone therapy: an Endocrine Society scientific statement // J. Clin. Endocri- nol. Metab. 2010.Vol. 95. №7 (1). P. s1-s66. [PMID: 20566620.]
- Cardozo L. et al. A systematic review of the effects of estrogens for symptoms suggestive of overactivebladder // Acta Obstet. Gynecol. Scand. 2004. Vol. 83. №10. P. 892-897. [PMID: 15453881.]
- Suckling J.A., Kennedy R., Lethaby A. et al. Local oestrogen for vaginal atrophy in postmenopausal women // Cochrane Database of Systematic Reviews /Ed. The Cochrane Collaboration. Chichester, UK: John Wiley & Sons, Ltd, 2006. [PMID: 17054136.]
- Mosser DM, Edwards JP. Exploring the full spectrum of macrophage activation. Nature Reviews Immunology. Dec 2008; 8 (12): 958-969.
- Lugrin J, Rosenblatt-Velin N, Parapanov R, Liaudet L. The role of oxidative stress during inflammatory processes. Biol Chem. 2014;395: 203-230
- Coulombe PA, Omary MB. ‘Hard' and ‘soft' principles defining the structure, function and regulation of keratin intermediate filaments. Current Opinion in Cell Biology. Feb 2002; 14 (1): 110-22.
- Conway SJ, Izuhara K, Kudo Y, Litvin J, Markwald R, Ouyang G, Arron JR, Holweg CT, Kudo A. «The role of periostin in tissue remodeling across health and disease». Cellular and Molecular Life Sciences. Apr 2014;71 (7): 1279-88.
- Duffy AM, Bouchier-Hayes DJ, Harmey JH. Vascular Endothelial Growth Factor (VEGF) and Its Role in Non-Endothelial Cells: Autocrine Signalling by VEGF. In: Madame Curie Bioscience Database. Austin (Tx): Landes Bioscience; 2000-2013.
- Официальная инструкция по применению препарата «Триожиналь». ГРЛС, 2015.
- Light and Energy Based Therapeutics for Genitourinary syndrome of Menopause: Consensus and Controversies. Lasers in Surgery and Medicine.Jan 2017; 49:137-159.
- Токтар Л.Р. Женская пролаптология: от патогенеза к эффективности профилактики и лечения// Акушерство и гинекология: новости, мнения, обучение. - 2017. - №3. - С.98-107
- Тотчиев Г.Ф., Токтар Л.Р., Тигиева А.В., Завадина Е.В. Состояние влагалищного биотопа у пациенток репродуктивного возраста, страдающих несостоятельностью тазового дна //Вестник РУДН. Серия «Медицина». Акушерство и гинекология. - 2013. - №5. - С.146-150.
- Медицина климактерия /под ред. В.П. Сметник. - Ярославль: ООО «Издательство Литера», 2006. - 848 с.
- Barlow D.H., Samsioe G., van Geelen I.M. A study of European women experience of the problems of urogenital aging and its management // Maturitas. - 1997. - №27 (3). - P. 239-247.
- Оразов М.Р., Хамошина М.Б., Носенко Е.Н., Силантьева Е.С., Кампос Е.С. Патогенетические механизмы формирования пролапса тазовых органов//Акушерство и гинекология: новости, мнения, обучение. -2017. -№ 3 (17). -С. 108-116.
- Оразов М.Р., Демяшкин Г.А., Токтар Л.Р., Силантьева Е.С., Хамошина М.Б., Кампос Е.С., Лологаева М.С. Ультраструктурные характеристики тканей тазового дна как патогенетическое обоснование применения направленной контактной диатермии при пролапсе тазовых органов// Доктор.Ру. -2017. № 13-14 (142-143). -С. 19-26.


