Репродуктивные показатели мышей линии AF после хронического гамма-облучения в малых дозах
Автор: Старобор Н.Н., Раскоша О.В.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Статья в выпуске: 5 (51), 2021 года.
Бесплатный доступ
В статье представлены результаты изучения репродуктивных показателей мышей линии Af после хронического низкоинтенсивного гамма-облучения в суммарных накопленных дозах 10, 20 и 30 сГр. Обнаружены увеличение плодовитости у самок и повышение содержания сперматозоидов в эпидидимисах самцов после радиационного воздействия в диапазоне малых доз. У родителей, облученных в дозах 20 и 30 сГр, выявлено повышение ранней постнатальной смертности детенышей F1, тем не менее, репродуктивный индекс, рассчитанный с учетом выживших детенышей в течение первого месяца жизни, подтверждает стимулирующее действие ионизирующего излучения в исследуемом диапазоне доз на плодовитость животных.
Ионизирующее излучение, малые дозы, мыши, семенники, плодовитость
Короткий адрес: https://sciup.org/149139321
IDR: 149139321 | УДК: 599.323.4:591.16:612.014.482.4 | DOI: 10.19110/1994-5655-2021-5-20-28
Текст научной статьи Репродуктивные показатели мышей линии AF после хронического гамма-облучения в малых дозах
Оценка биологических эффектов действия ионизирующего излучения в малых дозах и прогнозирование последствий антропогенного воздействия на биоту уже многие годы не теряют своей актуальности в связи с увеличением числа территорий с повышенным радиационным фоном. В природных условиях на биологические объекты действует комплекс экологически значимых факторов, поэтому сложно выделить собственно эффект облучения. Кроме того, миграционная активность мелких млекопитающих также влияет на точность оценки дозовой нагрузки. Одним из выходов из подобной ситуации является проведение хронических экспериментов в лабораторных условиях с известной поглощенной объектом дозой.
Важным показателем благополучия организма в техногенно загрязненной среде является его способность к воспроизводству. Во многих работах показано, что наибольшую опасность представляют радиационно-индуцированные повреждения гамет, совместимые с их жизнеспособностью, которые могут передаваться потомству [1-6]. К настоящему времени имеется большое количество экспериментальных работ, где подробно описаны радиационно-индуцированные эффекты в органах репродуктивной системы, развивающиеся в ответ на однократное облучение, в том числе и в малых дозах [79]. Возможные особенности таких эффектов при длительном низкоинтенсивном радиационном воздействии в научной литературе представлены лишь в единичных исследованиях [10]. Следует отметить, что для большинства тканей однократное облучение в определенной дозе вызывает большее лучевое поражение, чем облучение в той же дозе, но осуществляемое в течение длительного временного периода. Семенники, по-видимому, являются единственным исключением из общего правила: суммарная доза облучения, полученная в несколько приемов, для них более, а не менее опасна, чем та же доза, полученная за один прием [11].
Цель работы - изучить показатели размножения мышей линии At после хронического внешнего у-облучения в суммарных накопленных дозах 10, 20 и 30 сГр. Для достижения цели были поставлены следующие задачи: 1) проанализировать репродуктивные показатели у самок, подвергнутых хроническому облучению в диапазоне малых доз; 2) оценить плодовитость у самок в зависимости от времени, прошедшего после окончания радиационного воздействия; 3) исследовать состояние сперматогенеза в отдаленный период после хронического у-облучения самцов.
Материал и методы
В работе были использованы половозрелые мыши линии At (самцы (п = 50) и самки (п= 65)) в возрасте на начало эксперимента 2-3 месяца и массой тела 22-25 г и их потомки (п=335). Животных содержали в поликарбонатных клетках (размер 35x22x90 см, Tecniplast, Италия) в условиях климатического комфорта (температура = 20-22° С и влажность воздуха 50±5 %) со стандартным рационом питания на основе брикетированных кормов, со свободным доступом к воде и пище в УНУ «Научная коллекция экспериментальных животных» Института биологии ФИЦ Коми НЦ УрО РАН . При работе руководствовались этическими правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18 марта 1986 г., подтверждена в 15.06.2006 г.), и требованиями международных принципов Хельсинкской декларации о гуманном отношении к животным для экстирпации органов [12].
Путем случайной выборки мыши были разделены на контрольную и опытные группы. Животных опытных групп (самцы и самки) подвергали общему внешнему воздействию у-излучения от двух источников 22®Ra, разнесенных на расстояние 2.5 м и содержащих 0.474x10® и 0.451x10® кБк 22®Ra в течение 29, 56 и 84 суток при средней мощности дозы 150 мкЗв/ч. В результате суммарные поглощенные дозы у животных опытных групп составили соответственно 10, 20 и 30 сГр. Суммарную поглощенную дозу облучения животных определяли по показаниям термолюминесцентных дозиметров (ДТУ-01) с детекторами ДТГ-4 (LiF) на дозиметрической установке ДВГ-02ТМ (НПП «Доза», Россия). Контролем служили мыши аналогичного возраста и пола, содержавшиеся при нормальном радиационном фоне (0.08-0.10 мкЗв/ч).
Сразу после окончания радиационного воздействия во всех опытных группах формировали пары для размножения животных. Мыши контрольной группы были посажены на размножение одновременно с опытными группами животных. В течение последующих трех месяцев после окончания облучения в каждой группе регистрировали число самок, участвующих в размножении, число пометов и количество рожденных детенышей, также оценивали раннюю постнатальную смертность детенышей (F^. Вычисляли репродуктивный индекс - отношение числа выживших в течение первых 30 суток жизни детенышей к общему числу животных в группе, который характеризует потенциальную способность животных к увеличению их численности [13]. Кроме того, анализировали плодовитость самок, оплодотворенных самцами сначала в первые два-три дня, а потом через 40 и более суток после окончания радиационного воздействия. При выборе времени оплодотворения самок учитывали, что весь период сперматогенеза у самцов мышей длится в среднем 34-36 суток [14]. Поэтому в первые два-три дня оплодотворение самок происходило половыми клетками самцов, развивающимися в условиях постоянной радиационной нагрузки, а в отдаленный период (через 40 и более суток после окончания облучения) самки были оплодотворены самцами, у которых сперматогенез проходил в условиях нормального радиационного фона.
Пострадиационные эффекты в мужских половых клетках исследовали через четыре месяца после прекращения облучения и периода размножения животных. Предварительно взвешенных самцов подвергали декапитации, выделяли семенники и придатки (эпидидимисы). Абсолютную массу семенников оценивали с точностью до 1 мг с последующим расчетом относительной массы. Ткань семенников животных использовали для получения суспензии сперматогенных клеток, в которой после добавления 5 %-ной уксусной кислоты с генциан-виолеттом подсчитывали количество сперматого-ний, сперматоцитов, сперматид и сперматозоидов [15]. Подсчет числа сперматозоидов, выделенных из эпидидимиса, проводили в суспензии, окрашенной 1 %-ным раствором эозина [16]. Количество сперматогенных клеток и эпидидимальных сперматозоидов определяли в камере Горяева с использованием светового микроскопа (Micros, Austria) при чение плодовитости мышей позволило выявить статистически значимое повышение числа детенышей на самку (при всех дозах облучения) и числа детенышей в помете (при дозах 20 и 30 сГр). У самок, облученных в дозах 20 и 30 сГр, были зарегистрированы многоплодные пометы, состоящие из семидевяти детенышей, тогда как у контрольных животных и животных, облученных в минимальной дозе (10 сГр), число детенышей, рожденных в одном помете, не превышало шести особей (рис. 1). Данные, полученные нами ранее на полевках-экономках из природных популяций, также показали увеличение числа пометов и общего количества рожденных детенышей у самок, обитающих на радиационно-загрязненном участке по сравнению с контрольными самками [19].
Результаты, полученные по плодовитости животных, проанализированные в зависимости от времени, прошедшего после окончания радиацион-
Таблица 1
Показатели размножения самок и доля погибших детенышей у мышей линии Af после хронического у-облучения в малых дозах
Reproduction rates of females and the proportion of dead cubs in Af mice after chronic low-dose y-irradiation
Table 1
|
Группа животных |
Доля размножающихся самок, % |
Число пометов на самку |
Число детенышей в помете |
Число детенышей на самку |
Доля погибших детенышей, % |
Репродуктивный индекс, усл. ед. |
|
Контроль |
76.2 |
1 1±0.2 |
4.1±0.3 |
4.3±0.5 |
6.7 |
0.4 |
|
10 сГр |
87.5 |
1.4±0.3 |
4.7±0.3 |
6.5±0.9* |
3.8 |
1.6 |
|
20 сГр |
87.5 |
1.1±0.2 |
6.1±0.8* |
6.9±0.4*** |
21.8* |
1.4 |
|
30 сГр |
78.3 |
1 1±0.1 |
6.0±0.4** |
6.5±0.6** |
12.8 |
1.8 |
Примечание: различия с контролем статистически значимы при * р<0.05; ** р<0.01; *** рсО.001.
увеличении ок. 12.5 x об. 40. Уровень нарушений в половых клетках самцов оценивали по частоте встречаемости аномальных головок сперматозоидов на воздушно-сухих мазках эпидидимальных сперматозоидов, окрашенных 1 %-ным раствором эозина (у каждого животного анализировали по 500 клеток) [17, 18]. Данные представлены в виде среднего арифметического и стандартной ошибки среднего, а также в виде долевых показателей (%). Статистическую значимость различий между опытными и контрольными группами определяли с помощью критерия Стьюдента, для проверки равенства долей применяли угловой преобразователь Фишера.
Результаты и обсуждение
Результаты проведенного эксперимента показали, что доля размножающихся самок во всех опытных группах была в пределах контрольных значений, при этом после облучения в дозах 10 и 20 сГр отмечена тенденция к увеличению на 11 % числа самок, вступивших в размножение, по сравнению с не облученными самками (табл. 1). Изу-
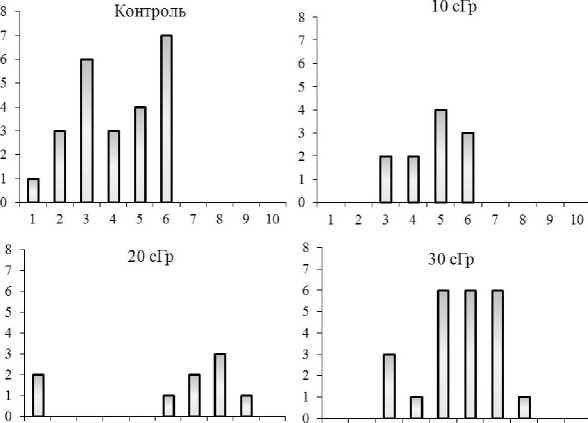
23456789 10
234 5 6789 10
Рис. 1. Число детенышей в пометах у мышей линии Af после хронического у-облучения в малых дозах за три месяца размножения. Примечание: по оси абсцисс - число детенышей; по оси ординат -число пометов.
Fig. 1. The number of cubs in the litters of Af mice after chronic low-dose y-irradiation for three months of reproduction.
Note: the abscissa is the number of cubs; the ordinate is the number of litters.
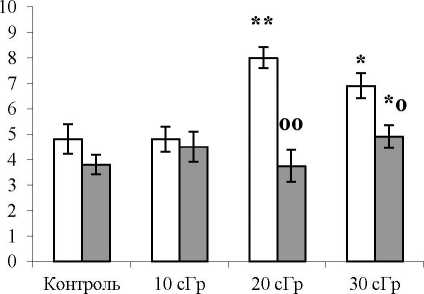
Рис. 2. Среднее число детенышей в пометах (по оси ординат) у самок, оплодотворенных в первый-третий дни (светлые столбики) и через 40 и более дней (темные столбики) после окончания хронического у-облу-чения в малых дозах.
Примечание: различия статистически значимы с контролем при * - р<0.05; ** - р<0.01; в пределах группы при ° - р<0.05 и оо - р<0.01.
Fig. 2. Average number of cubs in litters (on the ordinate) in females fertilized on the first or third day (light bars) and 40 or more days (dark bars) after the end of chronic low-dose у-irradiation.
Note: the differences with the control are statistically significant at *- pcO.05; ** - p<0.01; within the group at ° p O.Oo and oo-p<0.01.
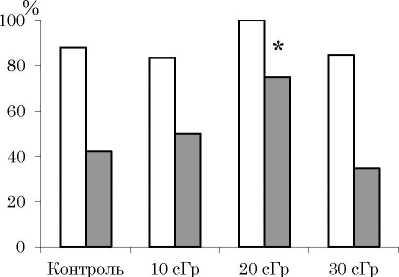
Рис. 3. Доля облученных самцов (светлые столбики) и самок (темные столбики), доживших до возраста 910 месяцев.
Примечание: различия статистически значимы при * - р<0.05
Fig. 3. The proportion of irradiated males (light bars) and females (dark bars) surviving to the age of 9-10 months.
Note: the differences are statistically significant at * - p<0.05.
ного воздействия, позволили выявить, что у самок, облученных в дозах 20 и 30 сГр и оплодотворенных в первые два-три дня после спаривания, среднее число детенышей в пометах было статистически значимо выше контроля (р<0.05) (рис. 2). Однако, если оплодотворение самок, облученных в этих же дозах, происходило через 40 и более дней после прекращения действия ионизирующего излучения, то среднее число детенышей в помете было приближено к контролю, достоверно снижаясь по сравнению с предыдущим периодом в 2.0 и 1.4 раза соответственно (р<0.05). При минимальной дозе облучения животных (10 сГр) как в ранний, так и в отдаленный периоды после окончания радиационного воздействия, среднее число детенышей в пометах существенно не изменялось. Стимулирующее действие ионизирующего излучения как в остром, так и в хроническом режимах как феномен гиперовуляции у животных было описано в ряде работ [20-24].
Воздействие ионизирующего излучения на гонады млекопитающих может привести к нарушениям пренатального и постнатального развития потомства [7-9, 25]. На полевках-экономках, привезенных с радиоактивно загрязненного участка, было показано, что стимуляция интенсивности размножения является компенсацией высокой эмбриональной и постэмбриональной смертности детенышей [19]. В экспериментах на крысах линии Вистар получены данные о том, что при участии в оплодотворении двух облученных родителей увеличение гибели потомства первого поколения наблюдается именно в области малых доз ионизирующего излучения (25-50 сГр) [7]. Результаты, проведенного нами эксперимента на мышах линии Af, также позволили выявить повышение ранней постнатальной смертности детенышей первого поколения, родители которых были подвергнуты хроническому у-облучению в дозах 20 и 30 сГр по сравнению с контролем (соответственно в 3.2 (р<0.01) и в 1.9 раза). При минимальной дозовой нагрузке на животных (10 сГр) прослежена тенденция к понижению (в 1.7 раза) ранней постнатальной смертности детенышей (см. табл. 1). Отметим, что у мышей, облученных в дозах 20 и 30 сГр, наблюдали случаи инфантицида, т. е. умерщвление родителем новорожденных детенышей, чего не отмечали у животных, облученных в минимальной из используемых доз и контрольной группе. В животном мире инфантицид считается одним из демографических механизмов регулирования численности популяции [26]. Репродуктивный индекс, рассчитанный с учетом выживших детенышей в течение первого месяца жизни, был во всех опытных группах в четыре-пять раз выше контроля, что подтверждает стимулирующее действие ионизирующего излучения в исследуемых дозах на плодовитость животных (см. табл. 1).
К возрасту 9-10 месяцев, когда начинается снижение репродуктивной активности мышей, доживало больше самцов, чем самок, как в опытных, так и в контрольной группах (рис. 3). Это можно связать с участием самок в размножении и последующей заботе о потомстве, которое требует больших энергетических затрат [27, 28]. Следует отметить, что по сравнению с контрольными животными максимальное число доживших до анализируемого возраста мышей зафиксировано после облучения в дозе 20 сГр, причем для самок это различие было статистически значимым (р<0.05).
Оценка состояния мужских половых клеток через четыре месяца после хронического у-облуче-ния животных в диапазоне доз 10-30 сГр показала, что относительная масса семенников и частота встречаемости аномальных головок сперматозоидов были в пределах контрольных значений (табл. 2). Содержание сперматогенных клеток, находящихся на различных стадиях дифференцировки, в семенниках мышей опытных групп также статистически значимо не отличалось от контроля, тем не менее, обращают на себя внимание некоторые тен- денции к изменению клеточного состава тестикулярной ткани в зависимости от радиационной нагрузки (рис. 4). Так, у самцов, облученных в дозе 20 сГр, наблюдались признаки торможения начального этапа сперматогенеза - число сперматогоний снижено на 17 % по сравнению с нормой, тогда как у самцов, подвергнутых воздействию ионизирующего излучения в дозах 10 и 30 сГр, клеточный состав плодовитости самок, подвергнутых хроническому внешнему у-облучению в малых дозах, которое проявлялось в увеличении числа детенышей на самку (при дозах 10-30 сГр) и числа детенышей в помете (при дозах 20 и 30 сГр). При этом обнаружено, что среднее число детенышей в пометах увеличивалось у самок, оплодотворенных в первые два-три дня после окончания радиационного воздейст-
Таблица 2
Морфофизиологическое состояние репродуктивной системы у самцов мышей пинии Af через четыре месяца после хронического у-облучения в малых дозах
' - ТаЫе 2
Morphophysiological state of the reproductive system in male Af mice 4 months after chronic low-dose y-irradiation
|
Группа животных |
Масса животных, г |
Относительная масса семенников, % |
Аномальные головки сперматозоидов, % |
Количество эпидидимальных сперматозоидов, х106 |
|
Контроль |
24.9±0.6 |
3.3±0.1 |
2.6±0.2 |
13.5±1.6 |
|
10 сГр |
33.3± 2.0 |
2.9±0.2 |
3.4±0.4 |
18.2±2.4 |
|
20 сГр |
27.3±0.6 |
3.2±0.1 |
2.3±0.3 |
11 9±1.9 |
|
30с Гр |
27.6±1.4 |
3.4±0.1 |
2.2±0.2 |
19.8±2.2* |
Примечание: различия статистически значимы с контролем при * - р<0.05.
Note: the differences with the control are statistically significant at * - pcO.05.
вия, когда половые клетки жи-
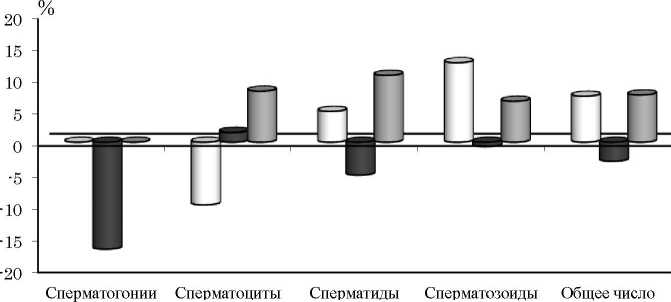
□ ЮсГр 120 сГр ПЗОсГр половых клеток
Рис. 4. Число сперматогенных клеток (по оси ординат % от контроля) в тестикулярной ткани у самцов мышей линии Af через четыре месяца после хронического у-облучения в малых дозах.
Fig. 4. The number of spermatogenic cells (on the ordinate, % of the control) in testicular tissue in male Af mice 4 months after chronic low-dose y-irradiation.
ткани сперматогенного эпителия превышал контрольные значения на 7 %. Схожая закономерность была отмечена и в числе зрелых половых клеток в эпидидимисах - тенденция к снижению сперматозоидов на 12 % после дозы 20 сГр и усиление продукции зрелых половых клеток у самцов, облученных в минимальной и максимальной дозах по сравнению с контролем (соответственно на 34 и 47 % (р<0.05)). Число сперматозоидов является одним из показателей, характеризующих оплодотворяющую способность спермы [29]. При изучении действия радиации в малых дозах на организм нередко обнаруживают стимулирующий эффект, в том числе и на сперматогенную функцию [10, 30].
Заключение
Результаты эксперимента, проведенного на мышах линии Af, свидетельствуют о повышении вотных, вступивших в размножение, развивались в условиях постоянной радиационной нагрузки. Если половые клетки самцов опытных групп проходили стадии дифференцировки в условиях нормального радиационного фона, то повышения плодовитости у облученных самок, вступивших в размножение с такими самцами (через 40 и более суток после облучения), не наблюдалось. Установлено повышение ранней постнатальной смертности детенышей первого поколения у родителей, облученных в дозах 20 и 30 сГр, тем не менее, репродуктивный индекс, рассчитанный с учетом выживших детенышей в течение первого месяца жизни, подтверждает стимулирующее действие ионизирующего излучения в исследуемых дозах на плодовитость животных. В отдаленный период после радиационного воздействия в половых клетках самцов выявлен эффект стимуляции, проявляющийся в повышенном содержании сперматозоидов в эпидидимисах животных после у-облучения в дозе 30 сГр. Перспективным является продолжение исследований в этом направлении с подробным изучением состояния сперматогенеза в зависимости от времени, прошедшего после окончания хронического радиационного воздействия. Оценка репродуктивной способности животных после воздействия ионизирующего излучения в малых дозах в хроническом режиме, когда облучению подвергались половые клетки на всем цикле гаметогенеза, имеет важное практическое значение в связи с аналогичностью циклов гаметогенеза у животных и человека для прогнозирования отдаленных эффектов и выявления риска для репродукции.
Исследования выполнены в рамках госзада-ния по теме «Механизмы биогенной миграции радионуклидов и закономерности возникновения отдаленных последствий, индуцированных у растений и животных в условиях хронического радиационного и химического воздействия» ИБ ФИЦ Коми НЦ УрО РАН (№ АААА-А18-118011190102-7).
Список литературы Репродуктивные показатели мышей линии AF после хронического гамма-облучения в малых дозах
- Evaluation of DNA Damage in Différent Stages of Mouse Spermatogenesis after Testicular X-Irradiation / E. Cordelli, A.M. Fresegna, G. Leter, P. Eleuteri, M. Spanm, P. Villani // Radiat. Res. 2003. Vol. 160. № 4. P. 443-451. DOI: 10.1667/rr3053
- Воробцова И.Е. Трансгенерационная передача радиационно-индуцированной нестабильности генома // Радиационная биология. Радиоэкология. 2006. Т. 46. № 4. С. 441-446.
- Палыга Г.Ф., Чибисова О.Ф. Последствия для потомства двух поколений облучения беременных самок крыс Вистар в малых дозах в период закладки репродуктивной системы плодов. Развитие потомства второго поколения и его репродуктивная функция // Радиационная биология. Радиоэкология. 2006. Т. 46. № 4. С. 494-497.
- Фоменко Л А., Ломаева М.Г., Безлепкин. В.Г. Геномная нестабильность, выявляемая микроядерным тестом, у потомства F| - подвергнутых воздействию ионизирующей радиации // Радиационная биология. Радиоэкология. 2006. Т. 46. № 4. С. 431-435.
- Агаджанян А.В. Изучение трансгенерационного феномена геномной нестабильности у детей - потомков облученных родителей в результате аварии на ЧАЭС: Автореф. дис. ... канд. биол. наук. М.: РУДН, 2008. 21 с.
- Карпенко НА., Ларъяновская Ю.Б. Плодовитость облученных в малых дозах самцов крыс и тератогенные эффекты у их потомства // Проблемы здоровья и экологии. 2012. № 1 (31). С. 125-130.
- Нефедов И.Ю., Нефедова И.Ю., Палыга Г.Ф. Генетические последствия облучения одного и обоих родителей (результаты экспериментов на крысах линии Вистар) // Радиационная биология. Радиоэкология. 2001. Т. 41. № 2. С. 133-136.
- Дергилев АА. Сравнительная оценка последствий облучения самцов крыс в нестерилизующих дозах в онтогенезе двух поколений их потомства: Автореф. дис. ... канд. биол. наук. Обнинск: Медицинский радиологический научный центр, 2013. 16 с.
- Мамина В.П. Радиационный риск эмбриональной гибели в различных стадиях развития половых клеток мышей-самцов после низкодозного радиационного облучения // Радиация и риск (Бюллетень Национального радиационно-эпидемиологического регистра). 2019. Т. 28. № 3. С. 54-62.
- Морфофункциональное состояние репродуктивной системы крыс-самцов после хронического низкоинтенсивного облучения в дозе 1.0 Гр / Е.Ф. Конопля, Г.Г. Верещако, AM. Ходо-совская, В.Н. Рыбаков, О.В. Артеменко // Радиационная биология. Радиоэкология. 2002. Т 42. № 2. С. 136-140.
- Радиация. Дозы, эффекты, риск: Пер. с англ. ЮА. Банникова. М.: Мир, 1990. 79 с.
- Европейская конвенция по защите позвоночных животных, используемых для экспериментальных и других научных целей (ETS N 123). Страсбург, 1986.
- Reproductive characteristics of the Yangtze vole (Microtus Fortis Calamoruni) under laboratory feeding conditions / M. Zhanga, Q. Hana, G. Shena, Y. Wanga, B. Lia, C. Guob, X. Zhou // Animal Reproduction Science. 2016. Vol. 164. P. 64-71.
- Oakberg E.F. Duration of spermatogenesis in the mouse and timing of stages of the cycle of the seminiferous epithelium // Amer. J Anat. 1956. Vol. 99. P. 507-516.
- Мамина В.П., Семенов Д.И. Метод определения количества сперматогенных клеток семенника в клеточной суспензии // Цитология. 1976. Т. 18. № 7. С. 913-914.
- Осадчук Л.В. Параметры сперматогенеза и продукция тестостерона при половом созревании как предикторы функциональной активности семенников у лабораторных мышей (Mus Musculus) // Журнал эволюционной биохимии и физиологии. 2016. Т. 52. № 6. С.423-428.
- Soares E.R., Sheridan W., Segall M. Increased frequencies of aberant sperm as indicators of mutagenic damage in mice // Mutation Research. 1979. Vol. 64. № 1. P. 27-35.
- Methods for assessing sperm motility, morphology, and counts in the rat, rabbit, and dog: A consensus re-port / J. Seed, R.E. Cha-pin, E.D. Clegg, LA. Dostal, R.H. Foote, M.E. Hurtt, G.R. Klinefelter, S.L. Makris, S.D. Perreault, S. Schrader, D. Seyler, R. Sprando, KA. Treinen, D.N. Veeramachaneni, L.D. Wise II Reprod. Toxicol. 1996. Vol. 10. P. 237-244. DOI: 10.1016/0890-6238(96) 00028-7
- Effects of Chronic Low-Intensity Irradiation on Reproductive Parameters of the Root Vole (Alexandromys oeconomus): Responses of Parents and Offspring / O.V. Ermakova, LA. Ba-shlykova, O.V. Raskosha, N.N. Starobor // Russian Journal of Ecology. 2020. Vol. 51. №. 3. P. 242-249. DOI: 10.1134/S106741362003 0066
- Шахдинарова Л.В. Радиочувствительность ооцитов млекопитающих в онтогенезе и ее модификация мексамином и гипоксической гипоксией: Автореф. дис. ... канд. биол. наук. Обнинск: ВНИИСХР, 1989. 22 с.
- Нефедов И.Ю., Палыга Г.Ф. Лучевые эффекты в онтогенезе потомства одного или обоих облученных родителей // Радиационная биология. Радиоэкология. 1995. Т. 35. № 3. С. 375-380.
- Пак В.В. Реакция организма кур на действие ионизирующих излучений: Дис... докт. биол. наук. М., 2001. 355 с.
- Twinning in the offspring of parents with chronic radiation exposure from nuclear testing in Kazakhstan / N. Mudie, A. Swerdlow, B. Gusev, M. Schoemaker, L. Pivina, S. Clisher-bakova, A. Mansarina, S. Bauer, Y. Jakovlev, K. Apsalikov // Radiation Research. 2010. Vol. 173. P. 829-836. DOI: 10.1667/RR1 722.1
- Пастухова Е.И., Шалагинов С А., Аклеев A.B. Частота многоплодных родов у женщин, подвергшихся хроническому радиационному воздействию в населенных пунктах на р. Тече // Медицинская радиология и радиационная безопасность. 2011. Т. 55. № 3. С. 29-36.
- Федосенко О.Л., Зайцева О Л. Влияние радиоэкологического фактора на репродуктивную систему и клетки костного мозга крыс-сам-цов в ряду поколений // Радиация и Чернобыль: Ближайшие и отдаленные последствия. 2007. Т.4. С. 117-120.
- Lukas D., Huchard Е. The evolution of infanticide by males in mammalian societies // Science. 2014. Vol. 346. P. 841-844. DOI: 10.11 26/science.1257226
- Oswald C., McClure РЛ. Energy allocation during concurrent pregnancy and lactation in Norway rats with delayed and undelayed implantation 11 J. Exp. Zool. 1987. Vol. 241. P. 343-357.
- Назарова Г.Г., Евсиков В.И. Влияние физического состояния матери в период беременности и лактации на постнатальный рост и репродуктивный успех потомков водяной полевки (Arvícola terrestris L.) // Онтогенез. 2008. T. 39. № 2. С. 125-133.
- Guzick D., Overstreet J., Factor-Litvak P. Sperm morphology, motility, and concentration in fertile and infertile men // N. Engl. J. Med. 2001. Vol. 345. P. 1388-1393.
- Мамина В.П. Изменение уровня половых гормонов, циклических нуклеотидов и пролиферативной активности сперматогониальных клеток у лабораторных мышей при воздействии облучения в малых дозах // Цитология. 2018. Т. 60. № 2. С. 122-127.


