Репротезирование восходящего отдела и дуги аорты гомографтом при инфекции протеза с разрывом аорты после операции Бенталла де Боно
Автор: Марченко А.В., Вронский А.С., Мялюк П.А., Оборин А.А., Петрищев А.А., Синельников Ю.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 1 т.37, 2022 года.
Бесплатный доступ
Инфекция сосудистых протезов является грозным осложнением после кардиохирургических вмешательств. До сих пор остается открытым вопрос о тактике ведения таких пациентов, а также сроках применения каждого из методов лечения, таких как консервативная антибиотикотерапия и хирургическое вмешательство. Кроме того, сам по себе выбор хирургического метода лечения ставит перед специалистами новые вопросы относительно применяемой методики (протезосохраняющая техника, эксплантация протеза со сменой его на синтетический или биологический графт, использование сальника для укрывания инфицированного ложа). Нами представлен случай лечения пациента с инфицированным синтетическим клапансодержащим кондуитом после операции Бенталла де Боно и разрывами аорты с образованием ложных аневризм. Обращает на себя внимание длительно текущее клиническое состояние больного, проявляющееся лихорадкой, и отсутствие данных за инфекционно-воспалительный процесс по результатам позитронно-эмиссионной томографии и по посевам крови. В качестве кондуита нами был выбран гомографт восходящей аорты и дуги аорты с аортальным клапаном. Также интересен факт, что посевы инфицированного протеза и аортального клапана не выявили инфекционного агента. Агрессивная антибиотикотерапия в совокупности с хирургической заменой инфицированного протеза на криозаготовленный аллотрансплантат позволила провести полноценное лечение пациента без осложнений.
Аневризма аорты, инфекция сосудистого протеза, гомографт, аллотрансплантат, репротезирование аорты
Короткий адрес: https://sciup.org/149140014
IDR: 149140014 | УДК: 616.132.13/.14-089.193.4-02:616.132-77-089.168.1-06
Текст научной статьи Репротезирование восходящего отдела и дуги аорты гомографтом при инфекции протеза с разрывом аорты после операции Бенталла де Боно
Инфекция протеза является наиболее грозным осложнением в сердечно-сосудистой хирургии. Случаи инфицирования протеза восходящей аорты крайне редки и составляют 1,4%, однако летальность без лечения может достигать 90% [1, 2]. Несмотря на то что хирургический подход является основным методом лечения, риски вмешательства крайне высоки [3, 4]. Представлен клинический случай успешного лечения пациента с инфицированием протеза восходящей аорты и разрывом аорты после операции Бенталла де Боно.
Клиническое наблюдение
Пациент Д., 30 лет, поступил в Федеральный центр сердечно-сосудистой хирургии имени С.Г. Суханова Министерства здравоохранения Российской Федерации в январе 2021 г. с жалобами на повышение температуры до 38,4 ºC, периодическое кровохарканье, одышку. В августе 2015 г. пациенту выполнена операция Бенталла де Боно по поводу аневризмы корня и восходящего отдела аорты и недостаточности аортального клапана. С января 2019 г.
стал отмечать повышение температуры до 40 ºC. На фоне антибактериальной терапии наступило кратковременное улучшение самочувствия, однако остались явления субфебрильной температуры. По данным эхокардиографии (ЭхоКГ) от декабря 2019 г.: по наружной поверхности правой полуокружности корня и восходящей аорты выявлено эхогенное неоднородное образование с неровным контуром, с супрастернальным распространением вдоль восходящей аорты. Была выполнена позитронно-эмиссионная томография, данных за инфекционно-воспалительный процесс не получено. Неоднократные посевы крови не выявили инфекционного агента. Принято решение о консервативном лечении больного, проводилась неоднократная госпитализация, консервативное лечение имело кратковременный положительный эффект. На серии мультиспиральной компьютерной томографии (МСКТ): признаки реактивных изменений в клетчатке переднего средостения без отрицательной динамики, анастомозы состоятельны. В декабре 2020 г. перенес двустороннюю пневмонию коронавирусной этиологии, с этого момента стало беспокоить периодическое кровохарканье, отмеча- лось повышение температуры до 38,5 ºC. На ЭхоКГ от января 2021 г.: гиперэхогенное утолщение парапротез-ных тканей вокруг протеза восходящей аорты; увеличение объемных образований по сравнению с прошлыми исследованиями. Признаки дисфукции протезированного клапана не выявлены.
В январе 2021 г. на МСКТ аорты обнаружены ложные аневризмы в области устья левой коронарной артерии (ЛКА) и дистального анастомоза протеза (рис. 1). Учитывая состояние пациента и отрицательную динамику по МСКТ, принято решение выполнить репротезирование аортального клапана, восходящей аорты и дуги аорты гомографтом.
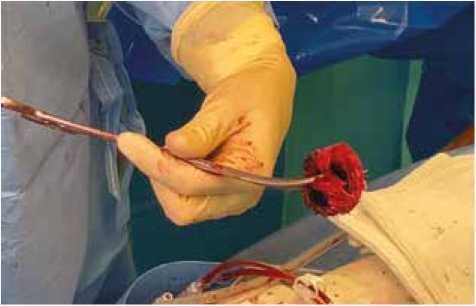
Рис. 2. Иссеченный протез с искусственным клапаном Fig. 2. Excised prosthesis with artificial valve
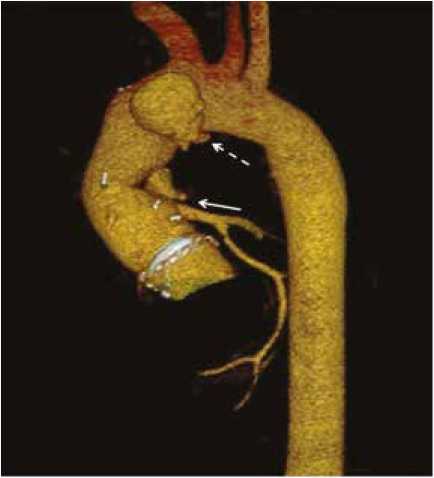
Рис. 1. Мультиспиральная компьютерная томография аорты: белой стрелкой обозначена аневризма в области устья левой коронарной артерии, белой пунктирной стрелкой – ложная аневризма в области проксимального анастомоза
Fig. 1. Multispiral computed tomography of the aorta: the white arrow indicates the aneurysm in the area of the left coronary artery orifice. The white dashed arrow indicates a false aneurysm in the proximal anastomosis
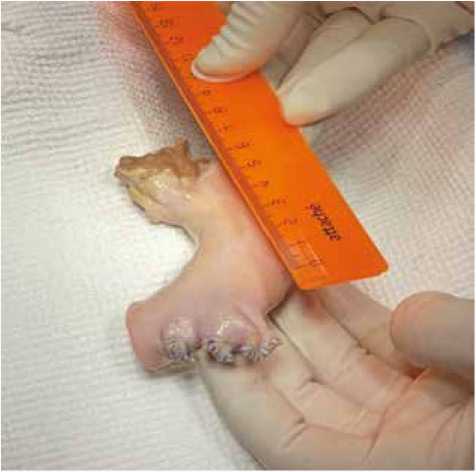
Рис. 3. Гомографт аорты
Fig. 3. Aortic homograft
До операции за 3 сут пациенту назначена антибиоти-котерапия в следующем объеме: даптомицин – 1,0 г/сут, амикацин – 1,0 г/сут, рифампицин – 300 мг/сут. В связи с высоким риском интраоперационного кровотечения и повреждения спаянных структур было принято решение выполнить канюляцию до проведения рестернотомии по схеме: подключичная артерия – бедренная вена. При рестернотомии область средостения представляла собой один спаянный конгломерат. Отмечались ложные аневризмы в области дистального анастомоза и анастомоза ЛКА. При тотальном аресте на 24 градусах и антеградной церебральной перфузии вскрыта капсула протеза восходящей аорты, в парапротезном пространстве отмечались тромбированные гнойные массы. Иссечен протез вместе со стенкой измененной аорты (рис. 2).
В качестве кондуита нами был использован криозаго-товленный аллотрансплантат восходящей аорты и дуги аорты с аортальным клапаном. Перед имплантацией гомографта средостение обработано растворами бетадина и рифампицина (рис. 3).
Выполнено протезирование аортального клапана, восходящего отдела и дуги аорты гомографтом. ЛКА пациента реимплантирована в устье ЛКА гомографта. Правая коронарная короткая (ПКА) спаяна. Выполнено протезирование ПКА аутовеной с реимплантацией в гомографт. Аутовена реимплантирована в гомографт. Время тотального ареста составило 51 мин, время искусственного кровообращения – 322 мин, время пережатия аорты – 155 мин. Общее время операции – 14 ч 45 мин. Столь длительное время вмешательства обусловлено длительным гемостазом. Возврат крови осуществлялся через аппаратную реинфузию. Перелито 2219 мл эритроцитарной массы, 1990 мл свежезамороженной плазмы, 360 мл тромбомассы, 360 мл криопреципитата. Время искусственной вентиляции легких составило 72 ч, время пребывания в отделении реанимации и интенсивной терапии – 7 сут. Реинфузия аутокрови с использованием аппарата Cell-Saver: 51 ч. В послеоперационном периоде пациенту назначена антибиотикотерапия по следующей схеме: амикацин – 1,0 г/сут, даптоми- цин – 1,0 г/сут, меропенем – 1,0 г/сут, левофлоксацин – 500 мг/сут в течение 6 нед. Роста бактерий в посевах с парапротезных масс, искусственного клапана и протеза аорты не выявлено. В послеоперационном периоде сохранялся подъем температуры до 37,8 ºC в течение недели после вмешательства, через неделю достигнута нормотермия.
МСКТ органов грудной клетки после операции: гомографт аорты проходим, сужений анастомозов не зарегистрировано, признаков объемных образований в пара-протезном пространстве не выявлено (рис. 4).
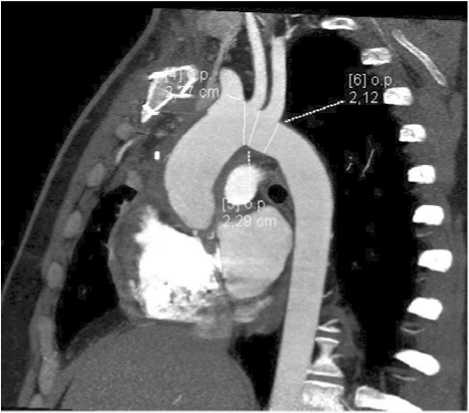
Рис. 4. МСКТ контроль после операции. Гомографт проходим, признаков парапротезных образований не выявлено
Fig. 4. MSCT control after surgery. The homograft was passable; no signs of paraprosthetic formations were found
Обсуждение
Инфекции при реконструктивных вмешательствах на сосудистой системе являются серьезной проблемой нашего времени. Активно проводятся исследования по разработке нового пластического материала, более устойчивого к инфицированию [5]. Инфицирование кондуита после операции Бенталла де Боно – редкое осложнение, которое встречается в 1,4% случаев, однако каждый подобный случай является серьезным испытанием как для хирурга, так и для пациента. В 1984 г. W.C. Hargrove и L.H. Edmunds стали пионерами в хирургии инфекции протеза восходящей аорты. Ими были предложены собственные рекомендации, суть которых сводилась к хирургической обработке ложа протеза и агрессивной антибиотикотерапии [6]. Является примечательным то, что на сегодня этими принципами по-прежнему руководствуются при выборе тактики ведения подобных случаев. На момент описания первых случаев инфекции протеза восходящей аорты стояло два главных вопроса: стоит ли осуществлять эксплантацию протеза, и если стоит, то на что его менять? Первое сравнительное исследование методик лечения инфекции протеза восходящей и грудной аорты провели J.S. Cosseli и соавт. Авторы сделали вывод, что тактика должна определяться индивидуально, однако в каждом случае без сомнений должна проводиться длительная парентеральная антибиотикотерапия.
В серии наблюдений J.S. Cosseli и соавт. 40% пациентов имели рецидив инфекции в течение 2 лет после лечения, что указывает на отсутствие оптимальной тактики ведения таких больных [7].
Имеются данные о возможности замены инфицированного кондуита на новый синтетический протез с 91%-й выживаемостью за 1 год [7]. Однако в ряде других исследований получены неутешительные результаты: авторы сообщили о 46%-й смертности в 30-дневный период [8]. Антибиотикотерапия является неотъемлемой частью лечения инфекции протеза, но все же изолированное лечение антибиотиками не эффективно, и лишь в нескольких исследованиях показана эффективность такого подхода [9]. Несмотря на возможности консервативной терапии, основным методом лечения является хирургический.
Ряд хирургов сообщают о протезосохраняющей тактике, которая заключается в дисекции окружающих тканей протеза, обязательной обработке растворами повидон-йода и антибиотиками и дальнейшей системной антибиотикотерапии [10]. Первым об удачном опыте сообщил Y. Kawachi [11]. Другие авторы также применили тактику сохранения кондуита с тщательной обработкой парапротезного пространства [12]. Однако такой подход несет в себе большие риски рецидива инфекции [8], к тому же при распространении инфекции на швы протеза и наличии вегетаций на искусственном клапане подобная тактика не применима. Многие авторы после тщательной обработки укладывают на протез васкуляризированную здоровую ткань (сальник или мышечный лоскут), что имеет положительный эффект [9]. Какая бы тактика не была выбрана, все же повторные операции по поводу инфекции протеза восходящей аорты требуют обширной резекции парапротезных тканей. Такие длительные операции с циркуляторным арестом и сложной реконструкцией анатомии аорты и ее ветвей показаны молодым и коморбидно неотягощенным пациентам [13]. Повторный доступ заставляет манипулировать в условиях рубцово-измененных тканей, что создает опасность повреждения жизненно важных структур. По нашему мнению, обход по схеме: подключичная артерия – бедренная вена до рестернотомии позволяет управлять кровотечением в случае повреждения жизненно важных органов.
Широко распространенным методом является замена синтетического протеза на криозаготовленный аллотрансплантат [13–15]. Структура аллографтов более устойчива к инфекции, к тому же ряд авторов сообщали что гистоархитектоника гомографтов позволяет накапливать антибиотики [16]. Аллотрасплантаты обладают неоспоримыми хирургическими преимуществами, такими как удобство в работе, биомеханическая и биологическая совместимость, возможность воспроизведения точной анатомической конфигурации, и являются уверенной альтернативой другим биопротезам. Все же аллограф-ты имеют свои недостатки, такие как аневризматическая трансформация и кальцификация в отдаленном периоде [16, 17]. Проблемы с использованием аллотрансплантатов связаны как с иммунным ответом, так и со способом консервации [18].
Все же аллотрансплантаты более устойчивы к инфекции, и мы считаем, что криозаготовленный аллографт является кондуитом выбора при инфекции восходящей аорты. Отсутствие роста по данным посевов, вероятно, связано с агрессивной антибиотикотерапией, которую пациент неоднократно получал до оперативного вмешательства.
Выводы
Инфекция протеза восходящей аорты является грозным осложнением с высокой вероятностью летальности. Из существующих методик лечения наиболее эффективным и безопасным считается эксплантация протеза с репротезированием криозаготовленным аллотранс- плантатом. Подключение аппарата искусственного кровообращения до рестернотомии позволяет профилакти-ровать риски фатальных кровотечений. Своевременная диагностика, раннее начало антибиотикотерапии, профессиональный хирургический подход и грамотное анестезиологическое пособие играют решающую роль в лечении данной тяжелой когорты пациентов [19]. Однако важным моментом является динамическое наблюдение пациентов с оценкой отдаленных результатов лечения.
Список литературы Репротезирование восходящего отдела и дуги аорты гомографтом при инфекции протеза с разрывом аорты после операции Бенталла де Боно
- Joo H.-C., Chang B.-C., Youn Y.-N., Yoo K.-J., Lee S. Clinical experience with the Bentall procedure: 28 years. Yonsei Med. J. 2012;53(5):915-923. DOI: 10.3349/ymj.2012.53.5.915.
- Teebken O.E., Bisdas T., Assadian O., Ricco J.-B. Recommendations for reporting treatment of aortic graft infections. Eur. J. Vase. Endovasc. Surg. 2012;43(2):174-181. DOI: 10.1016/j.ejvs.2011.11.003.
- Czerny M., von Allmen R., Opfermann P., Sodeck G., Dick F., Stellmes A. et al. Self-made pericardial tube graft: a new surgical concept for treatment of graft infections after thoracic and abdominal aortic procedures. Ann. Thorac. Surg. 2011;92(5):1657-1662. DOI: 10.1016/j.athorac-sur.2011.06.073.
- Coselli J.S., Koksoy C., LeMaire S.A. Management of thoracic aortic graft infections. Ann. Thorae. Surg. 1999;67(3):1990-1993; discussion 1997-1998. DOI: 10.1016/s0003-4975(99)00355-0.
- Гудков А.В., Идигов А.М., Козлов Б.Н. Применение буккально-го трансплантата (buccal mucosa) для пластики магистральных сосудов. Сибирский журнал клинической и экспериментальной медицины. 2021;36(1):150-157. DOI: 10.29001/2073-8552-2021-361-150-157.
- Hargrove W.C., Edmunds L.H. Management of infected thoracic aortic prosthetic grafts. Ann. Thorac. Surg. 1984;37(1):72-77. DOI: 10.1016/ s0003-4975(10)60714-x.
- Coselli J.S., Crawford E.S., Williams T.W., Bradshaw M.W., Wiemer D.R., Harris R.L. et al. Treatment of postoperative infection of ascending aorta and transverse aortic arch, including use of viable omentum and muscle flaps. Ann. Thorac. Surg. 1990;50(6):868-881. DOI: 10.1016/0003-4975(90)91111-N.
- LeMaire S.A., DiBardino D.J., Koksoy C., Coselli J.S. Proximal aortic reoperations in patients with composite valve grafts. Ann. Thorac. Surg. 2002;74(5):S1777-1780; discussion S1792-1799. DOI: 10.1016/s0003-4975(02)04152-8.
- Tossios P., Karatzopoulos A., Tsagakis K., Sapalidis K., Grosomanidis V., Kalogera A. et al. Treatment of infected thoracic aortic prosthetic grafts with the in situ preservation strategy: A review of its history, surgical technique, and results. Heart Lung Circ. 2014;23(1):24-31. DOI: 10.1016/j. hlc.2013.09.001.
- Chavanon O., Thony F., Lebeau J., Blin D. Exposed prosthesis of a complex reconstruction of the ascending aorta and aortic arch in a sternal wound infection: Successful treatment by a pectoral muscle flap. Eur. J. Cardio-Thorac. Surg. 1998;13(1):98-100. DOI: 10.1016/s1010-7940(97)00285-6.
- Kawachi Y., Nakashima A., Onzuka T., Yamauchi T. False aneurysm of the ascending aorta concomitant with chronic mediastinitis after tube graft replacement in octogenarian. Eur. J. Cardio-Thorac. Surg. 2002;22(3):450-453. DOI: 10.1016/s1010-7940(02)00340-8.
- Mathes D.W., Yaremchuk M.J., Isselbacher E.M., Madsen J.C. Successful in situ treatment of an infected ascending aortic graft. Ann. Thorac. Surg. 2000;70(4):1410-1412. DOI: 10.1016/s0003-4975(00)01964-0.
- Khaladj N., Pichlmaier U., Stachmann A., Peterss S., Reichelt A. et al. Cryopreserved human allografts (homografts) for the management of graft infections in the ascending aortic position extending to the arch. Eur. J. Cardio-Thorac. Surg. 2013;43(6):1170-1175. DOI: 10.1093/ejcts/ ezs572.
- Lytle B.W., Sabik J.F., Blackstone E.H., Svensson L.G., Pettersson G.B., Cosgrove D.M. Reoperative cryopreserved root and ascending aorta replacement for acute aortic prosthetic valve endocarditis. Ann. Thorac. Surg. 2002;74(5):S1754-1757; discussion S1792-1799. DOI: 10.1016/ s0003-4975(02)04129-2.
- Kaya A., Schepens M.A., Morshuis W.J., Heijmen R.H., Brutel de la Riviere A., Dossche K.M. Valve-related events after aortic root replacement with cryopreserved aortic homografts. Ann. Thorac. Surg. 2005;79(5):1491-1495. DOI: 10.1016/j.athoracsur.2004. 11.026.
- Vogt P.R., Brunner-La Rocca H.P., Carrel T., von Segesser L.K., Ruef C., Debatin J. et al. Cryopreserved arterial allografts in the treatment of major vascular infection: A comparison with conventional surgical techniques. J. Thorac. Cardiovasc. Surg. 1998;116(6):965-972. DOI: 10.1016/s0022-5223(98)70048-0.
- Мухамадеев И.С., Прохоров К.В., Оборин А.А. Аневризматическое перерождение биопротеза. Кардиология. 2018;58(6):90-94. DOI: 10.18087/cardio.2018.6.10136.
- Flameng W., Jashari R., De Visscher G., Mesure L., Meuris B. Calcification of allograft and stentless xenograft valves for right ventricular outflow tract reconstruction: An experimental study in adolescent sheep. J. Thorac. Cardiovasc. Surg. 2011;141(6):1513-1521. DOI: 10.1016/j. jtcvs.2010.08.082.
- Барбараш Л.С., Криковцов А.С., Журавлева И.Ю. Биологические протезы артерий. Кемерово: Кемеровский полиграфкомбинат; 1996:208.


