Респираторные эффекты активации паратригеминальной области у крыс
Автор: Ведясова О.А., Ковалева Т.Е.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 4, 2017 года.
Бесплатный доступ
Актуальным аспектом проблемы регуляции дыхания у млекопитающих животных является изучение механизмов, опосредующих респираторную активность паратригеминальной области (ПТО) моста. Цель. Анализ изменений внешнего дыхания и реакций диафрагмальной мышцы при электростимуляции и активации L-глутаматом ПТО у крыс. Материалы и методы. Поставлены острые опыты на крысах, наркотизированных уретаном. Электростимуляцию ПТО осуществляли монополярно импульсным током посредством стального игольчатого микроэлектрода. Раствор L-глутамата (10-7 М; 0,2 мкл) инъецировали в ПТО через стеклянную микроканюлю при помощи микрошприца МШ-1. Внешнее дыхание регистрировали методом спирографии, реакции диафрагмы оценивали по электромиограмме (ЭМГ). Результаты. Активация ПТО путем электростимуляции и микроинъекций L-глутамата вызывала сходные эффекты в виде ослабления легочной вентиляции и уменьшения частоты дыхания за счет пролонгации экспираторной фазы. Изменениям паттерна дыхания соответствовало увеличение интервалов между инспираторными залпами на ЭМГ диафрагмы. Заключение. ПТО у млекопитающих животных участвует в регуляции ритма и паттерна дыхания. Реализация респираторных эффектов ПТО опосредуется глутаматергическими связями, которые у крыс преимущественно включены в механизмы, определяющие длительность фазы выдоха и, таким образом, частоту дыхания.
Паратригеминальная область, глутамат, паттерн внешнего дыхания, электромиограмма диафрагмы
Короткий адрес: https://sciup.org/14113313
IDR: 14113313 | УДК: 612.28 | DOI: 10.23648/UMBJ.2017.28.8756
Текст научной статьи Респираторные эффекты активации паратригеминальной области у крыс
Введение. Центральные механизмы регуляции дыхания составляют важную медико-биологическую проблему, при решении которой внимание исследователей долгие годы было сосредоточено на ритмогенерирующей функции бульбарного дыхательного центра [1–3]. Нейроны, участвующие в рит-могенезе дыхания, также обнаружены в варолиевом мосту, в понтинной дыхательной группе, куда входят регион «парафациальная респираторная группа/ретротрапециевидное ядро» [4, 5] и паратригеминальная область (ПТО), респираторная активность которой впервые была выявлена у миноги [6]. Нейроны ПТО, названные паратригеминальной респираторной группой (ПТРГ), исследователи рассматривают как генератор дыхательного ритма у низших позвоночных [6, 7]. У крыс вблизи ПТО (в интер-, супра- и сенсор- ном тригеминальных ядрах) выявлены дыхательные нейроны с фазовопереходным паттерном разрядов [8], что позволяет предполагать участие ПТО в регуляции респираторного ритма и у млекопитающих животных.
Актуальным является изучение нейрохимической организации понтинной дыхательной группы [9], при этом закономерный интерес вызывает глутамат как основной возбуждающий медиатор, участвующий в регуляции дыхания [10]. Роль глутамата на уровне ритмогенерирующих нейронов ПТО в настоящее время интенсивно изучается у низших позвоночных [7, 11]. Вопрос о значении глутаматергической нейропередачи в формировании респираторной активности ПТО и в целом об участии ПТО в регуляции дыхания у млекопитающих животных остается открытым.
Цель исследования. Анализ изменений паттерна внешнего дыхания и реакций диафрагмальной мышцы при электростимуляции и активации глутаматом ПТО у крыс.
Материалы и методы. Поставлены две серии острых опытов на беспородных половозрелых крысах обоего пола массой 250–300 г, наркотизированных уретаном (1,5 г/кг, внутрибрюшинно). В первой серии (n=6) изучали респираторные реакции на электростимуляцию ПТО, во второй (n=7) – на микроинъекции в ПТО L-глутамата. Все этапы исследования выполнены с соблюдением правил биоэтики и одобрены комиссией по биоэтике Самарского университета. В ходе операции проводили трахеостомию, открывали подход к диафрагме через кожный разрез на левом боку, обнажали крышу черепа и высверливали трепанационное отверстие в париетальной кости. Оперированных крыс закрепляли в стереотаксическом приборе СЭЖ-3 спиной вверх. ПТО раздражали импульсным током от универсального электростимулятора посредством монополярного игольчатого микроэлектрода с диаметром кончика 60 мкм. Индифферентный электрод закрепляли на мышцах шеи. Параметры тока: частота 5 Гц; напряжение 3 и 7 В; длительность импульса 1 мс, время раздражения 3 с. Для микроинъекций в ПТО использовали раствор L-глутамата (Sigma Aldrich) концентрацией 10-7 М, который готовили ex tempore на основе искусственной цереброспинальной жидкости. Раствор инъецировали в объеме 0,2 мкл через стеклянную канюлю (диаметр кончика 20–25 мкм), укрепленную на игле микрошприца МШ-1. Электростимуляцию и микроинъекции осуществляли по координатам стереотаксического атласа мозга крысы [12]: 12,72 мм каудальнее bregma; 2,8 мм ла-теральнее срединного шва; 7,6 мм вглубь от поверхности черепа.
Внешнее дыхание регистрировали через трахеостомическую трубку при помощи электронного спирографа. Электромиограмму (ЭМГ) диафрагмальной мышцы отводили стальными биполярными электродами (межэлектродное расстояние 3 мм), подсоединенными к миографическому усилителю. Выходные сигналы от спирографа и электро- миографа через аналогово-цифровой преобразователь подавались на компьютер и записывались в программе PowerGraph 3.2 Profes-soinal (ООО «Интероптика-С»). Респираторные эффекты регистрировали в исходном состоянии, при электростимуляции ПТО и в течение 60 мин после микроинъекции глутамата. По спирограммам определяли длительность вдоха (Ti, c) и выдоха (Te, с), частоту дыхания (ЧД, цикл/мин), дыхательный объем (ДО, мл), минутный объем дыхания (МОД, мл/мин). На ЭМГ оценивали длительность инспираторных залпов (ДЗ, с), межзалповые интервалы (МЗИ, с), максимальную амплитуду осцилляций (отн. ед.).
Для статистической обработки применяли парный t-test из пакета программ SigmaStat 4.0 (Jandel Scientific, USA). Все данные приведены как средние значения и ошибка изменения в % относительно исходного уровня. Достоверными считали различия при p<0,05.
Результаты и обсуждение. Характерным респираторным эффектом активации ПТО путем электростимуляции и микроинъекций L-глутамата было угнетение дыхания, обусловленное изменениями частотных показателей спирограммы и ЭМГ диафрагмы. Интегральный эффект раздражения ПТО проявлялся уменьшением МОД на 5,4–9,6 % (p<0,05) от исходного уровня в зависимости от силы раздражения. Ослабление внешнего дыхания обусловливалось снижением ЧД на 6,6–7,9 % (p<0,05), тогда как ДО практически не менялся. Изменения ЧД определяя-лись преобразованиями фазовой структуры дыхательного цикла за счет увеличения Te от 0,512±0,03 (исходный уровень) до 0,683±0,04 c (при стимуляции ПТО). По мере усиления раздражения эффект пролонгации выдоха возрастал и мог достигать 33,4 % (p<0,05) от исходного значения. Изменениям Te и ЧД соответствовали увеличение МЗИ на 17,9 % (p<0,05) и уменьшение частоты инспираторных залпов на ЭМГ диафрагмы (рис. 1). Значимых изменений Ti на спиро-граммах, как и ДЗ и амплитуды осцилляций на ЭМГ диафрагмы, при электростимуляции ПТО у крыс не наблюдалось.
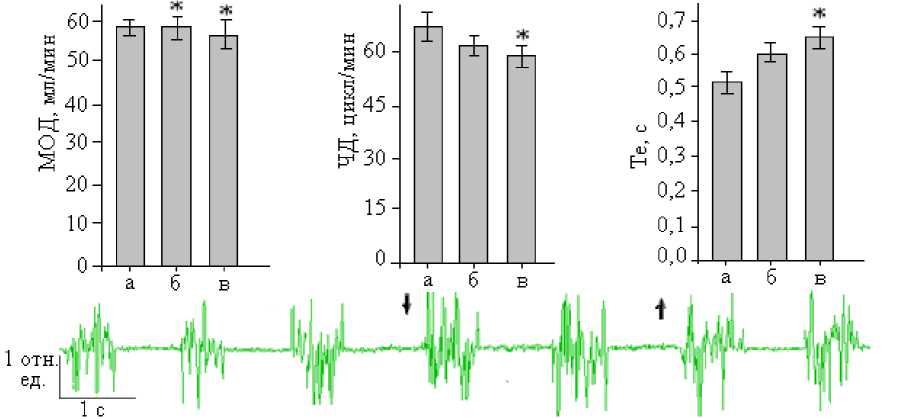
Рис. 1. Респираторные эффекты электростимуляции ПТО у крыс: вверху - изменение параметров внешнего дыхания
(а - исходное состояние; б, в - стимуляция током 5 Гц, 3 В и 5 Гц, 7 В соответственно), внизу - ЭМГ диафрагмы (начало и окончание раздражения отмечено стрелками).
* - достоверные различия с исходным уровнем (p<0,05)
Микроинъекции L-глутамата в ПТО крыс вызывали респираторные реакции, которые также проявлялись преимущественными изменениями временных параметров дыхания по тормозному типу. Результаты активации ПТО L-глутаматом подтвердили отмеченную в опытах с электростимуляцией тесную связь изучаемой области с экспираторными механизмами. Изменения спирограмм и ЭМГ после микроинъекции медиатора имели длительный латентный период, что можно объяснить участием глутаматцептивных элементов ПТО в регуляции ритмики дыхания посредством сложных межсинаптических взаимодействий.
Наиболее выраженные реакции дыхания в виде увеличения Те и синхронного снижения ЧД начинались с 30-й мин от момента введения медиатора и достигали максимальных проявлений после 40-й мин. Значения Те при действии L-глутамата на ПТО возрастали в диапазоне от 0,508±0,030 (исходное состояние) до 0,673±0,040 с на 60-й мин экспозиции (рис. 2а), что составляло 32,3 % (p<0,05). Эти изменения совпадали с динамикой ЧД, которая закономерно снижалась в течение всего периода регистрации. Наибольшее влияние L-глутамата отмечалось на 40-й мин экспози ции, когда ЧД уменьшалась на 22,9 % (p<0,05): от 66,88±3,82 до 51,56±3,08 цикл/мин (рис. 2б). Статистически значимых изменений ДО при этом не выявлено. Динамика временных параметров ЭМГ диафрагмы совпадала с отмеченными изменениями паттерна дыхания. Типичной реакцией диафрагмы на инъекции L-глутамата в ПТО было выраженное удлинение МЗИ на 27,9 и 38,9 % (p<0,001) на 50-й и 60-й мин экспозиции (рис. 2в) в сочетании с небольшим приростом ДЗ (10,7 %; p<0,05). То есть доминировали изменения МЗИ, которые являются электрофизиологическим коррелятом экспирации.
Величина ДО на фоне активации глутаматных рецепторов ПТО оставалась практически неизменной на протяжении всего времени наблюдений. Поэтому направленность динамики легочной вентиляции в сторону снижения была связана прежде всего с уменьшением ЧД. Как видно из гистограмм на рис. 2г, тенденция снижения МОД от исходного уровня (58,73±1,99 мл/мин) приобретала достоверный характер начиная с 40-й мин (уменьшение до 52,744±2,76 мл/мин, или на 10,2 %) и усиливалась к 60-й мин воздействия L-глутамата (уменьшение до 50,09± ±2,69 мл/мин, или на 14,7 %).
компонента внешнего дыхания и инспира-
мышцы торной активности диафрагмальной (рис. 3).
В качестве иллюстрации описанных реакций представлены спирограммы и ЭМГ, из которых видно, что активация ПТО L-глута-
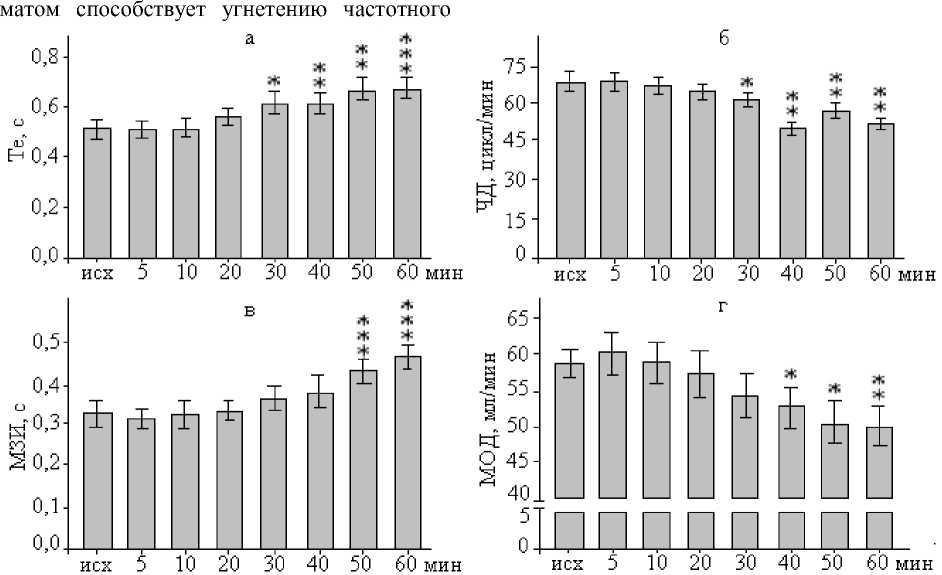
Рис. 2. Изменение параметров внешнего дыхания и ЭМГ диафрагмы после микроинъекции L-глутамата в ПТО у крыс.
Достоверные различия с исходным уровнем при: * - p<0,05; ** - p<0,01; *** - p<0,001
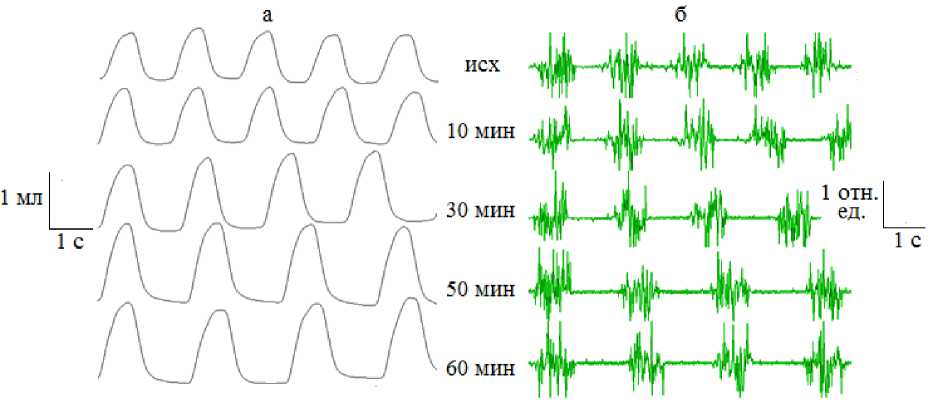
Рис. 3. Изменения абриса спирограмм (а) и ЭМГ диафрагмы (б) после микроинъекции 10-7 М раствора L-глутамата в ПТО у крыс
Результаты, полученные в настоящей работе с применением электрической и химической стимуляции ПТО у крыс, свидетельствуют об участии ПТО в регуляции дыхательной ритмики у млекопитающих живот- ных. Это в известной мере соответствует представлениям о ПТРГ как вероятном генераторе ритма дыхания [7], основанным на результатах изучения ПТО у низших позвоночных, в т.ч. на данных о прекращении дыхания после механического и химического разрушения указанной области у миноги [13].
Участие ПТО в респираторном контроле у крыс опосредуется глутаматергическими механизмами, активация которых снижает частоту инспираторных разрядов диафрагмы, а также уменьшает ЧД за счет значительной пролонгации экспираторной фазы. Существенное удлинение выдоха в ответ на введение L-глутамата в ПТО, на наш взгляд, может обеспечиваться двумя путями. Во-первых, при активации глутаматных рецепторов могут усиливаться залповые разряды премоторных экспираторных нейронов. Во-вторых, может происходить глутаматергическая активация тормозных нейромедиаторных механизмов, модулирующих разряды дыхательных нейронов, участвующих в респираторном ритмогенезе. В частности, у крыс это могут быть гистохимически и электрофизиологически идентифицированные фазовопереходные (I-E1, I-E2) и инспираторные нейроны, локализованные в пределах ПТРГ, взаимодействующие с дендритами нейронов пневмотаксического комплекса и направляющие свои аксоны в вентролатеральную часть моста [8]. Кроме того, в ПТРГ присутствуют нейроны, посылающие контралатеральные проекции в симметричную ПТРГ, а также премоторные интернейроны, образующие билатеральные связи со стволовыми респираторными мотонейронами [14]. В свою очередь нейроны понтомедуллярных районов мозгового ствола получают возбуждающие входы из каудальной вентральной респираторной группы [15]. Эти межнейронные связи позволяют говорить об участии ПТО как в генерации дыхательного ритма, так и в формировании паттерна дыхания.
В плане объяснения тормозного характера респираторных реакций на активацию глутаматных рецепторов ПТО у крыс представляют интерес исследования in vitro на мозге миноги, в которых установлено, что респираторные мотонейроны, направляющие аксоны в ПТРГ, обладают иммунореактивностью к глутамату и окружены глицинергическими клетками и ГАМК-иммунореактивными структурами. Блокада ГАМКА и глициновых рецепторов в моторных ядрах продолговато- го мозга увеличивает ЧД [7]. Однако исследователи полагают, что не ГАМК и не глицин, а только эндогенно высвобождаемые возбуждающие аминокислоты играют существенную роль в респираторном ритмогенезе [16]. В то же время ГАМК- и глицинергиче-ские входы к респираторным мотонейронам, например в пределах вагального комплекса, опосредуют изменения ЧД через модуляцию восходящих возбуждающих проекций к ПТРГ [17]. То есть восходящие глутаматер-гические пути к ПТРГ подвергаются мощным тормозным влияниям, а их растормаживание является одним из важнейших механизмов регуляции ЧД [7]. С учетом этих данных можно объяснить угнетение дыхания, наблюдаемое нами при микроинъекциях L-глутамата в ПТО крыс, как результат возбуждения имеющихся здесь ГАМКергических терминалей, выхода из них ГАМК и активации ГАМКА-рецепторов. Наличие последних в ПТО у грызунов подтверждено изменениями ларингеальных респираторных рефлексов и ЧД при микроинъекциях мусцимола в область ПТО у морских свинок [18].
Особенностью респираторных эффектов активации ПТО глутаматом оказалась их значительная продолжительность во времени, что, возможно, связано с метаботропной природой рецепторов и внесинаптическими влияниями экзогенного медиатора. В ряде работ установлено, что действие глутамата, как и ГАМК, не ограничивается только локальным постсинаптическим участком. Эти нейроактивные аминокислоты способны высвобождаться во внесинаптическое пространство за счет спилловера, т.е. растекания из синаптической щели [19]. Допустимо считать, что микроинъекции глутамата в ПТО приводят к широкому распространению данного медиатора по доступному пространству и активации определенных классов рецепторов, что способствует выделению эндогенной ГАМК. Имеются данные о том, что повышение содержания внеклеточной ГАМК может быть вызвано активацией каинатных рецепторов глутамата [20]. Высвобождающаяся ГАМК, в свою очередь, оказывает ингибирующее влияние на ритмогенерирующие и паттернформирующие нейроны, что ведет к снижению ЧД и легочной вентиляции у животных.
Заключение. Таким образом, ПТО у млекопитающих животных можно рассматривать как респираторно активную часть моста, участвующую в регуляции ритма и паттерна дыхания. Участие ПТО в респираторном контроле опосредуется глутаматерги-ческими связями, которые у крыс преимущественно включены в механизмы, регулирующие длительность экспираторной фазы и, следовательно, частоту дыхания.
Список литературы Респираторные эффекты активации паратригеминальной области у крыс
- Bianchi A.L., Denavit-Saubie M., Champagnat J. Central control of breathing in mammals: neuronal circuitry, membrane properties, and neurotransmitters. Physiol. Rev. 1995; 75 (1): 1-45.
- Сафонов В.А. Регуляция внешнего дыхания. Вестник СурГУ. Медицина. 2009; 1 (2): 13-22.
- Feldman J.L., Del Negro C.A. Looking for inspiration: new perspectives on respiratory rhythm. Nat. Rev. Neurosci. 2006; 7: 232-242.
- Huckstepp R.T.R., Cardoza K.P., Henderson L.E., Feldman J.L. Role of parafacial nuclei in control of breathing in adult rats. J. Neurosci. 2015; 35 (3): 1052-1067.
- Moraes D.J.A., Dias M.B., Cavalcanti-Kwiatkoski R., Machado B.H., Zoccal D.B. Contribution of the retrotrapezoid nucleus/parafacial respiratory region to the expiratory-sympathetic coupling in response to peripheral chemoreflex in rats. J. Neurophysiol. 2012; 108: 882-890.
- Cinelli E., Robertson B., Mutolo D., Grillner S., Pantaleo T. Bongianni F. Neuronal mechanisms of respiratory pattern generation are evolutionary conserved. J. Neurosci. 2013; 33 (21): 9104-9112.
- Cinelli E., Mutolo D., Contini M., Pantaleo T., Bongianni F. Inhibitory control of ascending glutamatergic projections to the lamprey respiratory rhythm generator. J. Neurosci. 2016; 326: 126-140.
- Song G., Yu Y., Poon C.-S. Cytoarchitecture of pneumotaxic integration of respiratory and nonrespiratory information in the rat. J. Neurosci. 2006; 26 (1): 300-310.
- Guyenet P.G., Bayliss D.A., Stornetta R.L., Ludwig M.-G., Kumar N.N., Shi Y., Burke P.G.R., Kanbar R., Basting T.M., Holloway B.B., Wenker I.C. Proton detection and breathing regulation by the retrotrapezoid nucleus. J. Physiol. 2016; 594 (6): 1529-1551.
- Alheid G.F., McCrimmon D.R. The chemical neuroanatomy of breathing. Respir. Physiol. Neurobiol. 2008; 164: 3-11.
- Villar-Cervino V., Barreiro-Iglesias A., Fernandez-Lopez B., Mazan S., Rodicio M.C., Anadon R. Glutamatergic neuronal populations in the brainstem of the sea lamprey, Petromyzon marinus: an in situ hybridization and immunocytochemical study. J. Comp. Neurol. 2013; 521: 522-557.
- Paxinos G., Watson C. The rat brain in stereotaxic coordinates. 6th ed. New York: Elsevier/Academic Press; 2007. 456.
- Mutolo D., Bongianni F., Cinelli E., Pantaleo T. Role of neurokinin receptors and ionic mechanisms within the respiratory network of the lamprey. Neuroscience. 2010; 169: 1136-1149.
- Gariepy J.-F., Missaghi K., Chartre S., Robert M., Auclair F., Dubuc R. Bilateral connectivity in the brainstem respiratory networks of lampreys. J. Comp. Neurol. 2012; 520: 1442-1456.
- Jones S.E., Saad M., Lewis D.I., Subramanian H.H., Dutschmann M. The nucleus retroambiguus as possible site for inspiratory rhythm generation caudal to obex. Respir. Physiol. Neurobiol. 2012; 180: 305-310.
- Bongianni F., Mutolo D., Cinelli E., Pantaleo T. Neural mechanisms underlying respiratory rhythm generation in the lamprey. Respir. Physiol. Neurobiol. 2016; 224: 17-26.
- Cinelli E., Mutolo D., Robertson B., Grillner S., Contini M., Pantaleo T., Bongianni F. Gabaergic and glycinergic inputs modulate rhythmogenic mechanisms in the lamprey respiratory network. J. Physiol. 2014; 592: 1823-1838.
- Driessen A.K., Farrell M.J., Mazzone S.B., McGovern A.E. The role of the paratrigeminal nucleus in vagal afferent evoked respiratory reflexes: A neuroanatomical and functional study in guinea pigs. Front. Physiol. 2015; 6: 378-391. URL: http://pubmedcentralcanada.ca/pmcc/articles/PMC4685097/(дата обращения: 15.02.2017) DOI: 10.3389/fphys.2015.00378
- Семьянов А.В. Диффузная внесинаптическая нейропередача посредством глутамата и ГАМК. Журнал высшей нервной деятельности им. И.П. Павлова. 2004; 54 (1): 68-84.
- Cossart R., Esclapez M., Hirsch J.C., Bernard C., Ben-Ari Y. GluR5 kainate receptor activation in interneurons increases tonic inhibition of pyramidal cells. Nat. Neurosci. 1998; 1 (6): 470-478.


