Респондеры и нереспондеры после катетерной аблации фибрилляции предсердий и антиаритмической терапии по данным имплантируемых кардиомониторов: рандомизированное контролируемое исследование
Автор: Симонян Алина Александровна, Колесников В.Н., Виленский Л.И., Кривошеев Ю.С., Башта Д.И., Гатило М.Ю., Мызникова Т.А., Мисходжева З.А.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 3 т.20, 2016 года.
Бесплатный доступ
Цель Оценка респондеров (пациентов, ответивших на терапию) и нереспондеров (пациентов, не ответивших на терапию) с пароксизмальной формой фибрилляции предсердий после катетерной аблации фибрилляции предсердий и антиаритмической терапии по данным аппаратов непрерывного мониторирования ритма сердца. Методы Девяносто два пациента с пароксизмальной формой фибрилляции предсердий рандомизированы на две группы: антиаритмическая терапия в сочетании с имплантацией кардиомонитора (I группа; n = 46); катетерная аблация фибрилляции предсердий в сочетании с имплантацией кардиомонитора (II группа; n = 46). Пациенты с процентом фибрилляции предсердий менее 0,5 по данным имплантируемого кардиомонитора считались ответившими на терапию (респондерами). Пациенты с процентом фибрилляции предсердий более 0,5 считались не ответившими на терапию (нереспондерами). Период контрольного наблюдения составил 24 мес. Результаты К концу периода наблюдения у 13 (28,3%) пациентов группы антиаритмической терапии и у 29 (63%) пациентов группы катетерной аблации отсутствовали пароксизмы фибрилляции предсердий / трепетаний предсердий / предсердной тахикардии (респондеры; лог-ранк тест, р = 0,0009; отношение рисков (ОР) 2,6; 95% доверительный интервал (ДИ) 1,44-4,69; р = 0,001, регрессионный анализ Кокса). По данным многофакторного логистического регрессионного анализа, процент фибрилляции предсердий более 4,5 по данным имплантируемого кардиомонитора в первые два месяца после начала терапии (отношение шансов (ОШ) 38,9; 95% ДИ, 6,2-245; p
Пароксизмальная фибрилляция предсердий, непрерывное мониторирование сердечного ритма, радиочастотная изоляция устьев легочных вен, антиаритмическая терапия, респондеры
Короткий адрес: https://sciup.org/142140761
IDR: 142140761 | DOI: 10.21688-1681
Текст научной статьи Респондеры и нереспондеры после катетерной аблации фибрилляции предсердий и антиаритмической терапии по данным имплантируемых кардиомониторов: рандомизированное контролируемое исследование
Согласно современным рекомендациям, катетерная аблация и антиаритмическая терапия (ААТ) могут применяться в лечении пациентов с пароксизмальной формой фибрилляции предсердий (ФП) [1].
Оценка эффективности проводится по данным электрокардиографии (ЭКГ) и холтеровского мониторирования ЭКГ, а любой зарегистрированный пароксизм предсердной тахиаритмии, длящийся более 30 с, через 3 мес. после начала терапии считается рецидивом [1]. Новые технологии непрерывного мониторирования сердечного ритма включают имплантацию кардиомониторов (ИКМ), которые позволяют объективно и точно оценивать ритм пациента в течение 3 лет после начала лечения [2–7]. Непрерывное мониторирование ЭКГ имеет ряд преимуществ, по сравнению с «прерывистым» мониторингом, в оценке эффективности и выявлении асимптомных эпизодов.
Цель исследования: оценка ответивших на терапию пациентов с пароксизмальной фибрилляцией предсердий после катетерной аблации и антиаритмической терапии по данным имплантируемого кардиомонитора.
Методы
С апреля 2010 г. по декабрь 2014 г. в исследование включены 92 пациента с пароксизмальной формой ФП, которым возможно проведение катетерной аблации и антиаритмической терапии. После подписания информированного согласия пациенты рандомизированы на две группы: антиаритмическая терапия в сочетании с имплантацией кардиомонитора (I группа; n = 46); катетерная аблация фибрилляции предсердий в сочетании с имплантацией кардиомонитора (II группа; n = 46). Период наблюдения составил 24 мес., контроль за пациентами осуществляли каждые 1–3, 6, 9, 12, 18, 24 мес. после включения в исследование путем анализа данных имплантируемых кардиомониторов. Схема дизайна исследования подробно описана ранее [16].
Основной целью исследования являлись оценка респондеров после катетерной аблации и антиаритми-ческой терапии, а также выявление предикторов рецидивов и прогрессирования ФП, перехода пациентов из одной группы лечения в другую (cross-over).
Прогрессирование ФП по данным ИКМ расценивалось как процент ФП более 30 после «слепого» периода (AF burden progression).
Определение респондеровпо данным имплантируемых кардиомониторов
Определение респондеров по данным ИКМ подробно описано ранее [8, 9]. Для оценки эффективности методов лечения мы использовали процент ФП по данным устройства непрерывного мониторирования ЭКГ, не превышающий 0,5%. Данный выбор связан с тем, что 0,5% ФП составляет 3,6 ч/мес., что соответствует нахождению пациента с синусовым ритмом 99,5% времени. Пациенты с процентом ФП более 0,5 считались не ответившими на терапию (нереспондерами). Эпизоды ФП визуально проанализированы двумя кардиологами.
Катетерная аблация и антиаритмическая терапия
Катетерная аблации ФП (радиочастотная изоляция легочных вен), имплантация устройства непрерывного мониторирования ЭКГ детально описаны в предыдущих исследованиях [8, 10–12].
В группе ААТ проводили медикаментозную терапию согласно современным рекомендациям по лечению ФП [1]. К моменту включения в исследование один анти-аритмический препарат (ААП) был неэффективен. Пациентам назначали препараты I, II или III класса: пропа-норм, соталол, бета-блокаторы, кордарон. Дозировка ААП не превышала среднетерапевтических значений. Пациентам группы катетерной аблации ААП отменены через 3 мес. после оперативного вмешательства.
Контрольное наблюдение
Данные ИКМ анализировали через 1–3, 6, 9, 12, 18, 24 мес. после включения пациентов в исследование. Данные с ИКМ были интерпретированы двумя кардиологами. Во время контрольного обследования при необходимости проводили коррекцию ААТ или решали вопрос о выполнении катетерной аблации.
Статистический анализ
Результаты представлены как среднее значение ± стандартное отклонение или как абсолютные значения и проценты. Количественные переменные сравнивались с помощью t-критерия Стьюдента. Критерий χ2 для качественных переменных использован для сравнения характеристик пациентов. Различия в прогрессировании ФП по данным ИКМ оценивали с помощью лог-ранк теста. Отсутствие ФП/ТП/ПТ (респондеры) также оценивалось с помощью лог-ранк теста. Анализ выживаемости с построением кривых Каплана – Майера использован для представления эффективности оперативного вмешательства и оценен как процент отсутствия ФП/ТП/ПТ. Регрессионный анализ Кокса использовали для оценки вероятности риска прогрессирования и возникновения ФП. Для выявления предикторов прогрессирования и рецидива ФП (потенциально влияющие факторы предопределены заранее) использовали логистическую регрессию и модель пропорциональных рисков Кокса.
КА 46 46 36 34 31 29 29 29 29
ААТ 46 46 25 20 16 14 14 13 13
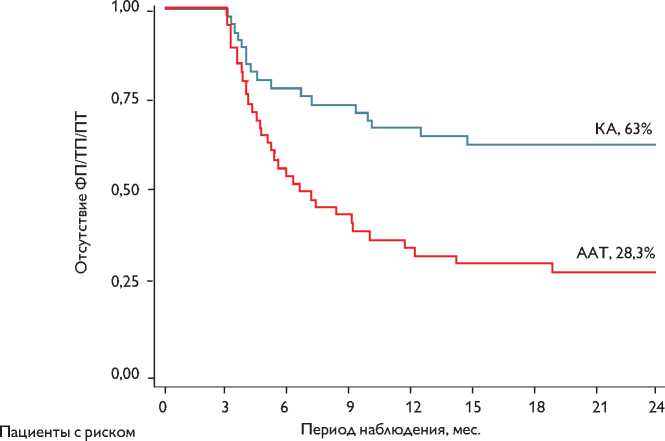
Рис. 1. Отдаленные результаты эффективности лечения в двух группах (респондеры)
Примечание . КА — катетерная аблация; ААТ — антиаритмическая терапия; ФП — фибрилляция предсердий; ТП — трепетание предсердий; ПТ — предсердная тахикардия
Fig. 1. Long-term results of treatment efficacy in two groups (responders).
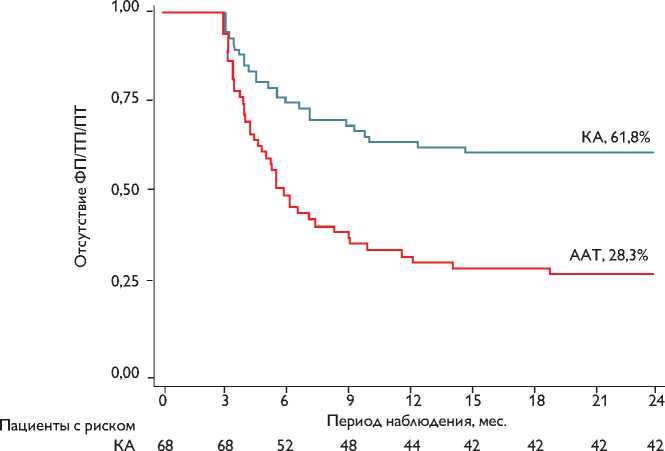
ААТ 60 60 30 24 20 18 18 17 17
Рис. 2. Отдаленные результаты эффективности лечения согласно фактически полученному лечению (on treatment analysis) Примечание. КА — катетерная аблация; ААТ — антиаритмическая терапия; ФП — фибрилляция предсердий; ТП — трепетание предсердий; ПТ — предсердная тахикардия
Fig. 2. Long-term results of on treatment analysis efficacy.
Таблица 1 Регрессионная модель пропорциональных рисков Кокса, демонстрирующая влияние переменных на отсутствие ФП/ТП/ПТ после двух методов лечения (респондеров)
|
Показатель |
Однофакторный анализ |
Многофакторный анализ ОР (95% ДИ) |
р |
|
|
ОР (95% ДИ) |
р |
|||
|
Процент фибрилляции предсердий >4,5 |
0,78 (0,43–1,4) |
0,41 |
1,34 (0,68–2,62) |
0,39 |
|
Сахарный диабет |
0,28 (0,01–2,2) |
0,62 |
– |
– |
|
Артериальная гипертензия |
0,21 (0,1–0,44) |
<0,001 |
0,29 (0,14–0,62) |
0,001 |
|
Возраст >65 лет |
0,91 (0,51–1,64) |
0,77 |
1,26(0,68–2,32) |
0,45 |
|
Острая недостаточность мозгового кровообращения в анамнезе |
0,25 (0,03–1,87) |
0,18 |
1,1 (0,12–8,54) |
0,96 |
|
Левое предсердие >50 мм |
0,84 (0,46–1,52) |
0,56 |
0,99 (0,5–1,96) |
0,99 |
|
Женский пол |
0,35 (0,15–0,84) |
0,019 |
0,47 (0,19–1,15) |
0,1 |
|
Курение |
1,32 (0,76–2,32) |
0,32 |
0,94 (0,52–1,68) |
0,83 |
|
Анамнез фибрилляции предсердий >5 лет |
0,77 (0,42–1,41) |
0,41 |
1,24 (0,64–2,39) |
0,52 |
Примечание. ОР — отношение рисков; ДИ — доверительный интервал. В многофакторный анализ включены потенциально значимые клинические факторы (не имеющие статистической значимости) для оценки «смешения» эффектов при многофакторной модели
Все представленные значения p основаны на двустороннем тесте, статистически достоверными считали различия при р<0,05. Все статистические расчеты выполняли с помощью программы Stata (версия 13.0, Чикаго, США).
Результаты
Эффективность оперативного вмешательства и антиаритмической терапии (респондеры)
-
В исследование включены 92 пациента с пароксизмальной ФП. Всех пациентов наблюдали в течение 24 мес. после включения в исследование.
В группе катетерной аблации ФП изоляция легочных вен с подтверждением блока входа и выхода достигнута у 46 (100%) пациентов. 18 (39%) пациентам с типичным трепетанием предсердий выполняли аблацию кавотрикуспидального перешейка. Средняя продолжительность процедуры составила 142±46 мин со временем рентгеноскопии 25±19 мин. У одного (2,2%) пациента в конце аблации выявлен гемоперикард, который успешно разрешился с помощью пункции перикарда по Марфану.
После аблации всем пациентам имплантированы кардиомониторы. Осложнений, связанных с процедурой имплантации, не выявлено. В группе ААТ имплантация кардиомониторов проводилась в условиях стационара. Осложнений во время имплантации не обнаружено.
К концу периода наблюдения у 13 (28,3%) пациентов группы ААТ и у 29 (63%) пациентов группы катетерной аблации отсутствовали пароксизмы ФП/ТП/ПТ (респондеры; лог-ранк тест, р = 0,0009; ОР 2,6; 95% ДИ 1,44–4,69; р = 0,001; регрессионный анализ Кокса;
рис. 1). Пациенты группы катетерной аблации не принимали ААП. В течение периода наблюдения 22 (48%) пациентам с пароксизмами ФП/ТП/ПТ группы ААТ выполнена катетерная аблация вследствие неэффективности двух и более антиаритмических препаратов. 3 (18%) из 17 пациентов группы катетерной аблации выполнена повторная аблация. Среднее время до повторной аблации составило 9,4±4,2 мес. 14 (30%) пациентам группы катетерной аблации с рецидивами ФП/ТП/ПТ назначена антиаритмическая терапия.
Общее количество пациентов, перешедших из одной группы лечения в другую (cross-over), составило 22 в группе антиаритмической терапии и 14 в группе катетерной аблации (р = 0,067). При анализе респондеров в двух группах после cross-over — фактического получения того или иного метода лечения (on treatment analysis) — у 17 (28,3%) из 60 пациентов группы ААТ и 42 (61,8%) из 68 пациентов группы катетерной аблации отсутствовали пароксизмы ФП/ПТ/ТП (р = 0,0001; лог-ранк тест; ОР 2,5; 95% ДИ 1,5–4,1; р<0,0001; регрессионный анализ Кокса; рис. 2).
В конце периода наблюдения в обеих группах серьезных осложнений, которые могли бы привести к гибели пациента или его инвалидизации, не зарегистрировано. В группе ААТ осложнения были связаны с побочным действием антиаритмических препаратов. Общее количество осложнений в течение всего периода наблюдения составило 24% (11 пациентов) в группе ААТ и 6,5% (3 пациента) в группе катетерной аблации (р = 0,02).
По данным многофакторного анализа пропорциональных рисков Кокса, предиктором рецидива ФП/ТП/ПТ являлась артериальная гипертензия. В табл.
Таблица 2 Одно- и многофакторный регрессионный анализ предикторов прогрессирования фибрилляции предсердий
|
Показатель |
Однофакторный анализ |
Многофакторный анализ ОШ (95% ДИ) |
р |
|
|
ОШ (95% ДИ) |
р |
|||
|
Процент фибрилляции предсердий >4,5 |
64 (17,2–238) |
<0,001 |
38,9 (6,2–245) |
<0,001 |
|
Сахарный диабет |
7,4 (0,9–58,4) |
0,2 |
– |
– |
|
Артериальная гипертензия |
5,5 (2,2–13,8) |
<0,001 |
6,8 (1,1–43,04) |
0,041 |
|
Возраст >65 лет |
2,52 (1,05–6,06) |
0,038 |
0,69 (0,08–5,84) |
0,74 |
|
Острая недостаточность мозгового кровообращения в анамнезе |
6,5 (0,7–61,1) |
0,1 |
– |
– |
|
Левое предсердие >50 мм |
4,24 (1,72–10,42) |
0,002 |
3,68 (0,67–20,2) |
0,13 |
|
Женский пол |
2,16 (0,81–5,7) |
0,12 |
4,98 (0,39–62,8) |
0,21 |
|
Курение |
0,32 (0,14–0,79) |
0,013 |
0,17 (0,02–1,09) |
0,063 |
|
Анамнез фибрилляции предсердий >5 лет |
5,86 (2,31–14,9) |
<0,001 |
8,5 (1,04–69,6) |
0,044 |
Список литературы Респондеры и нереспондеры после катетерной аблации фибрилляции предсердий и антиаритмической терапии по данным имплантируемых кардиомониторов: рандомизированное контролируемое исследование
- Calkins H., Kuck K.H., Cappato R., Brugada J., Camm A.J., Chen S.A., Crijns H.J., Damiano R.J. Jr., Davies D.W., DiMarco J., Edgerton J., Ellenbogen K., Ezekowitz M.D., Haines D.E., Haissaguerre M., Hindricks G., Iesaka Y., Jackman W., Jalife J., Jais P., Kalman J., Keane D., Kim Y.H., Kirchhof P., Klein G., Kottkamp H., Kumagai K., Lindsay B.D., Mansour M., Marchlinski F.E., McCarthy P.M., Mont J.L., Morady F., Nademanee K., Nakagawa H., Natale A., Nattel S., Packer D.L., Pappone C., Prystowsky E., Raviele A., Reddy V., Ruskin J.N., Shemin R.J., Tsao H.M., Wilber D. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design // Europace. 2012. Vol. 14. No. 4. P. 528-606 DOI: 10.1093/europace/eus027
- Hindricks G., Pokushalov E., Urban L., Taborsky M., Kuck K.H., Lebedev D., Rieger G., Pürerfellner H. XPECT Trial Investigators. Performance of a new leadless implantable cardiac monitor in detecting and quantifying atrial fibrillation: Results of the XPECT trial//Circ. Arrhythm. Electrophysiol. 2010. Vol. 3. No. 2. P. 141-147 DOI: 10.1161/CIRCEP.109.877852
- Pokushalov E., Romanov A., Corbucci G., Artyomenko S., Turov A., Shirokova N., Karaskov A. Use of an implantable monitor to detect arrhythmia recurrences and select patients for early repeat catheter ablation for atrial fibrillation: a pilot study//Circ. Arrhythm. Electrophysiol. 2011. Vol. 4. No. 6. P. 823-831 DOI: 10.1161/CIRCEP.111.964809
- Pokushalov E., Romanov A., Corbucci G., Bairamova S., Losik D., Turov A., Shirokova N., Karaskov A., Mittal S., Steinberg J.S. Does atrial fibrillation burden measured by continuous monitoring during the blanking period predict the response to ablation at 12-month follow-up?//Heart Rhythm. 2012. Vol. 9. No. 9. P. 1375-1379 DOI: 10.1016/j.hrthm.2012.03.047
- Лосик Д.В., Романов А.Б., Шабанов В.В., Байрамова С.А., Якубов А.А., Стенин И.Г., Покушалов Е.А. Прогрессирование фибрилляции предсердий после неэффективной первичной процедуры радиочастотной изоляции легочных вен: рандомизированное сравнение повторной катетерной аблации и медикаментозного метода лечения//Патология кровообращения и кардиохирургия. 2015. Т. 19. № 2. С. 84-92.
- Pokushalov E., Romanov A., Cherniavsky A., Corbucci G., Pak I., Kareva Y., Karaskov A. Ablation of paroxysmal atrial fibrillation during coronary artery bypass grafting: 12 months' follow-up through implantable loop recorder//Eur. J. Cardiothorac. Surg. 2011. Vol. 40. No. 2. P. 405-411 DOI: 10.1016/j.ejcts.2010.11.083
- Байрамова С.А., Романов А.Б., Миттель С., Муссат Д., Стейнберг Д., Покушалов Е.А. Имплантируемый аппарат длительного мониторирования ЭКГ для выявления фибрилляции предсердий после аблации кавотрикуспидального перешейка у пациентов с трепетанием предсердий//Патология кровообращения и кардиохирургия. 2015. Т. 19. № 3. С. 100-109.
- Pokushalov E., Romanov A., Corbucci G., Artyomenko S., Turov A., Shirokova N., Karaskov A. Ablation of paroxysmal and persistent atrial fibrillation: 1-year follow-up through continuous subcutaneous monitoring//J. Cardiovasc. Electrophysiol. 2011. Vol. 22. No. 4. P. 369-375. DOI: 10.1111/j.1540-8167.2010.01923
- Шабанов В.В., Романов А.Б., Артёменко С.Н., Елесин Д.А., Стрельников А.Г., Лосик Д.В., Байрамова С.А., Покушалов Е.А. Определение оптимального подхода в лечении пациентов с ранними рецидивами фибрилляции предсердий после первой процедуры аблации//Патология кровообращения и кардиохирургия. 2013. Т. 17. № 1. C. 39^3.
- Pappone C., Rosanio S., Augello G., Gallus G., Vicedomini G., Mazzone P., Gulletta S., Gugliotta F., Pappone A., Santinelli V., Tortoriello V., Sala S., Zangrillo A., Crescenzi G., Benussi S., Alfieri O. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for atrial fibrillation: outcomes from a controlled nonrandomized long-term study//J. Am. Coll. Cardiol. 2003. Vol. 42. No. 2. P. 185-197.
- Байрамова С.А., Романов А.Б., Артеменко С.Н., Шабанов В.В., Лосик Д.В., Караськов А.М., Покушалов Е.А. Превентивная изоляция легочных вен у пациентов с аблацией кавотрикуспидального перешейка: исследование PREVENT-AF Study I//Патология кровообращения и кардиохирургия. 2015. Т. 19. № 2. С. 93-101.
- Cheema A., Vasamreddy C.R., Dalal D., Marine J.E., Dong J., Henrikson C.A., Spragg D., Cheng A., Nazarian S., Sinha S., Halperin H., Berger R., Calkins H. Long-term single procedure efficacy of catheter ablation of atrial fibrillation//J. Interv. Card. Electrophysiol. 2006. Vol. 15. No. 3. P. 145-155. DOI: 10.1007/s10840-006-9005-9


