Ретроспективная оценка тяжести отдалённых лучевых повреждений онкологических пациентов методом цитогенетического обследования
Автор: Хвостунов И.К., Курсова Л.В., Шепель Н.Н., Коровчук О.Н., Коротков В.А., Хвостунова Т.И.
Рубрика: Научные статьи
Статья в выпуске: 3 т.31, 2022 года.
Бесплатный доступ
В настоящей работе выполнено исследование отдалённых последствий лучевой терапии онкологических пациентов с различными видами заболеваний. Цель исследования заключалась в ретроспективной оценке последствий дистанционной лучевой терапии (ДЛТ) для совершенствования процесса реабилитации. Оценка последствий выполнялась путём цитогенетического обследования пациентов в виде анализа аберраций хромосом в лимфоцитах периферической крови. В группу были включены пациенты, для которых требовалось уточнение, подтверждение или опровержение суммарной очаговой дозы (СОД), указанной в эпикризе после ДЛТ. Была обследована группа из 25 пациентов (5 мужского и 20 женского пола). В группе были представлены пациенты с болезнью Ходжкина, раком молочной железы, раком предстательной железы, раком шейки и тела матки, раком костей и множественной локализацией. Все обследованные пациенты проходили реабилитацию в отделении хирургического и консервативного лечения лучевых повреждений МРНЦ им. А.Ф. Цыба. Методика обследования заключалась в подготовке препаратов лимфоцитов крови, их окрашивании и микроскопическом анализе на флуоресцентном или световом микроскопе в клетках первого митоза. Для анализа аберраций хромосом применяли FISH-метод с окраской 2, 4 и 12 хромосом и стандартный анализ, используя рекомендации МАГАТЭ. В результате показано, что индивидуальная реакция пациентов существенно варьирует при схемах облучения, сопоставимых по суммарной дозе и фракционированию. Значимую роль играет фактор промежутка времени между окончанием ДЛТ и проведением цитогенетического анализа (∆T). Наблюдалось явное превышение наблюдаемой частоты аберраций в первую декаду после ДЛТ по сравнению с последующим временем. В работе не выявлена зависимость между суммарной частотой аберраций, равно как и отдельных её компонент, от вида онкологического заболевания. По предварительному заключению имеется основание для применения полученных оценок дозового коэффициента при ретроспективной биодозиметрии пациентов с перечисленными в группе заболеваниями. Выявленные закономерности индукции хромосомных повреждений в лимфоцитах крови онкологических пациентов доказывают необходимость внедрения персонализированного подхода к планированию и реализации ДЛТ для повышения ее эффективности и предотвращения побочных последствий.
Хромосомные аберрации, транслокации, суммарная очаговая доза, дистанционная лучевая терапия, онкология, цитогенетика, лимфоциты крови, радиационный маркер, биодозиметрия, реабилитация
Короткий адрес: https://sciup.org/170195749
IDR: 170195749 | УДК: 616-006.04-085.849.1-06:577.21 | DOI: 10.21870/0131-3878-2022-31-3-87-99
Текст научной статьи Ретроспективная оценка тяжести отдалённых лучевых повреждений онкологических пациентов методом цитогенетического обследования
Задача профилактики и лечения отдалённых лучевых повреждений онкологических пациентов после дистанционной лучевой терапии (ДЛТ) остаётся актуальной, несмотря на техническое совершенствование аппаратуры для лучевой терапии и развитие новых оптимальных схем [1]. При этом существенное значение имеет соотношение суммарной очаговой дозы (СОД) и патогенетических особенностей местных лучевых повреждений здоровых клеток и тканей пациентов. В частности, в случае явного несоответствия клинической картины отдалённых последствий облучения и СОД требуется подтверждение или опровержение указанной в эпикризе величины СОД. Одним из способов решения такой задачи является ретроспективная биологическая дозиметрия по частоте аберраций хромосом в лимфоцитах периферической крови [2, 3]. Полученный в МРНЦ
им. А.Ф. Цыба опыт профилактики и лечения отдалённых лучевых повреждений показал, что нередко имеют место случаи явных противоречий между данными о назначенной дозе ДЛТ и клинической картиной отдалённых последствий облучения. Для выявления объективных причин подобных противоречий необходима дальнейшая разработка и совершенствование алгоритма персонализированной оценки отдалённых последствий облучения [4, 5].
Среди биологических структур в организме человека, способных долговременно сохранять последствия воздействия ионизирующего излучения, выделяются эмаль зуба и лимфоциты крови. В первом случае причина заключается в кристаллической структуре эмали зуба, которая способна хранить образовавшиеся при облучении радиационные маркеры практически неограниченное время. Лимфоциты крови непрерывно обновляются в результате процесса пролиферации из стволовых клеток, однако облучённые ранее стволовые клетки передают часть полученных ими повреждений (стабильные радиационные маркеры) в продуцируемые лимфоциты. Таким образом, имеется возможность ретроспективной биологической дозиметрии путём анализа хромосомных аберраций, как в лимфоцитах периферической крови, так и в стволовых клетках. Следует отметить, что забор биологического материала для анализа по эмали зуба и лимфоцитов крови существенно различаются по возможному ущербу для испытуемого человека. Кроме того, анализ эмали зуба отражает лишь локальное воздействие в области головы, тогда как биодозиметрия по хромосомным аберрациям в лимфоцитах крови приводит к оценке общей дозы на всё тело. Кроме того, анализ эмали зуба отражает лишь локальное воздействие в области головы, тогда как биодозиметрия по хромосомным аберрациям в лимфоцитах крови приводит к оценке общей дозы на всё тело [6].
Оценка последствий лучевой терапии для онкологических пациентов на основе биодозиметрии по хромосомным аберрациям является актуальной задачей для отечественных и международных специалистов [7, 8]. По сравнению с классическим соотношением in vitro и in vivo облучением всего тела человека для оценки дозы при ДЛТ требуется учёт фактора локального облучения и фракционирования дозы в пределах месяца и более. При таком воздействии в составе крови пациента смешиваются как облучённые, так и необлучённые клетки. В промежутках между фракциями имеет место восстановление повреждённых клеток, а также может изменяться радиочувствительность соматических клеток вследствие онкологического заболевания и/или применения химиопрепаратов. Теоретическая оценка СОД при локальном фракционированном воздействии всё ещё далека от окончательного обоснования и требует дополнительных исследований [9-12]. По этой причине накопление результатов клинико-дозиметрического обследования онкологических пациентов в отдалённые сроки после ДЛТ может привести к существенному продвижению в решении данной задачи.
В рамках решения задачи биодозиметрии онкологических пациентов существенной проблемой является ретроспективная оценка СОД в пределах до 20-30 лет после ДЛТ, что необходимо для корректного планирования курса реабилитации пациентов. Ряд исследователей предлагает решение данной проблемы на основе как метода FISH, так и наиболее точного метода mFISH, когда анализируется весь геном пациента [13, 14]. Основная сложность в области ретроспективной биодозиметрии состоит в наличии большого числа факторов, способных повлиять на результаты цитогенетического анализа. По этой причине на данный момент не представляется возможным предложить строгую математическую оценку погрешности СОД по частоте аберраций. Тем не менее, ценность эмпирических результатов заключается в возможности достоверной верификации при разработке дозиметрических моделей.
В проведённых нами ранее исследованиях были проанализированы образцы крови больных раком лёгкого, взятые непосредственно после завершения курса ДЛТ [5]. Дальнейшее развитие данного направления в рамках настоящей работы заключалось в анализе аберраций хромосом в лимфоцитах крови пациентов с различными заболеваниями методом FISH с окраской трёх пар хромосом.
Цель настоящей работы состояла в ретроспективной оценке последствий воздействия ДЛТ на организм онкологических больных для повышения точности прогноза тяжести отдалённых лучевых повреждений, совершенствования специализированной высокотехнологичной медицинской помощи и улучшения качества жизни пациентов.
Материалы и методы
В работе была обследована группа онкологических пациентов, у которых провели однократный забор крови из локтевой вены. Обследование выполнялось путём анализа аберраций хромосом в лимфоцитах периферической крови. Обследовались онкологические больные, для которых требовалось уточнение, подтверждение или опровержение СОД, указанной в эпикризе после ДЛТ. Образцы крови у всех пациентов брались в соответствии с действующим законодательством РФ и нормами медицинской этики после получения информированного согласия. Были обследованы пациенты с болезнью Ходжкина (C81), раком молочной железы (C50), раком предстательной железы (C61), раком шейки и тела матки (C53, C54), раком костей (C40) и множественной локализацией (C97), табл. 1.
Таблица 1
Клинико-дозиметрические характеристики обследованных пациентов
|
Код |
Возраст, лет / пол |
Диагноз по МКБ-10 |
СОД, Гр |
Нелучевая терапия |
|
1 |
53,0 / ж |
C81 |
40 + 34 |
6 COPP1 |
|
2 |
39,4 / ж |
C81 |
35 |
ХЛЛ2 |
|
3 |
72,8 / ж |
C81 |
40 + 30 |
нет данных |
|
4 |
49,3 / ж |
C81 |
40 |
6 BEACOPP3 |
|
5 |
36,1 / ж |
C81 |
25 + 20 + 19,4 |
ХЛЛ2 |
|
6 |
70,2 / ж |
C81.1* |
36 |
ПХТ4 |
|
7 |
46,8 / ж |
C81.1* |
45 |
5 ПХТ4 |
|
8 |
66,0 / ж |
C81.1* |
45 |
ПХТ4 |
|
9 |
46,2 / ж |
C81.1* |
40 |
8 BEACOPP3 |
|
10 |
58,3 / ж |
C50 |
50 + 50 |
РМЭ5+6CMF6 |
|
11 |
68,0 / ж |
C50.9* |
42 + 46 |
ХЛЛ2 |
|
12 |
64,8 / ж |
C50.9* |
нет данных |
ХЛЛ2 |
|
13 |
68,7 / ж |
C50.9* |
44 |
РМЭ5+ХЛЛ2 |
|
14 |
68,4 / ж |
C50.9* |
50 + 40 |
РМЭ5+6CMF6 |
|
15 |
72,1 / м |
C61 |
67,5 |
нет данных |
|
16 |
69,3 / м |
C61 |
74 |
нет данных |
|
17 |
81,1 / м |
C61 |
70 |
ХЛЛ2 |
|
18 |
70,6 / м |
С61, C97 |
125 |
ГТ7 |
|
19 |
46,4 / ж |
C53 |
А-80 |
нет данных |
|
20 |
50,3 / ж |
C53.1* |
А-86 |
ХЛЛ2 |
|
21 |
58,6 / ж |
C53 |
40 + 20 |
нет данных |
|
22 |
51,4 / ж |
C54 |
70 |
нет данных |
|
23 |
78,6 / ж |
C54.9* |
70 |
ПХТ4 |
|
24 |
37,9 / ж |
C40 |
70 + 20 |
ПХТ4 |
|
25 |
58,0 / ж |
C97 |
50 |
РМЭ5+6CMF6 |
1 COPP – акроним для режима химиотерапии при лечении лимфогранулематоза (циклофосфамид, винкристин, прокар- базин, преднизолон) ; 2 ХЛЛ – химиолучевое лечение; 3 BEACOPP – интенсифицированный по дозовой плотности COPP (дополнительно блеомицин этопозид, доксорубицин) ; 4 ПХТ – полихимиотерапия; 5 РМЭ – радикальная мастэктомия; 6 CMF – акроним режима химиотерапии при лечении рака молочной железы (циклофосфамид, метотрексат, фторурацил) ;
7 ГТ – гормональная терапия; * – десятичные цифры означают разновидность основного заболевания.
Методика анализа состояла в приготовлении препаратов метафазных хромосом, их окрашивании и микроскопическом анализе. Культивирование клеток проводилось c использованием фитогемагглютинина (PHA M-form, Gibco, USA). Приготовление препаратов и фиксацию выполняли в соответствии с рекомендациями МАГАТЭ [6]. Для анализа аберраций применяли FISH-метод с окраской 2, 4 и 12 хромосом и стандартный анализ. При стандартном анализе идентифицировали ацентрические фрагменты (ace), дицентрики (dic) и центрические кольца (rc). При FISH-методе - полные (tc) и неполные (ti) транслокации, делеции (del), инсерции (ins), а также дицентрики и мультиаберрантные клетки (M-cells). При анализе методом FISH вычислялась частота аберраций (F g ) на число геном-эквивалентных (GE) метафаз. Детали расчёта были опубликованы ранее [15, 16].
Для стандартного анализа отбирали хорошо окрашенные метафазные пластинки, без наложений хромосом. Анализировали только метафазы первого митоза, которые в сумме имели 46 центромер. Для FISH-метода - хорошего качества препаратов добивались разведением суспензии, чтобы хромосомы в метафазе на стекле располагались свободно без наложений. При излишней плотности реакция гибридизации может быть неэффективной и давать интенсивный фон вследствие неспецифического связывания ДНК-зондов.
Классической методикой биодозиметрии по частоте аберраций является использование линейно-квадратичной модели, когда при облучении лимфоцитов в течение времени - T , частота аберраций - Y , как функция дозы - D , описывается следующей формулой [17]:
Y = c+ a D+G^ pD2 , (1)
где а , в - коэффициенты дозовой зависимости при остром облучении; G(T) - обобщённый временной фактор эффекта мощности дозы; с - спонтанная частота.
6(Г) = 2(х-1 + ехр(-х))/х2 , (2)
где x = T / t o , t o - средняя продолжительность существования разрывов ДНК, которая составляет порядка 2 ч. При T >> t o , G(T) ^ 0.
К сожалению, вследствие неопределённостей клинико-дозиметрических данных и несовершенства существующих теоретических моделей, погрешности дозовых коэффициентов в формуле (1) для данного исследования являются неприемлемо высокими. В настоящей работе были принято, что G(T) =0, поскольку характерная суммарная длительность фракционированного облучения составляет порядка месяца, тогда как восстановление разрывов хромосом происходит за 2 ч. В результате для оценки линейного дозового коэффициента ( α ) была принята модель эмпирической оценки соотношения частоты аберраций и физической величины СОД.
При статистической обработке полученных данных стандартные ошибки частоты аберраций вычисляли в предположении распределения Пуассона для аберраций по клеткам. Статистическую обработку полученных результатов и регрессионный анализ осуществляли с помощью стандартных алгоритмов, представленных в приложениях Microsoft Excel и OriginLab-6.0.
Результаты и обсуждение
В табл. 2 и 3 представлены результаты обследования онкологических пациентов методом FISH и стандартным методом соответственно. Методом FISH суммарно проанализировано 24776 метафаз, в которых число полных транслокаций составило 423, а число неполных транслокаций - 259. Выявлено 15 мультиаберрантных клеток. Стандартным методом в сумме было проанализировано 850 метафаз, в которых число дицентриков составило 50, а число центричес- ких колец – 12. Частота стабильных радиационных маркеров (tc+ti) варьировала в пределах (0,96÷19,9) трансл./100 GE клеток (в среднем 8,79±0,34).
Таблица 2
Результаты цитогенетического обследования онкологических пациентов методом FISH
Результаты цитогенетического обследования стандартным методом
|
Код |
Диагноз МКБ-10 |
∆T, лет |
Число клеток |
tc |
ti |
del |
ins |
dic |
M-cells |
F G (tc+ti)/100 GE±SE |
|
1 |
C81 |
18 |
806 |
5 |
0 |
1 |
0 |
0 |
0 |
1,98±0,89 |
|
2 |
С81 |
24 |
1000 |
17 |
7 |
0 |
0 |
0 |
1 |
7,67±1,57 |
|
3 |
С81 |
52 |
352 |
5 |
6 |
1 |
0 |
0 |
0 |
9,98±3,01 |
|
4 |
С81 |
27 |
1500 |
11 |
10 |
1 |
0 |
1 |
1 |
4,47±0,98 |
|
5 |
С81 |
15 |
1478 |
10 |
16 |
2 |
0 |
0 |
0 |
5,62±1,10 |
|
6 |
C81.1 |
10 |
1000 |
37 |
22 |
8 |
1 |
6 |
0 |
18,85±2,45 |
|
7 |
C81 |
28 |
1000 |
3 |
0 |
3 |
0 |
0 |
0 |
0,96±0,55 |
|
8 |
C81 |
18 |
577 |
5 |
7 |
0 |
0 |
0 |
0 |
6,64±1,92 |
|
9 |
C81.1 |
9 |
689 |
11 |
3 |
2 |
0 |
0 |
0 |
6,49±1,74 |
|
10 |
С50 |
19 |
999 |
18 |
14 |
6 |
0 |
0 |
1 |
10,23±1,81 |
|
11 |
С50 |
30 |
1533 |
42 |
25 |
11 |
2 |
1 |
1 |
13,96±1,71 |
|
12 |
С50.9 |
18 |
1999 |
13 |
18 |
5 |
0 |
1 |
4 |
4,95±0,89 |
|
13 |
С50.9 |
20 |
1000 |
15 |
12 |
14 |
0 |
1 |
0 |
8,63±1,66 |
|
14 |
С50.9 |
11 |
1000 |
36 |
15 |
6 |
0 |
4 |
1 |
16,29±2,28 |
|
15 |
С61 |
1 |
999 |
21 |
19 |
11 |
0 |
1 |
1 |
12,79±2,02 |
|
16 |
С61 |
1 |
999 |
34 |
16 |
8 |
0 |
7 |
1 |
15,99±2,26 |
|
17 |
С61 |
11 |
1000 |
9 |
2 |
5 |
0 |
1 |
0 |
3,51±1,06 |
|
19 |
С53 |
2 |
1129 |
33 |
15 |
4 |
1 |
6 |
1 |
13,58±1,96 |
|
20 |
C53.1 |
4 |
653 |
20 |
7 |
5 |
0 |
2 |
0 |
13,21±2,54 |
|
21 |
С53 |
2 |
1001 |
26 |
10 |
7 |
0 |
3 |
2 |
11,49±1,92 |
|
22 |
С54 |
29 |
1500 |
11 |
9 |
6 |
0 |
0 |
1 |
4,26±0,95 |
|
23 |
C54.9 |
28 |
562 |
11 |
9 |
1 |
0 |
0 |
0 |
11,37±2,54 |
|
24 |
С40 |
18 |
1000 |
12 |
6 |
4 |
0 |
0 |
0 |
5,75±1,36 |
|
25 |
С97 |
16 |
1000 |
18 |
11 |
2 |
0 |
2 |
0 |
9,27±1,72 |
Таблица 3
|
Код пациента |
∆T, лет |
Число клеток |
Число аберрантных клеток |
ace |
rc |
dic |
Частота (dic+rc) /100 клеток±SE |
Распределение (dic+rc) по клеткам |
σ2/Y* |
U** |
|
18 |
3 |
300 |
18 |
9 |
4 |
11 |
5,00±1,29 |
287/11/2/0 |
1,22 |
2,79 |
|
19 |
2 |
500 |
45 |
15 |
8 |
39 |
9,40±2,85 |
467/24/7/1/0/0/1/0 |
1,97 |
15,6 |
* – относительная дисперсия; ** – статистический критерий [18].
На рис. 1 представлены частоты основных наблюдаемых аберраций, определённых методом FISH, с детализацией по их компонентам в подгруппах пациентов с различными заболеваниями. На рис. 2 представлены аналогичные частоты в подгруппах пациентов в зависимости от времени между окончанием ДЛТ и проведённым цитогенетическим обследованием (∆T). На рис. 2 показаны результаты для трёх декадных интервалов и отдельно один уникальный случай при ∆ T=50 лет.
В табл. 4 представлены результаты индивидуального обследования методом FISH. Используя возрастной контроль согласно [19], наблюдаемую частоту F G (tc+ti) и величину СОД (табл. 2), по формуле (1) были оценены следующие показатели: индуцированная частота суммы (tc+ti) и эмпирический дозовый коэффициент α , (tc+ti)/100 GE клет./Гр (табл. 4).
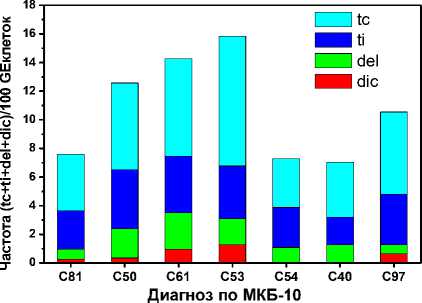
Рис. 1. Результаты обследования методом FISH в подгруппах по виду заболевания.
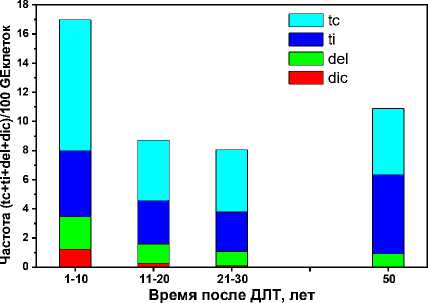
Рис. 2. Результаты обследования методом FISH в подгруппах по времени после ДЛТ.
Таблица 4
Результаты индивидуального цитогенетического обследования методом FISH
|
Код |
Назначенная СОД, Гр |
∆T, лет |
Возраст, лет |
Возрастной контроль, с, (tc+ti)/100 GE |
Частота наблюдаемых аберраций F G (tc+ti)/100 GE±SE |
Частота индуцированных аберраций F G - с, (tc+ti)/100 GE±SE |
Дозовый коэффициент, α, (tc+ti)/100 GE/Гр |
|
1 |
40-34 |
18 |
53,0 |
0,90 |
1,98±0,89 |
1,08±0,89 |
0.02 |
|
2 |
35 |
24 |
39 |
0,58 |
7,67±1,57 |
7,09±1,57 |
0,2 |
|
3 |
40-30 |
52 |
72,8 |
1,50 |
9,98±3,01 |
8,48±3,01 |
0,12 |
|
4 |
40 |
27 |
49,3 |
0,82 |
4,47±0,98 |
3,65±0,98 |
0,09 |
|
5 |
25-20-19 |
15 |
36,1 |
0,53 |
5,62±1,10 |
5,09±1,10 |
0,08 |
|
6 |
36 |
10 |
70,2 |
1,42 |
18,85±2,45 |
17,43±2,45 |
0,48 |
|
7 |
45 |
28 |
46,8 |
0,74 |
0,96±0,55 |
0,22±0,55 |
0,005 |
|
8 |
45 |
18 |
66,0 |
1,27 |
6,64±1,92 |
5,37±1,92 |
0,12 |
|
9 |
40 |
9 |
46,2 |
0,74 |
6,49±1,74 |
5,75±1,74 |
0,14 |
|
10 |
50+50 |
19 |
58,3 |
1,04 |
10,23±1,81 |
9,19±1,81 |
0,09 |
|
11 |
42-46 |
32 |
68,0 |
1,33 |
13,96±1,71 |
12,63±1,71 |
0,14 |
|
12 |
- |
18 |
64,8 |
1,23 |
4,95±0,89 |
3,72±0,89 |
- |
|
13 |
44 |
20 |
68,7 |
1,36 |
8,63±1,66 |
7,27±1,66 |
0,17 |
|
14 |
50+40 |
11 |
68,4 |
1,35 |
16,29±2,28 |
14,94±2,28 |
0,17 |
|
15 |
67,5 |
1 |
72,1 |
1,48 |
12,79±2,02 |
11,31±2,02 |
0,17 |
|
16 |
74 |
1 |
69,3 |
1,37 |
15,99±2,26 |
14,62±2,26 |
0,20 |
|
17 |
70 |
11 |
81,1 |
1,82 |
3,51±1,06 |
1,69±1,06 |
0,02 |
|
19 |
125 |
2 |
70,6 |
1,42 |
13,58±1,96 |
12,16±1,96 |
0,01 |
|
20 |
80 |
4 |
46,4 |
0,74 |
13,21±2,54 |
12,47±2,54 |
0,16 |
|
21 |
86 |
2 |
50,3 |
0,84 |
11,49±1,92 |
10,65±1,92 |
0,14 |
|
22 |
40-20 |
29 |
58,6 |
1,05 |
4,26±0,95 |
3,21±0,95 |
0,05 |
|
23 |
70 |
28 |
51,4 |
0,86 |
11,37±2,54 |
10,51±2,54 |
0,15 |
|
24 |
70-40 |
18 |
78,6 |
1,72 |
5,75±1,36 |
4,03±1,36 |
0,04 |
|
25 |
70-20 |
16 |
37,9 |
0,57 |
9,27±1,72 |
8,7±1,72 |
0,01 |
В табл. 5 представлены средние значения дозового коэффициента (< α >) в подгруппах пациентов с различными заболеваниями. В табл. 6 представлены средние значения дозового коэффициента (< α >) в подгруппах пациентов с различными временами между окончанием ДЛТ и датой проведения цитогенетического обследования. Для частоты аберраций наблюдались значимые отличия 1 и 2, 1 и 3, а также 2 и 3 интервалов ∆T. Для дозового коэффициента – 1 и 2, 1 и 3 интервалов соответственно. Отдельно представлены данные одного пациента при ∆T=50 лет.
Таблица 5
Результаты цитогенетического обследования онкологических пациентов методом FISH в подгруппах по виду заболевания
|
Диапазон кодов пациентов |
Диагноз по МКБ-10 |
Средний возраст, лет |
Число клеток |
tc |
ti |
Возрастной контроль, |
Частота инд. (tc+ti) |
Средний дозовый коэффициент, <α>, (tc+ti)/100 GE/Гр±SE |
|
1-9 |
C81 |
<53> |
8402 |
104 |
71 |
0,90 |
6,02±1,68 |
0,14±0,05 |
|
10-15 |
C50 |
<66> |
6531 |
124 |
84 |
1,20 |
9,84±1,64 |
0,15±0,02 |
|
15-17 |
C61 |
<74> |
2998 |
64 |
37 |
1,55 |
9,21±3,88 |
0,13±0,06 |
|
19-21 |
C53 |
<56> |
2783 |
79 |
32 |
0,98 |
12,7±1,2 |
0,12±0,05 |
|
22-23 |
C54 |
<55> |
2062 |
22 |
18 |
0,95 |
3,10±0,69 |
0,08±0,08 |
|
24 |
С40 |
78,6 |
1000 |
12 |
6 |
1,72 |
5,75±1,36 |
0,04 |
|
25 |
С97 |
37,9 |
1000 |
18 |
11 |
0,56 |
9,27±1,72 |
0,01 |
Таблица 6
Результаты цитогенетического обследования онкологических пациентов методом FISH в подгруппах в зависимости от времени после ДЛТ
|
∆T, лет |
Средний возраст, лет |
Число клеток |
tc |
ti |
Возрастной контроль, |
Частота инд. (tc+ti) |
Средний дозовый коэффициент, <α>, (tc+ti)/100 GE/Гр±SE |
|
1-10 |
<61> |
6470 |
182 |
92 |
1,12 |
13.5±0,82** |
0.19±0,05** |
|
11-20 |
<61> |
10859 |
141 |
101 |
1,12 |
7,12±0,46* |
0.08±0,06 |
|
21-30 |
<52> |
7095 |
95 |
60 |
0,87 |
5,05±0,54 |
0.10±0,08 |
|
50 |
72,8 |
352 |
5 |
6 |
1,50 |
8,48±3,01 |
0.12 |
* – значимое отличие между 2 и 3 интервалами (p<0,05); ** – значимое отличие между 1 и 2, 1 и 3 интервалами (p<0,05).
Результаты анализа аберраций методом FISH показали, что в группе пациентов частота суммы (tc+ti+del+dic) варьировала в пределах (1,9÷23,3) аберац./100 GE клет. (в среднем 11,0 ± 1,2) (табл. 2). Анализ стандартным методом показал 5,1 и 9,7 суммы (dic+rc)/100 клеток (табл. 3).
Это означает, что частоты наблюдаемых аберраций существенно превышали спонтанный уровень, который составляет для транслокаций от 0,2 до 2,0 в зависимости от возраста [19] и порядка 0,1 для (dic+rc) [6]. Таким образом, ретроспективная биодозиметрия свидетельствует о существенном радиационном воздействии, которое имело место в процессе ДЛТ у всех обследованных пациентов. Анализ распределения (dic+rc) в клетках для двух пациентов (табл. 3) показал, что облучение было локальным (U>1,96) [18], что является неотъемлемой особенностью ДЛТ. Возможность анализа нестабильных маркеров для этих пациентов была обусловлена сравнительно небольшой величиной ∆ T, 2-3 года, в течение которых в составе крови оставалось ещё достаточное число облучённых лимфоцитов.
Основными типами аберраций, детектированными методом FISH, были tc и ti (стабильные), а также del и dic (нестабильные) аберрации. Класс инсерций (стабильные) практически не был представлен. В отдалённый период после ДЛТ (в среднем 17 лет) у обследованных пациентов наблюдаются стабильные радиационные маркеры (tc и ti), которые в существенно меньшей степени сопровождались делециями (del) (рис. 1, 2). Кроме того, встречались также дицентрики, особенно в первую декаду после ДЛТ (рис. 2).
В данной работе не выявили явной зависимости между суммарной частотой аберраций, равно как и отдельных её компонент, от вида онкологического заболевания (рис. 1). Отмечалась лишь повышенная частота аберраций у пациентов с диагнозом C53 и C61, однако, данное повышение не является значимым в силу малочисленности подгрупп: всего по 3 пациента. На основании полученных результатов можно сделать предварительное заключение о том, что имеется основание для применения полученных дозовых коэффициентов при ретроспективной биодозиметрии для видов заболеваний обследованных пациентов.
Результаты настоящей работы показали значимую роль фактора промежутка времени между окончанием ДЛТ и проведением цитогенетического анализа (рис. 2). Наблюдается явное превышение суммарной наблюдаемой частоты аберраций в первую декаду после ДЛТ по сравнению с последующим временем. Аналогичная закономерность была получена нами ранее при обследовании методом FISH пострадавших лиц в результате различных радиационно-аварийных ситуаций [20]. Причина снижения частоты стабильных радиационных маркеров с течением времени заключается в том, что изначально они присутствуют как в стабильных, так и в нестабильных клетках, а в отдалённом периоде - только в существенно меньшем числе стабильных лимфоцитов, которые продуцируются из облучённых стволовых клеток. Фактор снижения частоты транслокаций (tc+ti) после 10 лет составляет порядка 2 как в данном исследовании, так и в работе [20].
Причина аномально высокой частоты радиационный маркеров у пациента #3 на длительный срок после ДЛТ (50 лет) не получила однозначной интерпретации. Возможные гипотезы: особенности радиационной чувствительности пациента, плохая реакция клеток на стимуляцию PHA (удалось проанализировать всего 352 клетки) и пр. Поэтому при обследовании пациентов подобной категории следует учитывать возможность появления особенных случаев.
Для биологической дозиметрии на основе аберраций наиболее важную роль играет соотношение частоты радиационно-индуцированных маркеров и величины поглощённой дозы. Для этого на основании полученных данных была оценена величина линейного дозового коэффициента в формуле (1). Оценка была сделана как по индивидуальным данным (табл. 4), так и в среднем по подгруппам пациентов (табл. 5, 6). Вариация дозового коэффициента подтверждает вывод об отсутствии явной его зависимости от вида заболевания. В среднем этот коэффициент варьирует в пределах 0,12-0,14, поскольку для заболеваний с диагнозом C54, C40, C97 данные имеют слишком низкую статистическую мощность.
Зависимость дозового коэффициента от времени после ДЛТ подтверждается анализом наблюдаемых маркеров (рис. 2). Так для первой декады получена оценка 0,19, а для последующих интервалов в 2 раза меньше: 0,08-0,10. Различия статистически значимы (p<0,05), табл. 6. Причина зависимости дозового коэффициента от времени после ДЛТ состоит в том, что доля лимфоцитов с изначально индуцированными радиационными маркерами снижается по естественным причинам. Однако лимфоциты с наследуемыми стабильными повреждениями остаются пригодными для анализа методом FISH и могут быть использованы для ретроспективной биодозиметрии.
Так, для пациента #12 отсутствуют данные о СОД. По результатам обследования методом FISH (F g =3,72, AT=18 лет), табл. 4, и среднего дозового коэффициента (< а >=0,08), табл. 6, получаем оценку СОД=F G /< a >=46 Гр.
Эмпирически оцененный дозовый коэффициент неявно учитывает такие факторы как пролонгированное дробное облучение, локальный способ воздействия, химиотерапию и пр. Однако очевидно, что подобная оценка является лишь первым предварительным этапом в решении задачи ретроспективной биодозиметрии онкологических пациентов. Необходимо отметить, что оценки и выводы данной работы носят полуколичественный характер. К сожалению, пока нет возможности выполнить строгую статистическую оценку погрешности дозового коэффициента, равно как и сформулировать положения математической модели ДЛТ с учётом неопределённостей исходных данных. Тем не менее, эмпирическая оценка позволяет рекомендовать использование соотношения частоты радиационных маркеров и СОД в зависимости от времени после ДЛТ и при этом не учитывать тип заболевания в пределах списка обследованных пациентов.
Характерной особенностью проведённого исследования являлось обнаружение в половине исследованных препаратов мультиаберрантных клеток, содержащих комплексные хромосомные перестройки, которые возникают вследствие сложных нерепарируемых повреждений ДНК. Присутствие в организме онкологических пациентов подобных клеток после ДЛТ может быть признаком вероятности возникновения вторых раков [1]. Несмотря на то, что мультиабер-рантные клетки, тем более при воздействии с низкой ЛПЭ, не являются прямыми маркерами вторичного рака, но свидетельствуют о существенных сбоях в процессе репарации. При этом может появиться клетка с множественными, но стабильными перестройками, которая теоретически может привести к первичной мутации в процессе канцерогенеза. Такие пациенты должны быть включены в группу повышенного риска для пристального наблюдения.
Важным фактором, влияющим на отдалённые лучевые повреждения, является тип аппаратуры для лучевой терапии и схема облучения, которые совершенствуются год от года. В настоящей работе данный фактор не удалось исследовать по причине отсутствия достоверных исходных данных. Однако, при определённых условиях эта задача может быть предметом последующих исследований.
Совокупность полученных в настоящей работе результатов цитогенетического обследования пациентов и их клинико-дозиметрические показатели были оформлены в виде базы данных в Федеральной службе по интеллектуальной собственности. В результате зарегистрированная ранее база данных пациентов о пациентах с раком лёгкого [5] будет дополнена результатами при других заболеваниях.
Заключение
В работе показано, что повышенная частота стабильных радиационных маркеров в лимфоцитах крови онкологических пациентов с различными видами заболеваний сохраняется на протяжении многих лет после ДЛТ, что позволяет использовать данный показатель для ретроспективной биологической дозиметрии. Вид заболевания при этом не имеет существенного значения. Значимую роль играет фактор промежутка времени между окончанием ДЛТ и цитогенетическим анализом. По этой причине для ретроспективной оценки СОД по частоте стабильных хромосомных маркеров необходимо использовать соответствующий дозовый коэффициент. Половина из обследованных пациентов относится к группе повышенного риска вторых раков по причине обнаружения у них мультиаберрантных клеток, которые возникают вследствие сложных не-репарируемых повреждений ДНК.
Список литературы Ретроспективная оценка тяжести отдалённых лучевых повреждений онкологических пациентов методом цитогенетического обследования
- Столбовой А.В., Залялов И.Ф. Радиобиологические модели и клиническая радиационная онкология //Онкология. Журнал им. П.А. Герцена. 2016. Т. 6. С. 88-96.
- Simon S.L., Bailiff I., Bouvill A., Fattibene P., Kleinerman R.A., Lloyd D.C., McKeever S.W.S., Romanyu-kha A., Sevan'kaev A.V., Tucker J.D., Wieser A. BiodosEPR-2006 consensus committee report on biodosi-metric methods to evaluate radiation doses at long times after exposure // Radiat. Meas. 2007. V. 42, N 6-7. P. 948-971.
- Roch-lefévre S., Pouzoulet F., Giraudet A.L., Voisin P.A., Vaurijoux A., Gruel G., Grégoire E., Buard V., Delbos M., Voisin Ph., Bourhis J., Roy L. Cytogenetic assessment of heterogeneous radiation doses in cancer patients treated with fractionated radiotherapy //Br. J. Radiol. 2010. V. 83, N 993. P. 759-766.
- Хвостунов И.К., Курсова Л.В., Шепель Н.Н., Рагулин Ю.А., Севанькаев А.В., Гулидов И.А., Глазырин Д.А., Иванова И.Н. Оценка целесообразности применения биологической дозиметрии на основе анализа хромосомных аберраций в лимфоцитах крови больных раком лёгкого при терапевтическом фракционированном у-облучении //Радиационная биология. Радиоэкология. 2012. Т. 52, № 5. С. 467-480.
- Хвостунов И.К., Курсова Л.В., Севанькаев А.В., Рагулин Ю.А., Шепель Н.Н., Коровчук О.Н., Пятенко В.С., Хвостунова Т.И. Оценка последствий дистанционной лучевой терапии у больных раком лёгкого путем анализа хромосомных аберраций в лимфоцитах крови //Радиация и риск. 2019. Т. 28, № 2. С. 87-101.
- Cytogenetic analysis for radiation dose assessment: a manual. Technical Reports Series No. 405. Vienna: IAEA, 2001. 127 p.
- Vorobtsova I., Darroudi F., Semyonov A., Kanayeva A., Timofeyeva N., Yakovleva T., Zharinov G., Na-tarajan A.T. Analysis of chromosome aberrations by FISH and Giemsa assays in lymphocytes of cancer patients undergoing whole-body irradiation: comparison of in vivo and in vitro irradiation //Int. J. Radiat. Biol. 2001. V. 77, N 11. P. 1123-1131. DOI: 10.1080/09553000110075527.
- Kutsuki S., Ihara N., Shigematsu N., Okamoto S., Kubo A. Relation between chromosomal aberrations and radiation dose during the process of TBI //Radiat. Med. 2005. V. 23, N 1. P. 37-42.
- Duran A., Barquinero J.F., Caballin M.R., Ribas M., Puig P., Egozcue J., Barrios L. Suitability of FISH painting techniques for the detection of partial-body irradiations for biological dosimetry //Radiat. Res. 2002. V. 157, N 4. P. 461-468. DOI: 10.1667/0033-7587(2002)157[0461:S0FPTF]2.0.C0;2.
- Matsubara S., Sasaki M.S., Adachi T. Dose response relationship of lymphocyte chromosome aberrations in locally irradiated persons //J. Radiat. Res. 1974. V. 15, N 4. P. 189-196. DOI: org/10.1269/jrr.15.189.
- Barquinero J.F., Barrios L., Caballin M.R. Miró R., Ribas M., Egozcue J. Biological dosimetry in simulated in vitro partial irradiations //Int. J. Radiat. Biol. 1997. V. 71, N 4. P. 435-440. DOI: 10.1080/095530097144058.
- Senthamizhchelvan S., Pant G.S., Rath G.K., Julka P.K., Nair O., Prabhakar R., Malhotra A. Biological estimation of dose in hemi-body irradiation of cancer patients by cytogenetic analysis //Health Phys. 2008. V. 94, N 2. P. 112-117. DOI: 10.1097/01.HP.0000284893.98079.ae.
- Balajee A.S., Hadjidekova V. Retrospective cytogenetic analysis of unstable and stable chromosome aberrations in the victims of radiation accident in Bulgaria //Mutat. Res. Genet. Toxicol. Environ. Mutagen. 2021. V. 861-862. P. 503295. DOI: 10.1016/j.mrgentox.2020.503295.
- Herate C., Sabatier L. Retrospective biodosimetry techniques: focus on cytogenetics assays for individuals exposed to ionizing radiation //Mutat. Res. Rev. Mutat. Res. 2020. V. 783. P. 108287. DOI: 10.1016/j.mrrev.2019.108287.
- Khvostunov I.K., Saenko V.A., Krylov V.V., Rodichev A.A., Yamashita S. Cytogenetic biodosimetry and dose-rate effect after radioiodine therapy for thyroid cancer //Radiat. Environ. Biophys. 2017. V. 56, N 3. P. 213-226.
- Хвостунов И.К., Крылов В.В., Родичев А.А., Шепель Н.Н., Коровчук О.Н., Пятенко В.С., Хвостунова Т.И. Доза общего облучения при лечении дифференцированного рака щитовидной железы радиоактивным йодом //Радиационная биология. Радиоэкология. 2017. Т. 57, № 5. С. 471-485.
- Brenner D.J., Hlatky L.R., Hahnfeldt P.J., Huang Y., Sachs R.K. The linear-quadratic model and most other common radiobiological models result in similar predictions of time-dose relationships //Radiat. Res. 1998. V. 150, N 1. P. 83-91.
- Edwards A.A., Lloyd D.C., Purrott R.J. Radiation induced chromosome aberration and the Poisson distribution //Radiat. Environ. Biophys. 1979. V. 16, N 2. P. 89-100.
- Sigurdson A.J., Ha M., Hauptmann M., Bhatti P., Sram R.J., Beskid O., Tawn E.J., Whitehouse C.A., Lindholm C., Nakano M., Kodama Y., Nakamura N., Vorobtsova I., Oestreicher U., Stephan G., Yong L.C., Bauchinger M., Schmid E., Chung H.W., Darroudi F., Roy L., Voisin P., Barquinero J.F., Livingston G., Blakey D., Hayata I., Zhang W., Wang C., Bennett L.M., Littlefield L.G., Edwards A.A., Kleinerman R.A., Tucker J.D. International study of factors affecting human chromosome translocations //Mutat. Res. 2008. V. 652, N 2. P.112-121. DOI: 10.1016/j.mrgentox.2008.01.005.
- Sevan'kaev A.V., Khvostunov I.K., Lloyd D.C., Voisen Ph., Golub E.V., Nadejina N.M., Nugis V.Yu., Si-dorov O.S., Skvortsov V.G. The suitability of FISH chromosome painting and ESR-spectroscopy of tooth enamel assays for retrospective dose reconstruction //J. Radiat. Res. 2006. V. 47, N Suppl. A. P. A75-A80.


