Ретроспективный анализ отдаленных результатов применения первичной циторедукции и предоперационной химиотерапии на первом этапе лечения больных IIIC-IV стадий рака яичника
Автор: Тюляндина А.С., Румянцев А.А., Морхов К.Ю., Нечушкина В.М., Тюляндин С.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Профилактика, диагностика и лечение онкологических заболеваний
Статья в выпуске: 3 т.8, 2018 года.
Бесплатный доступ
Выбор тактики лечения больных раком яичников (РЯ) IIIC-IV стадий на первом этапе остается предметом многочисленных дискуссий. Причиной этому являются неудовлетворительные результаты рандомизированных исследований и низкая частота первичных полных циторедукций в этих работах. Мы провели ретроспективный анализ по оценке эффективности хирургического лечения больных РЯ IIIC-IV стадий (n=314), проходивших лечение с 1995 по 2017 г. Медиана времени без прогрессирования (ВБП) при выполнении первичного хирургического вмешательства составила 15,6 мес., после интервальной циторедукции - 11,5 мес. (р=0,002; HR 0,61: 95 % CI 0,39-0,81). Выполнение первичной циторедукции позволило достоверно увеличить медиану продолжительности жизни (ПЖ) на 19,6 мес.: c 38,0 мес. при интервальной операции до 57,6 мес. при первичной циторедукции (р=0,04; HR 0,64: 95 % CI 0,41-0,99). Увеличение числа оптимальных интервальных операций не приводит к улучшению отдаленных результатов лечения в группе больных после предоперационной химиотерапии. Проведенный нами анализ за последние 20 лет продемонстрировал, что улучшение результатов лечения отмечается только в группе первичных циторедукций и обусловлено увеличением числа полных оптимальных циторедуктивных вмешательств
Рак яичников, полная циторедукция, оптимальная циторедукция, предоперационная химиотерапия, интервальная циторедукция
Короткий адрес: https://sciup.org/140243800
IDR: 140243800 | DOI: 10.18027/2224-5057-2018-8-3-86-94
Текст научной статьи Ретроспективный анализ отдаленных результатов применения первичной циторедукции и предоперационной химиотерапии на первом этапе лечения больных IIIC-IV стадий рака яичника
Материалы и методы, статистика
В течение года мы опубликовали несколько обзорных работ, посвященных обсуждению целесообразности интервальных циторедукций, а также оптимальности и оценке качества хирургических вмешательств у больных с IIIC– IV стадиями рака яичников (РЯ) [1–3]. В настоящий момент опубликовано три рандомизированных исследования по сравнению первичных и интервальных циторедукций совместно с предоперационной химиотерапией [4–6]. Напомним, что в трех рандомизированных работах оба подхода имели одинаковую эффективность. Причина критического отношения к полученным в исследованиях результатам обусловлена низким качеством хирургического пособия. Это подтверждается небольшим числом полных первичных циторедукций, доля которых составляет 11,6–15,5 %, и короткой медианой продолжительности жизни (ПЖ), не превышающей 30 мес. в европейской популяции [4, 5]. Ретроспективный анализ собственных данных, проведенный хирургами, стоящими на позиции агрессивной хирургии на первом этапе у больных РЯ IIIС–IV стадий, продемонстрировал, что увеличение доли полных первичных циторедукций более чем на 20 % приводит к медиане ПЖ, превышающей 57 мес. [7–9]. Целью нашей работы являлась оценка результатов лечения больных распространенным РЯ IIIС–IV стадий, прошедших лечение в нашем отделении за последние 20 лет, в зависимости от срока и объема циторедукции.
Нами был проведен ретроспективный анализ по оценке качества хирургического лечения больных РЯ IIIС–IV стадий, сравнению сроков и оптимальности циторедуктивных хирургических вмешательств у больных РЯ, получивших лечение в отделении клинической фармакологии и химиотерапии за период с 1995 по 2017 г. В данное исследование было включено 314 больных РЯ IIIС–IV стадий. Мы подразделили анализ на три этапа.
В первую очередь было проведено сравнение отдаленных результатов в зависимости от сроков хирургического лечения, для чего пациенты были разделены на две группы. В 224 из 314 случаев (71,3 %) на первом этапе выполнялась первичная циторедукция, у 90 (28,7 %) больных – интервальная циторедукция после предоперационной химиотерапии. Отбор в группу предоперационной химиотерапии определялся в большинстве случаев общим состоянием больных (ECOG ≥2), возрастом (пациенты старше 70–75 лет), распространенностью опухолевого процесса, квалификацией оперирующей бригады и парамедицинскими причинами.
На втором этапе была оценена эффективность хирургического лечения за последние 20 лет. Для этого мы подразделили больных на две группы в зависимости от периода выполнения хирургического вмешательства: с 1995 по 2005 г. (n=76) и с 2006 по 2017 г. (n=238). Анализ этих подгрупп включал оценку динамики развития хирургического лечения, сравнение с мировыми тенденциями и выживаемость больных в разные временные периоды в зависимости от сроков выполнения хирургического этапа лечения.
На третьем этапе проведена оценка радикальности хирургического лечения только в подгруппе больных, получавших лечение с 2006 по 2017 г., за этот период пациенты в обеих группах получали химиотерапию первой линии с препаратами платины и таксанами, являющуюся стандартным подходом к лечению. Сравнение проводилось в группах оптимальной циторедукции (остаточная опухоль 0–1 см, n=170) и в группе, в которой больные были прооперированы в неоптимальном объеме (≥1 см, n=56). Общее число пациенток в исследовании составило 226, поскольку у 12 из 238 больных отсутствовали данные по оптимальности циторедукции. Сравнительный анализ включал оценку отдаленных результатов в зависимости от радикальности хирургического лечения.
Оптимальной считалась циторедукция, при которой максимальной диаметр остаточной опухоли составлял 0–1 см, полной оптимальной циторедукцией (микроскопическая опухоль) считалось визуальное отсутствие очагов болезни и неоптимальной циторедукцией называлась операция при остаточной опухоли более 1 см в диаметре. Оценка производилась по данным протоколов операций и контрольному обследованию перед началом системного лечения.
В качестве основных критериев эффективности рассматривались: выживаемость без прогрессирования (ВБП), рассчитывающаяся с момента начала лечения (хирургического или системного в зависимости от того, что наступало раньше) до прогрессирования и/или смерти от любой причины либо даты последнего наблюдения; общая выживаемость, рассчитывающаяся с момента начала лечения до даты смерти от любой причины или даты последнего наблюдения. Выживаемость рассчитывалась по методу Каплана – Майера. Сравнение групп больных по выживаемости проводилось с помощью лог-ранг теста, теста Breslow-Wilcoxon или с помощью Cox-анализа в зависимости от статистической модели. Для переменных, отражающих различные признаки, применялись методы описательной статистики. Для сравнения групп по частоте встречаемости признаков, представленных непараметрическими переменными, применялся тест X2 с поправкой Йетса на непрерывность; при небольших выборках (5 и менее больных) применялся метод Фишера. Сравнение групп больных по факторам, представленным численными переменными, проводилось в зависимости от распределения признака. При нормальном распределении использовался t-критерий Стьюдента, при неправильном распределении независимых признаков – тест Манна – Уитни. Оценка зависимых параметрических признаков с неправильным распределением проводилась с помощью критерия Вилкоксона. При использовании перечисленных методов статистики применялся 95 %-й доверительный интервал и значение двустороннего «р». Статистический анализ проводился с помощью программ статистического пакета SPSS (IBM® SPPS® Statistics v. 20), программ Graph Pad v. 5.0 и Microsoft® Excel® 2010.
Результаты лечения больных раком яичников IIIC—IV стадий за последние 20 лет
В анализ вошли данные 314 больных РЯ IIIС–IV стадий. Основные клинико-морфологические характеристики обобщены в табл. 1. Из представленных данных видно, что возраст, общий статус больных, частота отдаленного метастазирования не отличались в группах первичной и интервальной циторедукций и, таким образом, не являлись критериями отбора больных для предоперационной химиотерапии. В группе интервальной циторедукции больные РЯ с IV стадией встречались чаще, чем в группе первичной операции (47,8 % vs 27,7 %, р=0,001), что в большинстве случаев было обусловлено метастатическим плевритом. В группе первичной циторедукции плеврит определялся у 18,7 % больных, а в группе интервальной операции – у 40 % (р=0,0001). В остальном сформированные группы не имели достоверных различий в распространении болезни. Частота оптимальных циторедукций в группе первичных и интервальных операций составила 33,5 и 50 % соответственно (р=0,007). Отмечена тенденция к увеличению числа хирургических вмешательств без остаточной опухоли в группе интервальной циторедукции по сравнению с первичными хирургическими вмешательствами: 22,7 и 17,8 % соответственно, однако статистическая достоверность достигнута не была (р=0,07).
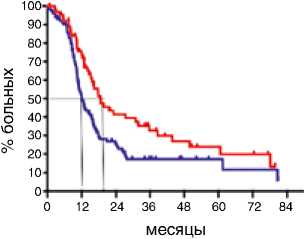
Показатели выживаемости были оценены у всех 314 пациенток и включали оценку ВБП и ПЖ у больных РЯ IIIС–IV стадий. Выполнение циторедукции на первом этапе статистически значимо увеличивало медиану ВБП у больных с IIIС–IV стадиями с 11,2 до 13,4 мес. по сравнению с интервальной циторедукцией (р=0,004; HR 0,65: 95 % CI 0,48–0,87). При этом 5-летняя ВБП в группе первичных циторедукций составляла 15 %, в то время как в группе интервальной циторедукции всего 6 % (p=0,003). ПЖ больных РЯ с IIIС–IV стадиями болезни была больше, если циторедуктивная операция выполнялась на первом этапе: медиана для первичной циторедукции составила 46,6 мес., а для интервальной – 36,6 мес. (р=0,05; HR 0,73: 95 % CI 0,51–0,99). При медиане наблюдения 31,5 мес. (диапазон 1,5–174,7 мес.) 5-летняя общая выживаемость для больных после первичной циторедукции составила 30 %, 10-летняя – 20 %. После интервальной циторедукции 5-летняя общая выживаемость равнялась 25 %, к 10 годам наблюдения все больные погибали (рис. 1).
Таблица 1. Клинико-морфологическая характеристика больных РЯ IIIС–IV стадий в зависимости от времени выполнения хирургического лечения
Признак Первичная циторедукция Интервальная циторедукция р
|
Число больных |
224 |
90 |
|
|
Возраст, медиана (годы) |
53 (23–78) |
57 (36–75) |
0,08 |
|
ECOG-статус до начала ХТ |
Оценен у 197 |
Оценен у 78 |
|
|
0–1 |
161/197 (81,7 %) |
61/78 (78,2 %) |
0,74 |
|
2–3 |
36/197 (18,3 %) |
17/78 (21,8 %) |
|
|
Стадия |
|||
|
IIIС |
162/224 (72,3 %) |
47/90 (52,2 %) |
0,001 |
|
IV |
62/224 (27,7 %) |
43/90 (47,8 %) |
|
|
Гистологический тип аденокарциномы |
|||
|
серозная |
194/224 (86,6 %) |
84/90 (93,3 %) |
0,22 |
|
другие |
30/224 (13,4 %) |
6/90 (6,7 %) |
|
|
Отдаленное метастазирование |
32/224 (14,3 %) |
15/90 (16,7 %) |
0,72 |
|
Асцит |
|||
|
есть |
164/224 (73,2 %) |
75/90 (83,3 %) |
0,08 |
|
нет/не известно |
60/224 (26,8 %) |
15/90 (16,7 %) |
|
|
Плеврит |
|||
|
есть |
42/224 (18,7 %) |
36/90 (40,0 %) |
0,0001 |
|
нет/не известно |
182/224 (81,3 %) |
54/90 (60,0 %) |
|
|
Оптимальность хирургического лечения |
|||
|
оптимальная циторедукция |
75/224 (33,5 %) |
45/90 (50,0 %) |
0,007 |
|
неоптимальная циторедукция |
137/224 (61,1 %) |
40/90 (44,4 %) |
|
|
не известно |
12/224 (5,4 %) |
5/90 (5,6 %) |
|
|
Размер остаточных очагов: |
40/224 (17,8 %) |
25/90 (27,8 %) |
|
|
микроскопические |
172/224 (76,8 %) |
60/90 (66,6 %) |
0,07 |
|
макроскопические не известно |
12/224 (5,4 %) |
5/90 (5,6 %) |
|
Время прогрессирования, мес.
Продолжительность жизни, мес.
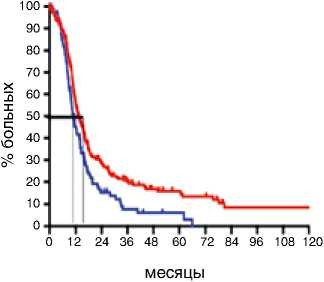
p=0.004
Первичная циторедукция
Интервальная циторедукция
HR 0.65
95%CI (0.48-0.87)
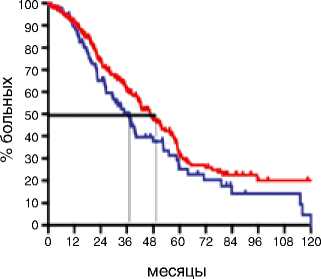
Первичная циторедукция
Интервальная циторедукция
p=0.05
HR 0.73
95%CI (0.51-0.99)
|
Вид циторедукции |
Первичная |
Интервальная |
|
Событие |
167 / 224 (74,5%) |
79 / 90 (87,7%) |
|
Медиана ВБП, мес. |
13,4 |
11,2 |
|
Вид циторедукции |
Первичная |
Интервальная |
|
Событие |
120 / 224 (53,6%) |
60 / 90 (66,7%) |
|
Медиана ПЖ, мес. |
46,6 |
36,6 |
Рисунок 1. Отдаленные результаты лечения больных РЯ IIIС–IV стадий в зависимости от сроков выполнения циторедукции
Лечение больных РЯ IIIС—IV стадий в разные временные периоды
Мы разделили больных в зависимости от времени выполнения циторедукции на два периода: 1995–2005 и 2006–2017 гг. Цель данного анализа включала изучение эволюции лечения больных РЯ IIIС–IV стадий в РОНЦ им. Н. Н. Блохина. В первый период попали 76 больных, получавших лечение с 1995 по 2005 г. За второй пери- од с 2006 по 2017 г. значительно увеличился поток пациентов, что позволило включить в анализ 238 больных. В табл. 2 продемонстрирована сравнительная характеристика основных показателей у больных РЯ IIIС–IV стадий в зависимости от периода лечения. Стоит отметить, что за последнее время в два раза снизилось число больных с IV стадией заболевания на момент постановки диагноза. В первом периоде почти половина больных была представлена диссеминированной болезнью (44,7 %),
Таблица 2. Клинико-морфологическая характеристика больных РЯ IIIС–IV стадий в зависимости от периода лечения
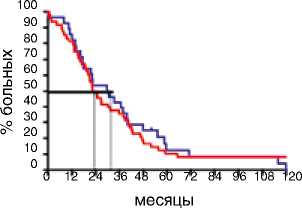
В первом десятилетии (1995–2005) не было получено различий в зависимости от сроков выполнения хирургического вмешательства. Медиана ВБП в группе первичных циторедукций составила 11,1 мес., в группе интер- вальных операций – 10,0 мес. (р=0,94; HR 0,91: 95 % CI 0,56–1,48). Эта же тенденция отразилась и на ПЖ больных: различия составили 6,5 мес., однако статистическая значимость не была получена (р=0,84; HR 1,05: 95 % CI 0,64–1,59). Ситуация поменялась кардинальным образом за последнюю декаду. Выполнение первичной циторедукции позволило достоверно увеличить медиану ВБП на 4,1 мес.: c 11,5 мес. при интервальной циторедукции до 15,6 мес. при первичной циторедукции (р=0,002; HR 0,61: 95 % CI 0,39–0,81) (рис. 2). Эта же тенденция прослеживается при анализе ПЖ: больные после первичной циторедукции живут значимо дольше (57,6 мес.) по сравнению с пациентами после интервальной циторедукции (38 мес.) (р=0,04; HR 0,64: 95 % CI 0,41–0,99) (рис. 3).
Таким образом, с увеличением агрессивности хирургического лечения в последние годы, а также улучшением качества стадирования больных и использованием стандартной терапии первой линии на основе препаратов платины и таксанов наблюдается значимый прирост в медиане ВБП и ПЖ у больных РЯ IIIС–IV стадий после первичной циторедукции. Это соответствует снижению относительного риска прогрессирования на 39 % и смерти на 36 % за период 2006–2017 гг. В то же время за последние 20 лет не было отмечено улучшения результатов лечения у пациентов после интервальной циторедукции.
Период 1995–2005
ВБП, мес.
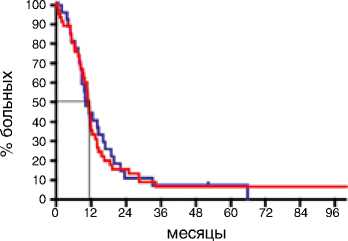
Вид циторедукции
Первичная
Событие
42 / 48 (87,5%)
Первичная циторедукция
Интервальная циторедукция
p=0.94
>< 60
§ 40
Ю 30
Медиана ВБП, мес.
11,1
HR 0.91
95%CI (0.56-1.48)
Период 2006–2017 ВБП, мес.
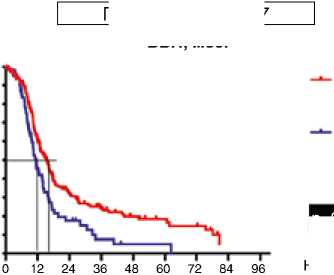
Интервальная циторедукция
Первичная циторедукция месяцы
Первичная
p=0.002
HR 0.61 95%CI (0.39-0.81)
Интервальная
26 / 28 (92,8%)
10,0
Вид циторедукции
Интервальная
Событие
125 / 176 (71,0%)
53 / 52 (85,5%)
Медиана ВБП, мес.
15,6
11,5
Рисунок 2. ВБП у больных раком яичников IIIС–IV стадий в разные временные периоды
Период 2006–2017
Период 1995–2005
ПЖ, мес.
Первичная циторедукция
Интервальная циторедукция
p=0.84
HR 1.05
95%CI (0.64-1.59)
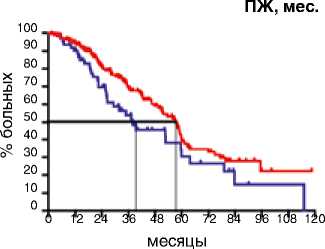
Первичная циторедукция
Интервальная циторедукция
p=0.04
Вид циторедукции
Первичная
Интервальная
Событие
44 / 48 (91,6%)
27 / 28 (96,4%)
Медиана ПЖ, мес.
23,5
30,0
HR 0.64
95%CI (0.41-0.99)
|
Вид циторедукции |
Первичная |
Интервальная |
|
Событие |
76 / 176 (43,2%) |
35 / 62 (56,4%) |
|
Медиана ПЖ, мес. |
57,6 |
38,0 |
Рисунок 3. ПЖ у больных раком яичников IIIС–IV стадий в разные временные периоды
Оптимальность хирургического лечения у больных РЯ IIIС—IV стадий за период 2006—2017 гг.
В анализ оптимальности хирургического лечения были включены 226 больных РЯ IIIС–IV стадий, получивших лечение за период с 2006 по 2017 г. В группу первичной циторедукции вошло 170 больных, в группу интервальной циторедукции – 56. В большинстве своем пациенты не отличались по представленным клинико-морфологическим признакам. В группе интервальной циторедукции встречались в два раза чаще больные с IV стадией заболевания (46,4 % случаев) по сравнению с группой первичной циторедукции (22,9 %). Отдаленное метастазирование в виде поражения печени, легких и нерегионарных лимфатических узлов наблюдалось чаще у больных, которым выполнялась первичная циторедуктивная операция, чем у начавших лечение с предоперацион- ной химиотерапии: 18 и 12 пациентов соответственно (р=0,06). Плеврит наблюдался у 44,6 % больных в группе предоперационной терапии, в группе первичной циторедукции – в 15,9 % случаев (р=0,001). Хирургическое лечение в оптимальном объеме не отличалось в обеих группах: в группе первичной циторедукции составило 39,4 % и в группе интервальной – 41,1 %. После предоперационной химиотерапии доля полных циторедукций (23,2 %) не увеличивалась по сравнению с больными, прооперированными на первом этапе (22,3 %) (табл. 3).
Больные, которым была выполнена первичная циторедукция в оптимальном объеме (т. е. с остаточной опухолью до 1 см), прогрессировали после первой линии достоверно позже. Медиана ВБП в группе оптимальной циторедукции составила 18,6 мес., в группе неоптимальной – 12 мес. (р=0,01; HR 0,63: 95 % CI 0,44–0,90). В группе интервальной циторедукции отмечена тенденция к увеличению медианы ВБП только у больных с оптимальным
Таблица 3. Сравнительная характеристика больных РЯ IIIС–IV стадий в зависимости от оптимальности хирургического лечения за период 2006–2017 гг.
|
Признак |
Первичная циторедукция |
Интервальная циторедукция |
р |
|
Число больных |
170 |
56 |
|
|
Возраст, медиана (годы) |
53 (23–78) |
57 (39–74) |
0,18 |
|
ECOG-статус до начала ХТ |
|||
|
0–1 |
146/170 (85,9 %) |
44/56 (78,6 %) |
0,27 |
|
2–3 |
24/170 (14,1 %) |
12/56 (21,4 %) |
|
|
Стадия |
|||
|
IIIС |
131/170 (77,1 %) |
30/56 (53,6 %) |
0,0014 |
|
IV |
39/170 (22,9 %) |
26/56 (46,4 %) |
|
|
Гистологический тип аденокарциномы |
|||
|
серозная |
157/170 (92,3 %) |
52/56 (92,8 %) |
1,0 |
|
другие |
13/170 (7,7 %) |
4/56 (7,2 %) |
|
|
Отдаленное метастазирование |
18/170 (10,6 %) |
12/56 (21,4 %) |
0,06 |
|
Плеврит |
|||
|
есть |
27/170 (15,9 %) |
25/56 (44,6 %) |
0,0001 |
|
нет/не известно |
143/170 (84,1 %) |
31/56 (55,4 %) |
|
|
Оптимальность хирургического лечения |
|||
|
оптимальная циторедукция |
67/170 (39,4 %) |
23/56 (41,1 %) |
0,95 |
|
неоптимальная циторедукция |
103/170 (60,6 %) |
33/56 (58,9 %) |
|
|
Размер остаточных очагов |
|||
|
микроскопические |
38/170 (22,3 %) |
13/56 (23,2 %) |
0,89 |
|
макроскопические |
132/64 (77,7 %) |
43/56 (76,8 %) |
|
Первичная циторедукция
Оптимальная циторедукция Неоптимальная циторедукция
p=0.01
HR 0.63
95%CI (0.44-0.90)
Интервальная циторедукция
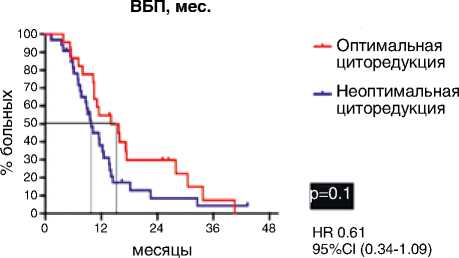
|
Объем циторедукции |
Оптимальная |
Неоптимальная |
|
Событие |
42 / 67 (62,7%) |
77 / 103 (74,8%) |
|
Медиана ВБП, мес. |
18,6 |
12 |
|
Объем циторедукции |
Оптимальная |
Неоптимальная |
|
Событие |
19 / 23 (82,6%) |
28 / 33 (84,8%) |
|
Медиана ВБП, мес. |
14,1 |
9,8 |
Рисунок 4. ВБП у больных РЯ IIIС–IV стадий в зависимости от оптимальности циторедукции
Таблица 4. Данные РОНЦ им. Н. Н. Блохина по изучению первичных и интервальных циторедукций за последние 20 лет
|
Исследование |
Циторедукция |
Оптимальная циторедукция |
Полная циторедукция (0 мм) |
ВБП, медиана, мес. |
ПЖ, медиана, мес. |
|
РОНЦ 1995–2005 гг. (n=71) |
ПЦ (n=44) |
9 (20,4 %) |
3 (6,8 %) |
11,1 |
23,5 |
|
ИЦ (n=27) |
18 (66,7 %) |
11 (40,7 %) |
10,0 |
30,0 |
|
|
РОНЦ 2006–2017 гг. (n=226) |
ПЦ (n=170) |
67 (39,4 %) |
38 (22,3 %) |
15,6 |
57,6 |
|
ИЦ (n=56) |
23 (41,1 %) |
13 (22,2 %) |
11,5 |
38,0 |
ПЦ – первичная циторедукция, ИЦ – интервальная циторедукция, ВБП – время без прогрессирования, ПЖ – продолжительность жизни объемом вмешательства: медиана ВБП для оптимальной циторедукции составила 14,1 мес. по сравнению с всего 9,8 мес. среди пациентов с неоптимальной циторедукцией (р=0,1; ОР=0,61: 95 % ДИ 0,34–1,09) (рис. 4).
Обсуждение
Целью нашей работы был анализ тенденций в хирургическом лечении диссеминированного РЯ за последние
Таблица 5. Результаты лечения больных с распространенным РЯ IIIС–IV стадий при проведении первичной циторедукции
|
Автор |
Стадия IV |
Медиана ПЖ, мес. |
Медиана ВБП, мес. |
Полная циторедукция |
|
РОНЦ, 2006–2017 (n=170) |
39 (22,9 %) |
57,6 |
15,6 |
38 (22,3 %) |
|
Chi et al., 2012 (n=285) [7] |
36 (17,0 %) |
50 |
17 |
69 (24 %) |
|
Tanner et al., 2012 (n=576) [8] |
85 (14,8 %) |
42,2 |
15,5 |
207 (35,9 %) |
|
du Bois et al., 2009 (n=3126) [9] |
530 (17,0 %) |
44,1 |
18,2 |
1046 (33,5 %) |
|
Oza et al., 2015 (n=764) [10] |
97 (13,0 %) |
58,6 |
17,5 |
373 (49 %) |
ВБП – время без прогрессирования, ПЖ – продолжительность жизни
20 лет. На примере РОНЦ им. Н. Н. Блохина мы видим, что за этот период не произошло существенных изменений в хирургических подходах. Значимо не увеличилось количество оптимальных и полных оптимальных циторедукций. Однако выполнение хирургического лечения на первом этапе улучшало результаты лечения.
В табл. 4 суммированы полученные нами результаты по изучению первичной и интервальной циторедукций. Во всех международных работах число первичных оптимальных циторедукций оказалось низким (36,9–43,1 %), что соответствует данным РОНЦ. Увеличение оптимальных циторедукций после предоперационной химиотерапии до 67,7–81,0 % во всех трех исследованиях не привело к улучшению отдаленных результатов лечения, о чем стоит задуматься. При этом медиана ПЖ в европейских работах крайне низкая и составляет 22,6–30 мес. [1, 2]. Лечение больных в РОНЦ в 1995–2005 гг. не противоречит данным международных исследований. При низком числе первичных циторедукций (20,4 %) и сопоставимых цифрах оптимальных интервальных циторедукций (66,7 %) медианы ВБП и ПЖ не уступают таковым в международных исследованиях и составляют 10,0 и 11,0 мес., 23,5 и 30,0 мес. соответственно. Это еще раз демонстрирует, что рандомизированные исследования не отвечают современной тенденции к агрессивной хирургической тактике при лечении больных распространенным РЯ, поскольку техника хирургического вмешательства в этих работах соответствует результатам лечения больных в конце прошлого века.
Анализ наших данных за последнее десятилетие показал, что выполнение интервальной циторедукции после предоперационной химиотерапии не позволяет значимо увеличить число оптимальных хирургических вмешательств (всего 41,1 %). При этом медиана ВБП у больных в группе интервальной циторедукции за период 2006– 2017 гг. соответствует таковой в 1995–2005 гг., а также данным исследований CHORUS и EORTC, составив 11,5 мес. То есть ни лекарственное лечение таксанами и препаратами платины по «золотому стандарту», ни попытка агрессивной хирургии у некоторых хирургических бригад не позволяют увеличить медиану ВБП в группе интервальной циторедукции за последние 20 лет. Отмеченное статистически незначимое увеличение ПЖ в этой группе с 30 до 38 мес., скорее всего, объясняется более эффективной лекарственной терапией рецидивов.
Тенденция к улучшению результатов лечения за последние 20 лет наметилась только у больных в группе первичной циторедукции, а именно в группе полного циторедуктивного вмешательства. В связи с совершенствованием хирургической техники у отдельных бригад, лучшей анестезиологической и реанимационной поддержкой сегодня у большинства больных (73,9 %) на первом этапе выполняется оперативное лечение. Достижение оптимальной циторедукции позволяет проводить данным пациентам агрессивное системное лечение, например внутрибрюшинную химиотерапию, а также планировать хирургическое лечение при возникновении рецидивов. Такой подход позволил увеличить долю полных первичных циторедукций за последние 10 лет до 22,3 %, медиану ВБП до 15,6 мес. и медиану ПЖ до 57,6 мес., приблизив наши показатели к результатам мировых лидеров в этом направлении (табл. 5).
Нам, как и многим хирургам, будущее лечения распространенного РЯ видится в агрессивном хирургическим подходе именно на первом этапе. Увеличение числа оптимальных циторедукций за счет использования предоперационной химиотерапии – тупиковый путь, который не дает преимуществ в отдаленных результатах лечения больных, что и было продемонстрировано в вышеупомянутых исследованиях и подтверждено нашими данными. Развитие хирургических навыков, обучение хирургических бригад и работа мультидисциплинарных групп может позволить увеличить число оптимальных циторедукций на первом этапе, что, в свою очередь, приведет к использованию новых современных методов лекарственного лечения и тем самым позволит улучшить выживаемость больных.
Заключение
Выбор тактики лечения на первом этапе необходимо основывать на комплексном анализе всех особенностей конкретного пациента, проведенном мультидисциплинар-ной командой. Приоритетным должно быть выполнение
-
А. С. Тюляндина, А. А. Румянцев, К. Ю. Морхов, В. М. Нечушкина, С. А. Тюляндин
Ретроспективный анализ отдаленных результатов применения первичной циторедукции и предоперационной химиотерапии на первом этапе лечения больных IIIC–IV стадий рака яичника первичной циторедукции в полном или как минимум оп- и назначаться в случае невозможности агрессивного хи-тимальном объеме. Предоперационная терапия для боль- рургического вмешательства, а не как равноценная замена ных РЯ должна рассматриваться как терапия отчаяния существующему стандарту.
Список литературы Ретроспективный анализ отдаленных результатов применения первичной циторедукции и предоперационной химиотерапии на первом этапе лечения больных IIIC-IV стадий рака яичника
- Румянцев А. А., Тюляндина А. С., Покатаев И. А., Тюляндин С. А. Спорные вопросы оптимальной тактики хирургического лечения больных распространенным раком яичников. Злокачественные опухоли. 2017. Т. 7. № 3 С. 13-22.
- Rumyantsev A. A., Tjulandina A. S., Pokataev I. A., Tjulandin S. A. Controversies in surgical treatment of advanced ovarian cancer. Malignant Tumours. Vol. 7. No. 3. P. 13-22 (In Russ.)
- Румянцев А. А., Тюляндина А. С., Покатаев И. А., Купчан Д. З., Тюляндин С. А. Критерии отбора больных с высоким шансом достижения оптимальной и полной циторедукции. Злокачественные опухоли. 2017. Т. 7. № 4. С. 53-62.
- Rumyantsev A. A., Tjulandina A. S., Pokataev I. A., Kupchan D. Z., Tjulandin S. A. Criteria for selection of patients with high chance of complete or optimal debulking in advanced ovarian cancer. Malignant Tumours. Vol. 7. No. 4. P. 53-62 (In Russ.)
- Румянцев А. А., Тюляндина А. С., Покатаев И. А., Тюляндин С. А. Вопросы качества хирургического лечения при раке яичников. Злокачественные опухоли. 2018. Т. 8. № 1. С. 31-37.
- Rumyantsev A. A., Tjulandina A. S., Pokataev I. A., Tjulandin S. A. Surgical quality issues in ovarian cancer. Malignant Tumours. Vol. 8. No. 1. P. 31-37 (In Russ.)
- Vergote I., Trope C. G., Amant F., Kristensen G. B., Ehlen T., Johnson N. et al. Neoadjuvant chemotherapy or primary surgery in stage IIIC or IV ovarian cancer. N. Engl. J. Med. 2010. Vol. 363. P. 943-953.
- Kehoe S., Hook J., Nankivell M., Jayson G. C., Kitchener H., Lopes T. et al. Primary chemotherapy versus primary surgery for newly diagnosed advanced ovarian cancer (CHORUS): an open-label, randomised, controlled, non-inferiority trial. Lancet. 2015. Vol. 386. P. 249-257.
- Takashi O., Toyomi S., Toshaiki S., Toru N., Kazuhiro T., Kenichi M. et al. Comparison of survival between upfront primary debulking surgery versus neoadjuvant chemotherapy for stage III/IV ovarian, tubal and peritoneal cancers in phase III randomized trial: JCOG0602. J. Clin. Oncol. 2018. Vol. 36. (Suppl.
- abstr. 5500).
- Chi D. S., Musa F., Dao F., Zivanovic O., Sonoda Y., Leitao M. M. et al. An analysis of patients with bulky advanced stage ovarian, tubal, and peritoneal carcinoma treated with primary debulking surgery (PDS) during an identical time period as the randomized EORTC-NCIC trial of PDS vs neoadjuvant chemotherapy (NACT). Gynecol. Oncol. 2012. Vol. 124 (1). P. 10-14.
- Tanner E. J., Long K. C., Feffer J. B., Leitao M. M. Jr, Abu-Rustum N. R., Barakat R. R. et al. Parenchymal splenic etastasis is an independent negative predictor of overall survival in advanced ovarian, fallopian tube, and primary peritoneal cancer. Gynecol. Oncol. 2013. Vol. 128 (1). P. 28-33.
- du Bois A., Reuss A., Pujade-Lauraine E., Harter P., Ray-Coquard I., Pfisterer J. Role of Surgical Outcome as Prognostic Factor in Advanced Epithelial Ovarian Cancer: A Combined Exploratory Analysis of 3 Prospectively Randomized Phase 3 Multicenter Trials. Cancer. 2009. Vol. 115 (6). P. 1234-1244.
- Oza A. M., Cook A. D., Pfisterer J., Embleton A., Ledermann J. A., Pujade-Lauraine E. et al. Standard chemotherapy with or without bevacizumab for women with newly diagnosed ovarian cancer (ICON7): overall survival results of a phase 3 randomised trial. Lancet Oncol. 2015. Vol. 16 (8). P. 928-936.


