Резекция артерий в хирургии рака поджелудочной железы: опыт одного учреждения
Автор: Чичеватов Дмитрий Андреевич, Калентьев Вячеслав Викторович, Глухов Артем Евгеньевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 5 т.19, 2020 года.
Бесплатный доступ
Панкреатодуоденальная резекция (ПДР) с пластикой сосудов по поводу рака поджелудочной железы выполняется примерно в 20 % случаев. В то время как резекция и пластика верхней брыжеечной вены является рутинно выполняемой операцией, целесообразность резекции артерий при ПДР остается предметом дискуссии. Цель исследования - оценить непосредственные и отдаленные результаты выполнения панкреатодуоденальных резекций с пластикой различных артерий. Материал и методы. Проанализированы результаты 89 панкреатодуоденальных резекций и панкреатодуоденэктомий, выполненных по поводу злокачественных опухолей периампулярной локализации II-IV стадий. Средний возраст пациентов составил 63,1 ± 8,2 года. Ангиопластических операций было 18 (20,2 %), из них 7 артериопластик. Результаты и обсуждение. В группе пациентов (n=7), перенесших резекцию артерии, послеоперационные осложнения развились в 5 (71,4 %) случаях, у 71 больного, которым выполнялись ПДР без пластики артерии и/или вены, осложнения возникли в 29 (40,8 %) наблюдениях (р=0,229). Послеоперационная летальность составила 1 (14,3 %) и 3 (4,2 %) случая соответственно (р=0,319). Медиана безрецидивной выживаемости при артериопластических операциях составила 5,0 мес (95 % ДИ 2,4-7,6 мес), при стандартных вмешательствах - 12,3 мес (95 % ДИ 9,2-15,4 мес) (log-rank test, p=0,011); медиана общей выживаемости - 8,0 мес (95 % ДИ 3,7-12,3 мес) и 21,8 мес (95 % ДИ 15,9-27,7 мес) (log-rank test, p=0,011). Выводы. Показатели безрецидивной и общей выживаемости значимо хуже при панкреатодуоденальных резекциях с артериопластикой, что, возможно, связано с малой выборкой пациентов. Необходимо проведение масштабных исследований с целью изучения непосредственной и отдаленной эффективности ПДР с ангиопластическим компонентом, выполненных по поводу злокачественных новообразований поджелудочной железы.
Рак поджелудочной железы, панкреатоэктомия, панкреатодуоденальная резекция, резекция артерии, ангиопластика
Короткий адрес: https://sciup.org/140254061
IDR: 140254061 | УДК: 616.37-006-089.844 | DOI: 10.21294/1814-4861-2020-19-5-82-87
Текст научной статьи Резекция артерий в хирургии рака поджелудочной железы: опыт одного учреждения
В последние десятилетия в связи с развитием хирургических технологий расширились показания для ангиопластических операций при панкреатодуоденальных резекциях (ПДР), выполняемых по поводу злокачественных опухолей этой анатомической области. По данным ряда авторов, ангиопластика при ПДР применяется примерно в 20 % случаев [1]. В то время как резекция и пластика верхней брыжеечной и воротной вен прочно вошла в практику хирургов и в настоящее время является рутинно выполняемой операцией, целесообразность резекции верхней брыжеечной артерии остается предметом дискуссии. Это обусловлено не столько техническим усложнением операции, сколько неудовлетворительными непосредственными и отдаленными результатами. При данных вмешательствах остаются высокими уровень послеоперационных осложнений и летальность при достаточно скромных показателях общей и безрецидивной выживаемости [2].
В современной литературе сообщения о серийных резекциях верхней брыжеечной артерии немногочисленны [1, 3]. По данным J. Santhalingam et al. (2017), проанализировавших в рамках обзора, 10 726 операций за период с 1978 по 2013 г., доля вмешательств, сопровождавшихся резекцией артерий, составила 0,65 % (70 наблюдений) [4]. Ограниченность наблюдений чрезвычайно затрудняет возможность проведения метаанализа для оценки истинных результатов общей выживаемости. По сообщениям D. Dunne et al. (2016), медиана выживаемости при ПДР с ангиопластикой составляет 12–24 мес, 5-летняя выживаемость – 0–15 % [5]. С другой стороны, применение мультидисциплинар-ного подхода с использованием современных схем лекарственного лечения сопровождается сравнимыми показателями общей выживаемости, что определяет сдержанное отношение специалистов к выполнению ангиопластических панкреатодуоденальных резекций.
Цель исследования – оценить непосредственные и отдаленные результаты выполнения панкреатодуоденальных резекций с пластикой различных артерий, выполненных в нашем центре.
Материал и методы
В период с 2014 по 2019 г. на базе ГБУЗ ООД г. Пензы было выполнено 89 ПДР и панкреато-дуоденэктомий (ПДЭ) по поводу злокачественных опухолей периампулярной локализации. Оперированы 50 (56,2 %) мужчин и 39 (43,8 %) женщин. Возрастной диапазон составил от 37 до 79 лет, средний возраст – 63,1 ± 8,2 года. Распределение больных в зависимости от диагноза было следующим: протоковая карцинома поджелудочной железы – 51 (57,2 %), рак двенадцатиперстной кишки – 25 (28,1 %), рак большого дуоденального сосочка – 9 (10,1 %), рак дистального отдела холедоха – 2 (2,2 %), нейроэндокринные опухоли головки поджелудочной железы – 2 (2,2 %). Ан-гиопластических операций выполнено 18 (20,2 %), из них 7 (7,8 %) пациентам выполнено 8 резекций артерий, в 1 наблюдении резецированы 2 артерии одновременно.
Выполнялись следующие варианты резекций артерии: циркулярная резекция печеночной артерии (ПА) с прямым анастомозом – в 2 случаях;
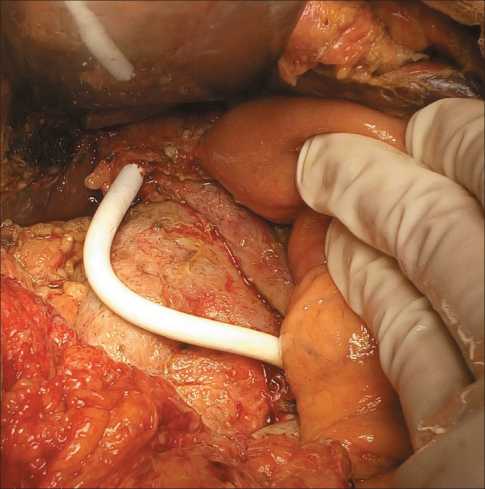
Рис. 1. Резекция правой печеночной артерии с протезированием
Fig. 1. Resection of the right hepatic artery with prosthesis implantation протезирование ПА – в 2 (рис. 1); циркулярная резекция верхней брыжеечной артерии с прямым анастомозом – в 2; протезирование верхней брыжеечной артерии – в 1 (рис. 2); резекция верхней брыжеечной артерии с заплатой – в 1 наблюдении (рис. 3). Из 7 пациентов, перенесших резекцию артерии, панкреатоэктомия выполнена – 3, ПДР – 4 больным. Шесть операций проведено по поводу протоковой карциномы головки поджелудочной железы, 1 – по поводу аденокарциномы двенадцатиперстной кишки. Распределение по стадиям опухолевого процесса, с учетом патоморфологи-ческого исследования операционного материала: II стадия – 2 больных; III стадия – 3; IV стадия – 2 пациента. Четвертая стадия была констатирована в связи с метастатическим поражением парааорталь-ных лимфатических узлов по данным послеоперационного гистологического исследования.
Результаты и обсуждение
У 7 пациентов, перенесших резекцию артерии, послеоперационные осложнения развились в 5 (71,4 %) случаях (таблица). В группе больных (n=71), которым были выполнены операции без пластики артерии и/или вены, осложнения возникли в 29 (40,8 %) наблюдениях. Различия между группами не являются статистически значимыми (р=0,229). Структура послеоперационных осложнений представлена в таблице.
Таким образом, мы не отметили значимого возрастания частота послеоперационных осложнений при выполнении артериопластических операций по сравнению со стандартными вмешательствами. Большая доля пациентов с осложнениями в
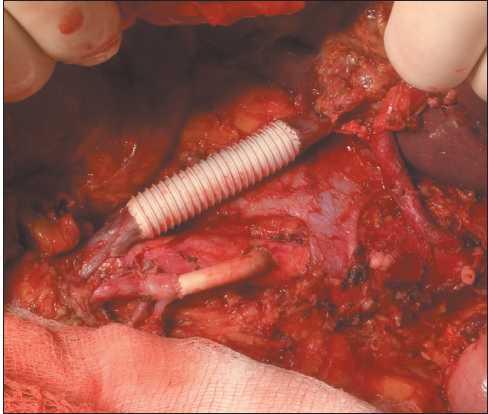
Рис. 2. Одномоментная резекция и протезирование верхних брыжеечных сосудов с переключением устья артерии Fig. 2. Simultaneous resection and prosthesis implantation of the superior mesenteric vessels with switching the orifice of the artery
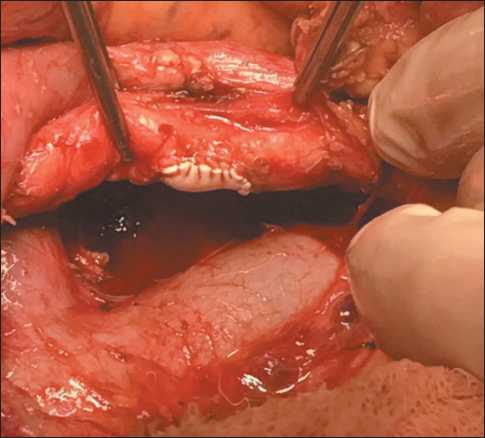
Рис. 3. Краевая резекция верхней брыжеечной артерии с заплатой
Fig. 3. Marginal resection of the superior mesenteric artery with a patch ангиопластической группе может быть объяснена слишком малой выборкой. По данным литературы, послеоперационные осложнения после ПДР/ПДЭ, включая стандартные радикальные вмешательства, наблюдаются в 15–80 % случаев [6].
Послеоперационная летальность при артерио-пластических вмешательствах отмечена в 1 из 7, при стандартных – в 3 из 71 случая, что составило 14,3 % и 4,2 % соответственно (р=0,319), различия статистически незначимы. Умерший пациент перенес ПДЭ с одномоментным протезированием верхней брыжеечной артерии и воротной вены.
Таблица/table
Структура послеоперационных осложнений structure of postoperative complications
|
Осложнение/ Complication |
Стандартные операции (n=71)/ Standard surgery (n=71) |
Артериопластические операции (n=7)/ Arterioplasic surgery (n=7) |
|
Анастомозит (гастроэнтероанастомоз)/ Anastomositis (gastrointestinal anastomosis) |
3 (4,2 %) |
1 (14,3 %) |
|
Внутрибрюшное кровотечение/Intraabdominal bleeding |
– |
1 (14,3 %) |
|
Гастростаз/Gastrostasis |
3 (4,2 %) |
– |
|
Желудочное кровотечение/Stomach bleeding |
3 (4,2 %) |
– |
|
Кровотечение из панкреатикоеюноанастомоза/ Bleeding from pancreaticojejunoanastomosis |
1 (1,4 %) |
– |
|
Мезентериальный тромбоз/Mesenterial arterial thrombosis |
1 (1,4 %) |
– |
|
Некроз левой доли печени/Necrosis of the left liver lobe |
– |
1 (14,3 %) |
|
Несостоятельность желчного анастомоза/ Billary-intestinal anastomosis leakage |
4 (5,6 %) |
– |
|
Панкреонекроз/Pancreonecrosis |
2 (2,8 %) |
– |
|
Пептическая язва анастомоза/Gastrointestinal anastomosis ulcer |
2 (2,8 %) |
– |
|
Печеночная недостаточность/Liver failure |
1 (1,4 %) |
1 (14,3 %) |
|
Пневмония/Pneumonia |
2 (2,8 %) |
– |
|
Секреторная диарея/Secretory diarrhea |
1 (1,4 %) |
– |
|
Фистула В/Pancreaticointestinalanastomosis fistula type В |
2 (2,8 %) |
– |
|
Фистула С/Pancreaticointestinalanastomosis fistula type C |
4 (5,6 %) |
– |
|
Эвентрация/Eventration |
– |
1 (14,3 %) |
|
Всего/Total |
29 (40,8 %) |
5 (71,4 %) |
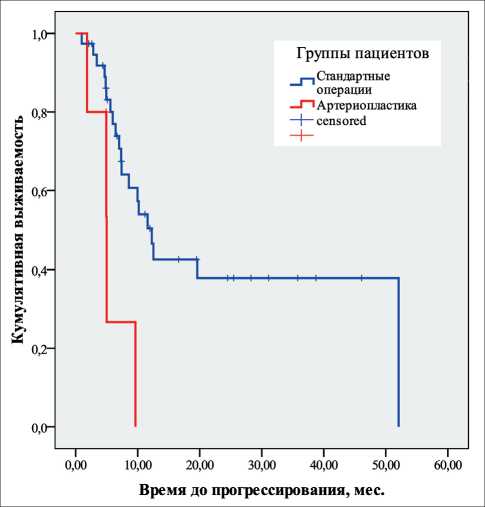
Рис. 4. Безрецидивная выживаемость, Kaplan–Meier
Fig. 4. Disease-free survival, Kaplan–Meier
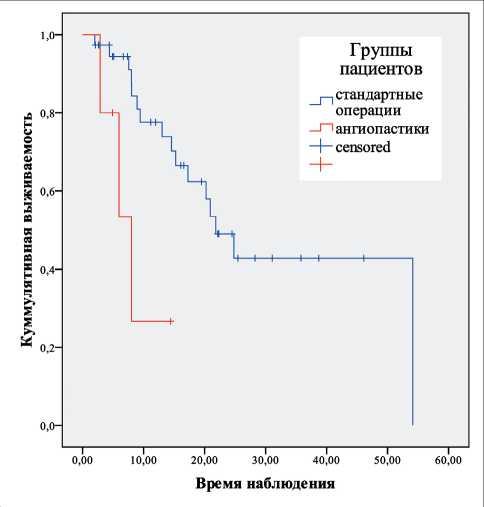
Рис. 5. Общая выживаемость, Kaplan–Meier
Fig. 5. Overall survival, Kaplan–Meier
В послеоперационном периоде развился некроз анатомической левой доли печени ввиду множественной тромбоэмболии из бассейна верхней брыжеечной вены, при этом осложнений со стороны артериального протеза не наблюдалось. После стандартных операций умерло 3 пациента, из них один от мезентериального тромбоза на фоне выраженного атеросклероза, 2 – от панкреонекроза.
Отдаленные результаты проанализированы только у пациентов с протоковой карциномой поджелудочной железы. Установлено, что медиана безрецидивной выживаемости после артериопла-стических операций составила 5,0 мес (95 % ДИ 2,4–7,6 мес). Аналогичный показатель при стандартных операциях равнялся 12,3 мес (95 % ДИ 9,2–15,4 мес). Различия между группами являются статистически значимыми (log-rank test, p=0,011). При стандартных операциях 3-летняя безреци-дивная выживаемость составила 37,9 ± 9,3 %, в то время как при артериопластических вмешательствах не наблюдалось годичной безрецидивной выживаемости (рис. 4). Таким образом, данный показатель при ПДР с артериопластикой значимо хуже, чем при стандартных операциях. По данным J. Santhalingam et al. (2017), медиана безрецидив-ной выживаемости в группе артериопластических вмешательств варьировала от 7,5 до 11,5 мес, что сравнимо с показателями выживаемости при проведении химиотерапии [4].
Медиана общей выживаемости при артериопла-стических операциях составила 8,0 мес (95 % ДИ
Список литературы Резекция артерий в хирургии рака поджелудочной железы: опыт одного учреждения
- Hackert T., Schneider L., Buchler M.W. Current State of Vascular Resections in Pancreatic Cancer Surgery. Gastroenterol Res Pract. 2015; 2015: 120207. DOI: 10.1155/2015/120207
- Marangoni G., O'Sullivan A., Faraj W., Heaton N., Rela M. Pancreatectomy with synchronous vascular resection-an argument in favour. Surgeon. 2012 Apr; 10(2): 102-6. DOI: 10.1016/j.surge.2011.12.001
- Klaiber U., Mihaljevic A., Hackert T. Radical pancreatic cancer surgery-with arterial resection. Transl Gastroenterol Hepatol. 2019 Feb 3; 4: 8. DOI: 10.21037/tgh.2019.01.07
- Jegatheeswaran S., Baltatzis M., Jamdar S., Siriwardena A.K. Superior mesenteric artery (SMA) resection during pancreatectomy for malignant disease of the pancreas: a systematic review. HPB (Oxford). 2017 Jun; 19(6): 483-490. DOI: 10.1016/j.hpb.2017.02.437
- Dunne D., Kleeff J., Yip V., Halloran C., Ghaneh P., Neoptolemos J. Arterial Resection in Pancreatic Cancer. Pancreatic Cancer. 2016 Jan: 1-16. DOI: 10.1007/978-1-4939-6631-8_72-1
- Ho C.K., Kleeff J., Friess H., Buchler M.W. Complications of pancreatic surgery. HPB (Oxford). 2005; 7(2): 99-108. DOI: 10.1080/13651820510028936
- Gong Y., Zhang L., He T., Ding J., Zhang H., Chen G., Zhang D., Wu Z., Chen Q., Fan H., Wang Q., Bie P., Wang H. Pancreaticoduodenec-tomy combined with vascular resection and reconstruction for patients with locally advanced pancreatic cancer: a multicenter, retrospective analysis. PLoS One. 2013 Aug 2; 8(8): e70340. 10.1371/journal. pone.0070340. DOI: 10.1371/journal.pone.0070340


