Резекция бифуркации трахеи в лечении больных немелкоклеточным раком легкого (обзор литературы)
Автор: Дадыев Ислам Артурович, Давыдов Михаил Михайлович, Чекини Антонио Константинович, Анисимов Михаил Александрович, Герасимов Сергей Семенович, Шогенов Мурат Сергеевич, Ахмедов Парвин Илгарович, Канзапетов Марат Робертович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 т.17, 2018 года.
Бесплатный доступ
В течение последних нескольких лет значительные успехи в хирургической технике, анестезиологическом и реанимационном пособиях, а также дифференцированный отбор пациентов привели к улучшению непосредственных и отдаленных результатов лечения больных немелкоклеточным раком легкого (НМРЛ) с распространением на бифуркацию трахеи. В соответствии с действующими критериями отбора пациенты с метастатически пораженными контралатеральными лимфатическими узлами (корень легкого, аортальное окно, паратрахеальная зона) нуждаются в химио- или химиолучевой терапии с последующей оценкой динамики процесса и принятием решения о дальнейшем лечении. Данная группа пациентов считается потенциально неоперабельной. Технические сложности выполнения операций и реанимационно-анестезиологических манипуляций ставят вмешательства с резекцией бифуркации трахеи, бронхов и сосудов в разряд сложнейших. Подобные операции должны проводиться у тщательно отобранных пациентов и только в центрах, имеющих большой опыт подобных операций, что позволяет снизить количество интра- и послеоперационных осложнений до минимума.
Местно-распространенный рак легкого, бронхопластические операции, каринальная резекция, хирургическое лечение, выживаемость, пневмонэктомия
Короткий адрес: https://sciup.org/140254219
IDR: 140254219 | УДК: 616.24-08:616.232-089 | DOI: 10.21294/1814-4861-2018-17-5-94-105
Текст обзорной статьи Резекция бифуркации трахеи в лечении больных немелкоклеточным раком легкого (обзор литературы)
Рак лёгкого занимает лидирующее место по показателям заболеваемости злокачественными новообразованиями. В течение одного года в мире выявляется примерно 1,8 млн впервые заболевших. Смертность при этом заболевании составляет бо‑ лее чем 1,59 млн человек в год (19,4 % от смерт‑ ности при онкозаболеваниях и около 3 % от общей смертности) [1]. В 2015 г. в России в структуре смертности доля умерших от злокачественных но‑ вообразований составила 15,5 % (296 476 случаев). Каждая пятая злокачественная опухоль, диагности‑ руемая у мужчин (21,3 %), локализуется в органах дыхания, у женщин заболеваемость почти в 5 раз ниже (4,1 %). Несмотря на это, среднегодовой темп прироста заболеваемости злокачественными ново‑ образованиями трахеи, бронхов и легких у женщин за период 2004–14 гг. составил 0,56 %, а прирост заболеваемости – 5,83 % (стандартизованные пока‑ затели – мировой стандарт) [2]. По данным WHO/ GLOBOCAN за 2012 г., в структуре смертности от злокачественных новообразований рак легкого у мужчин занимает первое место, у женщин – второе, уступая раку молочной железы 0,9 % [1].
В первый год после установления диагноза рак легкого погибает 51,4 % больных [3]. Соот‑ ношение «заболеваемость – смертность» при раке лёгкого одно из самых неблагоприятных – умирают 95,6 % заболевших [4–6]. Проблема рака легкого перестала быть только медицинской и приобрела социальный характер, что обусловлено быстрым ростом заболеваемости, большими затратами на диагностику и лечение и неудовлетворительными отдаленными результатами лечения.
Эффективность лечения рака легкого зависит от стадии болезни, возможности проведения опе‑ ративного вмешательства и его радикальности. В 2014 г. в России рак легкого диагностирован у 53 697 пациентов, при этом I–II стадии заболевания составили 26 %, III стадия – 31 %, IV стадия – 40 %. Только у 10–20 % из вновь заболевших возможно выполнение операции, при этом радикальное хирургическое лечение возможно не более чем у 70–80 % больных [5–9].
Скрининг рака легкого на сегодняшний день до‑ статочно сомнителен. Выполнение рентгенографии у пациентов высокого риска (курильщики, наслед‑ ственность) не снижает смертность, а выполнение СКТ как более чувствительного метода часто дает ложноположительные результаты. В связи с тем, что существующие методы диагностики рака легкого не позволяют увеличить количество пациентов с ранними стадиями, а также учиты‑ вая невысокую эффективность консервативной терапии, необходимо уменьшать категорию так называемых «иноперабельных» больных НМРЛ III стадии, за счет внедрения комбинированных, расширенно‑комбинированных оперативных вмешательств, которые, в свою очередь, позво‑ лят рассчитывать на повышение радикальности лечения и, как следствие, улучшение отдаленных результатов [10–13].
Достойной альтернативы хирургическому лече‑ нию рака легкого на данный момент нет. Медиана выживаемости у неоперабельных пациентов после химиотерапии в самостоятельном режиме состав‑ ляет около 6,5 мес, 1‑летняя выживаемость доходит до 25 %. Медиана выживаемости у больных неопе‑ рабельным раком легкого после лучевой терапии составляет около 10 мес, 5‑летняя выживаемость – не более 5 %. При комбинированной химиолучевой терапии 5‑летняя выживаемость повышается до 20–30 % [14–17].
В исследовании Н.Е. Левченко (2016) анализу подверглись больные раком легкого III стадии, которым выполнялись экономные бронхопла‑ стические лобэктомии и пневмонэктомии. При бронхопластической лобэктомии одногодичная безрецидивная выживаемость составила 84,6 % при пневмонэктомиях – 88,9 %, 3‑летняя безре‑ цидивная выживаемость – 47,1 и 55,3 %, 5‑летняя безрецидивная выживаемость – 34,4 и 35,2 % соот‑ ветственно. Медиана безрецидивной выживаемо‑ сти составила 23,4 и 41,0 мес. Разница оказалась статистически недостоверной (р=0,39). Все это соотносимо с данными других отечественных и зарубежных авторов [18, 19]. Основываясь на этом, можно сделать вывод о том, что бронхоангио‑ пластические операции являются альтернативой пневмонэктомии при НМРЛ III стадии при нали‑ чии противопоказаний, обусловленных низкими функциональными резервами [20].
Существует ряд подобных исследований, где показаны результаты экономных трахео‑, бронхо‑, ангиопластических операций, которые не уступа‑ ют по отдаленным результатам пневмонэктомии, многие хирурги выполняют эти операции тора‑
Òàблицà 1
Îтдàлåнныå ðåзóльтàты êîмбиниðîвàнныõ пнåвмîнэêтîмиé ñ ðåзåêциåé бифóðêàции тðàõåи ó бîльныõ ÍMÐЛ (Ò3–4)
|
Авторы, год публикации |
Число больных |
5‑летняя выживаемость |
|
Detterbeck F.C. et al., 2003 [27] |
327 |
26,0 % |
|
Давыдов М.И. и др., 2005 [28] |
39 |
23,5 % |
|
Харченко В.П. и др., 2005 [29] |
205 |
35,4 % |
|
Roviaro G.C. et al., 2006 [30] |
53 |
33,4 % |
|
Трахтенберг А.Х. и др., 2008 [31] |
92 |
26,9 % |
|
Yıldızeli et al., 2008 [24, 26] |
92 |
42,5 % |
|
Marc de Perrot et al., 2005 [32] |
119 |
44 % |
|
Mitchell et al., 2001 [33] |
60 |
42 % |
|
Kazumichi et al., 2004 [34] |
35 |
28,3 % |
|
Порханов и др., 2002 [35] |
231 |
24,7 % |
|
Regnard J.F. et al., 2002 [36] |
65 |
26,5 % |
коскопически [21, 22]. Однако к их проведению существуют определенные показания. Наличие метастатического поражения бронхопульмональ‑ ных лимфоузлов и/или корня легкого является по‑ казанием к пневмонэктомии, которая обеспечивает больший радикализм хирургического вмешатель‑ ства. Пятилетняя выживаемость после экономной лобэктомии и расширенной пневмонэктомии при поражении лимфатических узлов средостения со‑ ставляет 35,8 и 53,9 %. Необходимо также учиты‑ вать и тот факт, что имеется несовпадение микро‑ и макроскопических границ опухолевого роста – разница по некоторым данным составляет до 20 мм. Все это диктует необходимость оценивать целесообразность выполнения экономных бронхо‑ пластических операций в каждом случае, так как нерадикальные R1 резекции нецелесообразны, пя‑ тилетняя выживаемость после R1‑резекции ниже, чем R0 [23, 24].
D. Grunewald et al. [25] считают потенциаль‑ но операбельными больных НМРЛ III стадии с поражением легочной артерии (в том числе интраперикардиальным), трахеи, карины, левого предсердия, верхней полой вены и метастазами в лимфатические узлы уровня N3. По мнению этих авторов, неоперабельными являются случаи при диссеминации по плевре и перикарду, диффузное поражение средостения, инфильтрация сердца (ис‑ ключая левое предсердие), поражение позвонков и врастание в пищевод.
На данный момент резекция бифуркации тра‑ хеи в специализированных клиниках не является эксклюзивной. В литературе за последние 15 лет представлены публикации, в которых описан опыт подобных вмешательств от нескольких до трех‑ сот и более [24, 26–37]. Нередко выполняются комбинированные операции с резекцией и проте‑ зированием верхней полой вены, подключичных артерий. Есть отдельные публикации о реопера‑ циях с резекцией и пластикой бифуркации трахеи при рецидиве рака легкого. Ряд авторов указыва‑ ют, что отдаленные результаты лечения больных после выполнения обычной пневмонэктомии и пневмонэктомии с резекцией бифуркации трахеи не имеют существенной разницы и остаются удо‑ влетворительными: 5‑летняя выживаемость после выполнения пневмонэктомии с резекцией бифурка‑ ции трахеи колеблется от 17 до 44 % в зависимости от поражения лимфатических узлов средостения и радикальности выполненной операции (табл. 1).
Технические сложности выполнения операций и реанимационно‑анестезиологических манипу‑ ляций ставят операции с резекцией бифуркации трахеи, бронхов и сосудов в разряд сложнейших. Тем не менее необходимость выполнения этого типа вмешательств достаточно высока, что не‑ однократно подчеркивается в современных пу‑ бликациях ведущих отечественных и зарубежных клиник. Одним из наиболее сложных разделов торакальной онкохирургии является выполнение трахеобронхопластических операций с резекцией бифуркации трахеи. Этот тип вмешательства тре‑ бует как высокой хирургической техники, так и высококвалифицированного анестезиологического и реанимационного обеспечения, что позволяет снизить количество интра‑ и послеоперационных осложнений до минимума.
Разница послеоперационных осложнений обусловлена не только несовершенством техники исполнения (по данным ряда авторов, частота не‑ состоятельности бронхиального шва составляет порядка 15–20 %), но и техническим оснащением клиники. Большая разница в непосредственных и отдаленных результатах лечения больных НМРЛ с поражением бифуркации трахеи говорит о том, что эта проблема остается актуальной и необходимы пути оптимизации результатов лечения.
Особенности анестезиологического обеспечения
Анестезиологическое обеспечение при резекции бифуркации трахеи является сложной задачей. Ха‑ рактер операции диктует необходимость изоляции и однолегочной вентиляции легких, высокочастот‑ ной вентиляции лёгких, материально‑технической готовности к лечению массивной кровопотери. Стратегией проведения анестезии при торакаль‑ ных операциях в целом и резекции бифуркации трахеи в особенности является нацеленность на максимально раннюю активизацию, перевод на самостоятельное дыхание, активная профилакти‑ ка повреждения здорового лёгкого, что возможно реализовать только при хорошем обезболивании и управляемости всеми компонентами анестезии.
Общепризнанным считается мультимодальный подход к обезболиванию, когда аналгезия дости‑ гается назначением ряда препаратов с различным механизмом действия (например, ингаляционный наркоз + опиоиды + НПВС + неопиоидные цен‑ тральные анальгетики). В то же время комбинация регионарных методик в сочетании с неглубоким ингаляционным наркозом считается наиболее уни‑ версальной для большинства высокотравматичных операций. При этом принцип «мультимодальности» применяется к обеим методикам: в эпидуральный катетер, устанавливаемый на сегментарном уровне (ThIV–VI при торакотомии, ThI–III при стернотомии), вводится смесь низкоконцентрированного мест‑ ного анестетика (0,2 % ропивакаин) в сочетании с опиоидом фентанилом (2 мкг/мл) и низкими дозами адреналина 0,01 % (2 мкг/мл). Каждый из препаратов имеет низкую концентрацию и, соот‑ ветственно, вероятность развития побочных эф‑ фектов и усиливает обезболивающий эффект друг друга на сегментарном уровне спинного мозга. В то же время адреналин, действуя локально благодаря воздействию на альфа‑адренорецепторы, способен не только к самостоятельной анальгетической активности, но и, суживая сосуды эпидурального пространства, предотвратить резорбцию местного анестетика и фентанила в системный кровоток, что проявляется отсутствием седации и пролонгирова‑ нием действия местного анестетика. Низкие дозы местного анестетика ропивокаина и его свойства («дифференцированная» блокада) определяют отсутствие моторного блока на соответствующем сегментарном уровне, а симпатическая блокада оказывается не тотальной и легко преодолимой при введении низких доз вазопрессоров, а также не препятствует реализации защитных механизмов (в том числе «централизации кровообращения») при массивной кровопотере. Лечебное воздействие грудной эпидуральной аналгезии следует исполь‑ зовать и после операции, продолжив введение обезболивающей смеси с помощью одноразовых эластомерных помп с регулируемой скоростью. Сочетание грудной эпидуральной аналгезии с неглубоким ингаляционным наркозом на основе современных препаратов (севофлуран, десфлуран) называют мультимодальной комбинированной ане‑ стезией, которую следует признать оптимальной методикой при травматичных вмешательствах то‑ ракотомным или стернотомным доступом. Данная методика запатентована «РОНЦ им. Н.Н. Блохина» как медицинская технология в 2010 г. Этот метод позволяет экстубировать пациентов на операцион‑ ном столе и максимально рано активизировать без побочных эффектов.
Абсолютными противопоказаниями к катете‑ ризации эпидурального пространства являются коагулопатия любого происхождения, выражен‑ ная тромбоцитопения (50 и менее), шок любой этиологии и признаки инфекции в месте пред‑ полагаемой пункции. При невозможности уста‑ новки эпидурального катетера, при торакотомии альтернативной методикой регионарной анестезии признаётся грудная паравертебральная блокада на стороне операции. При условии правильной уста‑ новки катетера грудная паравертебральная блокада способна обеспечить хорошее обезболивание на всех этапах, при потенциально лучшем профиле безопасности: отсутствие или меньшая частота артериальной гипотензии, меньшая потенциальная опасность гематомы. Для успешной установки паравертебрального катетера может применяться нейростимулятор. «Золотым стандартом» в мире является ультразвуковая навигация, которая в России малодоступна. В ряде отечественных и за‑ рубежных клиник практикуется установка катетера хирургом под прямым визуальным контролем в конце операции, что может служить альтернативой послеоперационному обезболиванию.
Одной из важнейших задач при выполнении этого типа оперативного вмешательств является обеспечение адекватной искусственной вентиля‑ ции легких и поддержания нормального газового состава артериальной крови. Резекция бифуркации трахеи с опухолью и восстановление ее целостности сопровождаются разгерметизацией дыхательного контура, при этом традиционная ИВЛ невозможна или крайне затруднительна. До вскрытия просвета трахеи отключение легкого может реализовываться различными методами, в зависимости от степени изменения анатомии трахеи и главных бронхов и необходимости изоляции здорового лёгкого (кровь, мокрота и т. д.): двухпросветной (Карленса, Робертшоу) или однопросветной (Гордона – Гри‑ на, Макинтош – Литердейл) эндобронхиальной трубкой. Непосредственно перед вскрытием про‑ света трахеи манжеты эндобронхиальной трубки сдуваются, дистальная часть трубки подтягивается в трахею и через бронхиальный канал, в главный бронх здорового лёгкого заводится катетер для высокочастотной вентиляции. Высокочастотная вентиляция легких проводится с частотой 100–120 в 1 мин и рабочим давлением 0,5–2 атм.
Применение высокочастотной вентиляции (ВЧ) значительно улучшает условия оперирования, но требует постоянного внимания: подвижный катетер не должен изменять своего положения во время операции, поэтому иногда целесообраз‑ но временно подшивать катетер к дистальному участку резецируемой трахеи или бронха. Кроме того, следует убедиться, что контур открытый, т.е. выдох возможен. Если при проведении ВЧ ИВЛ выдох будет затруднён, то это немедленно вызовет перераздувание лёгкого и баротравму. Значительно повышаются требования к гемостазу окружающих тканей, так как следует избегать попадания даже незначительного количества крови в бронхиальное дерево. После формирования трахеобронхиаль‑ ного анастомоза ВЧ ИВЛ прекращают, раздувают трахеальную манжету эндобронхиальной трубки и возобновляют традиционную вентиляцию лёгких. Перед завершением операции выполняется фибро‑ бронхоскопия для оценки состояния анастомоза и санации.
Профилактика повреждения здорового лёгкого достигается применением пневмонпротективных режимов ИВЛ (снижение дыхательного объёма до 5 мл/кг веса тела при однолёгочной вентиляции, положительное давление в конце выдоха, рекру‑ тирующие манёвры), ограничительной стратегией инфузионной терапии и активной респираторной терапией после операции (побуждающая спироме‑ трия, ранняя вертикализация и т. д.).
Современная комбинированная анестезия является управляемой, позволяет добиться бы‑ строго безболезненного пробуждения и перево‑ да пациента на самостоятельное дыхание, что предотвращает резкие подъемы эндотрахеального давления и вероятность повреждения анастомоза. Однако участие анестезиолога в лечении данных больных значительно шире и включает период предоперационного планирования, интраопераци‑ онного управления и создания условий для ранней реабилитации.
Хирургическое лечение
Исторический очерк
Первые публикации, относящиеся к хирургии бифуркации трахеи, датируются 1949 г., когда в экс‑ перименте Grindlay et al. выполнили пневмонэкто‑ мию справа с резекцией бифуркации у собаки [39]. Ehrlich et al. в 1952 г. сообщили о пневмонэктомии слева с резекцией бифуркации трахеи и анасто‑ мозом правого главного бронха трахеей по типу «конец в бок» у собаки [40]. С этого времени был выполнен ряд подобных операций с реконструкци‑ ей бифуркации трахеи у животных [41–49].
Первые упоминания о резекции бифуркации трахеи у человека относятся к 1950 г., когда Abbott et al. сообщили о 5 правосторонних пнев‑ монэктомиях с краевой резекцией бифуркации трахеи, 2 пациента погибли [46]. До этого времени все больные с распространением опухоли на би‑ фуркацию трахеи считались неоперабельными. В 1955 г. Björk et al. из левого торакотомного доступа выполнили несколько пневмонэктомий с резекци‑ ей бифуркации трахеи. Abbey‑Smith и Nigan [47, 48] позже описали аналогичный левосторонний доступ к бифуркации трахеи в 1979 г. у пациентов с опухолевым поражением проксимальных отделов левого главного бронха. В 1963 г. Grillo [49] выпол‑ нил резекцию киля карины и нижней трети трахеи протяженностью 4 см с формированием новой бифуркации трахеи у пациента с аденокистозным раком. В 1966 г. Mathey et al. [50] сообщили о результатах лечения 5 пациентов, которым была выполнена резекция бифуркации трахеи из торако‑ томного доступа по поводу злокачественных ново‑ образований легкого. Однако авторы полагали, что стернотомия может быть предпочтительнее. Трем пациентам была выполнена пневмонэктомия, 2 – частичная резекция легких.
Опыт каринальных резекций и реконструкций рос медленно. С 1974 по 1982 г. было опубликовано всего несколько работ, из них наиболее известны: Eschapasse et al. [51], Perelman et al. [52] и Grillo et al. [53], в которых сообщалось о результатах лече‑ ния в общей сложности 84 больных, перенесших резекцию и реконструкцию бифуркации трахеи. Интраоперационная летальность в то время до‑ стигала 30–40 %, основными осложнениями яв‑ лялись острый респираторный дистресс‑синдром, постпневмонэктомический отек легкого некардио‑ генной природы. Mathisen считал это осложнение результатом баротравмы, причиненной во время операции [54]. Изменения условий проведения анестезиологического пособия, а именно более внимательное определение объемов вентиляции и давления в воздухоносных путях, а также оптими‑ зация реанимационного пособия позволили сокра‑ тить ближайшую послеоперационную смертность до 10 % и менее [55–57].
Хирургический доступ
Большинство хирургов отдавали предпочтение боковой торакотомии [49, 51, 53, 58, 59]. Левая бо‑ ковая торакотомия использовалась при поражении левого главного бронха и киля карины, с неболь‑ шим переходом на трахею [50, 51, 53, 60, 61]. В некоторых работах использовалась левая заднебо‑ ковая торакотомия [48, 62]. Срединная стернотомия для доступа к бифуркации трахеи впервые описана F.A. Goeltz [63] в 1907 г. для удаления инородных тел. M. Maeda et al. [61] добавили левую переднебо‑ ковую торакотомию к стернотомии для улучшения доступа. Grillo [53] использовал двустороннюю торакотомию с поперечной стернотомией (разрез «раскладушка») для свободного доступа к килю и к обеим плевральным полостям, при сложных пора‑ жениях, особенно при вовлечении левого главного бронха, карины с высоким поражением трахеи.
При поражении правого главного бронха с пере‑ ходом на бифуркацию трахеи используется стан‑ дартная передняя либо задняя боковая торакотомия справа. М.И. Давыдов и Б.В. Петровский отдавали предпочтение переднему боковому доступу по причине его практически полной универсальности, позволяющей свободно манипулировать на всех элементах корня легкого, средостения, грудной стенки и перикарда [64, 65]. Ряд авторов при по‑ добных вмешательствах предпочитают задний доступ [66].
При опухолевом поражении левого главного бронха с переходом на бифуркацию трахеи доступ к килю карины из левого переднебокового доступа затруднен из‑за с анатомических особенностей – дуга аорты и левые подключичная и общая сонная артерии располагаются непосредственно над левым главным бронхом и бифуркацией трахеи. В связи с чем были разработаны некоторые модификации, например: левое легкое мобилизуется полностью из стандартного левостороннего переднебокового доступа, выполняется пневмонэктомия с лимфо‑ диссекцией, затем выполняется передняя боковая торакотомия справа и больному резецируют би‑ фуркацию трахеи с формированием анастомоза между правым главным бронхом и трахеей по типу «конец в конец» из правой плевральной по‑ лости [57]. Также при необходимости выполнения резекции левого главного бронха и бифуркации трахеи используются «разрез раскладушка» [53] и стернотомия в разных модификациях – полная про‑ дольная стернотомия, стерно‑торакотомия. Однако при выполнении пневмонэктомии слева с резекцией бифуркации трахеи из стернотомного доступа так‑ же существует несколько возможных технических трудностей. Так, при наличии спаечного процесса в левой плевральной полости мобилизация легко‑ го из стернотомного доступа представляет собой большую техническую трудность; выполнение полноценной лимфодиссекции из стернотомного доступа может быть затруднительно в области зад‑ ней части корня легкого в связи с топографией серд‑ ца, а увеличение силы ретракции сердца вызывает нежелательные последствия в виде возникновения аритмии и нарушения гемодинамики вследствие гипотензии. Эти нежелательные последствия могут быть преодолены путем выполнения торакоскопии слева с полноценной лимфодиссекцией и мобили‑ зацией структур корня легкого [35].
Типы хирургических вмешательств
Лобэктомия, билобэктомия с резекцией би‑ фуркации трахеи; пневмонэктомия с резекцией бифуркации трахеи.
Типы резекции бифуркации трахеи
Краевая, клиновидная, циркулярная [35, 53].
Варианты трахео-бронхиальных анастомозов
При пневмонэктомии с резекцией бифуркации трахеи используется анастомоз «конец в конец» оставшегося главного бронха и трахеи.
При выполнении операций с сохранением одной или нескольких долей пораженного опу‑ холью легкого используется несколько вариантов анастомозов:
Верхняя лобэктомия справа с резекцией бифуркации трахеи
-
а. Анастомоз промежуточного бронха с трахеей «конец в конец», затем выполняется анастомоз трахеи с левым главным бронхом «конец в бок».
-
b. Обращенные друг к другу края просвета про‑ межуточного и левого главного бронхов клиновид‑ но иссекаются и по краям образовавшихся клиньев сшиваются друг с другом так, чтобы образовался один общий просвет, соответствующий диаметру трахеи. Затем накладывается второй типичный анастомоз по способу «конец в конец» с отрезком трахеи. Этот вариант соустья получил название «анастомоз‑штанишки» (рис. 1).
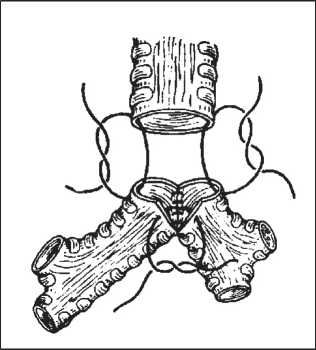
Рис. 1. Трахеобронхиальный «анастомоз-штанишки»
-
c. Анастомоз левого главного бронха с трахеей «конец в конец», далее формирование анастомоза промежуточного бронха с трахеей либо левым главным бронхом по типу «конец в бок» (рис. 2, 3) [35, 53].
Нижняя билобэктомия справа с резекцией бифуркации трахеи выполняется в случае опухолевого поражения промежуточного бронха либо нижнедолевого бронха с переходом на про‑ межуточный бронх, но без поражения правого верхнедолевого бронха и наличия конгломерата метастатически измененных лимфатических узлов области бифуркации трахеи с инфильтрацией киля карины (рис. 4).
Способы формирования межбронхиальных анастомозов
Формирование межбронхиального (трахеобронхиального) анастомоза по М.И. Давыдову (рис. 5):
– Этап 1. Сопоставление анастомозируемых концов хрящей бронхов двумя отдельными ли‑ гатурами, проводимыми через межхрящевые пространства у концов хрящей, без завязывания (лигатуры № 1 и 2).
– Этап 2. Соединение мембранозных частей бронхов отдельным непрерывным швом (лигатура № 3).
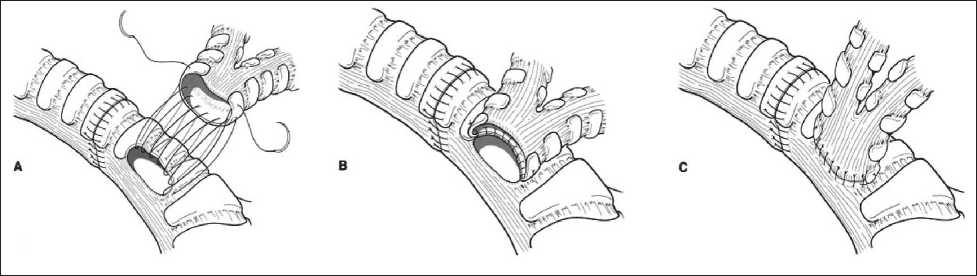
Рис. 2. Анастомоз промежуточного бронха с левым главным бронхом «конец в бок», который предварительно соединен с трахеей «конец в конец»
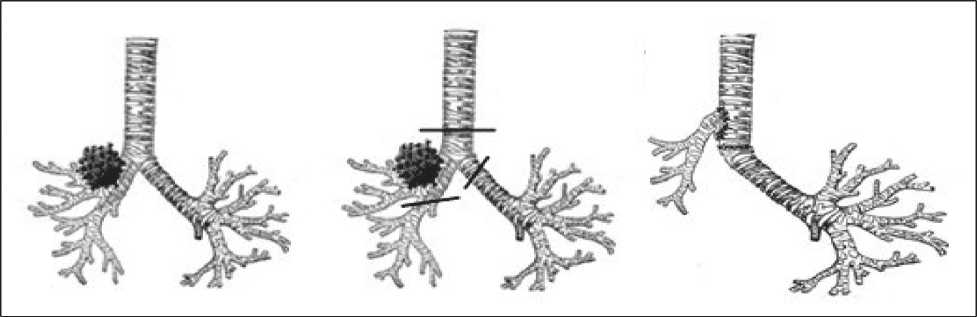
Рис. 3. Анастомоз промежуточного бронха с трахеей «конец в бок», который предварительно соединен с левым главным бронхом «конец в конец»
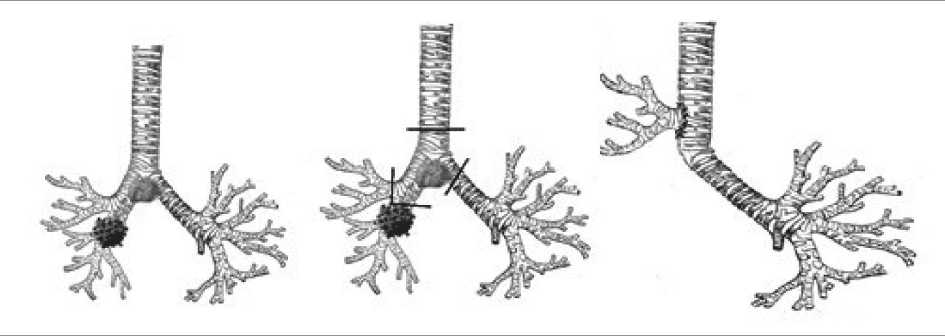
Рис. 4. Анастомоз между левым главным бронхом и трахеей по типу «конец в конец» и верхнедолевым бронхом с трахеей по типу «конец в бок», при нижней билобэктомии справа с циркулярной резекцией бифуркации трахеи
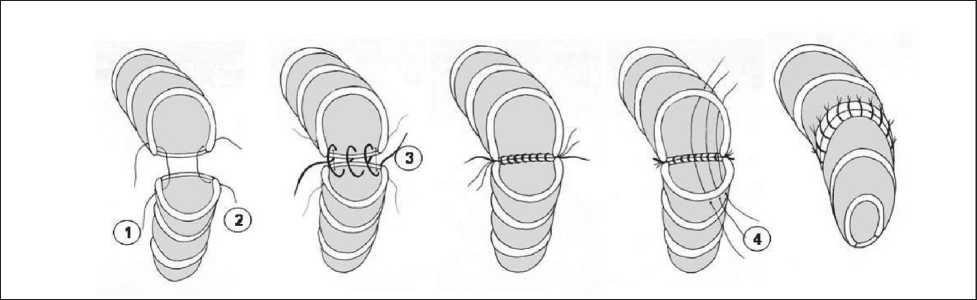
Рис. 5. Формирование межбронхиального (трахео-бронхиального) анастомоза по М.И. Давыдову
– Этап 3. Завязывание лигатур; сначала – ли‑ гатур № 1 и 2, анастомозирующих концы хрящей, затем – этих (уже завязанных) лигатур с концами лигатуры, соединяющей мембранозные части бронхов.
– Этап 4. Сопоставление хрящевых частей бронхов отдельными лигатурами (№ 4).
– Этап 5 . Завязывание лигатур, сопоставляю‑ щих хрящевые части бронхов с последующим укрытием зоны анастомоза лоскутом медиасти‑ нальной плевры.
Формирование межбронхиального анастомоза по Е.В. Левченко: разработан для трахео‑ бронхиального анастомоза после пневмонэктомии справа с циркулярной резекцией бифуркации трахеи. При его формировании накладывают от‑ дельные узловые швы на левую полуокружность анастомозируемых частей трахеи и бронха через межхрящевые промежутки трахеи и левого главно‑ го бронха (рис. 6). Накладывают отдельные узло‑ вые швы на правую половину анастомозируемых частей трахеи и бронха следующим образом: пер‑ вый шов накладывают через межхрящевую часть левого главного бронха и середину хрящевого полукольца трахеи; второй шов – через середину хрящевого полукольца левого главного бронха и межхрящевую часть трахеи. Чередуют швы. Ин‑ вагинируют при формировании анастомоза левый главный бронх в просвет трахеи на ширину хря‑ щевого полукольца по левой полуокружности, на 1/2, 1/3 ширины хрящевого полукольца по правой полуокружности анастомоза. Способ позволяет перераспределить часть нагрузки с правой по‑ луокружности анастомоза на левую, повысить надежность анастомоза.
У вышеперечисленных методик существуют разные модификации, например анастомоз по Ка‑ гану, Бежину и т.д. Некоторые авторы предлагают использование непрерывного циркулярного шва, однако недостатки этой техники (при нарушении целостности нити происходит полное разобщение соустья) не позволяют широко применять методику циркулярного анастомоза.
При несоответствии диаметров сопоставляе‑ мых бронхов для анастомоза «конец в конец» есть несколько способов устранения этих проблем:
– увеличение межшовного интервала между лигатурами на каудальной и краниальной культях бронха [49, 65]. Преимущество этой техники в ее технической простоте. К недостаткам можно отне‑ сти высокий риск несостоятельности анастомоза в случае большой разницы в диаметрах каудальной и краниальной культей бронхов;
– сужение бронха большего диаметра за счёт гофрирования мембранозной части трахеи, что достигается путём наложения П‑образных швов [67, 68];
– формирование анастомоза возможно с выпол‑ нением ротации трахеи. Суть метода заключается в том, что дистальный и проксимальный концы ротируются друг относительно друга на 30–60°, и это даёт возможность адаптировать анастомози‑ руемые участки за счёт растяжения мембранозной части [69, 70];
– косое пересечение бронха меньшего диаметра [71, 72]. Данная методика связана с повреждением полухрящевых колец и требует точного сопостав‑ ления слизистой оболочки сшиваемых бронхов во избежание выступания концов пересеченных хрящей в просвет анастомоза, при этом нередко ухудшаются процессы репарации и нарушается бронхиальная архитектоника;
– клиновидное иссечение хрящевой части брон‑ ха большего диаметра с последующим ушиванием [73]. При этом способе возникают определенные сложности в сопоставлении краев клиновидного дефекта, концы хрящей выступают в просвет и как следствие происходит нарушение эпителизации.
Кроме того, существует так называемый инва‑ гинационный способ, который использует принцип телескопа, когда хрящевая часть главного бронха проводится в просвет трахеи на 1–2 мм, а мембра‑ нозная сшивается по типу край в край, формиро‑ вание анастомоза достигается путем вкола иглы ближе к краю бронха большего диаметра и дальше от линии резекции бронха меньшего калибра с ин‑ вагинацией бронха меньшего диаметра в больший на одно хрящевое полукольцо. Предложена также методика с инвагинацией 2–3 полуколец. Неко‑ торые авторы относят к недостаткам описанной техники развитие послеоперационных стриктур [74, 75].
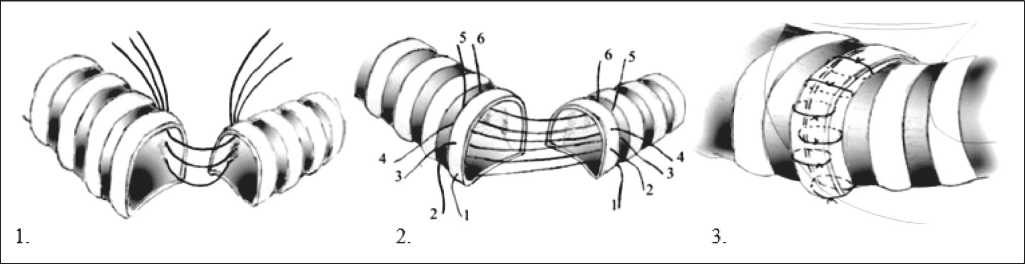
Рис. 6. Формирование межбронхиального анастомоза по Е.В. Левченко
Несмотря на широкое распространение рекон‑ структивных операций на бронхиальном дереве, в медицинской литературе мало данных по сравне‑ нию методик межбронхиальных анастомозов. Так, в работе E. Palade et al. [75] сравнивались 2 группы пациентов. В первой группе межбронхиальный анастомоз формировался по типу «конец в конец». Во второй группе использовался инвагинационный способ. В результате анализа достоверных разли‑ чий в группах выявлено не было.
Таким образом, при изучении российских и зарубежных публикаций, посвященных оценке от‑ далённых результатов лечения пациентов с немел‑ коклеточным раком легкого с распространением на бифуркацию трахеи, мы получили данные, что 5‑летняя выживаемость после лоб‑, билобэкто‑ мии с резекцией бифуркации трахеи достигается лишь у 45–48 % (в случае отсутствия поражения лимфатических узлов). Кроме того, есть ряд работ, которые сравнивают результаты лечения больных, где в одной группе выполнялась экономная лоб/ билобэктомия с резекцией бифуркации трахеи, в другой группе – пневмонэктомия. Так, например, в работе В.П. Харченко и др. (2008) сообщается, что 5‑летняя выживаемость пациентов, перенес‑ ших лоб/билобэктомию с резекцией бифуркации трахеи, составляет 42,5 ± 3,3 %, что почти в 2 раза
Список литературы Резекция бифуркации трахеи в лечении больных немелкоклеточным раком легкого (обзор литературы)
- Lung Cancer. Estimated Incidence, Mortality and Prevalence Worldwide in 2012. GLOBOCAN 2012 . URL: http://globocan. iarc.fr/Pages/fact_sheets_cancer.aspx (cited 20.04.2018).
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). М., 2017. 4-5, 131-132. .
- Федеральная служба государственной статистики Российской Федерации . URL: www.gks.ru/wps/wcm/connect/rosstat_main/rosstat/ru (cited 20.04.2018). . URL: www.gks.ru/wps/wcm/connect/rosstat_main/rosstat/en (cited 04/20/2018). ].
- Мерабишвили В.М. Злокачественные новообразования в мире, России, Санкт-Петербурге. СПб., 2007. 422. .
- Давыдов М.И., Полоцкий Б.Е. Рак лёгкого. М., 1994. 160. .


