Режим паклитаксел, ифосфамид, цисплатин (TIP) при несеминомных герминогенных опухолях неблагоприятного и промежуточного прогноза с неудовлетворительным снижением уровня онкомаркеров: исследование II фазы
Автор: Исраелян Эдгар Р., Трякин Алексей А., Румянцев Алексей А., Федянин Михаил Ю., Тюляндина Александра С., Проценко Светлана А., Пайчадзе Анна А., Бычков Юрий М., Юнаев Григорий С., Тюляндин Сергей А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 3 т.12, 2022 года.
Бесплатный доступ
Цель исследования: Оценка эффективности режима TIP (паклитаксел, ифосфамид, цисплатин) у пациентов c диссеминированными герминогенными опухолями при неудовлетворительном снижении уровня маркеров после первого курса ХТ. Материалы и методы: В многоцентровое нерандомизированное исследование II фазы вошли пациенты из 4 центров Российской Федерации c диагнозом герминогенной несеминомной опухоли яичка или внегонадной природы, промежуточным или неблагоприятным прогнозом согласно классификации IGCCCG. Всем пациентам был проведен 1 курс химиотерапии (ХТ) по схеме ВЕР (блеомицин 30 мг в день 1, 3, 5, этопозид 100 мг / м2 в дни 1-5, цисплатин 20 мг /м2 в дни 1-5). Пациенты с неудовлетворительной скоростью снижения опухолевых маркеров к 18-21 дню получили 4 курса TIP (паклитаксел 120 мг /м2 в дни 1-2, ифосфамид 1500 мг/ м2 в дни 2-5, цисплатин 25 мг/ м2 в дни 2-5 + Г-КСФ с 6 по 15 дни). При наличии резидуальной опухоли размером более 1 см и технической возможности ее удаления, выполнялось хирургическое лечение. Первичной конечной точкой являлась однолетняя выживаемость без прогрессирования. Результаты исследования: С 2017 по 2021 годы в исследование включено 28 пациентов: 7 пациентов с промежуточным прогнозом и 21 с неблагоприятным. Медиана наблюдения за пациентами составила 15,5 месяцев (диапазон 4,4-38,3 месяцев). Одногодичная выживаемость без прогрессирования и общая выживаемость без учета риска по IGCCCG составили 76,6% и 81 % соответственно. Одногодичная выживаемость без прогрессирования и общая выживаемость с учетом классификации: для промежуточного прогноза - 100% и 100%, для неблагоприятного - 68% и 73,8% соответственно. За период наблюдения прогрессирование заболевания отмечено у 9 (32%) больных, 7 (25%) пациентов умерло от основного заболевания, включая один случай агрессивно протекающего синдрома растущей зрелой тератомы в средостении. Хирургическое лечение было выполнено 11 (39 %) больным. Патоморфологический полный ответ отмечен у 6 (21,4%) пациентов, зрелая тератома у 2 (7,1 %), жизнеспособная опухоль у 3 (10,7%) больных. Режим TIP продемонстрировал удовлетворительный профиль токсичности, несмотря на это у 1 пациента развился синдром лизиса опухоли. Заключение: Режим TIP может улучшить результаты лечения в первой линии при неудовлетворительном снижении опухолевых маркеров после одного курса ХТ, что требует дальнейшего изучения в рандомизированном исследовании.
Герминогенные опухоли, неблагоприятный прогноз, скорость снижения опухолевых маркеров, блеомицин, этопозид, паклитаксел, ифосфамид, цисплатин
Короткий адрес: https://sciup.org/140296522
IDR: 140296522 | DOI: 10.18027/2224-5057-2022-12-3-11-20
Текст научной статьи Режим паклитаксел, ифосфамид, цисплатин (TIP) при несеминомных герминогенных опухолях неблагоприятного и промежуточного прогноза с неудовлетворительным снижением уровня онкомаркеров: исследование II фазы
Стандартом первой линии терапии герминогенных опухолей (ГО) является режим ВЕР (блеомицин, этопозид, цисплатин). Согласно обновленным данным International Germ Cell Cancer Collaborative Group (IGCCCG) на фоне стандартной терапии длительная общая выживаемость (ОВ) пациентов с несеминомными герминогенными опухолями в группах благоприятного, промежуточного и неблагоприятного прогнозов составляет 96%, 89%, 67% соответственно [1]. Одногодичная выживаемость без прогрессирования (ВБП), представленная в данном исследовании, равняется 93,8%, 84,3%, 60,4% соответственно. Очевидно, что пациенты с неблагоприятным прогнозом нуждаются в разработке альтернативных, более эффективных режимов лечения [1]. Было предпринято множество попыток улучшить результаты лечения в этой категории больных за счет применения новых комбинаций препаратов [2,3], интенсифицированных режимов [4] и высокодозной химиотерапии (ХТ) [5–7], однако это не позволило существенно улучшить отдаленные результаты и привело лишь к повышению частоты осложнений. Соответственно, интенсификация ХТ только на основе классификации IGCCCG не показала своей эффективности.
Замедленная скорость снижения опухолевых маркеров — альфа-фетопротеина (АФП) и хорионического гонадотропина человека (ХГЧ) — после первого курса терапии является фактором плохого прогноза [8], позволяющим выделить пациентов, которые могут выиграть от интенсификации или изменения режима.
В исследовании III фазы GEТUG13 (n = 254) продемонстрирована эффективность интенсификации терапии при неблагоприятном прогнозе ГО у пациентов с неудовлетворительной скоростью снижения концентрации опухолевых маркеров. В соответствии с дизайном работы, после 1 курса ХТ по схеме ВЕР пациенты рандомизировались в группу стандартного лечения (до 4 курсов ВЕР) или дозоинтенсивной химиотерапии (2 курса паклитаксел + ВЕР, оксалиплатин с последующим проведением 2 курсов по схеме цисплатин, ифосфамид (+месна), блеомицин). Экспериментальный режим позволил улучшить 3-летнюю ВБП, данный показатель составил 60% и 47% соответственно (отношение рисков (ОР) 0,65; p = 0,037) без значимого увеличения ОВ (73% и 65%; ОР 0,78; p=0,34) [8]. Надо отметить, что примененный режим оказался мало воспроизводимым в практике и не стал стандартом лечения.
Комбинация TIP (паклитаксел, ифосфамид, цисплатин) является золотым стандартом второй линии терапии ГО. Кроме того, прямое сравнение ее с режимом ВЕР в первой линии у пациентов с промежуточным и неблагоприятным прогнозом по IGCCCG показало их равную эффективность (одногодичная ВБП в обеих группах 72%) и удовлетворительный профиль токсичности [9].
Основываясь на предположении о необходимости интенсификации ХТу пациентов с неблагоприятным снижением концентрации опухолевых маркеров, мы провели однорукавное исследование II фазы по оценке эффективности режима TIP у пациентов с неблагоприятной динамикой снижения АФП и/или ХГЧ на фоне первого курса химиотерапии по схеме ВЕР.
Материалы и методы
Исследование проведено в рамках протокола клинической апробации Министерства здравоохранения Российской Федерации №2017-5-56 от 13.02.2017. Исследование одобрено локальным этическим комитетом.
Критерии включения
-
• Возраст старше 18 лет;
-
• морфологически подтвержденный диагноз несемином-ной ГО (при тяжелом состоянии больного, обусловленном распространенностью опухолевого процесса, диагноз мог основываться на типичной клинической картине и высоком уровне АФП и/или ХГЧ; пациенты, у которых в гистологическом заключении фигурировал диагноз «семинома», но наблюдался повышенный уровень АФП, также относились к несеминомным ГО),
-
• любая локализация первичной опухоли, за исключением центральной нервной системы (ЦНС);
-
• наличие повышенного уровня АФП и/или ХГЧ до начала первого курса химиотерапии;
-
• неудовлетворительное снижение уровня маркеров после первого курса по схеме ВЕР в соответствие с моделью K. Fizazi [10];
-
• промежуточный или неблагоприятный прогноз в соответствии с классификацией IGCCCG [11];
-
• удовлетворительные показатели гемограммы (число нейтрофилов ≥1,5 ×109/л, тромбоциты ≥100 ×109/л), функция почек (уровень креатинина не более 1,5 × верхней границы нормы либо расчетный клиренс креатинина (Cockroft–Gault) ≥40 мл/мин) и печени (уровень билирубина до 2-кратного повышения верхней границы времени (ВГН), уровень АЛТ и АСТ до 5 ВГН);
-
• проведение «стабилизационного» курса по схеме ЕР;
-
• статус по шкале ECOG 0–4.
Критерии исключения
-
• ГО с соматической трансформацией;
-
• гистологически «чистая» семинома с нормальным уровнем АФП и уровнем бета-ХГЧ ниже 1000 мМЕ/мл;
-
• первичные ГО ЦНС;
-
• ранее проводившаяся химиотерапия или лучевая терапия по поводу диссеминированной ГО;
-
• любая другая злокачественная опухоль в анамнезе, за исключением адекватно леченного базальноклеточного рака кожи;
-
• активные инфекционные заболевания и сопутствующая патология, которые могли повлиять на переносимость химиотерапии.
РЕЖИМ ПАКЛИТАКСЕЛ, ИФОСФАМИД, ЦИСПЛАТИН (TIP) ПРИ НЕСЕМИНОМНЫХ ГЕРМИНОГЕННЫХ ОПУХОЛЯХ НЕБЛАГОПРИЯТНОГО И ПРОМЕЖУТОЧНОГО ПРОГНОЗА С НЕУДОВЛЕТВОРИТЕЛЬНЫМ СНИЖЕНИЕМ УРОВНЯ ОНКОМАРКЕРОВ: ИССЛЕДОВАНИЕ II ФАЗЫ
Собственные исследования
Скрининг
Процедуры скрининга включали сбор анамнеза, осмотр, проведение электрокардиографии, общий анализ крови, определение уровня АФП, бета-ХГЧ, лактатдегидрогеназы (ЛДГ), биохимический анализ крови, компьютерную томографию (КТ) органов грудной клетки, брюшной полости, малого таза с внутривенным контрастированием, магнитно-резонансную томографию (МРТ) головного мозга с внутривенным контрастированием при наличии показаний (неврологическая симптоматика, уровень ХГЧ свыше 50000 мМЕ/мл или множественные метастазы в легкие).
ДИЗАЙН ИССЛЕДОВАНИЯ
Всем больным проводился один курс ХТ по программе ВЕР (блеомицин 30 мг в/в в 1, 3, 5 дни, этопозид 100 мг/м2 в 1–5 дни, цисплатин 20 мг/м2 в 1–5 дни). Пациентам с крайне высоким уровнем опухолевых маркеров (АФП ≥100000 нг/мл и/или бета-ХГЧ ≥ 200000 мМЕ/мл) и/или тяжелым соматическим статусом на момент начала терапии допускалось проведение «стабилизационного» курса ХТ по схеме ЕР с редукцией доз на 40–60% с последующим продолжением терапии по схеме ВЕР. На основании определения уровней опухолевых маркеров (АФП и ХГЧ) к 18–21-му дню рассчитывалась скорость их снижения согласно формуле, опубликованной ранее [10]. В случае благоприятной скорости пациенты получали еще 3 курса ХТ по программе ВЕР каждые 3 недели и не включались в исследование. Пациентам с неблагоприятной скоростью снижения проводилось 4 курса терапии по схеме TIP (паклитаксел 120 мг/м2 в день 1, 2 + ифосф-амид 1500 мг/м2 в день 2–5, месна 1500 мг/м2 в день 2–5, цисплатин 25 мг/м2 в день 2–5 + филграстим 5 мг/кг в день 6–15 п/к) каждые 3 недели (экспериментальная группа). Перед каждым курсом определялись показатели гемограммы, биохимического анализа крови, уровни АФП, ХГЧ и ЛДГ, оценивалась токсичность предыдущего курса терапии. С целью контроля гематологической токсичности еженедельно контролировался общий анализ крови.
После завершения всего запланированного объема химиотерапии оценка эффективности лечения включала в себя КТ органов грудной клетки, брюшной полости, малого таза с в/в контрастированием, МРТ головного мозга по показаниям, определение уровней опухолевых маркеров. При полном ответе пациенты переходили под динамическое наблюдение. При сохранении потенциально операбельных резидуальных опухолевых очагов более 1 см выполнялось хирургическое вмешательство с целью их удаления. При наличии некроза в удаленных резидуальных массах по данным гистологического исследования, пациент переходил под наблюдение. Пациенты с жизнеспособной злокачественной опухолью получали еще 2 курса ХТ по схеме TIP.
После завершения терапии пациенты находились под наблюдением. Анализ проводился на основе всех включенных пациентов. Первичная оценка эффективности производилась, когда у 80% больных период наблюдения после завершения химиотерапии превысил один год. Процедуры наблюдения проводились в соответствии с клиническими рекомендациями RUSSCO [12].
Конечные точки
Первичной конечной точкой являлась одногодичная выживаемость без прогрессирования — время от момента включения в исследование до прогрессирования либо смерти от любой причины в течение одного года.
Вторичные конечные точки:
-
• общая выживаемость — время от момента включения в исследование до смерти от любой причины или даты последнего наблюдения;
-
• полный ответ — нормализация опухолевых маркеров (АФП и ХГЧ), отсутствие радиологических проявлений болезни размерами 1 см и более или полностью резецированные опухолевые массы;
-
• маркер-негативный неполный ответ — нормализация опухолевых маркеров (АФП и ХГЧ), остается резидуальная опухоль 1 см и более, которая не была полностью хирургически удалена;
-
• маркер-позитивный неполный ответ — опухолевые маркеры (АФП или ХГЧ) снизились, но остаются все еще повышенными после завершения всех курсов терапии; если в течение последующего 1 месяца после первичной оценки эффекта (14–30 дней после завершения химиотерапии) наблюдается нормализация опухолевых маркеров самостоятельно или после резекции резидуальной опухоли, то данный ответ классифицируется как полный или маркер-негативный неполный (продолжительность полного и неполного ответов должна быть не менее 1 месяца);
-
• прогрессирование заболевания — рост уровня опухолевых маркеров (АФП или ХГЧ) на протяжении двух последовательных измерений с интервалом в 2 недели; рост или появление новых опухолевых очагов, за исключением случаев растущей зрелой тератомы; нерадикальное удаление резидуальной опухоли, содержащей жизнеспособную злокачественную опухоль;
-
• безопасность согласно шкале CTCAE v. 4.0 — в виде доли пациентов, у которых развились нежелательные явления 3–4 степени.
Статистический анализ
Нулевая и альтернативная гипотезы основаны на данных рандомизированного исследования GETUG13. Согласно результатам исследования, 1-летняя ВБП в группе больных, получивших стандартный режим, составила 55%. Следовательно, нулевая гипотеза (Н0) равняется 1-летней ВБП 55%. Альтернативная гипотеза (Н1) — 1-летняя ВБП составляет 75%. При ошибке первого рода (α) = 0,1 и ошибке второго
РЕЖИМ ПАКЛИТАКСЕЛ, ИФОСФАМИД, ЦИСПЛАТИН (TIP) ПРИ НЕСЕМИНОМНЫХ ГЕРМИНОГЕННЫХ ОПУХОЛЯХ НЕБЛАГОПРИЯТНОГО И ПРОМЕЖУТОЧНОГО ПРОГНОЗА С НЕУДОВЛЕТВОРИТЕЛЬНЫМ СНИЖЕНИЕМ УРОВНЯ ОНКОМАРКЕРОВ: ИССЛЕДОВАНИЕ II ФАЗЫ
Собственные исследования рода (β) = 0,2 (мощность 0,8), ожидаемой потери данных 10% в исследование должно быть включено 28 пациентов.
Выживаемость анализировалась в соответствии с методом Каплана–Мейера и сравнивалась по лог-ранг тесту. Для сравнения качественных признаков использовался
Таблица 1. Характеристика пациентов.
|
Показатель |
N (%) |
|
Количество пациентов |
28 (100%) |
|
Патоморфологический вариант |
|
|
Несеминомая ГО |
24 (85,7%) |
|
• опухоль желточного мешка |
3 (10,7%) |
|
• хорионкарцинома |
1 (3,6%) |
|
• эмбриональный рак |
7 (25%) |
|
• незрелая тератома |
1 (3,6%) |
|
• зрелая тератома |
1 (3,6%) |
|
• опухоль смешанного строения |
10 (35,7%) |
|
Нет патоморфологического подтверждения |
3 (10,7%) |
|
Семинома + повышенный АФП |
1 (3,6%) |
|
Локализация первичной опухоли |
|
|
Яичко |
20 (71,4%) |
|
Забрюшинное пространство |
3 (10,7%) |
|
Средостение |
5 (17,9%) |
|
Метастазы |
|
|
Забрюшинные лимфоузлы |
18 (64,3%) |
|
Лимфоузлы средостения |
9 (32,1 %) |
|
Легкие |
15 (53,6%) |
|
Печень |
8 (28,5%) |
|
Кости |
5 (17,9%) |
|
Головной мозг |
1 (3,6%) |
|
ECOG PS |
|
|
0–1 |
2 (7,1%) |
|
2 |
6 (21,4%) |
|
3–4 |
20 (71,4%) |
|
Уровень онкомаркеров |
|
|
ХГЧ > 50000, МЕ/мл |
6 (21,4%) |
|
Медиана ХГЧ, МЕ/мл (диапазон) |
1310 (0–490000) |
|
АФП > 10000, мМЕ/мл |
6 (21,4%) |
|
Медиана АФП, мМЕ/мл (диапазон) |
995 (1–161056) |
|
ЛДГ > 10 ВГН, Ед/л |
3 (10,7%) |
|
Медиана ЛДГ, Ед/л (диапазон) |
670,5* (180–11151) |
|
Прогноз по IGCCCG |
|
|
Промежуточный |
7 (25%) |
|
Неблагоприятный |
21 (75%) |
ECOG PS – шкала оценки тяжести состояния пациента (Eastern Cooperative Oncology Group Performance Status). ХГЧ –хорионический гонадотропин человека. АФП – альфа-фетопротеин. ЛДГ – лактатдегидрогеназа. ВГН – верхняя граница нормы. IGCCCG – Международная консенсусная группа по изучению герминогенных опухолей (International Germ Cell Cancer Collaborative Group).
* верхняя граница нормы ЛДГ до 450 Ед / л.
χ2-тест с поправкой Йетса на непрерывность при таблицах сопряжения 2 ×2 или точный критерий Фишера при малых выборках. Для сравнения количественных признаков будет применяться Манн–Уитни тест. Во всех случаях будет использован 95% доверительный интервал и двусторонний Р. Статистическая обработка данных проводилась с использованием программы MedCalc.
РЕЗУЛЬТАТЫ
С 2017 по 2021 годы в исследование было включено 28 пациентов из 4 центров на территории Российской Федерации: Национальный медицинский исследовательский центр (НМИЦ) онкологии им. Н.Н. Блохина (15 паци-ентов/53,5%), НМИЦ онкологии им. Н.Н. Петрова (8 паци-ентов/28,5%), Московский научно-исследовательский онкологический институт им. П.А. Герцена (4 пациен-та/14,2%), Российский научный центр рентгенрадиологии (1 пациент/3,5%). Согласно классификации IGCCCG 7 (25%) пациентов относились к группе промежуточного прогноза, 21 (75%) — к группе неблагоприятного прогноза. Первичная опухоль в большинстве случаев располагалась в яичке (71,4%), реже в средостении и забрюшинном пространстве. Орхифуникулэктомия на первом этапе была выполнена 20 пациентам (71,4%). У 8 (28,5%) пациентов на момент начала лечения определялись метастазы в печени, у 5 (17,9%) пациентов — поражение костей, у 1 (3,6%) пациента — метастатическое поражение головного мозга. Подробная характеристика пациентов представлена в табл. 1.
Одному пациенту (3,5%) был проведен «стабилизационный» курс по схеме ЕР с редукцией доз в связи с тяжелым состоянием на момент госпитализации и крайне высоким уровнем бета-ХГЧ, расчет скорости снижения концентрации опухолевых маркеров проводился после первого курса по схеме ВЕР.
Оценка эффективности терапии
При медиане наблюдения за пациентами 15,5 месяцев (диапазон 4,4–38,3 мес.) у 9 (32,1%) пациентов развилось прогрессирование заболевания, умерло 7 (25%) человек, включая одного от агрессивно протекающего синдрома растущей зрелой тератомы, расположенной в средостении.
По результатам исследования в общей популяции однолетняя ВБП в независимости от прогноза по IGCCCG составила 76,6%, в группе промежуточного прогноза — 100%, в группе неблагоприятного прогноза — 68% (рис. 1).
Однолетняя ОВ для всех проанализированных больных составила 81%, в группе пациентов с промежуточным и неблагоприятным прогнозами — 100% и 73,8% соответственно (рис. 2).
Непосредственная эффективность лечения оценена у всех пациентов (табл. 2). У 3 (11%) пациентов наблюдался полный ответ, у 17 (60,7%) пациентов частичный ответ с нормализацией уровня онкомаркеров, частичный ответ с повышенным уровнем маркеров у 5 (18%) пациентов,
РЕЖИМ ПАКЛИТАКСЕЛ, ИФОСФАМИД, ЦИСПЛАТИН (TIP) ПРИ НЕСЕМИНОМНЫХ ГЕРМИНОГЕННЫХ ОПУХОЛЯХ НЕБЛАГОПРИЯТНОГО И ПРОМЕЖУТОЧНОГО ПРОГНОЗА С НЕУДОВЛЕТВОРИТЕЛЬНЫМ СНИЖЕНИЕМ УРОВНЯ ОНКОМАРКЕРОВ: ИССЛЕДОВАНИЕ II ФАЗЫ
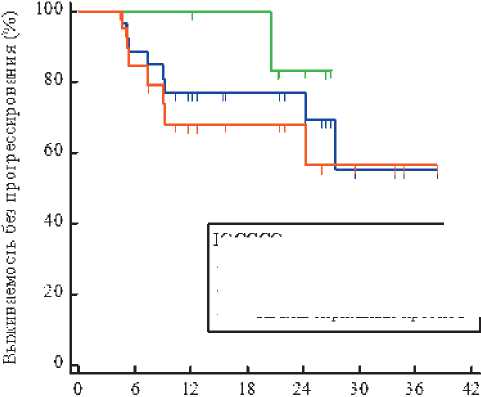
IGCCCG
---Вся когорта
---Промежуточный прогноз
---Неблагоприятный прогноз
Месяцы Цщзуриров энные больные
Вся когорта
28 23 17 13 103
Промежуточный прогноз
7 7 7 6 30
Неблагоприятный прогноз
21 16 10 8 63
Собственные исследования
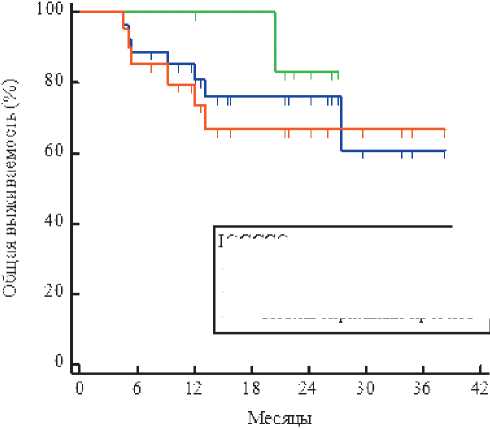
IGCCCG
---Вся когорта
---Промежуточный прогноз
---Неблагоприятный прогноз
Оо
Цзгзуриров энные больные Вся когорта
28 24 19
Промежуточный прогноз
Неблагоприятный прогноз
21 17 12
о
б
о
о
о
О
Рисунок 1. График выживаемости без прогрессирования.
Рисунок 2. Графики общей выживаемости.
прогрессирование у 3 (10,7%) пациентов. Одиннадцать пациентов подвергнуты хирургическому удалению резидуальной опухоли. У 4 (14,2%) пациентов после оперативного лечения остались резидуальные очаги в легких. У 3 (10,7%) пациентов при гистологическом исследовании обнаружена жизнеспособная злокачественная опухоль, при чем у каждого из них первичной локализацией явилось средостение, оперативное лечение проведено в этой же анатомической области. Частота благоприятного исхода, рассчитываемая как сумма пациентов с полным ответом после завершения ХТ или удаления резидуальной опухоли, а также частичным ответом и негативными маркерами, отмечена у 19 больных (68%) (табл. 2).
Токсичность
Медиана числа курсов ХТ составила 5 (диапазон 3–6), включая «стабилизационный» ЕР. Из 28 человек 22 (79%) получили запланированные 4 курса ХТ по схеме TIP. У 5 (18%) пациентов было проведено 3 курса ХТ по вышеуказанной схеме (последний курс отменен в связи с гематологической токсичностью 3–4 степени у 3 пациентов, инфекционными осложнениями 2 степени у 2 пациентов). Одному больному проведено только 2 курса ХТ в связи с развитием синдрома растущей зрелой тератомы в средостении. Основной токсичностью была гематологическая. Фебрильная нейтропения была отмечена у 7 пациентов (25%) с крайне диссеминированной болез-
Таблица 2. Непосредственная эффективность лечения.
|
Показатель |
N (%) |
|
Все пациенты |
28 (100%) |
|
Эффект после ХТ |
|
|
Полный ответ |
3 (10,7%) |
|
МННО |
17 (60,7%) |
|
МПНО |
5 (17,8%) |
|
Прогрессирование |
3 (10,7%) |
|
Хирургическое лечение |
11 (39,2%) |
|
ЗЛАЭ |
5 (17,8%) |
|
Удаление опухоли средостения |
5 (17,8%) |
|
Резекция легких |
1 (3,6%) |
|
Эффект после ХТ + Хирургия |
|
|
Без проявлений болезни |
6 (21,4%) |
|
Резидуальная опухоль + нормальные маркеры |
4 (14,2%) |
|
Резидуальная опухоль + повышенные маркеры |
0 (0%) |
|
Прогрессирование |
1 (3,6%) |
|
Патоморфологический ответ |
|
|
Некроз, фиброз |
6 (21,4%) |
|
Тератома |
2 (7,1%) |
|
Жизнеспособная опухоль |
3 (10,7%) |
ХТ – химиотерапия
МПНО – маркер-позитивный неполный ответ МННО – маркер-негативный неполный ответ ЗЛАЭ – забрюшинная лимфаденэктомия
РЕЖИМ ПАКЛИТАКСЕЛ, ИФОСФАМИД, ЦИСПЛАТИН (TIP) ПРИ НЕСЕМИНОМНЫХ ГЕРМИНОГЕННЫХ ОПУХОЛЯХ НЕБЛАГОПРИЯТНОГО И ПРОМЕЖУТОЧНОГО ПРОГНОЗА С НЕУДОВЛЕТВОРИТЕЛЬНЫМ СНИЖЕНИЕМ УРОВНЯ ОНКОМАРКЕРОВ: ИССЛЕДОВАНИЕ II ФАЗЫ
Собственные исследования нью: после первого курса по схеме ВЕР у троих, у четверых —после проведения первого курса в режиме TIP. У одного пациента с метастатическим поражением средостения после проведения одного курса TIP развился синдром лизиса опухоли с исходом в острое почечное повреждение, эмпиему плевры, хилоторакс. Несмотря на это, данному больному удалось провести 3 курса ХТ по схеме TIP с последующим полным ответом после хирургического лечения. Летальных исходов, связанных с проведенным лечением, не было. Токсичность режима представлена в табл. 3.
Таблица 3. Нежелательные явления 3–4 степени.
|
Токсичность 3–4 степени |
N (%) |
|
Анемия |
7 (25%) |
|
Тромбоцитопения |
3 (10,7%) |
|
Нейтропения |
5 (17,9%) |
|
Фебрильная нейтропения |
7 (25%) |
|
Тош нота |
1 (3,6%) |
|
Синдром лизиса опухоли |
2 (7,1%) |
|
Эмпиема плевры |
1 (3,6%) |
|
Хилоторакс |
1 (3,6%) |
|
Сепсис |
2 (7,1%) |
|
ТЭЛА |
1 (3,6%) |
|
Почечное повреждение |
1 (3,6%) |
|
Кровотечение из органов ЖКТ |
1 (3,6%) |
ТЭЛА — тромбоэмболия легочной артерии. ЖКТ — желудочно-кишечный тракт.
ОБСУЖДЕНИЕ
Несмотря на успехи лекарственной терапии, около 40% больных из группы неблагоприятного и 10% промежуточного прогноза погибают от прогрессирования заболевания. Возможность ранней (после первого курса терапии) оценки эффективности лечения по скорости снижения опухолевых маркеров была продемонстрирована в исследовании K. Fizazi в 2004 году [10]. У 653 пациентов с диссеминированным опухолевым процессом определялся уровень опухолевых маркеров до и после первого курса ХТ, затем проводился расчет скорости снижения. Удовлетворительным считалось снижение в случае: исходно нормального значения маркеров, нормализации исходно повышенных опухолевых маркеров к 18-21му дню 1-го курса ХТ, повышенных значений опухолевых маркеров к моменту проведения 2-го курса, но имеющие адекватное время до нормализации (TNm), рассчитываемое по формуле: TNm = 3 А/В. А = log (M0) - log (MN), где М0 — уровень маркера на момент начала ХТ, МN — нормальное значение маркера, B=log (M0) - log (M1), где M1 — уровень маркера на момент начала второго курса (т. е. спустя 3 недели). За верхнюю границу адекватного TNm были приняты TAFP = 9 и THCG = 6 недель.
Показатель 4-летней ВБП при удовлетворительном и неудовлетворительном снижении маркеров в группе неблагоприятного прогноза составил 64% и 38% соответственно (p=0,007), а 4-летняя ОВ составила 83% и 58% соответственно (p=0,009). В многофакторном анализе была подтверждена значимость этого признака по отношению к ВБП (ОР=2,5; p=0,1) и ОВ (ОР=4,6; p=0,02).
Данный подход позже был проспективно изучен в ранее упомянутом французском рандомизированном исследовании GETUG13, где «переключение» пациентов с неудовлетворительным снижением опухолевых маркеров на альтернативный режим ХТ позволил по сравнению с продолжением терапии комбинацией ВЕР статистически значимо улучшить ВБП, но не ОВ [8]. Помимо прочего, в группе пациентов с исследуемым режимом чаще отмечались тромбоцитопения, мукозиты, тошнота, рвота, диарея, моторная и сенсорная нейропатия (в частности, 3–4 степени). Токсичность проводимого лечения стала поводом для отмены последнего курса ХТ в группе интенсифицированного лечения для 6 (6%) пациентов, в то время как в группе ВЕР — для 1 (1%) больного.
Принимая во внимание вышеизложенное, а также приемлемую переносимость более изученного режима TIP, его эффективность как в первой, так и во второй линиях ХТ, авторы из Словакии во главе с M. Mego инициировали нерандомизированное проспективное исследовании II фазы [13]. В работу по оценке эффективности режима TIP при неудовлетворительном снижении маркеров у пациентов с неблагоприятным прогнозом НГО включено 19 человек. Первичной конечной точкой являлась частота полных ответов, которая не была достигнута. Частота благоприятных ответов составила 73,7%, одногодичная ВБП и ОВ — 52,2% и 79,3% соответственно. Авторы, сравнив полученные результаты с исследованием GETUG13, сделали вывод о безуспешности перехода на режим TIP в сравнении с изучаемым дозоинтенсивным режимом. Однако стоит отметить малое число пациентов, небольшую продолжительность наблюдения, отсутствие контрольной группы, что может делать подобный вывод преждевременным.
Включение пациентов с промежуточным прогнозом в наше исследование обусловлено медленным набором пациентов с неблагоприятным прогнозом, а также тем фактом, что неудовлетворительная скорость снижения опухолевых маркеров после первого курса стандартной ХТ также ассоциировалась с достоверным ухудшением ВБП у этой подгруппы пациентов (ОР = 2,06; p=0,008) [14]. Возможно, что благодаря этому мы сумели достичь первичную конечную точку. Однолетняя ВБП и ОВ без учета риска по IGCCCG составили 76,6% и 100% соответственно. Однолетняя ВБП и ОВ с учетом классификации: для промежуточного (n=7) прогноза 100% и 100%, для неблагоприятного (n=21) 68% и 73,8% соответственно. У 5 (17,9%) пациентов первичная локализация опухоли была в средостении, что является самым неблагоприятным прогностическим фактором у пациентов с НГО. В исследовании авторов из Словакии со схожим дизайном не были включены пациенты с первичной
РЕЖИМ ПАКЛИТАКСЕЛ, ИФОСФАМИД, ЦИСПЛАТИН (TIP) ПРИ НЕСЕМИНОМНЫХ ГЕРМИНОГЕННЫХ ОПУХОЛЯХ НЕБЛАГОПРИЯТНОГО И ПРОМЕЖУТОЧНОГО ПРОГНОЗА С НЕУДОВЛЕТВОРИТЕЛЬНЫМ СНИЖЕНИЕМ УРОВНЯ ОНКОМАРКЕРОВ: ИССЛЕДОВАНИЕ II ФАЗЫ
Собственные исследования локализацией опухоли в средостении, что не позволяет провести корректное непрямое сравнение с нашими результатами [13]. Остается неясным вопрос и о возможности экстраполяции данных о прогностической значимости неудовлетворительного снижения опухолевых маркеров в случае проведения первого курса со значительной редукцией доз препаратов. Так, у ряда пациентов с крайне распространенным опухолевым процессом в качестве первого курса приходится применять «стабилизационные» курсы ХТ — комбинацию ЕР с редукцией доз на 40–60% [14] или монотерапию карбоплатином.
Токсичность режима TIP является предсказуемой. Однако мы столкнулись с нежелательными событиями особой важности, такими как тумор-лизис синдром, острое почечное повреждение, эмпиема плевры и хилоторакс, развившиеся у пациента с метастатическим поражением средостения. Несмотря на это, удалось достичь полного ответа после хирургического удаления резидуальной опухоли. Это подчеркивает важность проведения лечения пациентов с распространенными ГО в профильных учреждениях с наличием мультидисциплинарной команды для выработки адекватной тактики лечения и коррекции осложнений.
Недостатками нашей работы являются малочисленность выборки пациентов, включение больных с промежуточным риском, отсутствие рандомизации, а также короткий период наблюдения. Однако полученные обнадеживающие данные даже в подгруппе пациентов с неблагоприятным прогнозом заставляют нас задуматься над реализацией исследования III фазы с привлечением большего числа специализированных центров.
ЗАКЛЮЧЕНИЕ
Определение скорости снижения опухолевых маркеров продемонстрировало свою предсказательную роль в определении ВБП и ОВ у пациентов с неблагоприятным и промежуточным прогнозами. Учитывая тот факт, что 4-летняя ОВ для пациентов с неблагоприятным прогнозом и неудовлетворительным снижением маркеров после 1 курса ВЕР составляет 58%, становится очевидным поиск новых алгоритмов и/или схем лечения. Мы считаем, что режим TIP может быть эффективным в первой линии лечения после одного курса стандартной ХТ при неблагоприятном темпе снижения маркеров, что продемонстрировано в нашем исследовании. Необходимо проведение дальнейших работ для подтверждения использования данного подхода у пациентов с неблагоприятным прогнозом.
Прозрачность финансовой деятельности: исследование проведено в рамках клинической апробации.
Список литературы Режим паклитаксел, ифосфамид, цисплатин (TIP) при несеминомных герминогенных опухолях неблагоприятного и промежуточного прогноза с неудовлетворительным снижением уровня онкомаркеров: исследование II фазы
- Gillesen S., Sauve N., Collette L. et al. Predicting Outcomes in Men With Metastatic Nonseminomatous Germ Cell Tumors (NSGCT): Results From the IGCCCG Update Consortium. J Clin Oncol. 2021;39 (14): 1563-1574. https://doi.org/10.1200/JCO.20.03296
- Nichols C., Catalano P., Crawford E. et al. Randomized comparison of cisplatin and etoposide and either bleomycin or ifosfamide in treatment of advanced disseminated germ cell tumors: an Eastern Cooperative Oncology Group, Southwest Oncology Group, and Cancer and Leukemia Group B Study. J Clin Oncol. 1998;16 (4): 1287-93. https://doi.org/10.1200/JCO.1998.16.4.1287
- Tryakin A., Fedyanin M., Kanagavel D. et al. Paclitaxel + BEP (T-BEP) regimen as induction chemotherapy in poor prognosis patients with nonseminomatous germ cell tumors: a phase II study. Urology. 2011;78 (3):620-5. https://doi.org/10.1016/j.urology.2011.05.005
- Tryakin A., Fedyanin M., Sergeev U. et al. Two-weekly accelerated BEP (aBEP) regimen as induction chemotherapy in intermediate and poor prognosis patients (pts) with nonseminomatous germ cell tumors (NSGCT): Efficacy results of phase II trial. J Clin Oncol. 2015; 33 (suppl): abstr e15566. https://doi.org/10.1200/jco.2015.33.15_suppl.e15566
- Droz J., Kramar A., Biron P. et al. Failure of high-dose cyclophosphamide and etoposide combined with double-dose cisplatin and bone marrow support in patients with high-volume metastatic nonseminomatous germ-cell tumours: mature results of a randomised trial. Eur Urol. 2007;51:739-48. https://doi.org/10.1016/j.eururo.2006.10.035
- Motzer R., Nichols C., Margolin K. et al. Phase III randomized trial of conventional-dose chemotherapy with or without high-dose chemotherapy and autologous hematopoietic stem-cell rescue as first-line treatment for patients with poor-prognosis metastatic germ cell tumors. J Clin Oncol. 2007; 25: 247-56. https://doi.org/10.1200/JCO.2005.05.4528
- Schmoll H., Kollmannsberger C., Metzner B. et al. Long-term results of first-line sequential high-dose etoposide, ifosfamide, and cisplatin chemotherapy plus autologous stem cell support for patients with advanced metastatic germ cell cancer: an extended phase I/II study of the GTCSG. J Clin Oncol. 2003; 21:4083-4091. https://doi.org/10.1200/JCO.2003.09.035
- Fizazi K., Pagliaro L., Laplanche A. et al. Personalised chemotherapy based on tumour marker decline in poor prognosis germ-cell tumours (GETUG 13): a phase 3, multicentre, randomised trial. Lancet Oncol. 2014;15:1442-50. https://doi.org/10.1016/S1470-2045(14)70490-5
- Feldman D., Hu J., Srinivas S. et al. Multicenter randomized phase 2 trial of paclitaxel, ifosfamide, and cisplatin (TIP) versus bleomycin, etoposide, and cisplatin (BEP) for first-line treatment of patients (pts) with intermediateor poorrisk germ cell tumors (GCT). J Clin Oncol. 2018;36 (15 suppl): 4508-4508. https://doi.org/10.1200/JCO.2018.36.15_suppl.4508
- Fizazi K., Culine S., Kramar A. et al. Early Predicted Time to Normalization of Tumor Markers Predicts Outcome in Poor-Prognosis Nonseminomatous Germ Cell Tumors. J Clin Oncol. 2004;22:3868-3876. https://doi.org/10.1200/JCO.2004.04.008
- International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. International Germ Cell Cancer Collaborative Group. J Clin Oncol. 1997;15:594-603. https://doi.org/10.1200/JCO.1997.15.2.594
- Трякин А. А., Гладков О. А., Матвеев В. Б. и соавт. Практические рекомендации по лечению герминогенных опухолей у мужчин. Злокачественные опухоли: Практические рекомендации RUSSCO. 2021;11 (3s2):556-585. https://doi.org/10.18027/2224-5057-2021-11-3s2-34
- Mego M., Rejlekova K., Svetlovska D. et al. Paclitaxel, Ifosfamide, and Cisplatin in Patients with Poor-prognosis Disseminated Nonseminomatous Germ Cell Tumors with Unfavorable Serum Tumor Marker Decline After First Cycle of Chemotherapy. The GCT-SK-003 Phase II Trial. Eur Urol Open Sci. 2021; 33:19-27. https://doi.org/10.1016/j.euros.2021.09.002
- Трякин А. А. Лекарственное и комбинированное лечение несеминомных герминогенных опухолей у мужчин. Дис. на соискание уч. степени д-ра мед. наук. М., 2015.


