Режим паклитаксел, ифосфамид, цисплатин (TIP) в индукционном лечении при несеминомных герминогенных опухолях неблагоприятного прогноза с замедленным снижением концентрации онкомаркеров: финальные результаты
Автор: Исраелян Э.Р., Трякин А.А., Румянцев А.А., Федянин М.Ю., Кононец П.В., Герасимов С.С., Матвеев В.Б., Волкова М.И., Климов А.В., Семенова А.И., Пайчадзе А.А., Царева А.А., Юнаев Г.С., Тюляндин С.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.15, 2025 года.
Бесплатный доступ
Введение: Пациенты с герминогенными опухолями (ГО) и неблагоприятным прогнозом демонстрируют неудовлетворительные онкологические результаты, однолетняя выживаемость без прогрессирования (ВБП) составляет около 50 %. Мы предположили, что смена режима химиотерапии (ХТ) на TIP (паклитаксел, ифосфамид (месна), цисплатин) в случае замедленной скорости снижения онкомаркеров после 1 курса ВЕР (блеомицин, этопозид, цисплатин) сможет улучшить результаты лечения в данной подгруппе пациентов.Материалы и методы: В многоцентровое проспективное нерандомизированное исследование II фазы включены пациенты с несеминомными ГО и неблагоприятным прогнозом по IGCCCG. Всем пациентам проведен 1 курс ХТ в режиме ВЕР. Пациентам с замедленным снижением концентрации опухолевых маркеров далее проведено 4 курса ХТ в режиме TIP (паклитаксел 120 мг / м2 в день 1, 2 + ифосфамид 1500 мг / м2 в дни 2-5 (+ месна) + цисплатин 25 мг / м2 в дни 2-5 + Г-КСФ). При наличии остаточной опухоли размером более 1 см и технической возможности ее удаления выполнялось хирургическое лечение. Первичной конечной точкой явилась 1-летняя ВБП.Результаты исследования: С 2017 по 2023 годы в исследование включено 34 пациента. Набор в исследование досрочно прекращен в связи с крайне низкой вероятностью достижения первичной конечной точки. Однолетняя ВБП и общая выживаемость составили 57,1 % и 74,4 % соответственно. Благоприятная частота ответов, расцениваемая как полный ответ и маркер-негативный неполный ответ, отмечена у 55,7 % пациентов. Прогрессирование заболевания зарегистрировано у 21 пациента, у 8 (37 %) из них первым сайтом прогрессирования явилась центральная нервная система. Хирургическое лечение выполнено 16 пациентам, жизнеспособная злокачественная резидуальная опухоль обнаружена у 4 больных. Проведение первого курса в «стабилизационном» режиме пациентам «сверхвысокого риска» не оказало влияния ни на ВБП (р = 0,28), ни на ОВ (р = 0,434). Профиль токсичности режима TIP оказался приемлемым.Выводы: Смена режима ВЕР на TIP для пациентов с несеминомными ГО и замедленным снижением скорости опухолевых маркеров не продемонстрировало своей эффективности. Необходимо изучение иных лекарственных подходов с целью улучшения результатов лечения.
Герминогенные опухоли, неблагоприятный прогноз, снижение скорости опухолевых маркеров, стабилизационный курс, паклитаксел, ифосфамид, цисплатин, блеомицин, этопозид
Короткий адрес: https://sciup.org/140310086
IDR: 140310086 | DOI: 10.18027/2224-5057-2025-034
Текст научной статьи Режим паклитаксел, ифосфамид, цисплатин (TIP) в индукционном лечении при несеминомных герминогенных опухолях неблагоприятного прогноза с замедленным снижением концентрации онкомаркеров: финальные результаты
Герминогенные опухоли (ГО) являются курабельными даже при метастатическом процессе ввиду высокой чувствительности к цисплатин-содержащей химиотерапии
(ХТ) [1]. ВЕР — стандарт первоначального лечения диссеминированных ГО [2]. Использование современных режимов ХТ позволяет достичь показатель 5-летней выживаемости без прогрессирования (ВБП) на уровне 90% и 78% для пациентов с благоприятным и промежуточным прогнозами по классификации IGCCCG, однако при плохом прогнозе неблагоприятные исходы отмечаются примерно у 50% больных [3]. Именно пациенты с плохим прогнозом нуждаются в разработке более эффективных методов лечения, но на данный момент все попытки оказались безуспешными [4–11].
В многофакторном анализе крупного ретроспективного исследования [12] продемонстрировано, что группу пациентов с плохим прогнозом можно разделить в зависимости от биологической чувствительности к химиотерапии, косвенно оцениваемой по темпам снижения концентрации опухолевых маркеров на фоне ХТ. Замедленное снижение скорости опухолевых маркеров демонстрирует прогностическую значимость как для ВБП, так и общей выживаемости (ОВ) пациентов с неблагоприятным прогнозом.
В исследовании III фазы GETUG-13 [13] дозоинтенсивный многокомпонентный режим ХТ (2 курса паклитаксел-ВЕР, оксалиплатин + 2 курса цисплатин, ифосфамид (+ мес-на), блеомицин) позволил достоверно улучшить 3-летнюю ВБП в сравнении с ВЕР в этой подгруппе пациентов, хотя значимых различий в ОВ не получено. Экспериментальный подход оказался более токсичным и маловоспроизводимым в клинической практике, что не позволило ему стать новым стандартом лечения.
Режим TIP (паклитаксел, ифосфамид (+ месна), цисплатин) — предпочтительная опция второй линии терапии диссеминированных ГО и демонстрирует сопоставимую с BEP эффективность в первоначальном лечении пациентов при удовлетворительном профиле безопасности [14]. Мы предположили, что ранний переход на TIP при замедленном снижении концентрации опухолевых маркеров может позволить повысить эффективность ХТу пациентов неблагоприятной прогностической группы и с замедленным снижением АФП и/или бета-ХГЧ после 1 курса ХТ в режим ВЕР. Для проверки этой гипотезы нами проведено исследование II фазы.
МАТЕРИАЛЫ И МЕТОДЫ
В данное проспективное многоцентровое исследование II фазы включены пациенты возрастом старше 18 лет с морфологически подтвержденным диагнозом несеми-номной ГО (при тяжелом состоянии больного, обусловленном распространенностью опухолевого процесса, диагноз мог основываться на типичной клинической картине и высоком уровне АФП и/или ХГЧ; пациенты, у которых в гистологическом заключении фигурировал диагноз «семинома», но наблюдался повышенный уровень АФП, также относились к несеминомным ГО), удовлетворяющие критериям неблагоприятного прогноза по IGCCCG (уровень бета-ХГЧ ≥ 50000 мМЕ/мл и/или АФП ≥ 10000 нг/мл и/или лактатдегидрогеназы (ЛДГ) ≥ 10 ВГН, и/или наличие висцеральных нелегочных метастазов), любым статусом по шкале ECOG, удовлетворительными показателями гемограммы (число нейтрофилов ≥ 1,5 × 109 /л, тромбо- циты ≥100×109/л), функциями почек (уровень креатинина не более 1,5 ВГН либо расчетный клиренс креатинина (Co ckroft–Gault) ≥ 40 мл /мин) и печени (уровень билирубина до 2 ВГН), уровень АЛТ и АСТ до 5 ВГН). Исследование одобрено локальным этическим комитетом в каждой медицинской организации, принявшей участие в исследовании. Все пациенты подписали информированное согласие на проведение лечения до начала терапии.
СКРИНИНГ
Процедуры скрининга включали: сбор анамнеза, осмотр, проведение электрокардиографии, общий анализ крови, определение уровня АФП, бета-ХГЧ, ЛДГ, биохимический анализ крови, компьютерную томографию (КТ) органов грудной клетки, брюшной полости, малого таза с внутривенным контрастированием, магнитно-резонансную томографию (МРТ) головного мозга с внутривенным контрастированием при наличии показаний (неврологическая симптоматика, уровень бета-ХГЧ свыше 5000 мМЕ/мл и/или множественные метастазы в легких).
ДИЗАЙН ИССЛЕДОВАНИЯ
Всем больным проводился один курс ХТ по программе ВЕР (блеомицин 30 мг в/в в дни 1, 3, 5 , этопозид 100 мг/м 2 в дни 1–5, цисплатин 20 мг/м 2 в дни 1–5). Пациентам «сверхвысокого риска» (с уровнем опухолевых маркеров АФП ≥100000 нг/мл и/или бета-ХГЧ ≥ 200000 мМЕ/мл, и/или тяжелым соматическим статусом на момент начала терапии) допускалось проведение «стабилизационного» курса ХТ по схеме ЕР с последующей эскалацией доз до режима ВЕР (рис. 1). На основании определения уровней опухолевых маркеров (АФП и ХГЧ) к 18–21 дню рассчитывалась кинетика их снижения согласно формуле, опубликованной ранее [13]. В случае удовлетворительного снижения концентрации опухолевых маркеров пациенты получали еще 3 курса ХТ по программе ВЕР каждые 3 недели и не включались в исследование. Пациентам с замедленной кинетикой проводилось 4 курса терапии по схеме TIP (паклитаксел 120 мг/м 2 в дни 1, 2 + ифосфамид 1500 мг/м 2 в дни 2–5, месна 1500 мг/м 2 в дни 2–5, цисплатин 25 мг/м 2 в дни 2–5 + филграстим 5 мг / кг в дни 6–15 п /к) каждые 3 недели. Перед каждым курсом определялись показатели гемограммы, биохимического анализа крови, уровни АФП, ХГЧ и ЛДГ, оценивалась токсичность предыдущего курса терапии. С целью контроля гематологической токсичности еженедельно контролировался общий анализ крови.
После завершения всего запланированного объема ХТ оценка эффективности лечения включала в себя КТ органов грудной клетки, брюшной полости, малого таза с в/в контрастированием, МРТ головного мозга по показаниям, определение уровней опухолевых маркеров. При полном ответе пациенты переходили под динамическое наблюдение. При сохранении потенциально резектабель-ных резидуальных опухолевых очагов более 1 см выполнялось хирургическое вмешательство с целью их удаления. При наличии некроза в удаленных резидуальных массах по данным гистологического исследования, пациент переходил под наблюдение. Пациенты с жизнеспособной злокачественной опухолью получали еще 2 курса ХТ по схеме TIP.
После завершения терапии пациенты находились под наблюдением. Анализ проводился на основе данных всех включенных пациентов. Первичная оценка эффективности производилась, когда у 80% больных период наблюдения после завершения химиотерапии превысил один год. Процедуры наблюдения проводились в соответствии с клиническими рекомендациями RUSSCO [15].
День 1 — этопозид 100 мг/м 2
День 2 — цисплатин 20 мг/м 2
День 3 — этопозид 100 мг/м 2 + цисплатин 20 мг/м 2
День 4–7 — Г-КСФ профилактика
День 9 — блеомицин 30 мг + этопозид
100 мг/м 2 + цисплатин 20 мг/м 2
День 10 — этопозид 100 мг/м 2 + цисплатин 20 мг/м 2
День 11 — блеомицин 30 мг + этопозид
100 мг/м 2 + цисплатин 20 мг/м 2
День 13 — блеомицин 30 мг
День 14 — старт Г-КСФ профилактики до нормализации АЧН.
Примечание: указанный вариант является примерным, решение о проведении каждого дня принималось индивидуально на основании соматического статуса пациента и осложнений опухолевого процесса
Рисунок 1. Режим ВЕР в «стабилизационном» варианте
Figure 1. The BEP regimen in the “stabilization» version
КОНЕЧНЫЕ ТОЧКИ
Первичной конечной точкой являлась одногодичная ВБП — время от момента включения в исследование до прогрессирования либо смерти от любой причины в течение одного года.
Вторичные конечные точки:
-
• ОВ — время от момента включения в исследование до смерти от любой причины или даты последнего наблюдения.
-
• Полный ответ — нормализация опухолевых маркеров (АФП и ХГЧ), отсутствие радиологических проявлений болезни размерами 1 см и более или полностью резецированные опухолевые массы.
-
• Маркер-негативный неполный ответ — нормализация опухолевых маркеров (АФП и ХГЧ), остаточная резидуальная опухоль 1 см и более, которая не была полностью хирургически удалена.
-
• Маркер-позитивный неполный ответ — опухолевые маркеры (АФП или ХГЧ) снизились, но остаются все еще повышенными после завершения всех курсов терапии; если в течение последующего 1 месяца после первичной оценки эффекта (14–30 дней после завершения химиотерапии) наблюдается нормализация опухолевых маркеров самостоятельно или после резекции резидуальной опухоли, то данный ответ классифицируется как полный или маркер-негативный неполный (продолжительность полного и неполного ответов должна быть не менее 1 месяца).
-
• Прогрессирование заболевания — рост уровня опухолевых маркеров (АФП или ХГЧ) на протяжении двух последовательных измерений с интервалом в 2 недели; рост или появление новых опухолевых очагов, за исключением случаев растущей зрелой тератомы; нерадикальное удаление резидуальной опухоли, содержащей жизнеспособную злокачественную опухоль.
-
• Влияние «стабилизационного» первого курса ХТ в режиме ВЕР на ОВ.
-
• Безопасность согласно шкале CTCAE v4.0 — в виде доли пациентов, у которых развились нежелательные явления 3–4 степени.
СТАТИСТИЧЕСКИЙАНАЛИЗ
Нулевая и альтернативная гипотезы основаны на данных рандомизированного исследования GETUG-13. Согласно результатам исследования, 1-летняя ВБП в группе больных, получивших стандартный режим, составила 55%. Следовательно, нулевая гипотеза (Н0) равняется 1-летней ВБП 55%. Альтернативная гипотеза (Н1) — 1-летняя ВБП составляет 75%. При ошибке первого рода (двусторонняя α) = 0,05 и ошибке второго рода (β) = 0,2 (мощность 0,8), ожидаемой потери данных 10% в исследование должно быть включено 45 пациентов. Однако была предусмотрена возможность преждевременного закрытия набора в исследование при выявлении признаков нецелесообразности данного подхода (в случае низкой вероятности достижения первичной конечной точки).
Выживаемость анализировалась в соответствии с методом Каплана–Мейера и сравнивалась по лог-ранк тесту. Для сравнения качественных признаков использовался χ 2 -тест с поправкой Йетса на непрерывность при таблицах сопряжения 2 × 2 или точный критерий Фишера при малых выборках. Для сравнения количественных признаков применен Манн–Уитни тест. Во всех случаях использован 95% доверительный интервал и двусторонний Р. Статистическая обработка данных проводилась с использованием программы MedCalc.
РЕЗУЛЬТАТЫ
С 2017 по 2023 годы в исследование включено 34 пациента c замедленной кинетикой опухолевых маркеров, медиана возраста составила 28 лет (диапазон 18–46). У 22 (65%) пациентов первичная опухоль локализовалась в яичке, в средостении — у 18%. Орхфуникулэктомия на первом этапе выполнена 17 больным (50%). У 19 (56%) пациентов на момент начала лечения выявлены внелегочные висцеральные метастазы, у 12 (35%) — признаки «сверхвысокого риска». Подробная характеристика пациентов представлена в таблице 1.
Двенадцати (35,2%) пациентам 1 курс ВЕР проведен в «стабилизационном» режиме в связи с крайне высокой концентрацией опухолевых маркеров и/или тяжелым соматическим статусом.
Таблица 1. Характеристика пациентов
Table 1. Characteristics of patients
|
Показатель |
N (%) |
|
Количество пациентов |
34 (100%) |
|
Патоморфологический вариант |
|
|
Несеминомая ГО |
|
|
— опухоль желточного мешка |
4 (11,7%) |
|
— хорионкарцинома |
4 (11,7%) |
|
— эмбриональный рак |
6 (17,6%) |
|
— опухоль смешанного строения |
11 (34%) |
|
Нет патоморфологического подтверждения |
8 (24%) |
|
Семинома + повышенный АФП |
1 (3%) |
|
Локализация первичной опухоли |
|
|
Яичко |
22 (64,8%) |
|
Забрюшинное пространство |
6 (17,6%) |
|
Средостение |
6 (17,6%) |
|
Метастазы |
|
|
Забрюшинные лимфоузлы |
26 (76,4%) |
|
Лимфоузлы средостения |
7 (20,5%) |
|
Легкие |
21 (61,7%) |
|
Печень |
12 (35,2%) |
|
Кости |
6 (17,6%) |
|
Головной мозг |
6 (17,6%) |
|
ECOG PS |
|
|
0–1 |
13 (38,2%) |
|
2 |
13 (38,2%) |
|
3–4 |
8 (23,6%) |
|
Уровень онкомаркеров |
|
|
бета-ХГЧ > 50000, МЕ/мл |
12 (35,2%) |
|
Медиана бета-ХГЧ, МЕ/мл (диапазон) |
1419 (0–3019200) |
|
АФП > 10000, нг/мл |
12 (35,2%) |
|
Медиана АФП, мМЕ/мл (диапазон) |
995 (1–161056) |
|
ЛДГ>10 ВГН, Ед/л |
3 (8,8%) |
|
Медиана ЛДГ, Ед/л (диапазон) |
915,5* (180–11351) |
Примечание: ECOG PS — шкала оценки тяжести состояния пациента (Eastern Cooperative Oncology Group Performance Status). Бета-ХГЧ — бета-хорионический гонадотропин человека. АФП — альфа-фетопротеин. ЛДГ — лактатдегидрогеназа. ВГН — верхняя граница нормы. IGCCCG — Международная консенсусная группа по изучению герминогенных опухолей (International Germ Cell Cancer Collaborative Group).
* верхняя граница нормы ЛДГ до 450 Ед /л.
ОЦЕНКА ЭФФЕКТИВНОСТИТЕРАПИИ
При медиане наблюдения 23,8 месяцев (диапазон, 4,9– 80 мес.) 1-летняя ВБП составила 57,1 % (рис. 2), 1-летняя ОВ — 74,4% (рис. 3). Медиана ВБП и ОВ составили 24 мес. (95% ДИ, 7,6–47,1 мес.) и 36 мес. (95% ДИ, 18,4–35,9 мес.) соответственно. В связи с невозможностью достижения первичной конечной точки было принято решение о досрочном завершении набора пациентов в данное исследование в октябре 2023 года после обсуждения с независимым надзорным комитетом.
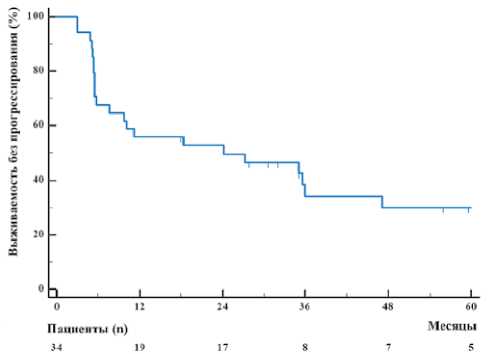
Рисунок 2. Выживаемость без прогрессирования
Figure 2. Progression-free survival
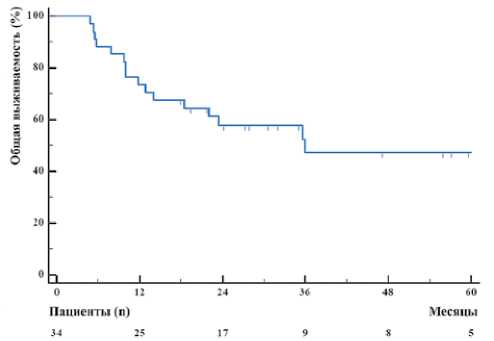
Рисунок 3. Общая выживаемость
Figure 3. Overall survival
Полный ответ (ПО) отмечен у 13 пациентов (38,4%), только после ХТ — у 3 (8,8%) пациентов, у остальных 10 — после последующего хирургического лечения (табл. 2). Шестнадцать (47%) пациентов подвергнуты хирурги- ческому лечению после завершения 1 линии. Наиболее часто выполнялась ЗЛАЭ (26,4%) и удаление опухоли средостения (14,7%). У 9 (26,4%) пациентов при гистологическом исследовании обнаружен некроз/фиброз, у 6 — тератома, у 4 — злокачественная жизнеспособная ткань (у 1 пациента обнаружена соматическая трансформация тератомы в рабдомиосаркому). Частота благоприятных ответов, рассчитываемая как сумма пациентов с ПО после завершения ХТ или удаления резидуальной опухоли и маркер-негативным неполным ответом, составила 55,8%.
Таблица 2. Непосредственная эффективность лечения
Table 2. Effectiveness of treatment
|
Показатель |
N (%) |
|
Все пациенты |
34 (100%) |
|
Эффект после ХТ |
|
|
Полный ответ |
13 (38,4%) |
|
МННО |
6 (17,6%) |
|
МПНО |
8 (23,5%) |
|
Прогрессирование |
7 (20,5%) |
|
Хирургическое лечение |
16 (47%) |
|
ЗЛАЭ |
9 (26,4%) |
|
Удаление опухоли средостения |
5 (14,7%) |
|
ОФЭ |
3 (8,8%) |
|
Резекция печени |
1 (3%) |
|
Патоморфологический ответ |
|
|
Некроз, фиброз |
9 (26,4%) |
|
Тератома |
6 (17,6%) |
|
Жизнеспособная опухоль |
4 (11,7%) |
Примечание: ХТ — химиотерапия. МПНО — маркер-позитив-ный неполный ответ. МННО — маркер-негативный неполный ответ. ЗЛАЭ — забрюшинная лимфаденэктомия.
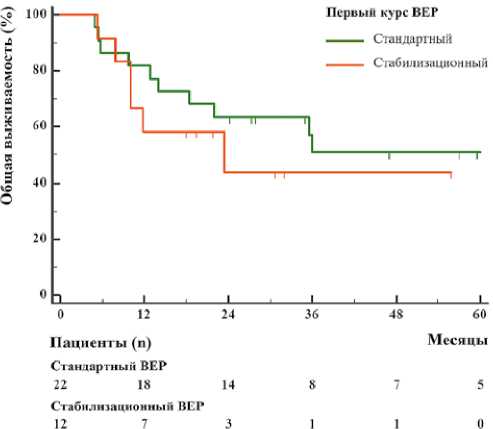
Рисунок 4. Влияние дозового режима 1 курса на общую выживаемость
Figure 4. Effect of the first course dose regimen on overall survival
Проведение 1 курса ВЕР в «стабилизационном» режиме не продемонстрировало негативного влияния на ВБП (ОР 0,60; 95 % ДИ, 0,23–1,55; р = 0,208) и ОВ (ОР 0,67; 95% ДИ, 0,23–1,99; р = 0,434) в сравнении с пациентами, получившими 1 курс в стандартном дозовом режиме (рис. 4).
Прогрессирование заболевания отмечено у 21 (61,7%) пациента, непосредственно сразу после ХТ — у 7 (20,5%). Наиболее часто первым сайтом прогрессирования явилось поражение головного мозга (n = 8 (38 %)) и висцеральных органов (за исключением легких) (n = 7 (33 %)). Преимущественно прогрессирование отмечалось в течение первого года после завершения ХТ (у 71 % пациентов). Один пациент отнесен к группе низкого риска согласно классификации The International Prognostic Factor Study Group, 3 — к группе промежуточного риска, 9 — к высокому риску и 7 — очень высокому риску.
По поводу прогрессирования заболевания 12 пациентов получили вторую линию терапии: по 3 пациента — ВЕР и Т-ВЕР (паклитаксел + ВЕР), 2 пациента — модифицированный TGO (паклитаксел, гемцитабин, оксалиплатин) c последующей высокодозной химиотерапией (карбопла-тин/этопозид), по 1 пациенту — режимы VIP (цисплатин, этопозид, ифосфамид), GemOX, TGO, TGP (паклитаксел, гемцитабин, цисплатин).
ТОКСИЧНОСТЬ ТЕРАПИИ
Медиана числа курсов ХТ составила 5 (диапазон 3–5). Из 34 пациентов 23 (67,6%) получили весь запланированный объем лекарственной терапии (1 ВЕР + 4 TIP). Десятерым (29,4%) проведено 3 курса в режиме TIP (последний курс отменен в связи с гематологической токсичностью у 6 пациентов, по причине рецидивирующего инфекционного процесса — у 2 пациентов, прогрессирования заболевания — у 2 больных). Одному больному проведено лишь 2 курса ХТ в режиме TIP в связи с агрессивно протекавшим синдромом растущей зрелой тератомы в средостении. У одного пациента с первичной локализацией опухоли в средостении после проведения первого курса TIP развился синдром лизиса опухоли с исходом в острое почечное повреждение, эмпиему плевры, хилоторакс. Тем
Таблица 3. Нежелательные явления 3–4 степени
Table 3. Adverse events grade 3–4
ОБСУЖДЕНИЕ
В нашем исследовании II фазы не удалось улучшить 1-летнюю ВБП в группе пациентов с неблагоприятным прогнозом и замедленным снижением скорости опухолевых маркеров после 1 курса стандартной ХТ путем смены на режим TIP. После обсуждения промежуточных данных с независимым надзорным комитетом было принято решение о досрочном прекращении набора пациентов в связи с крайне низкой вероятностью достижения первичной конечной точки. Однолетняя ВБП и ОВ составили 57,1 % и 74,4% соответственно. У больных наблюдалась преимущественно гематологическая токсичность и, несмотря на использование Г-КСФ профилактики, у 44% пациентов отмечена фебрильная нейтропения. Режим продемонстрировал схожую эффективность с режимом BEP.
В GETUG-13 [16], проспективно валидировавшем прогностическую значимость скорости снижения опухолевых маркеров, при медиане наблюдения 7 лет 1-годичная ВБП составила в группе дозоинтенсивного режима и ВЕР — 64% и 55% соответственно. При этом превосходство экспериментального подхода над стандартной терапией кажется сомнительным в отношении ВБП (ОР 0,67; 95% ДИ, 0,45– 0,99; р = 0,0436), а в ОВ различия оказались не достоверны (ОР 0,71; 95% ДИ, 0,44–1,14; р = 0,1494). Полученные данные 1-летней ВБП для группы ВЕР согласуются с аналогичным показателем в нашем исследовании, что указывает на нецелесообразность смены режима ВЕР на TIP после 1 курса.
Словацким коллективом авторов также было инициировано исследование II фазы с аналогичным нашей работе планом лечения [17]. В исследование включено 19 пациентов, полный ответ отмечен у 3, что не удовлетворило критериям продолжения исследования (≥ 6). Частота благоприятных ответов составила 73,7%, 1-летняя ВБП и ОВ — 52,2% и 79,3% соответственно. Безусловно, выбранная первичная конечная точка не может в полной мере коррелировать с эффективностью лечения ввиду массивной распространенности опухоли у большинства больных и невозможностью удалить все резидуальные проявления после ХТ. Тем не менее, 1-летняя ВБП аналогична таковой в ранее упомянутом французском исследовании [16] и данной работе.
Концепция оценки снижения концентрации опухолевых маркеров не нова [18,19]. В двух рандомизированных исследованиях, посвященных роли высокодозной химиотерапии (ВДХТ) при неблагоприятном прогнозе, оценивалась прогностическая значимость кинетики маркеров, но стоит отметить, что использованная формула учитывала значения маркеров после двух первых курсов ХТ. В иссле- довании R. Motzer с соавторами, сравнившего 4 курса ВЕР и 2 курса ВЕР + 2 курса ВДХТ (карбоплатин / этопо-зид/циклофосфамид), продемонстрировано, что однолетняя частота полных ответов не различается между двумя группами, но в случае замедленной кинетики маркеров ВДХТ была лучше, чем ВЕР (61% против 34%, p = 0,03) [18]. В работе G. Daugaard с соавторами, посвященной оценке эффективности 1 курса VIP + 3 курса высокодозного VIP и 4 курсов ВЕР, замедленное снижение не оказывало какого-либо влияния ни на бессобытийную выживаемость (БСВ), ни на ОВ. При благоприятном снижении маркеров ифосфамид-содержащий режим ХТ демонстрирует некий выигрыш в отношении 2-летней БСВ, но с пограничной значимостью (71,7% против 42,6%, p = 0,05) [19].
Обращает на себя внимание большая частота интракраниального прогрессирования в нашем исследовании, составившая 38%. В поданализе исследования GETUG-13 [20] показано, что из 109 пациентов с прогрессированием заболевания у 21 (19%) первым сайтом рецидива стал головной мозг (ГМ). При этом частота поражения ГМ нумерически выше в группе дозоинтенсивного подхода, чем в группе ВЕР (29% против 12%). Авторы предположили, что это может быть связано с низкой пенетрантностью в центральную нервную систему препаратов, входящих в дозоинтенсивный режим. Вероятно, более низкая кумулятивная доза этопозида, полученная пациентами в экспериментальной группе (1500 мг/м 2 вместо стандартных 2000 мг/м 2 ), могла оказать влияние на частоту интракраниального прогрессирования, учитывая высокую пенетрацию данного лекарственного агента сквозь гематоэнцефалический барьер в отличие от ифосфамида [21].
Двенадцати пациентам потребовалось проведение первого курса ХТ в «стабилизационном» режиме в связи с распространенностью опухолевого процесса и/или «сверхвысокими признаками». В нашей работе модифицированный режим ВЕР не оказал негативного влияния ни на ВБП, ни на ОВ. В работе Трякина А.А. с соавторами [22] проведение дозоредуцированного первого курса ЕР позволило снизить частоту развития жизнеугрожающих осложнений с 76% до 44% (р = 0,01), при этом не отмечено влияния на ОВ. В ранее упомянутом словацком исследовании [17] первый курс в «стабилизационном» режиме также не оказал негативного влияния на отдаленные онкологические результаты (р = 0,49 для ВБП, р = 0,20 для ОВ). В многофакторном анализе исследования ТЕ23 [23], оценивавшем эффективность ВЕР и СВОР/ВЕР в категории пациентов с неблагоприятным прогнозом, продемонстрировано, что «стабилизационный» курс ХТ негативно влияет на ВБП (р = 0,017) и ОВ (р < 0,001). Сами авторы отмечают, что определение показаний к «стабилизационному» курсу ХТ непосредственно лечащими врачами может играть роль в полученных результатах.
В то же время стоит обратить внимание и на некоторые недостатки нашего исследования: отсутствие рандомизации, гетерогенная популяция пациентов внутри неблагоприятного прогноза, большое число больных «сверхвысокого риска».
ЗАКЛЮЧЕНИЕ
Смена режима химиотерапии на TIP для пациентов с неблагоприятным прогнозом и с замедленной кинетикой опухолевых маркеров после 1 курса ВЕР оказалась неэффективной, несмотря на негативное прогностическое значение данного маркера. Необходимо изучение новых режимов терапии для улучшения результатов лечения пациентов с неблагоприятными характеристиками опухоли.


